Цвет хром – это не только красота
Серебристый цвет хрома знают многие водители. Мастера меняют качество и внешний вид деталей до неузнаваемости, используя простые принципы. Главной особенностью таких действий стал тяжелый металл. Он часто применяется в промышленности, но обычно в качестве тончайшего слоя на поверхности. Такое решение дает неоспоримые преимущества, указывающие на необходимость его применения.
Какой цвет у хрома?
Хром – тяжелый серебристый металл, обладающий ярким блеском. Его гладкая поверхность подобна зеркалу, хотя в чистом виде он отличается темным оттенком. Свой истинный вид он обретает после гальванического нанесения на другой металл. Это минимизирует толщину слоя, делая его незначительным.
Цвет хрома притягивает взгляды блеском
Настоящий темный цвет хрома объясняется образованием оксида на поверхности. Он отлично противостоит коррозии, но с течением времени покрывается легкой пленкой, которая лишь влияет на тон и устраняет серебристый блеск. Из-за этого рекомендуется детали, обработанные подобным образом регулярно полировать.
Что представляет собой хромирование?
Приятный хромовый блеск позволяет получить хромирование. Оно осуществляется гальваническим способом, оставаясь несложным процессом. С ним можно справиться даже в домашних условиях, не обладая профессиональными познаниями. Пора с ним познакомиться на бытовом уровне, разъяснив некоторые подробности.
- Сначала готовится ванна с электролитом. Она нужна для того, чтобы перемещались ионы хрома, образующиеся после распада его оксида.
- В нее с одной стороны помещают катод, а анод необходимо присоединить к обрабатываемой детали.
- После подключения электрического тока начинается движение ионов, причем положительные от хрома перемещаются к детали, становясь тонким слоем.
После доступного объяснения процесс оказывается не таким уж страшным. Да, в некоторых мастерских пугают водителей, что приходится применять специальное оборудование. С одной стороны оно полезно, а с другой – при работе с небольшими поверхностями металла можно обойтись без него. Сегодня опытные водители самостоятельно проводят работы, тем более что они требуют минимум времени. Пусть им приходится активнее полировать поверхность перед установкой детали, но результат совпадает с профессиональными услугами крупных мастерских.
Что дает хромирование?
Нанесение хрома на поверхность металла приносит колоссальную пользу. Автовладельцы должны хорошо понимать это, так как им чаще остальных людей приходится сталкиваться с ржавчиной и чисткой деталей. Какие же плюсы дает дополнительная обработка?
- Долговечность;
- Защита от коррозии;
- Защита от повреждений;
- Серебристый блеск.

Его гладкая поверхность подобна зеркалу, хотя в чистом виде он отличается темным оттенком
От удивительного цвета меняется многое.
В первую очередь рекомендуется использовать хромирование на открытых поверхностях, в частности, на дисках, но также оно незаменимо для деталей двигателя. Посредством него удается изменить их срок службы, увеличив его на несколько лет.
Долговечность
Поверхность стали обычно быстро разрушается. Причин для этого множество, поэтому найти оптимальный химический состав для стопроцентной защиты невозможно. Об этом говорят аналитические исследования, показывающие, что даже антикоррозийное покрытие постепенно теряет свои свойства. Намного практичнее воспользоваться абсолютно гладким слоем другого металла.
После нанесения хрома удается получить новую поверхность. Внешнее тонкое покрытие превращается в идеальный способ быстрого удаления влаги и пыли, что способствует длительному сохранению основы в отличном состоянии. Не стоит искать альтернативных вариантов, они не существуют, лучше научиться, в домашних условиях справляться с работами.
Защита от коррозии
Чистый хром практически не окисляется на воздухе. Для этого требуется длительное и постоянное воздействие влаги, поэтому тонкий слой на поверхности стали легко справляется с жесткими условиями эксплуатации. Сложно найти что-то подобное, поэтому изученная методика широко применяется специалистами.

Хромированная ручка двери авто
Защита от коррозии всегда была первоочередной задачей для автовладельцев. Они должны отлично понимать, что не только кузов, но и двигатель остается в опасности. Да, некоторые химические составы и масло откладывают срок образования ржавчины, но все равно остается неприятной реальностью.
Защита от повреждений
Некоторые люди восторгаются дисками, какой прекрасный блеск, но немногие из них понимают, что причиной является не качественная полировка. Серебристый оттенок скрывает легкую защиту от механических повреждений. Об этом говорит статистика, показывающая, что цельная поверхность из тяжелого металла способна отталкивать мелкие частицы.
Во время движения по дорогам водителю приходится сталкиваться с щебнем, кусками асфальта и металлическими частями. Они оставляют после себя на поверхности стали незначительные царапины и трещины. Поначалу их появление лишь портит внешний вид, но со временем становится очагом распространения коррозии. Полезнее заранее предусмотреть такие последствия, воспользовавшись проверенной методикой.
Серебристый блеск
Цветхром – это фантастический серебристый блеск. Его сложно спутать с любым другим металлом, поэтому не стоит даже пытаться найти альтернативу. Тонкий слой металла, наносимый при помощи гальванических элементов, становится максимально чистым. В результате он превращается в декор любой детали двигателя или кузова.

Нанесение хрома на отдельные детали и элементы кузова стало распространенной процедурой
Если молодые водители предпочитают заказывать обработку исключительно из-за внешнего вида, опытные автомобилисты отлично понимают, что под блеском скрываются разные преимущества. Хотя привлекательность машины также нельзя сбрасывать со счетов. Всегда хочется поражать окружающих своей изящностью, поэтому стоит заинтересоваться предлагаемыми работами.
А нужно ли хромирование?
Нанесение хрома на отдельные детали и элементы кузова стало распространенной процедурой. Подобные услуги предлагаются практически в каждой мастерской, а также существуют инструкции для выполнения работ в домашних условиях. Сохраняется единственный вопрос, а есть ли смысл тратить время и деньги?
- Тонкий слой тяжелого металла дает дополнительную защиту сразу по нескольким пунктам. С точки зрения функционального применения проверенного процесса невозможно найти никакого минуса.
- Поверхность приобретает приятный блеск и требует минимум ухода, что делает ее прекрасным решением для .ленивых автомобилистов.
- После хромирования увеличивается срок эксплуатации. Этот факт подтвержден практическими аналитическими данными, которые показывают, насколько выгодно обращаться к специалистам.
- Затраты на проведение работ несравнимо ниже, чем получаемые преимущества. Можно не задумываться о расходах, так как они остаются небольшими.
Не стоит рассуждать о достоинствах и недостатках, намного проще выделить лишь несколько пунктов, которые наилучшим образом описывают хромирование. Их достаточно для принятия решения, заставляющего задуматься о дополнительных затратах. Все-таки забота об автомобиле гарантирует его долговечность и сокращение регулярных расходов на обслуживание и уход.
Хром – тяжелый металл, годами неиспользовавшийся в промышленности. Его большой вес и высокая стоимость заставляла отказываться от полезных свойств. Сегодня подробно изучен процесс создания тончайшего слоя на любой металлической поверхности. Он приобретает те же самые плюсы, поэтому во время эксплуатации долго остается надежным. Так что водителям пора забыть об экономии и всерьез задуматься об изменении собственного транспортного средства, которые коснутся не только внешнего вида.
www.avtokrasim.ru
Хром и его соединения
Хром
Открытие хрома относится к периоду бурного развития химико-аналитических исследований солей и минералов. В России химики проявляли особый интерес к анализу минералов, найденных в Сибири и почти неизвестных в Западной Европе. Одним из таких минералов была сибирская красная свинцовая руда (крокоит), описанная еще Ломоносовым. Минерал исследовался, но ничего, кроме окислов свинца, железа и алюминия в нем не было найдено. Однако в 1797 году Вокелен, прокипятив тонко измельченный образец минерала с поташом и осадив карбонат свинца, получил раствор, окрашенный в оранжево – красный цвет. Из этого раствора он выкристаллизовал рубиново-красную соль, из которой выделили окисел и свободный металл, отличный от всех известных металлов. Вокелен назвал его Хром (Chrome) от греческого слова — окраска, цвет; правда здесь имелось в виду свойство не металла, а его ярко окрашенных солей.
Нахождение в природе.
Важнейшей рудой хрома, имеющей практическое значение, является хромит, приблизительный состав которого отвечает формуле FeCrO4.

Он встречается в Малой Азии, на Урале, в Северной Америке, на юге Африки. Техническое значение имеет также вышеназванный минерал крокоит – PbCrO4. В природе встречаются также оксид хрома (3) и некоторые другие его соединения. В земной коре содержание хрома в пересчете на металл составляет 0,03%. Хром обнаружен на Солнце, звездах, метеоритах.
Физические свойства.
Хром – белый, твердый и хрупкий металл, исключительно химически стойкий к воздействию кислот и щелочей. На воздухе он окисляется, имеет на поверхности тонкую прозрачную пленку оксида. Хром имеет плотность 7,1 г/см
Получение.
При сильном нагреве хромистого железняка с углем происходит восстановление хрома и железа:
FeO * Cr2O3 + 4C = 2Cr + Fe + 4CO
В результате этой реакции образуется сплав хрома с железом, отличающийся высокой прочностью. Для получения чистого хрома, его восстанавливают из оксида хрома(3) алюминием:
Cr2O3 + 2Al = Al2O3 + 2Cr
В данном процессе обычно используют два оксида – Cr2O3 и CrO
Химические свойства.
Благодаря тонкой защитной пленке оксида, покрывающей поверхность хрома, он весьма устойчив к воздействию агрессивных кислот и щелочей. Хром не реагирует с концентрированными азотной и серной кислотами, а также с фосфорной кислотой. Со щелочами хром вступает во взаимодействие при t = 600-700оC. Однако хром взаимодействует с разбавленными серной и соляной кислотами, вытесняя водород:
2Cr + 3H2SO4 = Cr2(SO4)3 + 3H2
2Cr + 6HCl = 2CrCl3 + 3H2
При высокой температуре хром горит в кислороде, образуя оксид(III).
Раскаленный хром реагирует с парами воды:
2Cr + 3H2O = Cr2O3 + 3H2
Хром при высокой температуре реагирует также с галогенами, галоген — водородами, серой, азотом, фосфором, углем, кремнием, бором, например:
Cr + 2HF = CrF2 + H2
2Cr + N2 = 2CrN
2Cr + 3S = Cr2S3
Cr + Si = CrSi
Вышеуказанные физические и химические свойства хрома нашли свое применение в различных областях науки и техники. Так, например, хром и его сплавы используются для получения высокопрочных, коррозионно-стойких покрытий в машиностроении. Сплавы в виде феррохрома используются в качестве металлорежущих инструментов. Хромированные сплавы нашли применение в медицинской технике, при изготовлении химического технологического оборудования.

Положение хрома в периодической системе химических элементов:
Хром возглавляет побочную подгруппу VI группы периодической системы элементов. Его электронная формула следующая:
+24Cr IS22S22P63S23P63d54S1
В заполнении орбиталей электронами у атома хрома нарушается закономерность, согласно которой сначала должна была бы заполнятся 4S – орбиталь до состояния 4S
Соединения двухвалентного хрома.
Оксид хрома (II) CrO – пирофорный черный порошок (пирофорность – способность в тонкораздробленном состоянии воспламенятся на воздухе). CrO растворяется в разбавленной соляной кислоте:
CrO + 2HCl = CrCl2 + H2O
На воздухе при нагревании свыше 100
Соли двухвалентного хрома образуются при растворении металлического хрома в кислотах. Эти реакции проходят в атмосфере малоактивного газа (например H2), т.к. в присутствии воздуха легко происходит окисление Cr(II) до Cr(III).
Гидроксид хрома получают в виде желтого осадка при действии раствора щелочи на хлорид хрома (II):
CrCl2 + 2NaOH = Cr(OH)2 + 2NaCl
Cr(OH)2 обладает основными свойствами, является восстановителем. Гидратированный ион Cr2+ окрашен в бледно – голубой цвет. Водный раствор CrCl2 имеет синюю окраску. На воздухе в водных растворах соединения Cr(II) переходят в соединения Cr(III). Особенно это ярко выражается у гидроксида Cr(II):
4Cr(OH)2 + 2H2O + O2 = 4Cr(OH)3
Соединения трехвалентного хрома.
Оксид хрома (III) Cr2O3 – тугоплавкий порошок зеленого цвета. По твердости близок к корунду. В лаборатории его можно получить нагреванием дихромата аммония:
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2
Cr2O3 – амфотерный оксид, при сплавлении со щелочами образует хромиты: Cr
Гидроксид хрома также является амфотерным соединением:
Cr(OH)3 + HCl = CrCl3 + 3H2O
Cr(OH)3 + NaOH = NaCrO2 + 2H2O
Безводный CrCl3 имеет вид листочков темно-фиолетового цвета, совершенно нерастворим в холодной воде, при кипячении он растворяется очень медленно. Безводный сульфат хрома (III) Cr2(SO4)3 розового цвета, также плохо растворим в воде. В присутствии восстановителей образует фиолетовый сульфат хрома Cr2(SO4)3*18H2O. Известны также зеленые гидраты сульфата хрома, содержащие меньшее количество воды. Хромовые квасцы KCr(SO
Реакции с хромом и его соединениями
Почти все соединения хрома и их растворы интенсивно окрашены. Имея бесцветный раствор или белый осадок, мы можем с большой долей вероятности сделать вывод об отсутствии хрома.
- Сильно нагреем в пламени горелки на фарфоровой чашке такое количество бихромата калия, которое поместится на кончике ножа. Соль не выделит кристаллизационной воды, а расплавится при температуре около 4000С с образование темной жидкости. Погреем ее еще несколько минут на сильном пламени. После охлаждения на черепке образуется зеленый осадок. Часть его растворим в воде ( она приобретает желтый цвет), а другую часть оставим на черепке. Соль при нагревании разложилась, в результате образовался растворимый желтый хромат калия K
- Растворим 3г порошкообразного бихромата калия в 50мл воды. К одной части добавим немного карбоната калия. Он растворится с выделением CO2, а окраска раствора станет светло – желтой. Из бихромата калия образуется хромат. Если теперь по порциям добавить 50% раствор серной кислоты, то снова появится красно – желтая окраска бихромата.
- Нальем в пробирку 5мл. раствора бихромата калия, прокипятим с 3мл концентрированной соляной кислоты под тягой. Из раствора выделяется желто-зеленый ядовитый газообразный хлор, потому, что хромат окислит HCl до Cl
- При добавлении раствора нитрата свинца выпадает желтый хромат свинца; при взаимодействии с раствором нитрата серебра образуется красно – коричневый осадок хромата серебра.
- Добавим пероксид водорода к раствору бихромата калия и подкислим раствор серной кислотой. Раствор приобретает глубокий синий цвет благодаря образованию пероксида хрома. Пероксид при взбалтывании с некоторым количеством эфира перейдет в органический растворитель и окрасит его в голубой цвет. Данная реакция специфична для хрома и очень чувствительна. С ее помощью можно обнаружить хром в металлах и сплавах. Прежде всего необходимо растворить металл. При длительном кипячении с 30% — ной серной кислотой (можно добавить и соляную кислоту) хром и многие стали частично растворяются. Полученный раствор содержит сульфат хрома (III). Чтобы можно было провести реакцию обнаружения, сначала нейтрализуем его едким натром. В осадок выпадает серо-зеленый гидроксид хрома (III), который растворится в избытке NaOH и образует зеленый хромит натрия. Профильтруем раствор и добавим 30% -ый пероксид водорода. При нагревании раствор окрасится в желтый цвет, так как хромит окислится до хромата. Подкисление приведет к появлению голубой окраски раствора. Окрашенное соединение можно экстрагировать, встряхивая с эфиром.
Аналитические реакции на ионы хрома.
- К 3-4 каплям раствора хлорида хрома CrCl3 прибавьте 2М раствор NaOH до растворения первоначально выпавшего осадка. Обратите внимание на цвет образовавшегося хромита натрия. Нагрейте полученный раствор на водяно бане. Что при этом происходит?
- К 2-3 каплям р-ра CrCl3 прибавьте равный объем 8М раствора NaOH и 3-4 капли 3% р-ра H2O2. Нагрейте реакционную смесь на водяной бане. Что при этом происходит? Какой осадок образуется, если полученный окрашеный раствор нейтрализовать, добавить к нему CH3COOH, а затем Pb(NO3)2?
- Налейте в пробирку по 4-5 капель растворов сульфата хрома Cr2(SO4)3, IMH2SO4 и KMnO4. Нагрейте реакционную смест в течение нескольких минут на водяной бане. Обратите внимание на изменение окраски раствора. Чем оно вызвано?
- К 3-4 каплям подкисленного азотной кислотой раствора K2Cr2O7 прибавьте 2-3 капли раствора H2O2 и перемешайте. Появляющиеся синее окрашивание раствора обусловлено возникновением надхромовой кислоты H2CrO6:
Cr2O72- + 4H2O2 + 2H+ = 2H2CrO6 + 3H2O
Обратите внимание на на быстрое разложение H2CrO6:
2H2CrO6 + 8H+ = 2Cr3+ + 3O2 + 6H2O
синий цвет зеленый цвет
Надхромовая кислота значительно более устойчива в органических растворителях.
- К 3-4 каплям подкисленного азотной кислотой раствора K2Cr2O7 прибавьте 5 капель изоамилового спирта, 2-3 капли раствора H2O2 и взболтайте реакционную смесь. Всплывающий на верх слой органического растворителя окрашен в ярко-синий цвет. Окраска исчезает очень медленно. Сравните устойчивость H2CrO6 в органической и водных фазах.
- При взаимодействии CrO42- и ионами Ba2+ выпадает желтый осадок хромата бария BaCrO4.
- Нитрат серебра образует с ионами CrO42- осадок хромата серебра кирпично-красного цвета.
- Возьмите три пробирки. В одну из них поместите 5- 6 капель раствора K2Cr2O7, во вторую – такой же объем раствора K2CrO4, а в третью – по три капли обоих растворов. Затем добавте в каждую пробирку по три капли раствора иодида калия. Объясните полученный результат. Подкислите раствор во второй пробирке. Что при этом происходит? Почему?
Занимательные опыты с соединениями хрома
- Смесь CuSO4 и K2Cr2O7 при добавлении щелочи становится зеленой, а в присутствии кислоты становится желтой. Нагревая 2мг глицерина с небольшим количеством (NH4)2Cr2O7 с последующим добавлением спирта, после фильтрования получается ярко-зеленый раствор, который при добавлении кислоты становится желтым, а в нейтральной или щелочной среде становится зеленым.
- Поместить в центр консервной банки с термитом «рубиновую смесь» — тщательно растертый и помещенный в алюминиевую фольгу Al2O3 (4,75г) с добавкой Cr2O3(0,25г). Чтобы банка подольше не остывала, необходимо закопать под верхний обрез в песок, а после поджигания термита и начала реакции, накрыть ее железным листом и засыпать песком. Банку выкопать через сутки. В итоге образуется красно – рубиновый порошок.
- 10г бихромата калия растирают с 5г нитрата натрия или калия и 10г сахара. Смесь увлажняют и смешивают с коллодием. Если порошок спрессовать в стеклянной трубке, а затем вытолкнуть палочку и поджечь ее с торца, то начнет выползать «змея», сначала черная, а после охлаждения — зеленая. Палочка диаметром 4 мм горит со скоростью около 2мм в секунду и удлиняется в 10 раз.
- Если смешать растворы сульфата меди и дихромата калия и добавить немного раствора аммиака, то выпадет аморфный коричневый осадок состава 4СuCrO4 * 3NH3 * 5H2O, который растворяется в соляной кислоте с образованием желтого раствора, а в избытке аммиака получается зеленый раствор. Если далее к этому раствору добавить спирт, то выпадет зеленый осадок, который после фильтрации становится синим, а после высушивания – сине-фиолетовым с красными блестками, хорошо видимыми при сильном освещении.
- Оставшийся после опытов «вулкан» или «фараоновы змеи» оксид хрома можно регенерировать. Для этого надо сплавить 8г Cr2O3 и 2г Na2CO3 и 2,5г KNO3 и обработать остывший сплав кипятком. Получается растворимый хромат, который можно превратить и в другие соединения Cr(II) и Cr(VI), в том числе и исходный дихромат аммония.
Примеры окислительно – восстановительных переходов с участием хрома и его соединений
1. Cr2O72- — Cr2O3 — CrO2— — CrO42- — Cr2O72-
a) (NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O б) Cr2O3 + 2NaOH = 2NaCrO2 + H2O
б) Cr2O3 + 2NaOH = 2NaCrO2 + H2O
в) 2NaCrO2 + 3Br2 + 8NaOH = 6NaBr +2Na2CrO4 + 4H2O
г) 2Na2CrO4 + 2HCl = Na2Cr2O7 + 2NaCl + H2O
2. Cr(OH)2 — Cr(OH)3 — CrCl3 — Cr2O72- — CrO42-
а) 2Cr(OH)2 + 1/2O2 + H2O = 2Cr(OH)3
б) Cr(OH)3 + 3HCl = CrCl3 + 3H2O
в) 2CrCl3 + 2KMnO4 + 3H2O = K2Cr2O7 + 2Mn(OH)2 + 6HCl
г) K2Cr2O7 + 2KOH = 2K2CrO4 + H2O
3. CrO — Cr(OH)2 — Cr(OH)3 — Cr(NO3)3 — Cr2O3 — CrO—2
Cr2+
а) CrO + 2HCl = CrCl2 + H2O
б) CrO + H2O = Cr(OH)2
в) Cr(OH)2 + 1/2O2 + H2O = 2Cr(OH)3
г) Cr(OH)3 + 3HNO3 = Cr(NO3)3 + 3H2O
д) 4Сr(NO3)3 = 2Cr2O3 + 12NO2 + O2
е) Cr2O3 + 2 NaOH = 2NaCrO2 + H2O
Элемент хром в роли художника
Химики довольно часто обращались к проблеме создания искусственных пигментов для живописи. В XVIII-XIXвв была разработана технология получения многих живописных материалов. Луи Никола Воклен в 1797г., обнаруживший в сибирской красной руде ранее неизвестный элемент хром, приготовил новую, замечательно устойчивую краску – хромовую зелень. Хромофором ее является водный оксид хрома (III). Под названием « изумрудная зеленая» ее начали выпускать в 1837 году. Позже Л.Вокелен предложил несколько новых красок: баритовую, цинковую и хромовые желтые. Со временем они были вытеснены более стойкими желтыми, оранжевыми пигментами на основе кадмия.
Зеленая хромовая – самая прочная и светостойкая краска, не поддающаяся воздействию атмосферных газов. Растертая на масле хромовая зелень обладает большой кроющей силой и способна к быстрому высыханию, поэтому с XIX в. ее широко применяют в живописи. Огромное значение она имеет в росписи фарфора. Дело в том, что фарфоровые изделия могут декорироваться как подглазурной, так и надглазурной росписью. В первом случае краски наносят на поверхность лишь слегка обожженного изделия, которое затем покрывают слоем глазури. Далее следует основной, высокотемпературный обжиг: для спекания фарфоровой массы и оплавления глазури изделия нагревают до 1350 – 14500С. Столь высокую температуру без химических изменений выдерживают очень немногие краски, а в старину таких вообще было только две – кобальтовая и хромовая. Черный оксид кобальта, нанесенный на поверхность фарфорового изделия, при обжиге сплавляется с глазурью, химически взаимодействуя с ней. В результате образуются ярко-синие силикаты кобальта. Такую декарированную кобальтом синюю фарфоровую посуду все хорошо знают. Оксид хрома (III) не взаимодействует химически с компонентами глазури и просто залегает между фарфоровыми черепками и прозрачной глазурью «глухим» слоем.
Помимо хромовой зелени художники применяют краски, полученные из волконскоита. Этот минерал из группы монтмориллонитов (глинистый минерал подкласса сложных силикатов Na(Mo,Al), Si4O10(OH)2 был обнаружен в 1830г. русским минералогом Кеммерером и назван в честь М.Н Волконской – дочери героя битвы при Бородино генерала Н.Н. Раевского, жены декабриста С.Г.Волконского. Волконскоит представляет собой глину, содержащую до 24% оксида хрома, а так же оксиды аллюминея и железа (III). Непостоянство состава минерала, встечающегося на Урале, в Пермской и Кировской областях, обусловливает его разнообразную окраску – от цвета зимней потемневшей пихты до ярко-зеленого цвета болотной лягушки.
Пабло Пикассо обращался к геологам нашей страны с просьбой изучить запасы волконскоита, дающего краску неповторимо свежего тона. В настоящее время разработан способ получения искусственного волконскоита. Интересно отметить, что по данным современных исследований, русские иконописцы использовали краски из этого материала еще в средние века, задолго до его «официального» открытия. Известной популярностью пользовалась у художников и зелень Гинье (создана в 1837г.), хромоформ которой является гидрат окиси хрома Cr2O3 * (2-3) H2O, где часть воды химически связана, а часть адсорбирована. Этот пигмент придает краске изумрудный оттенок.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
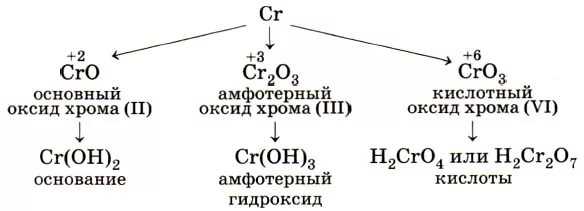
Характеристика и качества хрома
Хром (Cr), химический элемент VI группы периодической системы Менделеева. Относится к переходным металлом с атомным номером 24 и атомной массой 51,996. В переводе с греческого, название металла означает «цвет». Такому названию металл обязан разнообразной цветовой гамме, которая присуща его различным соединениям.

Физические характеристики хрома
Металл обладает достаточной твердостью и хрупкостью одновременно. По шкале Мооса твердость хрома оценивается в 5,5. Этот показатель означает, что хром имеет максимальную твердость из всех известных на сегодня металлов, после урана, иридия, вольфрама и бериллия. Для простого вещества хрома характерен голубовато-белый окрас.
| Атомный номер | 24 |
| Атомная масса | 51,996 |
| Плотность, кг/м³ | 7190 |
| Температура плавления, °С | 1856 |
| Теплоемкость, кДж/(кг·°С) | 0,46 |
| Электроотрицательность | 1,6 |
| Ковалентный радиус, Å | 1,18 |
| 1-й ионизац. потенциал, эв | 6,76 |
Металл не относится к редким элементам. Его концентрация в земной коре достигает 0,02% масс. долей. В чистом виде хром не встречается никогда. Он содержится в минералах и рудах, которые являются главным источником добычи металла. Хромит (хромистый железняк, FeO*Cr2O3) считается основным соединением хрома. Еще одним достаточно распространенным, однако менее важным минералом, является крокоит PbCrO4.
Металл легко поддается плавке при температуре 19070С (21800К или 34650F). При температуре в 26720С – закипает. Атомная масса металла составляет 51,996 г/моль.
Хром является уникальным металлом благодаря своим магнитным свойствам. В условиях комнатной температуры ему присуще антиферромагнитное упорядочение, в то время, как другие металлы обладают им в условиях исключительно пониженных температур. Однако, если хром нагреть выше 370С, физические свойства хрома изменяются. Так, существенно меняется электросопротивление и коэффициент линейного расширения, модуль упругости достигает минимального значения, а внутреннее трение значительно увеличивается. Такое явление связано с прохождением точки Нееля, при которой антиферромагнитные свойства материала способны изменяться на парамагнитные. Это означает, что первый уровень пройден, и вещество резко увеличилось в объеме.
Строение хрома представляет собой объемно-центрированную решетку, благодаря которой металл характеризуется температурой хрупко-вязкого периода. Однако, в случае с данным металлом, огромное значение имеет степень чистоты, поэтому, величина находится в пределах -500С — +3500С. Как показывает практика, раскристаллизированный металл не имеет никакой пластичности, но мягкий отжиг и формовка делают его ковким.
Химические свойства хрома
Атом имеет следующую внешнюю конфигурацию: 3d54s1. Как правило, в соединениях хром имеет следующие степени окисления: +2, +3, +6, среди которых наибольшую устойчивость проявляет Сr3+.Кроме этого существуют и другие соединения, в которых хром проявляет совершенно иную степень окисления, а именно: +1, +4, +5.
Металл не отличается особой химической активностью. Во время нахождения хрома в обычных условиях, металл проявляет устойчивость к влаге и кислороду. Однако, данная характеристика не относится к соединению хрома и фтора – CrF3, которое при воздействии температур, превышающих 6000С, взаимодействует с парами воды, образуя в результате реакции Сr2О3, а также азотом, углеродом и серой.
Во время нагревания металлического хрома, он взаимодействует с галогенами, серой, кремнием, бором, углеродом, а также некоторыми другими элементами, в результате чего получаются следующие химические реакции хрома:
Cr + 2F2 = CrF4 (с примесью CrF5)
2Cr + 3Cl2 = 2CrCl3
2Cr + 3S = Cr2S3
Хроматы можно получить, если нагреть хром с расплавленной содой на воздухе, нитратами или хлоратами щелочных металлов:
2Cr + 2Na2CO3 + 3O2 = 2Na2CrO4 + 2CO2.
Хром не обладает токсичностью, чего нельзя сказать о некоторых его соединениях. Как известно, пыль данного металла, при попадании в организм, может раздражать легкие, через кожу она не усваивается. Но, поскольку в чистом виде он не встречается, то его попадание в человеческий организм является невозможным.
Трехвалентный хром попадает в окружающую среду во время добычи и переработки хромовой руды. В человеческий организм попадание хрома вероятно в виде пищевой добавки, используемой в программах по похудению. Хром с валентностью, равной +3, является активным участником синтеза глюкозы. Ученые установили, что излишнее употребление хрома особого вреда человеческому организму не наносит, поскольку не происходит его всасывание, однако, он способен накапливаться в организме.
Соединения, в котором участвует шестивалентный металл, являются крайне токсичными. Вероятность их попадания в человеческий организм появляется во время производства хроматов, хромирования предметов, во время проведения некоторых сварочных работ. Попадание такого хрома в организм чревато серьезными последствиями, так как соединения, в которых присутствует шестивалентный элемент, представляют собой сильные окислители. Поэтому, могут вызвать кровотечение в желудке и кишечнике, иногда с прободением кишечника. При попадании таких соединений на кожу возникают сильные химические реакции в виде ожогов, воспалений, возникновения язв.
В зависимости от качества хрома, которое необходимо получить на выходе, существует несколько способов производства металла: электролизом концентрированных водных растворов оксида хрома, электролизом сульфатов, а также восстановлением оксидом кремния. Однако, последний способ не очень популярен, так как при нем на выходе получается хром с огромным количеством примесей. Кроме того, он также является экономически невыгодным.
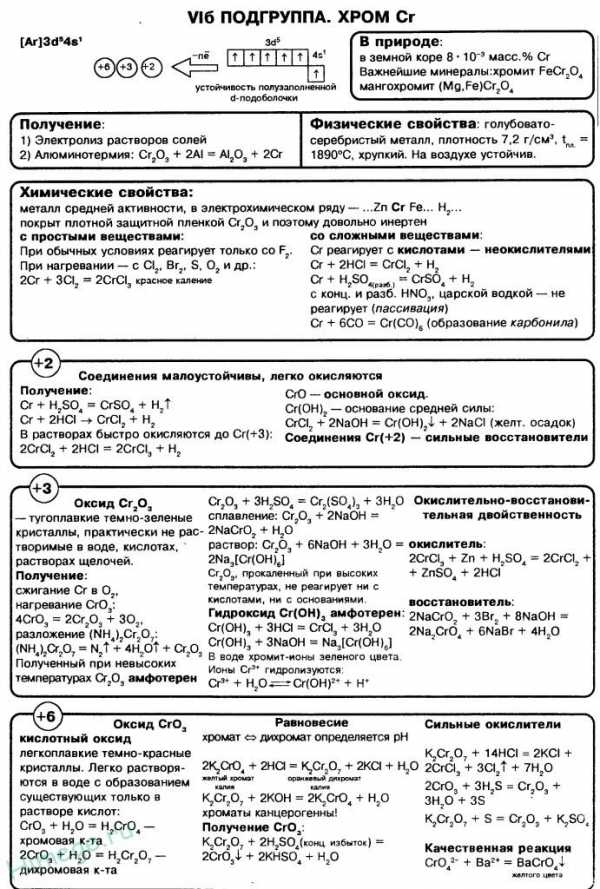
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
| +2 | CrO (чёрный) | Cr(OH)2 (желтый) | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
|
+3 |
Cr2O3 (зелёный) | Cr(OH)3 (серо-зеленый) | Амфотерный |
Cr3+ (зеленые или лиловые соли) |
|
| +4 | CrO2 | не существует | Несолеобразующий | — |
Встречается редко, малохарактерна |
| +6 | CrO3 (красный) |
h3CrO4 |
Кислотный |
CrO42- (хроматы, желтые) |
Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. |
mining-prom.ru
Краска хром — виды и технология окрашивания
Чтобы создать на поверхности эффект полированного металла, существуют специализированные средства. Краска, имитирующая хром, своими свойствами обязана микроскопическим металлическим частицам, входящим в ее состав. При правильном нанесении получается идеально зеркальная поверхность, устойчивая к негативным воздействиям.

Игра с цветом
Хром-краска имеет несколько видов, каждый из которых обеспечивает качественный эффект хромирования благодаря высокой отражающей способности содержащегося металлического порошка. Чаще всего встречается минеральная хромовая краска, в состав которой входит алюминиевая пудра. Выпускаются эти красители либо в банках для применения с помощью краскопульта, либо в виде аэрозоля. Второй вариант лучше всего подходит для окрашивания своими руками. Существует также порошковая краска, особо долговечная и термостойкая.
Помимо мельчайших частиц металла, выступающих в качестве наполнителя, в средстве присутствует алкидный либо нитроцеллюлозный лак-основа, надежно связывающий их при нанесении как между собой, так и с поверхностью. Важнейшее свойство – зеркальная отражающая способность – обеспечивается не только применением порошка, но и оригинальными свойствами лака, позволяющими равномерно распределить состав. Помимо того, что хромированное покрытие выглядит намного эффектнее, чем матовое, оно обладает свойством термостойкой защиты и немалой прочностью.
В зависимости от добавленных красителей различают несколько видов покрытий:
- Чаще всего встречается покраска хромом в классической вариации, имеющая белый зеркальный блеск, похожий на полированное серебро. В этом случае хромирования никаких дополнительных красителей не подмешивается.
- Нередко можно увидеть золотой хром. Благородный оттенок достигается благодаря использованию в составе краски частиц желтого металла. При полном высыхании такая смесь образует зеркальный золотой металлик.
- Кроме двух основных вариантов, существует возможность экспериментирования с цветом. Покраска под хром иных тонов осуществляется путем введения в лак определенного объема пигмента требующегося оттенка.
- Оригинальным эффектом, которому стоит уделить особое внимание, обладает черный хром. Такая краска содержит в дополнение к алюминиевому порошку темный полупрозрачный пигмент.
Все перечисленные типы имеют при высыхании глянцевую зеркальную поверхность, напоминающую жидкое серебро. Существует сильно отличающаяся от них разновидность – матовый хром. Это достаточно популярный вид окрашивания, нередко используемый для деталей интерьера. Красивый матовый эффект получается при некотором изменении состава краски, придающем отражающей способности некоторое рассеивание.
к содержанию ↑Хром-хамелеон
Помимо привычных металлизированных хром-красок, придающих эффект зеркального блеска и матового покрытия, разработаны составы с иными интересными свойствами. К таким средствам относится термохромная краска. Главная ее особенность в том, что она меняет свой цвет при изменении воздействующей на нее температуры, одновременно являясь достаточно термостойкой. Цвета и оттенки при этом очень разнообразны, возможен матовый эффект, покрытие может даже становиться прозрачным.
Классифицируется термохромная краска двумя методами: по виду изменения цвета и по обратимости этого изменения. В первом случае выделяются три разновидности:
- Покрытие, будучи изначально прозрачным, приобретает определенный тон при отклонении от комнатной температуры в сторону нагрева или охлаждения.
- Обратный вариант: краска, являющаяся цветной, обретает прозрачность при различных температурных колебаниях.
- По мере изменения окружающей температуры цвет состава обладает свойством постепенно переходить из одного в другой.
По второму признаку термохромная краска разделяется на обратимую и необратимую. Как нетрудно понять из названия, обратимая сменяет цвет сколько угодно раз, а необратимая – лишь единожды.

Оригинальность данного состава, тем не менее не нашла широкого применения. Причиной послужили немалая стоимость и трудоемкий способ окрашивания. В основном краска с эффектом хамелеон используется для изготовления сувенирной продукции, к примеру, кружек с интересными матовыми и глянцевыми рисунками, которые можно увидеть, лишь налив внутрь горячий напиток. На упаковках некоторых продуктов питания находятся специальные метки, выполненные термохромной краской, позволяющие осуществлять контроль над температурным режимом хранения.
к содержанию ↑Технология окрашивания
Стоит остановиться на том, как покрасить хром-краской детали кузова автомобиля своими руками. Прежде всего, важна подготовка поверхности, особенно в том случае, если она не матовая, а глянцевая. Ведь на гладкой, как зеркало, детали даже самые микроскопические дефекты станут сильно заметны. Нужно обязательно позаботиться о том, чтобы в помещении отсутствовала пыль, иначе все старания будут напрасны.

Проверив эти условия, можно переходить непосредственно к покраске.
Жидкий акриловый состав имеет свои плюсы – он термостойкий, выдерживает химические воздействия, влажность, и в отличие от порошкового варианта, можно нанести его только на часть детали, сделав ее разноцветной.
Сам процесс заключается в следующем:
- Загрунтованную поверхность детали покрыть слоем черного красителя.
- Когда он высохнет, произвести полировку.
- Аэрозолем нанести необходимое количество слоев хром-краски с промежуточной просушкой каждого из них.
- В заключение обработать деталь лаком.
Порошковая краска – несколько иной состав, благодаря чему имеет повышенные показатели прочности: она устойчива к растворителям, менее подвержена возникновению ржавчины, термостойкая и долговечная.

Литые автомобильные диски окрашиваются именно с применением порошковой технологии. Современные разработки позволяют выполнить этот процесс своими руками в гаражных условиях, так как они не требуют высокой температуры воздействия. Вся процедура заключается в четырех этапах:
- тщательной очистке деталей;
- покрытии грунтовкой;
- сушке;
- нанесении порошковой краски.
Помимо литых дисков, термостойкую хром-краску в виде порошка можно наносить и на иные металлические детали.
Широкий выбор существующих видов хром-краски и обширная цветовая палитра позволяют создать качественное покрытие на любой вкус. Можно собственноручно нанести как порошковый вариант, так и аэрозоль, создав глянцевый или матовый эффект. При должном умении не составит труда воплотить в жизнь любую идею.
kraska.guru
Хром цвет. TERMA BONE (metallic black, белый, хром, цвет RAL) водяные и электрические
хром — это… Что такое хром?
ХРОМ -а; м. [от греч. chrōma — цвет, краска]
1. Химический элемент (Сr), твёрдый металл серо-стального цвета (используется при изготовлении твёрдых сплавов и для покрытия металлических изделий).
2. Мягкая тонкая кожа, выдубленная солями этого металла. Сапоги из хрома.
◁ Хро́мовый (см.).
ХРОМ (лат. chromium, от греческого хрома — цвет, окраска, для соединений хрома характерна широкая цветовая палитра), Cr (читается «хром»), химический элемент с атомным номером 24, атомная масса 51,9961. Расположен в группе VIB в 4 периоде периодической системы элементов. Природный хром состоит из смеси четырех стабильных нуклидов: 50Cr (содержание в смеси 4,35%), 52Cr (83,79%), 53Cr (9,50%) и 54Cr (2,36%). Конфигурация двух внешних электронных слоев 3s2р6d54s1. Степени окисления от 0 до +6 , наиболее характерны +3 (самая устойчивая) и +6 (валентности III и VI). Радиус нейтрального атома 0,127 нм, радиус ионов (координационное число 6): Cr2+ 0,073 нм, Cr3+ 0,0615 нм, Cr4+ 0,055 нм, Cr5+ 0,049 нм и Cr6+0,044 нм. Энергии последовательной ионизации 6,766, 16,49, 30,96, 49,1, 69,3 и 90,6 эВ. Сродство к электрону 1,6 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 1,66. История открытия В 1766 в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO4. Современное название — крокоит. В 1797 французский химик Л. Н. Воклен (см. ВОКЛЕН Луи Никола) выделил из него новый тугоплавкий металл (скорее всего Воклен получил карбид хрома). Нахождение в природе Содержание в земной коре 0,035 % по массе. В морской воде содержание хрома 2·10-5 мг/л. В свободном виде хром практически не встречается. Входит в состав более 40 различных минералов (хромит FeCr2O4, волконскоит, уваровит, вокеленит и др.). Некоторые метеориты содержат сульфидные соединения хрома. Получение Промышленным сырьем при производстве хрома и сплавов на его основе служит хромит. Восстановительной плвкой хромита с коксом (восстановителем), железной рудой и другими компонентами получают феррохром с содержанием хрома до 80% (по массе). Для получения чистого металлического хрома хромит с содой и известняком обжигают в печах: 2Cr2O3 + 2Na2CO3+ 3O2 = 4Na2CrO4 + 4CO2Образующийся хромат натрия Na2CrO4 выщелачивают водой, раствор фильтруют, упаривают и обрабатывают кислотой. При этом хромат Na2CrO4 переходит в дихромат Na2Cr2O7: 2Na2CrO4 + h4SO4 = Na2Cr2O7 + Na2SO4 + h4O Полученный дихромат восстанавливают серой: Na2Cr2O7 + 3S = Na2S + Cr2O3 + 2SO2, Образующийся чистый оксид хрома(III) Cr2O3 подвергают алюминотермии: Cr2O3 + 2Al = Al2O3 + 2Cr. Также используют кремний: 2Cr2O3 + 3Si = 3SiO2 + 4Cr Для получения хрома высокой чистоты, технический хром электрохимически очищают от примесей. Физические и химические свойства В свободном виде — голубовато-белый металл с кубической объемно-центрированной решеткой, а = 0,28845 нм. При температуре 39°C переходит из парамагнитного состояния в антиферромагнитное (точка Нееля). Температура плавления 1890°C, температура кипения 2680°C. Плотность 7,19 кг/дм3. Устойчив на воздухе. При 300°C сгорает с образованием зеленого оксида хрома (III) Cr2O3, обладающего амфотерными свойствами. Сплавляя Cr2O3 со щелочами получают хромиты: Cr2O3 + 2NaOH = 2NaCrO2 + h4O Непрокаленный оксид хрома (III) легко растворяется в щелочных растворах и в кислотах: Cr2O3 + 6НСl = 2CrСl3 + 3Н2О При термическом разложении карбонила хрома Cr(OH)6 получают красный основной оксид хрома(II) CrO. Коричневый или желтый гидроксид Cr(OН)2 со слабоосновными свойствами осаждается при добавлении щелочей к растворам солей хрома(II). При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают диоксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью. При взаимодействии концентрированной серной кислоты с растворами дихроматов образуются красные или фиолетово-красные кристаллы оксида хрома(VI) CrO3. Типично кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовая h4CrO4, дихромовая h4Cr2O7 и другие. Известны галогениды, соответствующие разным степеням окисления хрома. Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и СrI2 и тригалогениды CrF3, CrCl3, CrBr3 и СrI3. Однако, в отличие от аналогичных соединений алюминия и железа, трихлорид CrCl3 и трибромид CrBr3 хрома нелетучи. Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах. Известен гексафторид хрома CrF6. Получены и охарактеризованы оксигалогениды хрома CrO2F2 и CrO2Cl2. Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N). В растворах наиболее устойчивы соединения хрома(III). В этой степени окисления хрому соответствуют как катионная форма, так и анионные формы, например, существующий в щелочной среде анион [Cr(OH)6]3-. При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI): 2Na3[Cr(OH)6] + 3h4O2 = 2Na2CrO4+ 2NaOH + 8h4O Cr (VI) отвечает ряд существующих только в водных растворах кислот: хромовая h4CrO4, дихромовая h4Cr2O7, трихромовая h5Cr3O10 и другие, которые образуют соли — хроматы, дихроматы, трихроматы и т. д. В зависимости от кислотности среды анионы этих кислот легко превращаются друг в друга. Например, при подкислении желтого раствора хромата калия K2CrO4 образуется оранжевый дихромат калия K2Cr2O7: 2K2CrO4 + 2НСl = K2Cr2O7 + 2КСl + Н2О Но если к оранжевому раствору K2Cr2O7 прилить раствор щелочи, как окраска вновь переходит в желтую т. к. снова образуется хромат калия K2CrO4: K2Cr2O7 + 2КОН = 2K2CrO4 + Н2О При добавлении к желтому раствору, содержащему хромат-ионы, раствора соли бария выпадает желтый осадок хромата бария BаCrO4: Bа2+ + CrO42- = BаCrO4Соединения хрома(III)— сильные окислители, например: K2Cr2O7 + 14 НСl = 2CrCl3+ 2KCl + 3Cl2 + 7h4O Применение Использование хрома основано на его жаропрочности, твердости и устойчивости к коррозии. Применяют для получения сплавов: нержавеющей стали, нихрома и др. Большое количество хрома идет на декоративные коррозионно-стойкие покрытия. Соединения хрома — огнеупорные материалы. Оксид хрома (III) — пигмент зеленой краски, также входит в состав абразивных материалов (паст ГОИ). Изменение окраски при восстановлении соединений хрома(VI) применяют для проведения экспресс-анализа на содержание алкоголя в выдыхаемом воздухwww.consei.ru
Химические свойства
«Национальный исследовательский Томский политехнический Университет»

Институт природных ресурсов Геоэкология и геохимия
РЕФЕРАТ
Хром
по дисциплине:
Химия
Выполнил:
студент группы 2Г41 Ткачева Анастасия Владимировна 29.10.2014
Проверил:
преподаватель Стась Николай Федорович
Томск 2014
Положение в периодической системе
Хром — элемент побочной подгруппы 6-ой группы 4-го периода периодической системы химических элементов Д. И. Менделеева с атомным номером 24. Обозначается символом Cr(лат. Chromium). Простое вещество хром — твёрдый металлголубовато-белого цвета. Хром иногда относят к чёрным металлам.
Строение атома
+17 Cl )2 )8 )7 — схема строения атома
1s2s2p3s3p- электронная формула
Атом располагается в III периоде, и имеет три энергетических уровня
Атом располагается в VII в группе, в главной подгруппе – на внешнем энергетическом уровне 7 электронов
Свойства элемента
Физические свойства
Хром — белый блестящий металл с кубической объемно-центрированной решеткой, а = 0,28845 нм, отличающийся твердостью и хрупкостью, с плотностью 7,2 г/см3, один из самых твердых чистых металлов (уступает только бериллию, вольфраму и урану), с температурой плавления 1903 град. И с температурой кипения около 2570 град. С. На воздухе поверхность хрома покрывается оксидной пленкой, которая предохраняет его от дальнейшего окисления. Добавка углерода к хрому еще больше увеличивает его твердость.
Хром при обычных условиях – инертный металл, при нагревании становится довольно активным.
Взаимодействие с неметаллами
При нагревании выше 600°С хром сгорает в кислороде:
4Cr + 3O2 = 2Cr2O3.
С фтором реагирует при 350°С, с хлором – при 300°С, с бромом – при температуре красного каления, образуя галогениды хрома (III):
2Cr + 3Cl2 = 2CrCl3.
С азотом реагирует при температуре выше 1000°С с образованием нитридов:
2Cr + N2 = 2CrN
или 4Cr + N2 = 2Cr2N.
Сера при температуре выше 300°С образует сульфиды от CrS до Cr5S8, например:
2Cr + 3S = Cr2S3.
Реагирует с бором, углеродом и кремнием с образованием боридов, карбидов и силицидов:
Cr + 2B = CrB2 (возможно образование Cr2B, CrB, Cr3B4, CrB4),
2Cr + 3C = Cr2C3 (возможно образование Cr23C6, Cr7B3),
Cr + 2Si = CrSi2 (возможно образование Cr3Si, Cr5Si3, CrSi).
С водородом непосредственно не взаимодействует.
Взаимодействие с водой
В тонкоизмельченном раскаленном состоянии хром реагирует с водой, образуя оксид хрома (III) и водород:
2Cr + 3H2O = Cr2O3 + 3H2
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов хром находится до водорода, он вытесняет водород из растворов неокисляющих кислот:
Cr + 2HCl = CrCl2 + H2;
Cr + H2SO4 = CrSO4 + H2.
В присутствии кислорода воздуха образуются соли хрома (III):
4Cr + 12HCl + 3O2 = 4CrCl3 + 6H2O.
Концентрированная азотная и серная кислоты пассивируют хром. Хром может растворяться в них лишь при сильном нагревании, образуются соли хрома (III) и продукты восстановления кислоты:
2Cr + 6H2SO4 = Cr2(SO4)3 + 3SO2 + 6H2O;
Cr + 6HNO3 = Cr(NO3)3 + 3NO2 + 3H2O.
Взаимодействие с щелочными реагентами
В водных растворах щелочей хром не растворяется, медленно реагирует с расплавами щелочей с образованием хромитов и выделением водорода:
2Cr + 6KOH = 2KCrO2 + 2K2O + 3H2.
Реагирует с щелочными расплавами окислителей, например хлоратом калия, при этом хром переходит в хромат калия:
Cr + KClO3 + 2KOH = K2CrO4 + KCl + H2O.
Восстановление металлов из оксидов и солей
Хром – активный металл, способен вытеснять металлы из растворов их солей: 2Cr + 3CuCl2 = 2CrCl3 + 3Cu.
Свойства простого вещества
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
2Cr→2Cr
Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или желтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (ион [Cr(H2O)6]3+) до зелёного (в координационной сфере присутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
Cr+3NH+3h3O→Cr(OH)↓+3NH
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
Cr+3OH→Cr(OH)↓
Cr(OH)+3OH→[Cr(OH)]
Сплавляя Cr2O3 со щелочами получают хромиты:
Cr2O3+2NaOH→2NaCrO2+h3O
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
Cr2O3+6HCl→2CrCl3+3h3O
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
2Na[Cr(OH)]+3HO→2NaCrO+2NaOH+8HO
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):
2Cr2O3+8NaOH+3O2→4Na2CrO4+4h3O
Соединения хрома (+4)[
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетикоми обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие изополикислоты с общей формулой H2CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
2CrO+2H→Cr2O+h3O
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую так как снова образуется хромат K2CrO4:
Cr2O+2OH→2CrO+HO
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
h3CrnO3n+1→h3O+nCrO3
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, желтый хромат бария BaCrO4 выпадает при добавлении солей бария, как к растворам хроматов, так и к растворам дихроматов:
Ba+CrO→BaCrO↓
2Ba+CrO+h3O→2BaCrO↓+2H
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
K2Cr2O7+14HCl→2CrCl3+2KCl+3Cl2↑+7h3O
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего пероксида хрома CrO5L (L — молекула растворителя), который экстрагируется в органический слой; данная реакция используется как аналитическая.
studfiles.net
Хром №24 химический элемент
Элемент № 24 хром — один из самых твердых металлов. Обладает высокой химической стойкостью. Один из важнейших металлов, используемых в производстве легированных сталей. Большинство соединений хрома имеет яркую окраску, причем самых разных цветов. За эту особенность элемент и был назван хромом, от греческого «хрома» — цвет, краска.
Минерал, содержащий хром, был открыт близ Екатеринбурга в 1766 г. И. Г. Леманном и назван «сибирским красным свинцом». Сейчас этот минерал называется крокоитом. Известен и его состав — PbCrO4. А в свое время «сибирский красный свинец» вызвал немало разногласий среди ученых. Тридцать лет спорили о его составе, пока, наконец, в 1797 г. французский химик Луи Никола Воклен не выделил из него металл, который (тоже, кстати, после некоторых споров) назвали хромом.
Воклен обработал крокоит поташем K2CO3: хромат свинца превратился в хромат калия. Затем с помощью соляной кислоты хромат калия был превращен в окись хрома и воду (хромовая кислота существует только в разбавленных растворах). Нагрев зеленый порошок окиси хрома в графитовом тигле с углем, Воклен получил новый тугоплавкий металл.
Парижская академия наук по всей форме засвидетельствовала открытие. Но, скорее всего, Воклен выделил не элементный хром, а его карбиды. Об этом свидетельствует иглообразная форма полученных Вокленом светлосерых кристаллов.
Название «хром» предложили друзья Воклена, но оно ему не понравилось — металл не отличался особым цветом. Однако друзьям удалось уговорить химика, ссылаясь на то, что из ярко окрашенных соединений хрома можно получать хорошие краски. (Кстати, именно в работах Воклена впервые объяснена изумрудная окраска некоторых природных силикатов бериллия и алюминия; их, как выяснил Воклен, окрашивали примеси соединений хрома.) Так и утвердилось за новым элементом это название.
Между прочим, слог «хром», именно в смысле «окрашенный», входит во многие научные, технические и даже музыкальные термины. Широко известны фотопленки «изопанхром», «панхром» и «ортохром». Слово «хромосома» означает «тело, которое окрашивается». Есть «хроматическая» гамма (в музыке) и есть гармоника «хромка».
В земной коре хрома довольно много — 0,02%. Основной минерал, из которого промышленность получает хром, — это хромовая шпинель переменного состава с общей формулой (Mg, Fe)O-(Cr, Al, Fe)2O3. Хромовая руда носит название хромитов или хромистого железняка (потому, что почти всегда содержит и железо). Залежи хромовых руд есть во многих местах. Наша страна обладает огромными запасами хромитов. Одно из самых больших месторождений находится в Казахстане, в районе Актюбинска; оно открыто в 1936 г. Значительные запасы хромовых руд есть и на Урале.
Хромиты идут большей частью на выплавку феррохрома. Это — один из самых важных ферросплавов, абсолютно необходимый для массового производства легированных сталей.
Царская Россия почти не производила ферросплавов. На нескольких доменных печах южных заводов выплавляли низкопроцентные (по легирующему металлу) ферросилиций и ферромарганец. Да еще на реке Сатке, что течет на Южном Урале, в 1910 г. был построен крошечный заводик, выплавлявший мизерные количества ферромарганца и феррохрома.
России в первые годы прошлого века приходилось ввозить ферросплавы из-за рубежа. Такая зависимость от других стран была недопустимой. Уже в 1927-1928 гг. началось сооружение советских ферросплавных заводов. В конце 1930 г. была построена первая крупная ферросплавная печь в Челябинске, а в 1931 г. вступил в строй Челябинский завод — первенец ферросплавной промышленности СССР. В 1933 г. были пущены еще два завода — в Запорожье и Зестафони. Это позволило прекратить ввоз ферросплавов. Всего за несколько лет в Советском Союзе было организовано производство множества видов специальных сталей — шарикоподшипниковой, жароупорной, нержавеющей, автотракторной, быстрорежущей… Во все эти стали входит хром.
Завод на базе Актюбинского месторождения построен позже, в годы Великой Отечественной войны. Первую плавку феррохрома он дал 20 января 1943 г. В сооружении завода принимали участие трудящиеся города Актюбинска. Феррохром нового завода шел на изготовление металла для танков и пушек, для нужд фронта.
Прошли годы. Сейчас Актюбинский ферросплавный завод — крупное предприятие, выпускающее феррохром всех марок. На заводе выросли высококвалифицированные национальные кадры металлургов. Из года в год завод и хромитовые рудники наращивают мощность, обеспечивая нашу черную металлургию высококачественным феррохромом.
В нашей стране есть уникальное месторождение природнолегированных железных руд, богатых хромом и никелем. Оно находится в оренбургских степях. На базе этого месторождения построен и работает Орско-Халиловский металлургический комбинат. В доменных печах комбината выплавляют природнолегированный чугун, обладающий высокой жароупорностью. Частично его используют в виде литья, но большую часть отправляют на передел в никелевую сталь; хром при выплавке стали из чугуна выгорает.
Хромит применяется преимущественно в трех отраслях промышленности: металлургии, химии и производстве огнеупоров, причем металлургия потребляет примерно две трети всего хромита. Сталь, легированная хромом, обладает повышенной прочностью, стойкостью против коррозии в агрессивных и окислительных средах.
Получение чистого хрома — дорогой и трудоемкий процесс. Поэтому для легирования стали применяют главным образом феррохром, который получают в дуговых электропечах непосредственно из хромита. Восстановителем служит кокс. Содержание окиси хрома в хромите должно быть не ниже 48%, а отношение Cr: Fe не менее 3:1.
Полученный в электропечи феррохром обычно содержит до 80% хрома и 4-7% углерода (остальное — железо). Но для легирования многих качественных сталей нужен феррохром, содержащий мало углерода (о причинах этого — ниже, в главе «Хром в сплавах»). Поэтому часть высокоуглеродистого феррохрома подвергают специальной обработке, чтобы снизить содержание углерода в нем до десятых и сотых долей процента.
Из хромита получают и элементный, металлический хром. Производство технически чистого хрома (97-99%) основано на методе алюминотермии, открытом еще в 1865 г. известным русским химиком Н. Н. Бекетовым. Сущность метода — в восстановлении окислов алюминием, реакция сопровождается значительным выделением тепла. Но предварительно надо получить чистую окись хрома Cr2O3. Для этого тонко измельченный хромит смешивают с содой и добавляют к этой смеси известняк или окись железа. Вся масса обжигается, причем образуется хромат натрия:
2Cr2O3 + 4Na2CO3 + 3O2 → 4Na2CrO4 + 4CO2.
Затем хромат натрия выщелачивают из обожженной массы водой; щелок фильтруют, упаривают и обрабатывают кислотой. В результате получается бихромат натрия Na2Cr2O7. Восстанавливая его серой или углеродом при нагревании, получают зеленую окись хрома.
Металлический хром можно получить, если чистую окись хрома смешать с порошком алюминия, нагреть эту смесь в тигле до 500-600°С и поджечь с помощью перекиси бария. Алюминий отнимает у окиси хрома кислород. Эта реакция Cr2О3 + 2Аl → AI2O3 + 2Сг
— основа промышленного (алюминотермического) способа получения хрома, хотя, конечно, заводская технология значительно сложнее. Хром, полученный алюминотермически, содержит алюминия и железа десятые доли процента, а кремния, углерода и серы — сотые доли процента.
Используют также силикотермический способ получения технически чистого хрома. В этом случае хром из окиси восстанавливается кремнием по реакции 2Cr2O3 + 3Si → 3SiO2 + 4Cr.
Эта реакция происходит в дуговых печах. Для связывания кремнезема в шихту добавляют известняк. Чистота силикотермического хрома примерно такая же, как и алюминотермического, хотя, разумеется, содержание в нем кремния несколько выше, а алюминия несколько ниже. Для получения хрома пытались применить и другие восстановители — углерод, водород, магний. Однако эти способы не получили широкого распространения.
Хром высокой степени чистоты (примерно 99,8%) получают электролитически. Технически чистый и электролитический хром идет главным образом на производство сложных хромовых сплавов.
Атомная масса хрома 51,996. В менделеевской таблице он занимает место в шестой группе. Его ближайшие соседи и аналоги — молибден и вольфрам. Характерно, что соседи хрома, так же как и он сам, широко применяются для легирования сталей.
Температура плавления хрома зависит от его чистоты. Многие исследователи пытались ее определить и получили значения от 1513 до 1920°С. Такой большой «разброс» объясняется прежде всего количеством и составом содержащихся в хроме примесей. Сейчас считают, что хром плавится при температуре около 1875°С. Температура кипения 2199°С. Плотность хрома меньше, чем железа; она равна 7,19.
По химическим свойствам хром близок к молибдену и вольфраму. Высший окисел его CrO3 — кислотный, это — ангидрид хромовой кислоты h3CrO4. Минерал крокоит, с которого мы начинали знакомство с элементом № 24, — соль этой кислоты. Кроме хромовой, известна двухромовая кислота H2Cr2O7, в химии широко применяются ее соли — бихроматы.
Что характерно для хрома
Наиболее распространенный окисел хрома Cr2O3 — амфотерен. А вообще в разных условиях хром может проявлять валентности от 2 до 6. Широко используются только соединения трех- и шестивалентного хрома. Хром обладает всеми свойствами металла — хорошо проводит тепло и электрический ток, имеет характерный металлический блеск. Главная особенность хрома — его устойчивость к действию кислот и кислорода.
Для тех, кто постоянно имеет дело с хромом, стала притчей во языцех еще одна его особенность: при температуре около 37°С некоторые физические свойства этого металла резко, скачкообразно меняются. При этой температуре — явно выраженный максимум внутреннего трения и минимум модуля упругости. Почти также резко изменяются электросопротивление, коэффициент линейного расширения, термоэлектродвижущая сила. Объяснить эту аномалию ученые пока не могут. Известны четыре природных изотопа хрома. Их массовые числа 50, 52, 53 и 54. Доля самого распространенного изотопа 52Cr — около 84%.
Соединения хрома
Главная хромовая руда — хромит используется и в производстве огнеупоров. Магнезитохромитовые кирпичи химически пассивны и термостойки, они выдерживают многократные резкие изменения температур. Поэтому их используют в конструкциях сводов мартеновских печей. Стойкость магнезитохромитовых сводов в 2-3 раза больше, чем динасовых.
Химики получают из хромита в основном бихроматы калия и натрия K2Cr2O7 и Na2Cr2O7. Бихроматы и хромовые квасцы KCr(SO4)2 применяются для дубления
кожи. Отсюда и идет название «хромовые» сапоги. Кожа, дубленная хромовыми соединениями, обладает красивым блеском, прочна и удобна в использовании.
Из хромата свинца PbCrO4 изготовляют различные красители. Раствором бихромата натрия очищают и травят поверхность стальной проволоки перед цинкованием, а также осветляют латунь. Хромит и другие соединения хрома широко применяются в качестве красителей керамической глазури и стекла.
Наконец, из бихромата натрия получают хромовую кислоту, которая используется в качестве электролита при хромировании металлических деталей.
Будущее хрома
Хром и в будущем сохранит свое значение как легирующая добавка к стали и как материал для металлопокрытий; не утратят ценности и соединения хрома, используемые в химической и огнеупорной промышленности.
Гораздо сложнее обстоит дело со сплавами на основе хрома. Большая хрупкость и исключительная сложность механической обработки пока не позволяют широко применять эти сплавы, хотя по жаропрочности и износостойкости они могут потягаться с любыми материалами. В последние годы наметилось новое направление в производстве хромсодержащих сплавов — легирование их азотом. Этот обычно вредный в металлургии газ образует с хромом прочные соединения — нитриды. Азотирование хромистых сталей повышает их износостойкость, позволяет уменьшить содержание дефицитного никеля в «нержавейках». Быть может, этот метод позволит преодолеть и «необрабатываемость» сплавов на основе хрома? Или здесь придут на помощь другие, пока не известные методы? Так или иначе, надо думать, что в будущем эти сплавы займут достойное место среди нужных технике материалов.
natural-museum.ru