Медь — Википедия
| Медь | |
|---|---|
| ← Никель | Цинк → | |
| пластичный металл красно-розового цвета | |
Самородная медь | |
| Название, символ, номер | Медь/Cuprum (Cu), 29 |
| Атомная масса (молярная масса) | 63,546(3)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d10 4s1 |
| Радиус атома | 128 пм |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+2e) 73 (+1e) 77 (K=6) пм |
| Электроотрицательность | 1,90 (шкала Полинга) |
| Электродный потенциал | +0,337 В/ +0,521 В |
| Степени окисления | 3, 2, 1, 0 |
| Энергия ионизации (первый электрон) | 745,0 (7,72) кДж/моль (эВ) |
| Плотность (при н. у.) | 8,92 г/см³ |
| Температура плавления | 1356,55 K (1 083,4 °С) |
| Температура кипения | 2 567 °С |
| Уд. теплота плавления | 13,01 кДж/моль |
| Уд. теплота испарения | 304,6 кДж/моль |
| Молярная теплоёмкость | 24,44[2] Дж/(K·моль) |
| Молярный объём | 7,1 см³/моль |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 3,615 Å |
| Температура Дебая | 315 K |
| Теплопроводность | (300 K) 401 Вт/(м·К) |
| Номер CAS | 7440-50-8 |
Медь (Cu от лат. Cuprum) — элемент одиннадцатой группы четвёртого периода (побочной подгруппы первой группы) периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко используется человеком.
Медь — один из первых металлов, хорошо освоенных человеком из-за доступности для получения из руды и малой температуры плавления. Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Одни из самых древних изделий из меди, а также шлак — свидетельство выплавки её из руд — найдены на территории Турции, при раскопках поселения Чатал-Гююк
В древности медь применялась также в виде сплава с оловом — бронзы — для изготовления оружия и т. п., бронзовый век пришёл на смену медному. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. На смену бронзовому веку относительно орудий труда пришёл железный век.
Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
- 2CO+(CuOH)2CO3→2Cu+3CO2+h3O{\displaystyle {\mathsf {2CO+(CuOH)_{2}CO_{3}\rightarrow 2Cu+3CO_{2}+H_{2}O}}}
На Кипре уже в 3 тысячелетии до нашей эры существовали медные рудники и производилась выплавка меди.
На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале (наиболее известное месторождение — Каргалы), в Закавказье, в Сибири, на Алтае, на территории Украины.
В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. Много меди шло на изготовление колоколов. Из бронзы были отлиты такие произведения литейного искусства, как Царь-пушка (1586 г.), Царь-колокол (1735 г.), Медный всадник (1782 г.), в Японии была отлита статуя Большого Будды (храм Тодай-дзи) (752 г.).
С открытием электричества в XVIII—XIX вв. большие объёмы меди стали идти на производство проводов и других связанных с ним изделий. И хотя в XX в. провода часто стали делать из алюминия, медь не потеряла значения в электротехнике[5].
Латинское название меди Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где было богатое месторождение.
У Страбона медь именуется халкосом, от названия города Халкиды на Эвбее. От этого слова произошли многие древнегреческие названия медных и бронзовых предметов, кузнечного ремесла, кузнечных изделий и литья. Второе латинское название меди Aes (санскр. ayas, готское aiz, герм. erz, англ. ore) означает руда или рудник.
Слова медь и медный встречаются в древнейших русских литературных памятниках. Славянское *mědь «медь» не имеет чёткой этимологии, возможно, исконное слово[6][7]. В. И. Абаев предполагал происхождение слова от названия страны Мидия: *Мѣдь из ир. Мādа- через посредство греч. Μηδία[8]. Согласно этимологии М. Фасмера, слово «медь» родственно др-герм. smid «кузнец», smîdа «металл»[8].
Медь обозначалась алхимическим символом «♀» — «зеркало Венеры», и иногда сама медь именовалась алхимиками тоже как «венера». Это связано с тем, что богиня красоты Венера (Афродита), являлась богиней Кипра
Среднее содержание меди в земной коре (кларк) — (4,7-5,5)·10−3% (по массе)[2]. В морской и речной воде содержание меди гораздо меньше: 3·10−7 % и 10−7 % (по массе) соответственно[2].
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
Кристаллы медиМедь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло-[13] и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м[14]. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
Атомная плотность меди (N0) = 8,52⋅1028{\displaystyle 8,52\cdot 10^{28}} (атом/м³).
Изотопы меди[править | править код]
Природная медь состоит из двух стабильных изотопов — 63Cu (изотопная распространённость 69,1 %) и 65Cu (30,9 %). Известны более двух десятков нестабильных изотопов, самый долгоживущий из которых 67Cu с периодом полураспада 62 часа[15].
Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз.
Пирометаллургический метод[править | править код]
- Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Халькопиритное сырьё содержит 0,5-2,0 % Cu. После флотационного обогащения исходной руды концентрат подвергают окислительному обжигу при температуре 1400 °C :
- 2CuFeS2+O2⟶Cu2S+2FeS+SO2↑{\displaystyle {\mathsf {2CuFeS_{2}+O_{2}\longrightarrow Cu_{2}S+2FeS+SO_{2}\uparrow }}}
- 2FeS+3O2⟶2FeO+2SO2↑{\displaystyle {\mathsf {2FeS+3O_{2}\longrightarrow 2FeO+2SO_{2}\uparrow }}}
Затем обожжённый концентрат подвергают плавке на штейн. В расплав для связывания оксида железа добавляют кремнезём:
- FeO+SiO2⟶FeSiO3{\displaystyle {\mathsf {FeO+SiO_{2}\longrightarrow FeSiO_{3}}}}
Образующийся силикат в виде шлака всплывает, и его отделяют. Оставшийся на дне штейн — сплав сульфидов FeS и Cu2S — подвергают бессемеровской плавке. Для этого расплавленный штейн переливают в конвертер, в который продувают кислород. При этом оставшийся сульфид железа окисляется до оксида и с помощью кремнезёма выводится из процесса в виде силиката. Сульфид меди частично окисляется до оксида и затем восстанавливается до металлической (черновой) меди:
- 2Cu2S+3O2⟶2Cu2O+2SO2{\displaystyle {\mathsf {2Cu_{2}S+3O_{2}\longrightarrow 2Cu_{2}O+2SO_{2}}}}
- 2Cu2O+Cu2S⟶6Cu+SO2{\displaystyle {\mathsf {2Cu_{2}O+Cu_{2}S\longrightarrow 6Cu+SO_{2}}}}
Получаемая металлическая (черновая) медь содержит 90,95 % металла и подвергается дальнейшей электролитической очистке с использованием в качестве электролита подкислённого раствора медного купороса. Образующаяся на катоде электролитическая медь имеет высокую чистоту до 99,99 % и используется для изготовления проводов, электротехнического оборудования, а также сплавов.
- CuO+h3↑⟶Cu+h3O+Q↑{\displaystyle {\mathsf {CuO+H_{2}\uparrow \longrightarrow Cu+H_{2}O+Q\uparrow }}}
Гидрометаллургический метод[править | править код]
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом:
- CuSO4+Fe⟶Cu↓+FeSO4{\displaystyle {\mathsf {CuSO_{4}+Fe\longrightarrow Cu\downarrow +FeSO_{4}}}}
Электролизный метод[править | править код]
Электролиз раствора сульфата меди:
- CuSO4⇄Cu2++SO42−{\displaystyle {\mathsf {CuSO_{4}\rightleftarrows Cu^{2+}+SO_{4}^{2-}}}}
- K−:Cu2++2e⟶Cu0{\displaystyle {\mathsf {K^{-}:Cu^{2+}+2e\longrightarrow Cu^{0}}}}
- A+:2h3O−4e⟶O2+4H+{\displaystyle {\mathsf {A^{+}:2H_{2}O-4e\longrightarrow O_{2}+4H^{+}}}}
- 2CuSO4+2h3O⟶2Cu↓+O2↑+2h3SO4{\displaystyle {\mathsf {2CuSO_{4}+2H_{2}O\longrightarrow 2Cu\downarrow +O_{2}\uparrow +2H_{2}SO_{4}}}}
Возможные степени окисления[править | править код]
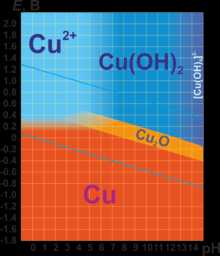
В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI и т. п.) или комплексах (например, [Cu(NH3)2]+). Её соединения бес
ru.wikipedia.org
Свойства меди, ее получение и область применения
Свойства меди, которая в природе встречается и в виде достаточно крупных самородков, люди изучили еще в древние времена, когда из этого металла и его сплавов делали посуду, оружие, украшения, различные изделия бытового назначения. Активное использование данного металла на протяжении многих лет обусловлено не только его особыми свойствами, но и простотой обработки. Медь, которая присутствует в руде в виде карбонатов и окислов, достаточно легко восстанавливается, что и научились делать наши древние предки.

Медный слиток
Интересное о меди
Изначально процесс восстановления этого металла выглядел очень примитивно: медную руду просто нагревали на кострах, а затем подвергали резкому охлаждению, что приводило к растрескиванию кусков руды, из которых уже можно было извлекать медь. Дальнейшее развитие такой технологии привело к тому, что в костры начали вдувать воздух: это повышало температуру нагревания руды. Затем нагрев руды стали выполнять в специальных конструкциях, которые и стали первыми прототипами шахтных печей.
О том, что медь используется человечеством с древних времен, свидетельствуют археологические находки, в результате которых были найдены изделия из данного металла. Историками установлено, что первые изделия из меди появились уже в 10 тысячелетии до н.э, а наиболее активно она стала добываться, перерабатываться и использоваться спустя 8–10 тысяч лет. Естественно, предпосылками к такому активному использованию данного металла стали не только относительная простота его получения из руды, но и его уникальные свойства: удельный вес, плотность, магнитные свойства, электрическая, а также удельная проводимость и др.
В наше время уже сложно найти медь в природе в виде самородков, обычно ее добывают из руды, которая подразделяется на следующие виды.
- Борнит — в такой руде медь может содержаться в количестве до 65%.
- Халькозин, который также называют медным блеском. В такой руде меди может содержаться до 80%.
- Медный колчедан, также называемый халькопиритом (содержание до 30%).
- Ковеллин (содержание до 64%).

Халькопирит
Медь также можно извлекать из множества других минералов (малахит, куприт и др.). В них она содержится в разных количествах.
Физические свойства
Медь в чистом виде представляет собой металл, цвет которого может варьироваться от розового до красного оттенка.
Радиус ионов меди, имеющих положительный заряд, может принимать следующие значения:
- если координационный показатель соответствует 6-ти — до 0,091 нм;
- если данный показатель соответствует 2 — до 0,06 нм.
Радиус атома меди составляет 0,128 нм, также он характеризуется сродством к электрону, равном 1,8 эВ. При ионизации атома данная величина может принимать значение от 7,726 до 82,7 эВ.
Медь — это переходный металл, показатель электроотрицательности которого составляет 1,9 единиц по шкале Полинга. Кроме этого, его степень окисления может принимать различные значения. При температурах, находящихся в интервале 20–100 градусов, его теплопроводность составляет 394 Вт/м*К. Электропроводность меди, которую превосходит лишь серебро, находится в интервале 55,5–58 МСм/м.
Так как медь в потенциальном ряду стоит правее водорода, она не может вытеснять этот элемент из воды и различных кислот. Ее кристаллическая решетка имеет кубический гранецентрированный тип, величина ее составляет 0,36150 нм. Плавится медь при температуре 1083 градусов, а температура ее кипения — 26570. Физические свойства меди определяет и ее плотность, которая составляет 8,92 г/см3.

Самородная медь
Из ее механических свойств и физических показателей стоит также отметить следующие:
- термическое линейное расширение — 0,00000017 единиц;
- предел прочности, которому медные изделия соответствуют при растяжении, составляет 22 кгс/мм2;
- твердость меди по шкале Бринелля соответствует значению 35 кгс/мм2;
- удельный вес 8,94 г/см3;
- модуль упругости составляет 132000 Мн/м2;
- значение относительного удлинения равно 60%.
Совершенно уникальными можно считать магнитные свойства данного металла, который является полностью диамагнитным. Именно эти свойства, наряду с физическими параметрами: удельным весом, удельной проводимостью и другими, в полной мере объясняют широкую востребованность данного металла при производстве изделий электротехнического назначения. Похожими свойствами обладает алюминий, который также успешно используется при производстве различной электротехнической продукции: проводов, кабелей и др.
Основную часть характеристик, которыми обладает медь, практически невозможно изменить, за исключением предела прочности. Данное свойство можно улучшить практически в два раза (до 420–450 МН/м2), если осуществить такую технологическую операцию, как наклеп.
Химические свойства
Химические свойства меди определяются тем, какое положение она занимает в таблице Менделеева, где она имеет порядковый номер 29 и располагается в четвертом периоде. Что примечательно, она находится в одной группе с благородными металлами. Это лишний раз подтверждает уникальность ее химических свойств, о которых следует рассказать более подробно.

Оттенки медных сплавов
В условиях невысокой влажности медь практически не проявляет химическую активность. Все меняется, если изделие поместить в условия, характеризующиеся высокой влажностью и повышенным содержанием углекислого газа. В таких условиях начинается активное окисление меди: на ее поверхности формируется зеленоватая пленка, состоящая из CuCO3, Cu(OH)2 и различных сернистых соединений. Такая пленка, которая называется патиной, выполняет важную функцию защиты металла от дальнейшего разрушения.
Окисление начинает активно происходить и тогда, когда изделие подвергается нагреву. Если металл нагреть до температуры 375 градусов, то на его поверхности формируется оксид меди, если выше (375-1100 градусов) — то двухслойная окалина.
Медь достаточно легко реагирует с элементами, которые входят в группу галогенов. Если металл поместить в пары серы, то он воспламенится. Высокую степень родства он проявляет и к селену. Медь не вступает в реакцию с азотом, углеродом и водородом даже в условиях высоких температур.
Внимание заслуживает взаимодействие оксида меди с различными веществами. Так, при его взаимодействии с серной кислотой образуется сульфат и чистая медь, с бромоводородной и иодоводородной кислотой — бромид и иодид меди.
Иначе выглядят реакции оксида меди с щелочами, в результате которых образуется купрат. Получение меди, при котором металл восстанавливается до свободного состояния, осуществляют при помощи оксида углерода, аммиака, метана и других материалов.
Медь при взаимодействии с раствором солей железа переходит в раствор, при этом железо восстанавливается. Такая реакция используется для того, чтобы снять напыленный медный слой с различных изделий.
Одно- и двухвалентная медь способна создавать комплексные соединения, отличающиеся высокой устойчивостью. Такими соединениями являются двойные соли меди и аммиачные смеси. И те и другие нашли широкое применение в различных отраслях промышленности.

Бухты медной проволоки
Области применения меди
Применение меди, как и наиболее схожего с ней по своим свойствам алюминия, хорошо известно — это производство кабельной продукции. Медные провода и кабели, характеризуются невысоким электрическим сопротивлением и особыми магнитными свойствами. Для производства кабельной продукции применяются виды меди, характеризующиеся высокой чистотой. Если в ее состав добавить даже незначительное количество посторонних металлических примесей, к примеру, всего 0,02% алюминия, то электрическая проводимость исходного металла уменьшится на 8–10%.
Невысокий вес меди и ее высокая прочность, а также способность поддаваться различным видам механической обработки — это те свойства, которые позволяют производить из нее трубы, успешно использующиеся для транспортировки газа, горячей и холодной воды, пара. Совершенно не случайно именно подобные трубы применяются в составе инженерных коммуникаций жилых и административных зданий в большинстве европейских стран.
Медь, кроме исключительно высокой электропроводности, отличается способностью хорошо проводить тепло. Благодаря этому свойству она успешно используется в составе следующих систем:
- тепловые трубки;
- кулеры, использующиеся для охлаждения элементов персональных компьютеров;
- системы отопления и охлаждения воздуха;
- системы, обеспечивающие перераспределение тепла в различных устройствах (теплообменники).
Металлические конструкции, в которых использованы медные элементы, отличаются не только небольшим весом, но и исключительной декоративностью. Именно это послужило причиной их активного использования в архитектуре, а также для создания различных интерьерных элементов.

Шина электротехническая медная
Оценка статьи:
Загрузка…Поделиться с друзьями:
met-all.org
Медь — свойства, характеристики | Cu-prum.ru
 Медь – это пластичный золотисто-розовый металл с характерным металлическим блеском. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.
Медь – это пластичный золотисто-розовый металл с характерным металлическим блеском. В периодической системе Д. И. Менделеева этот химический элемент обозначается, как Сu (Cuprum) и находится под порядковым номером 29 в I группе (побочной подгруппе), в 4 периоде.
Латинское название Cuprum произошло от имени острова Кипр. Известны факты, что на Кипре ещё в III веке до нашей эры находились медные рудники и местные умельцы выплавляли медь. Купить медь можно в комании «КУПРУМ».
По данным историков, знакомству общества с медью около девяти тысячелетий. Самые древние медные изделия найдены во время археологических раскопок на местности современной Турции. Археологи обнаружили маленькие медные бусинки и пластинки для украшения одежды. Находки датируются рубежом VIII-VII тыс. до нашей эры. Из меди в древности изготавливали украшения, дорогую посуду и различные инструменты с тонким лезвием.
Великим достижением древних металлургов можно назвать получение сплава с медной основой – бронзы.
Основные свойства меди
1. Физические свойства.
На воздухе медь приобретает яркий желтовато-красный оттенок за счёт образования оксидной плёнки. Тонкие же пластинки при просвечивании зеленовато-голубого цвета. В чистом виде медь достаточно мягкая, тягучая и легко прокатывается и вытягивается. Примеси способны повысить её твёрдость.
Высокую электропроводность меди можно назвать главным свойством, определяющим её преимущественное использование. Также медь обладает очень высокой теплопроводностью. Такие примеси как железо, фосфор, олово, сурьма и мышьяк влияют на базовые свойства и уменьшают электропроводность и теплопроводность. По данным показателям медь уступает лишь серебру.
Медь обладает высокими значениями плотности, температуры плавления и температуры кипения. Важным свойством также является хорошая стойкость по отношению к коррозии. К примеру, при высокой влажности железо окисляется значительно быстрее.
Медь хорошо поддаётся обработке: прокатывается в медный лист и медный пруток, протягивается в медную проволоку с толщиной, доведённой до тысячных долей миллиметра. Этот металл является диамагнетиком, то есть намагничивается против направления внешнего магнитного поля.
2. Химические свойства.
Медь является сравнительно малоактивным металлом. В нормальных условиях на сухом воздухе её окисления не происходит. Она легко реагирует с галогенами, селеном и серой. Кислоты без окислительных свойств не оказывают воздействия на медь. С водородом, углеродом и азотом химических реакций нет. На влажном воздухе происходит окисление с образованием карбоната меди (II) – верхнего слоя платины.
Медь обладает амфотерностью, то есть в земной коре образует катионы и анионы. В зависимости от условий, соединения меди проявляют кислотные или основные свойства.
Способы получения меди
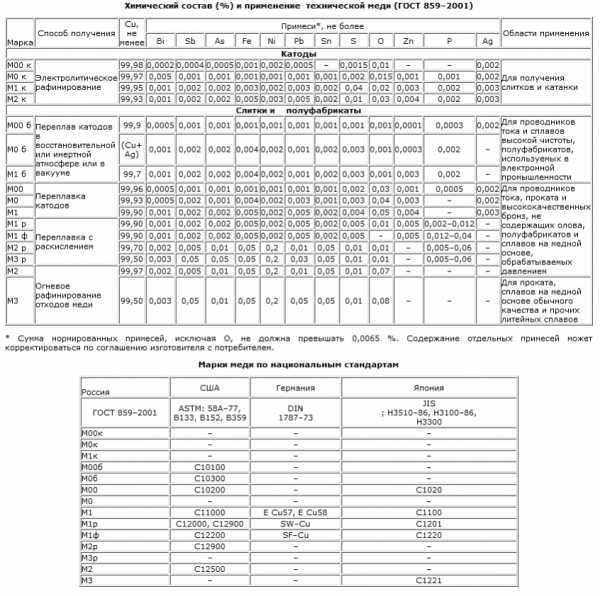
В природе медь существует в соединениях и в виде самородков. Соединения представлены оксидами, гидрокарбонатами, сернистыми и углекислыми комплексами, а также сульфидными рудами. Самые распространённые руды — это медный колчедан и медный блеск. Содержание меди в них составляет 1-2%. 90% первичной меди добывают пирометаллургическим способом и 10% гидрометаллургическим.
1. Пирометаллургический способ включает в себя такие процессы: обогащение и обжиг, плавка на штейн, продувка в конвертере, электролитическое рафинирование.
Обогащают медные руды методом флотации и окислительного обжига. Сущность метода флотации заключается в следующем: частицы меди, взвешенные в водной среде, прилипают к поверхности пузырьков воздуха и поднимаются на поверхность. Метод позволяет получить медный порошкообразный концентрат, который содержит 10-35% меди.
Окислительному обжигу подлежат медные руды и концентраты со значительным содержанием серы. При нагреве в присутствии кислорода происходит окисление сульфидов, и количество серы снижается почти в два раза. Обжигу подвергаются бедные концентраты, в которых содержится 8-25% меди. Богатые концентраты, содержащие 25-35% меди, плавят, не прибегая к обжигу.
Следующий этап пирометаллургического способа получения меди – это плавка на штейн. Если в качестве сырья используется кусковая медная руда с большим количеством серы, то плавку проводят в шахтных печах. А для порошкообразного флотационного концентрата применяют отражательные печи. Плавка происходит при температуре 1450 °С.
В горизонтальных конвертерах с боковым дутьём медный штейн продувается сжатым воздухом для того, чтобы произошли процессы окисления сульфидов и феррума. Далее образовавшиеся окислы переводят в шлак, а серу в оксид. В конвертере образуется черновая медь, которая содержит 98,4-99,4% меди, железо, серу, а также незначительное количество никеля, олова, серебра и золота.
Черновая медь подлежит огневому, а далее электролитическому рафинированию. Примеси удаляют с газами и переводят в шлак. В результате огневого рафинирования образуется медь с чистотой до 99,5%. А после электролитического рафинирования чистота составляет 99,95%.
2. Гидрометаллургический способ заключается в выщелачивании меди слабым раствором серной кислоты, а затем выделении металлической меди непосредственно из раствора. Такой способ применяется для переработки бедных руд и не допускает попутного извлечения драгоценных металлов вместе с медью.

Применение меди
Благодаря ценным качествам медь и медные сплавы используются в электротехнической и электромашиностроительной отрасли, в радиоэлектронике и приборостроении. Существуют сплавы меди с такими металлами, как цинк, олово, алюминий, никель, титан, серебро, золото. Реже применяются сплавы с неметаллами: фосфором, серой, кислородом. Выделяют две группы медных сплавов: латуни (сплавы с цинком) и бронзы (сплавы с другими элементами).
Медь обладает высокой экологичностью, что допускает её использование в строительстве жилых домов. К примеру, медная кровля за счёт антикоррозионных свойств, может прослужить больше ста лет без специального ухода и покраски.
Медь в сплавах с золотом используется в ювелирном деле. Такой сплав увеличивает прочность изделия, повышает стойкость к деформированию и истиранию.
Для соединений меди характерна высокая биологическая активность. В растениях медь принимает участие в синтезе хлорофилла. Поэтому её можно увидеть в составе минеральных удобрений. Недостаток меди в организме человека может вызвать ухудшение состава крови. Она есть в составе многих продуктов питания. К примеру, этот металл содержится в молоке. Однако важно помнить, что избыток соединений меди может вызвать отравление. Именно поэтому нельзя готовить пищу в медной посуде. Во время кипячения в пищу может попасть большое количество меди. Если же посуда внутри покрыта слоем олова, то опасности отравления нет.
В медицине медь используют, как антисептическое и вяжущее средство. Она является компонентом глазных капель от конъюнктивита и растворов от ожогов.
cu-prum.ru
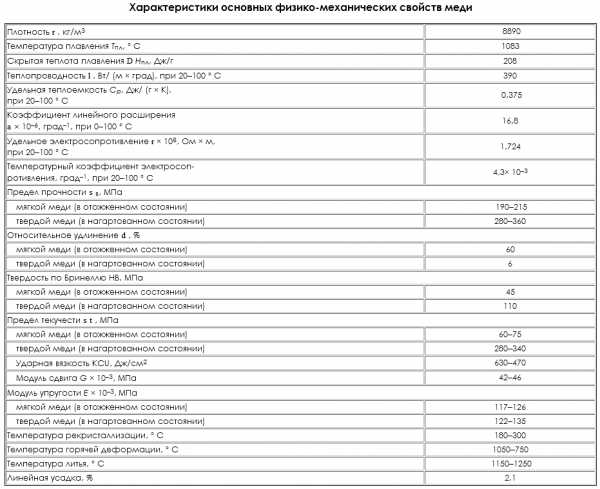
| Табл. 2. Значения температурного коэффициента линейного расширения меди при различных температурах | |||||
| t, К | α х 10 6 , К -1 | t, К | α х 10 6 , К -1 | t, К | α х 10 6 , К -1 |
| 200 | 15,2 | 450 | 17,6 | 900 | 20,9 |
| 220 | 15,6 | 500 | 17,9 | 950 | 21,4 |
| 240 | 15,9 | 550 | 18,3 | 1000 | 21,8 |
| 260 | 16,2 | 600 | 18,7 | 1050 | 22,3 |
| 280 | 16,5 | 700 | 19,4 | 1100 | 22,8 |
| 300 | 16,7 | 750 | 19,7 | 1150 | 23,3 |
| 350 | 17,0 | 800 | 20,1 | 1200 | 23,8 |
| 400 | 17,3 | 850 | 20,5 | 1250 | 24,4 |
Теплопроводность меди λ существенно снижают примеси и легирующие элементы (рис. 4).
Рис. 4. Влияние содержания элементов на теплопроводность меди
Теплопроводность меди разных марок при 20°С составляет:
Марка λ , Вт(м * К)
П овышение температуры меди приводит к уменьшению ее теплопроводности (табл. 3. ).
| Табл. 3. Значения теплопроводности λ меди при различных температурах | |||||||||
| t, К | λ, Вт/(м*К) | t, К | λ, Вт/(м*К) | t, К | λ, Вт/(м*К) | t, К | λ, Вт/(м*К) | t, К | λ, Вт/(м*К) |
| 100 | 500 | 350 | 393 | 600 | 382 | 850 | 376 | 1100 | 349 |
| 150 | 435 | 400 | 391 | 650 | 379 | 900 | 364 | 1150 | 345 |
| 200 | 414 | 450 | 383 | 700 | 376 | 950 | 360 | 1200 | 342 |
| 250 | 403 | 500 | 387 | 750 | 372 | 1000 | 356 | 1250 | 338 |
| 300 | 398 | 550 | 385 | 800 | 370 | 1050 | 353 | 1300 | 334 |
Влияние температу ры на физические свойства меди на примере М0 показано в табл. 4.
Главная страница » Медь: свойства характеристики применение металла

Медь (производная греческого слова «Κύπρος») — материал, с которым приходится сталкиваться повсеместно в обычной жизни, даже не замечая и не задумываясь о контакте. Каждый раз, применяя какое-то электрическое устройство, например, пылесос или стиральную машину, пользователь прямо или косвенно контактирует с медью. Универсальный металл – неотъемлемая часть высокотехнологичных гаджетов и машин — от электронных микроскопов и мобильных телефонов, до простых пищевых кастрюль. Примерно 10 000 лет насчитывает вся история существования меди с момента обнаружения этого металла на Кипре. Этого вполне достаточно, чтобы уделить внимание популярному металлу.
Что такое медь в общем смысле слова?
Медь физически выглядит мягким металлом, имеющим красновато-оранжевый окрас. Особенность металла хорошая электрическая проводимость и тепловой обмен. Среди распространённых химических элементов, присутствующих в земной коре, медь занимает 25 место своеобразного рейтинга.
 Медные прутки разного диаметра наглядно демонстрируют внешний вид материала и качество структуры в целом. Однако это наиболее простые изделия из всех возможных
Медные прутки разного диаметра наглядно демонстрируют внешний вид материала и качество структуры в целом. Однако это наиболее простые изделия из всех возможных
Ведущим поставщиком меди в мире является Чили (примерно треть мировой добычи). Также список достаточно мощных источников добычи дополняют:
- Польша
- Англия
- Канада
- Перу
- Соединенные Штаты
- Замбия
- Австралия
Если сравнивать с алюминием и титаном, медь при добыче нередко встречается в необработанном виде, смешанном в породах с другими металлами — золотом, серебром, свинцом.
Также встречаются медьсодержащие минералы — халькоцит, халькопирит, борнит. Несмотря на объёмную добычу меди из недр земли, достаточно большие объёмы производятся методом переработки материалов, к примеру, устаревшего электрооборудования.
Процесс производства химического элемента
Как правило, концентрация меди в руде отмечается на уровне не более 4%. Подавляющее большинство руды составляют отходы. Используются различные процессы для разделения меди и отходов.
Точный характер процесса переработки зависит от металлов и других примесей, смешанных с медью, а также от требований к чистоте конечного продукта. Процесс очистки обычно охватывает несколько этапов разной сложности. Каждая стадия удаления примесей даёт большую концентрацию и улучшение чистоты меди.
 Примерно таким выглядит природный медный минерал, встречающийся в процессе добычи популярного химического элемента. Подобные образования отличаются более высоким содержанием вещества
Примерно таким выглядит природный медный минерал, встречающийся в процессе добычи популярного химического элемента. Подобные образования отличаются более высоким содержанием вещества
Типичный процесс начинается с функции дробления руды с последующим приготовлением суспензии путём добавления воды. Суспензия загружается в резервуары, смешивается с воздухом и маслянистыми химикатами. Это примеси, помогающие отделить частицы «Cuprum» от других присутствующих минералов.
Затем оставшуюся руду нагревают в большой плавильной печи, где сжигаются оставшиеся примеси. После термообработки остаётся материал — медный штейн, по меньшей мере, содержащий 50% меди.
На следующем этапе проводится второй процесс нагревания медного штейна с кремнеземом и воздухом с целью ещё более «тонкого» удаления отходов. Остаётся переработанный материал — черновая медь, обладающий чистотой более 97%.
Максимально возможную чистоту меди получают электролизом, когда электрический ток пропускается через раствор, содержащий медь. Медь, полученная электролизом, характерна степенью чистоты на уровне 99,9% — идеальный материал для проводки электричества.
Физические свойства меди
Физически медь очень хорошо проводит тепло и электричество. Материал относительно мягкий и легкий. Металл не ржавеет, но подвержен эффекту окисления на открытом воздухе.
 Традиционное применение медных проводников в конструкции электрических двигателей. Вместе с тем существует огромный ассортимент медных проводов, в том числе изолированных, скрученных, многожильных, специальных и других
Традиционное применение медных проводников в конструкции электрических двигателей. Вместе с тем существует огромный ассортимент медных проводов, в том числе изолированных, скрученных, многожильных, специальных и других
Структура материала допускает значительное усложнение посредством образования более длинных кристаллов. Этим увеличивается общая структура с образованием нечто подобного «арматуре» железобетона.
Какие существуют соединения «Cuprum»?
Несмотря на слабую реакционную способность меди, этот металл допускает создание широкого спектра полезных соединений и сплавов. Когда атомы меди соединяется с атомами других металлов, химически отмечаются два совершенно разных поведения:
- Образуются соединения Cuprum I
- Образуются соединения Cuprum II
Двумя наиболее важными соединениями меди являются сульфат меди (II) ярко-синего цвета, используемый в сельском хозяйстве и в медицине, а также хлорид меди (II), применяемый в качестве антисептика древесины, а также в полиграфической и красильной индустрии.
Как получают медные сплавы?
Получение медных сплавов выполняется путём смешивания с одним или несколькими другими металлами. В результат получается новый материал, сочетающий лучшие свойства. Самые известные медные сплавы — бронза и латунь. Металл бронза — сплав, где основой структуры являются медь и олово. Иногда добавляется цинк или свинец.
 Продукт на основе никель-медного сплава характеризуется не только улучшенными механическими свойствами, но также демонстрирует улучшенный внешний вид
Продукт на основе никель-медного сплава характеризуется не только улучшенными механическими свойствами, но также демонстрирует улучшенный внешний вид
Бронза существенно твёрже, прочнее и устойчивее (с точки зрения коррозии) чистой меди. Разновидности бронзы отличаются разными пропорциями отмеченных ингредиентов в структуре. Например, твердая бронза для изготовления статуй обычно содержит:
Латунь также представляет сплав меди и обычно содержит 10-50% цинка, в зависимости от предназначения к использованию.
Для чего применим медный металл?
Конкретное применение материалов целиком и полностью зависит от физических и химических свойств, которыми эти материалы обладают. Собственно, в этом кроется суть науки, именуемой материаловедением. Что касается конкретно меди, мягкий, ковкий и пластичный материал проводит электричество и тепло, имеет приятный внешний вид.
Вот почему две основных сферы применения меди – это строительство зданий и производство электрического (электронного) оборудования. Крайне сложно найти электрический (электронный прибор), конструкция которого не содержит меди.
 Бытовые и хозяйственные аксессуары, предметы искусства и поделок достаточно часто выполняются на основе медного материала. Получаются очень интересные привлекательные изделия
Бытовые и хозяйственные аксессуары, предметы искусства и поделок достаточно часто выполняются на основе медного материала. Получаются очень интересные привлекательные изделия
Поскольку «Cuprum» хороший проводник тепла, этот материал также широко используется в производстве аксессуаров бытовой сферы. Классический пример — кастрюли с медным дном. Учитывая, что металл не ржавеет, актуальным видится применение в качестве покрытий (например, как в своё время для покрытия днищ кораблей). Наконец, производство денег никак не обходится без меди.
Особенности присущие популярному химическому элементу
Практически идеальным электрическим проводником считается именно медный материал. Лучшие свойства проводимости демонстрирует только серебро. Однако по сравнению с медью, проводник серебра – это достаточно дорогое удовольствие.
Поэтому серебряные электрические линии транспорта тока применяются очень ограниченно, в схемах устройств, предъявляющих особые требования к передаче электричества.
Многие живые организмы и природные растения нуждаются в некоторых количествах «Cuprum». Такая природная «добавка» помогает в прямом смысле выживать растениям и организмам.
Если среди живых организмов выделить именно человека, определённые количества меди, поступающей в организм, способствует образованию гемоглобина, ответственного за транспорт кислорода в крови.
vi-pole.ru
Характеристика меди — химические и физические свойства
Свойства меди, металла, который встречается и в виде довольно больших самородков, люди изучали еще в древности. Тогда из меди и его сплавов создавали предметы посуды, оружие, украшения, разные предметы бытового назначения. Столь высокая популярность этого металла на протяжении столетий была обусловлена не только его особыми качествами, но и легкостью обработки. Медь, присутствующую в руде в форме карбонатов и окислов, довольно легко восстановить, что и научились делать наши предки в древности. В этой статье поговорим о свойствах меди и методах ее определения.
Физические свойства меди
Чистая медь – это металл, цвет которого варьируется от розового до красного оттенка. Радиус положительно заряженных ионов меди, может принимать такие значения:
- при координационном показателе равном 6-ти — до 0,091 нм
- при координационном показателе равном 2 — до 0,06 нм.
Радиус атома меди равняется 0,128 нм. Величина сродства к электрону достигает 1,8 эВ. Процесс ионизации данного атома увеличивает сродство к электрону от 7,726 до 82,7 эВ.
Медь является переходным металлом. Величина показателя его электроотрицательности достигает 1,9 единиц по шкале Полинга. Стоит отметить, что степень окисления способна принимать разные значения. В условиях температуры в пределах от 20 до 100 градусов, показатель теплопроводности равен 394 Вт/м*К. показатель электропроводности меди, уступает по которому она только серебру, колеблется в пределах 55,5–58 МСм/м. Поскольку медь в потенциальном ряду расположена справа от водорода, то она не способна вытеснять этот элемент из воды и разного типа кислот. Медь имеет кристаллическую решетку кубического гранецентрированного типа, а ее величина достигает 0,36150 нм. Плавление меди начинается при температуре 1083 градусов, а закипает она при 26570 градусах. Плотность меди определяется ее физическими свойствами и составляет 8,92 г/см3.
Поскольку медь в потенциальном ряду расположена справа от водорода, то она не способна вытеснять этот элемент из воды и разного типа кислот. Медь имеет кристаллическую решетку кубического гранецентрированного типа, а ее величина достигает 0,36150 нм. Плавление меди начинается при температуре 1083 градусов, а закипает она при 26570 градусах. Плотность меди определяется ее физическими свойствами и составляет 8,92 г/см3.
Кроме вышеперечисленных, стоит выделить еще и такие физические и механические свойства меди:
- показатель термического линейного расширения составляет 0,00000017 единиц
- показатель предела прочности на растяжение достигает 22 кгс/мм2
- уровень твердости меди по шкале Бринелля равен 35 кгс/мм2
- удельная масса составляет 8,94 г/см3
- показатель упругости равен 132000 Мн/м2
- относительное удлинение равняется 60%.
Абсолютно неповторимыми можно назвать магнитные свойства этого металла, который является полностью диамагнитным. Именно благодаря этим показателям, вместе с физическими свойствами, к примеру, удельным весом и удельной проводимостью, можно объяснить такую широкую популярность этого металла в производстве изделий электротехнической отрасли. Несколько похожие свойства имеет алюминий, который тоже активно применяется в изготовлении различной электротехнической продукции, к примеру, проводов, кабелей и прочего.
Единственная характеристика меди, которую можно изменить — это предел прочности. Этот показатель может быть улучшен почти в два раза (до 420–450 МН/м2), путем специальной технологической операции, называемой наклеп.
Химические свойства меди
Химическая характеристика меди определяется ее расположением в периодической таблице элементов Менделеева, где ей присвоен порядковый номер 29. Находится она в четвертом периоде и в одной группе с благородными металлами. Таким образом, лишний раз подтверждается уникальность ее химических качеств, о которых дальше мы расскажем более детально.
Если уровень влажный не высокий, то медь почти не проявляет химической активности. Однако, все кардинально меняется, когда изделия помещают в условия высокой влажности и повышенного содержания углекислого газа. Именно такие условия являются идеальными для начала активного окисления меди. В процессе окисления на поверхности медного предмета создается зеленоватая пленка, которая состоит из CuCO3, Cu(OH)2, а также разных сернистых соединений. Эту пленку называют патиной и она очень важна, поскольку защищает металл от дальнейшего разрушения. Кроме влажности, процесс окисления запускает и нагревание. В условиях нагревания до температуры 375 градусов, на поверхности предмета формируется оксид меди, если температуру поднять до 1100 градусов, то формируется двухслойная окалина.
Кроме влажности, процесс окисления запускает и нагревание. В условиях нагревания до температуры 375 градусов, на поверхности предмета формируется оксид меди, если температуру поднять до 1100 градусов, то формируется двухслойная окалина.
Медь довольно легко вступает в реакции с элементами, находящимися в группе галогенов. Под действием паров серы металл воспламеняется. Высокий уровень родства медь демонстрирует и к селену. Общие свойства меди не позволяют ей вступить в реакцию с азотом, углеродом и водородом даже при нагревании.
Взаимодействие с кислотами:
- результатом реакции с серной кислотой является сульфат и чистая медь
- с бромоводородной и иодоводородной кислотой соответственно образуются бромид и иодид меди.
А вот взаимодействие со щелочами позволяет получить купрат. Реакции получения меди, при которых происходит восстановление металла до свободного состояния, невозможны без присутствия оксида углерода, аммиака, метана и некоторых других веществ.
Основные свойства меди позволяют ей вступать во взаимодействие с раствором солей железа. Результатом такой реакции является восстановление железа. Эту реакцию применяют для снятия ранее напыленного медного слоя с разных изделий.
Свойства солей меди
Одно- и двухвалентная медь может формировать комплексные соединения, которые выделяются высоким уровнем устойчивости. К подобным соединениям можно отнести двойные соли меди и аммиачные смеси. Они активно используются в различных отраслях промышленности.
Сульфат меди (II) — CuSO4 в безводном состоянии является белым порошком. При добавлении воды он приобретает синюю окраску. Поэтому его используют для выявления остатков воды в органических жидкостях. Водный раствор сульфата меди отличается сине-голубым оттенком. За этот цвет отвечают гидратированные ионы [Cu(h3O)4]2+, следовательно, такого же цвета и все остальные разбавленные растворы солей меди (II). Исключением являются растворы с содержанием окрашенных анионов.
Из водного раствора сульфат меди кристаллизуется с пятью молекулами воды, путем формирования прозрачных синих кристаллов медного купороса. Полученное соединение используется:
- в процессе электролитического нанесения меди на металлы
- для создания минеральных красок
- как исходный материал для получения прочих соединений меди.
 В сельскохозяйственной отрасли разбавленный раствор медного купороса очень популярен для опрыскивания растений и замачивания семян перед посевом, потому что он уничтожает споры вредных грибов.
В сельскохозяйственной отрасли разбавленный раствор медного купороса очень популярен для опрыскивания растений и замачивания семян перед посевом, потому что он уничтожает споры вредных грибов.
Хлорид меди (II) — CuCl2. 2h3O. Это легко растворимое в воде соединение темно-зеленого цвета. Высокая концентрация хлорида меди позволяет получить растворы зеленого цвета, а разбавление приводит к окраске в сине-голубой оттенок.
Нитрат меди (II) — Cu(NO3)2.3h3O. Его получают путем растворения меди в азотной кислоте. В процессе нагревания синие кристаллы нитрата меди сначала отдают воду, после чего с легкостью разлагаются, выделяя кислород и бурый диоксид азота, становясь оксидом меди (II).
Гидроксокарбонат меди (II) — (CuOH)2CO3. Данное вещество можно встретить в природе в виде минерала малахита, который отличается красивым изумрудно-зеленым цветом. В лабораторных условиях его можно создать при помощи действия Na2CO3 на растворы солей меди (II).
2CuSO4 + 2Na2CO3 + h3O = (CuOH)2CO3↓ + 2Na2SO4 + CO2↑
Кроме этого, его используют, чтобы получить хлорид меди (II), а также приготовить синие и зеленые минеральные краски. Ацетат меди (II) — Cu (Ch4COO)2.h3O. Это соединение можно получить, если провести обработку металлической меди или оксида меди (II) раствором уксусной кислоты. Чаще всего – это смесь основных солей разного состава и цвета (от зеленого до сине-зеленого).
Ацетат меди (II) — Cu (Ch4COO)2.h3O. Это соединение можно получить, если провести обработку металлической меди или оксида меди (II) раствором уксусной кислоты. Чаще всего – это смесь основных солей разного состава и цвета (от зеленого до сине-зеленого).
Помните, что все без исключения соли меди являются ядовитыми. По этой причине, во избежание формирования медных солей, вся медная посуда должна быть изнутри покрыта слоем олова.
Методы определения меди
Определение меди может проводиться такими методами:
- химическими
- количественными
- фотометрическими.
Различные химические составы способны оказывать влияние на расщепление молекул и атомов вещества, следовательно, можно выделить его составные части. Химический метод определения количества заключается в электролитическом методе измерения медной части в сплавах других металлов. Его осуществляют при помощи таких элементов:
- ацетилен
- винная кислота
- водный аммиак
- азотнокислый аммоний
- динатриевая соль
- этиловый спирт
- купризон.
Прежде всего, происходит взвешивание медного состава (навески). После этого ее отправляют в подготовленный раствор реактивов. В этом растворе навеска должна полностью раствориться. Далее весь раствор нужно нагреть, так как в процессе нагревания удаляются окиси азота. Очищенный раствор необходимо разбавить водой и снова нагреть до 40 оС. Теперь массу можно подвергать процессу электролиза. Электроды, погружаемые в раствор создают из платины. Далее включается ток силой 2,2 В и в условиях постоянного помешивания происходит выделение меди.
Контрольным испытанием является повторный процесс электролиза. Необходимо электроды погрузить в раствор, ниже уровня выделенной меди и подключить ток. При правильном проведении первой реакции, во время контрольной процедуры вы не увидите налета металла. Полученный таким образом медный катод нужно промыть водой, не отключая электроток, а потом обработать этиловым спиртом и высушить. После этого катод необходимо взвесить, и сопоставить массу с первоначальным весом. Итак, вы получите удельный вес меди в соединении.
Разработано большое количество видов химических растворов для очистки медных изделий.
Количественное определение массы меди в общем объеме металла целесообразно использовать для сплавов с никелем, бронзой или цинком. При воздействии на вещество происходит осаждение меди и в таком виде ее можно измерить. Осаждение может быть осуществлено неорганическими и органическими элементами. Из неорганических веществ можно выделить:
- тетрароданодиаминхромиат аммония, называемый солью Рейнеке
- тиокарбонат калия способен осадить медь при температуре выше 80 оС
- уксусной кислотой можно осадить медный оксалат.
Из органических веществ применяются:
- оксихинолин-8, который способен осадить медь в комплексе с аммиачным и щелочным раствором. Нагревание осадка приводит к образованию оксида меди
- α-бензоиноксим при участии спирта может осадить металл в форме хлопьев. Реакция невозможна, если в составе есть никель
- йодид калия применяют в нейтральной и кислой среде. Нет смысла использовать его, когда в сплаве имеется железо, сурьма и мышьяк.
Достоинства фотометрического метода заключаются в высоком показателе точности измерения количества меди, а также простота применения. Для реализации этого метода потребуются такие соединения:
- купризон
- диэтилдитиокарбамат свинца.
Смысл фотометрического метода определения меди состоит в фиксации интенсивности цвета материала, прошедшего через концентрированный раствор. Раствор состоит из:
- аммиака
- лимоннокислого раствора аммония
- диэтилдитиокарбамата свинца
- сернокислого натрия.
 Вещество, в котором нужно выявить количество меди пропускают через указанные выше растворы. Отметим, что здесь важно соблюдать пропорции. Далее происходит процесс фотометрии.
Вещество, в котором нужно выявить количество меди пропускают через указанные выше растворы. Отметим, что здесь важно соблюдать пропорции. Далее происходит процесс фотометрии.
Определение меди возможно также и в сточных, канализационных, речных, морских водах, и в составе почве. Существует три способа:
- атомноабсорбционный прямой
- атомноабсорбционный при участии хелатообразования
- атомноабсорбционный, подразумевающий использование графитовой печи.
Чтобы определить количество меди в почве самым надежным методом является метод с использованием графитной печи.
Для этого пробу почвы нужно поместить в графитовую трубу, обезводить при помощи сжигания и распылить. Процедура распыления сопряжена с разделением вещества на атомы, с последующей фильтрацией и выделением из них нужного металла. Чтобы оценить пробу грунта можно воспользоваться любым фотометрическим методом определения меди.
mining-prom.ru
температура плавления, физические свойства, сплавы
Твердый металл медь люди научились плавить еще до нашей эры. Название элемента по таблице Менделеева – Cuprum, в честь первого массового расположения производства меди. Именно на острове Кипр в третьем тысячелетии до н.э. начали добывать руду. Металл зарекомендовал себя как хорошее оружие и красивый, блестящий материал для изготовления посуды и других приборов.
 Процесс плавления меди
Процесс плавления медиИзготовление предметов требовало множество усилий при отсутствии технологий. В первых шагах развития цивилизации и поиску новых металлов, люди научились добывать и плавить медную руду. Получение руды происходило в малахитовом, а не в сульфидном состоянии. Получение на выходе свободной меди, из которой можно изготавливать детали, требовало обжига. Для исключения окислов, металл с древесным углем размещалась в сосуд из глины. Поджигался металл в специально подготовленной яме, образующийся в процессе угарный газ способствовал процессу появления свободной меди.
Для точных расчетов использовался график плавления меди. В то время производился точный расчет времени и примерная температура, при которой происходит плавка меди.
Медь и ее сплавы
Металл имеет красновато-желтый оттенок благодаря оксидной пленке, которая образуется при первом взаимодействии металла с кислородом. Пленка придает благородный вид и обладает антикоррозийными свойствами.
Сейчас доступно несколько способов добычи металла. Распространёнными являются медный колчедан и блеск, которые встречаются в виде сульфидных руд. Каждая из технологий получения меди требует особого подхода и следования процессу.
Добыча в природных условиях происходит в виде поиска медных сланцев и самородков. Объемные месторождения в виде осадочных пород находятся в Чили, а медные песчаники и сланцы расположились на территории Казахстана. Использование металла обусловлено невысокой температурой плавления. Практически все металлы плавятся путем разрушения кристаллической решетки.
Основной порядок плавления и свойства:
- на температурных порогах от 20 до 100° материал полностью сохраняет свои свойства и внешний вид, верхний оксидный слой остается на месте;
- кристаллическая решетка распадается на отметке 1082°, физическое состояние становится жидким, а цвет белым. Уровень температуры задерживается на некоторое время, а затем продолжает рост;
- температура кипения меди начинается на отметке 2595°, выделяется углерод, происходит характерное бурление;
- при отключении источника тепла происходит снижение температуры, происходит переход в твердую стадию.
Плавка меди возможна в домашних условиях, при соблюдении определенных условий. Этапы и сложность задачи зависят от выбора оборудования.
Физические свойства
Основные характеристики металла:
- в чистом виде плотность металла составляет 8.93 г/см3;
- хорошая электропроводность с показателем 55,5S, при температуре около 20⁰;
- теплопередача 390 Дж/кг;
- кипение происходит на отметке 2600°, после чего начинает выделение углерода;
- удельное электрическое сопротивление в среднем температурном диапазоне – 1.78×10 Ом/м.
Основными направлениями эксплуатации меди является электротехнические цели. Высокая теплоотдача и пластичность дают возможность применения к различным задачам. Сплавы меди с никелем, латунью, бронзой, делаю более приемлемой себестоимость и улучшают характеристики.
Химический состав меди
В природе она не однородна по своему составу, так как содержит ряд кристаллических элементов, образующих с ней устойчивую структуру, так называемые растворы, которые можно подразделить на три группы:
- Твердые растворы. Образуются, если в составе содержаться примеси железа, цинка, сурьмы, олова, никеля и многих других веществ. Такие вхождения существенно снижают ее электрическую и тепловую проводимость. Они усложняют горячий вид обработки под давлением.
- Примеси, растворяющиеся в медной решетке. К ним относятся висмут, свинец и другие компоненты. Не ухудшают качества электропроводимости, но затрудняют обработку под давлением.
- Примеси, формирующие хрупкие химические соединения. Сюда входят кислород и сера, а также другие элементы. Они ухудшают прочностные качества, в том числе снижают электропроводность.
Масса меди с примесями гораздо больше, чем в чистом виде. Ко всему прочему, элементы примесей существенно влияют на конечные характеристики уже готового продукта. Поэтому их суммарный состав, в том числе количественный, по отдельности должен регулироваться еще на этапе производства. Рассмотрим более подробно влияние каждого элемента на характеристики конечных медных изделий.
- Кислород. Один из самых нежелательных элементов для любого материала, не только медного. С его ростом ухудшается такое качество, как пластичность и устойчивость к коррозионным процессам. Его содержание не должно превышать 0,008%. В ходе термической обработки в результате процессов окисления количественное содержание этого элемента уменьшается.
- Никель. Образует устойчивый раствор и существенно снижает показатели проводимости.
- Сера или селен. Оба компонента одинаково влияют на качество готовой продукции. Высокая концентрация таких вхождений снижает пластичные свойства медных изделий. Содержание таких компонентов не должно превышать 0,001% от общей массы.
- Висмут. Негативно влияет на механические и технологические характеристики готовой продукции. Максимальное содержание не должно превышать 0,001%.
- Мышьяк. Он не меняет свойств, но образует устойчивый раствор, является своего рода защитником от пагубного влияния других элементов, как кислород, сурьма или висмут.
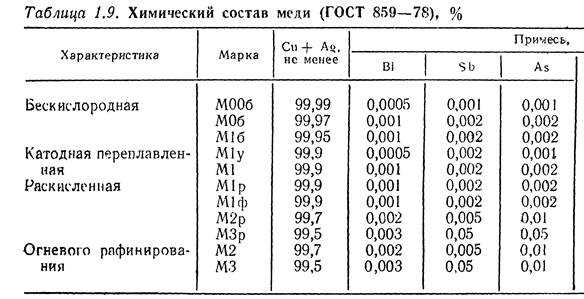
Химический состав меди
- Марганец. Он способен полностью раствориться в меди практически при комнатной температуре. Влияет на проводимость тока.
- Сурьма. Компонент лучше всех растворятся в меди, наносит ей минимальный вред. Содержание его не должно превышать 0,05% от массы меди.
- Олово. Образует устойчивый раствор с медью и повышает ее свойства по проведению тепла.
- Цинк. Его содержание всегда минимально, поэтому такого пагубного влияния он не оказывает.
Фосфор. Основной раскислитель меди, максимальное содержание которого при температуре 714°С составляет 1,7%.
Латунь

Латунь
Сплав на основе меди с добавлением цинка называется латунь. В некоторых ситуациях добавляется олово в меньших пропорциях. Джеймс Эмерсон в 1781 году решил запатентовать комбинацию. Содержание цинка в сплаве может варьироваться от 5 до 45%. Латуни различают в зависимости от предназначения и спецификации:
- простые, состоящие из двух компонентов – меди и цинка. Маркировка таких сплавов обозначается буквой «Л», напрямую значащая содержание меди в сплаве в процентах;
- многокомпонентные латуни – содержат множество других металлов в зависимости от назначения к использованию. Такие сплавы повышают эксплуатационные свойства изделий, обозначаются также буквой «Л», но с прибавлением цифр.
Физические свойства латуни относительно высокие, коррозийная стойкость на среднем уровне. Большинство сплавов не критично к пониженным температурам, возможно эксплуатировать металл в различных условиях.
Технологии получения латуни взаимодействует с процессами медной и цинковой промышленности, обработке вторичного сырья. Эффективным способом плавки является использование электропечи индукционного типа с магнитным отводом и регулировкой температуры. После получения однородной массы, она разливается в формы и подвергается процессам деформации.

Плавка латуни
Применение материала в различных отраслях, повышает на него спрос с каждым годом. Сплав применяется в суд строительстве и производстве боеприпасов, различных втулок, переходников, болтов, гаек и сантехнических материалов.
Бронза

Бронза
Цветной металл для изготовки изделий разных типов начали использовать с древних времен. Данный факт подтверждается найденными материалами при археологических раскопках. Состав бронзы изначально был богат оловом.
Промышленностью выпускается различное количество разновидностей бронзы. Опытный мастер способен по цвету металла определить его предназначение. Однако не каждому под силу определить точную марку бронзы, для этого используется маркировка. Способы производства бронзы подразделяются на литейные, когда происходит плавление и отлив и деформируемые.
Состав металла зависит от предназначения к использованию. Основным показателем является наличие бериллия. Повышенная концентрация элемента в сплаве, подвергнутая процедуре закаливания, может соперничать с высокопрочными сталями. Наличие в составе олова отнимает у металла гибкость и пластичность.
Производство бронзовых сплавов изменилось с древних времен фактически внедрением современного оборудования. Технология с использованием в качестве флюса в виде древесного угля используется до сих пор. Последовательность получения бронзы:
- печь разогревается для требуемой температуры, после этого в нее устанавливается тигель;
- после плавки металл может окислится, во избежание этого добавляют флюс в качестве древесного угля;
- кислотным катализатором служит фосфорная медь, добавление происходит после полного прогрева сплава.

Плавка бронзы
Старинные изделия из бронзы подвержены естественным процессам – патинирование. Зеленоватый цвет с белым оттенком проявляется из-за образования пленки, обволакивающей изделие. Искусственные методы патинирования включают в себя методы с использованием серы и параллельным нагреванием до определенной температуры.
Температура плавления меди
Плавится материал при определенной температуре, которая зависит от наличия и количества сплавов в составе.
В большинстве случаев, процесс происходит при температуре от 1085°. Наличие олова в сплаве дает разбег, плавление меди может начаться при 950°. Цинк в составе также понижает нижнюю границу до 900°.
Для точных расчетов времени понадобится график плавления меди. На обычном листке бумаги используется график, где по горизонтали отмечается время, а по вертикали градусы. График должен указывать, на каких моментах поддерживается температура при нагреве для полного процесса кристаллизации.

Печь для плавки меди
Плавление меди в домашних условиях
В домашних условиях медные сплавы возможно плавить несколькими способами. При использовании любого из методов, понадобятся сопутствующие материалы:
- тигель – посуда, изготовленная из закаленной меди или другого огнеупорного металла;
- древесный уголь, понадобится в роли флюса;
- крюк металлический;
- форма будущего изделия.
Наиболее легким вариантом для плавления является муфельная печь. В емкость опускаются куски материала. После установки температуры плавления процесс можно наблюдать через специальное окошко. Установленная дверца позволяет удалять образованную в процессе оксидную пленку, для этого понадобиться заранее подготовленный металлический крюк.
Вторым способом плавления в домашних условиях является использование горелки или резака. Пропан – кислородное пламя отлично подойдет для работ с цинком или оловом. Куски материалов для будущего сплава помещаются в тигель, и нагреваются мастером произвольными движениями. Максимальная температура плавления меди может быть достигнута при взаимодействии с пламенем синего цвета.
Плавка меди в домашних условиях подразумевает работу с повышенными температурами. Приоритетом служит соблюдение техники безопасности. Перед любой процедурой следует одеть защитные огнеупорный перчатки и плотную, полностью закрывающую тело одежду.
Значение плотности меди
Плотность — это отношение массы к объему. Выражается она в килограммах на кубический метр всего объема. В виду неоднородности состава, значение плотности может меняться в зависимости процентного содержания примесей. Поскольку существуют разные марки медных прокатов с разным содержанием компонентов, то и значение плотности у них будет разное. Плотность меди можно найти в специализированных технических таблицах, которая равна 8,93х103 кг/м3. Это справочная величина. В этих же таблицах показан удельный вес меди, который равен 8,93 г/см3. Таким совпадением значений плотности и его весовых показателей характеризуются не все металлы.

Основные показатели меди
Не секрет, что от плотности напрямую зависит конечная масса изготовленного изделия. Однако для расчетов гораздо правильнее использовать удельный вес. Этот показатель очень важен для производства изделий из меди или любых других металлов, но применим больше к сплавам. Он выражается отношением массы меди к объему всего сплава.
Расчет удельного веса
В настоящее время учеными разработано огромное количество способов, помогающих найти характеристики удельного веса меди, которые позволяют даже без обращения к специализированным таблицам вычислять этот немаловажный показатель. Зная его, можно с легкостью подобрать необходимые материалы, благодаря которым в конечном итоге можно получить нужную деталь с требуемыми параметрам. Это делается еще на стадии подготовки, когда планируется создать необходимую деталь из меди или ее содержащих сплавов.
Как уже говорилось выше, удельный вес меди можно подсмотреть в специализированном справочнике, но если под рукой такого нет, то его можно рассчитать по следующей формуле: вес делим на объем и получаем необходимую нам величину. Общими словами такое соотношение можно выразить как общее весовое значение к общему значению объема всего изделия.
Не стоит путать его с понятием плотности, так как он характеризует металл по-другому, хоть и имеет одинаковые значения показателей.
Рассмотрим, как можно вычислить удельный вес, если известна масса и объем медного изделия.
Например, имеем чистый медный лист толщиной 5 мм, шириной 2 м и длиной 1 м. Для начала посчитаем его объем: 5 мм * 1000 мм (1 м = 1000 мм) * 2000 мм, что составляет 10 000 000 мм3 или 10 000 см3. Для удобства расчетов будем считать, что масса листа составляет 89 кг 300 грамм или 89300 грамм. Делим рассчитанный результат на объем и получаем 8,93 г/см3. Зная этот показатель, мы всегда с легкостью можем вычислить весовое содержание в меди того или иного сплава. Это удобно, например, для обработки металла.
Единицы измерения удельного веса
В разных системах измерения используются разные единицы для обозначения удельного веса меди:
- В системе измерения СГС или сантиметр-грамм-секунда используется дин/см3.
- В Международной СИ используются единицы н/м3.
- В системе МКСС или метр-килограмм-секунда-свеча применяется кг/м3.
Первые два показателя равны между собой, а третий при конвертации равен 0,102 кг/м3.
Расчет веса с использованием значений удельного веса
Не будем уходить далеко и воспользуемся примером, описанным выше. Вычислим общее содержание меди в 25 листах. Поменяем условие и будем считать, что листы изготовлены из медного сплава. Таким образом, берем удельный вес меди из таблицы и он равен 8.93 г/см3. Толщина листа 5 мм, площадь (1000 мм * 2000 мм) составляет 2 000 000 мм, соответственно объем будет равняться 10 000 000 мм3 или 10 000 см3. Теперь умножаем удельный вес на объем и получаем 89 кг и 300 гр. Мы вычислили общий объем меди, который содержится в этих листах без учета веса самих примесей, то есть общее весовое значение может быть больше.
Теперь умножаем рассчитанный результат на 25 листов и получаем 2 235 кг. Такие расчеты уместно использовать при обработке медных деталей, так как позволяют узнать, сколько меди всего содержится в изначальных объектах. Аналогичным образом можно рассчитать медные прутки. Площадь сечения провода умножается на его длину, где получим объем прутка, а далее по аналогии с вышеописанным примером.
Как определяется плотность
Плотность меди, как и плотность любого другого вещества, является справочной величиной. Она выражается соотношением массы к объему. Самостоятельно вычислить этот показатель весьма сложно, так как без специальных приборов состав проверить невозможно.
Пример расчета плотности меди
Выражается показатель в килограммах на кубический метр или в граммах на кубический сантиметр. Показатель плотности более полезен для производителей, которые на основе имеющихся данных могут скомпоновать ту или иную деталь с требуемыми свойствами и характеристиками.
Области использования меди
Благодаря физико-механическим свойствам, она широко используется для различных отраслей промышленности. Наиболее часто ее можно встретить в электротехнической области в качестве составляющей части электрического провода. Не меньшей популярностью она пользуется также в производстве систем отопления и охлаждения, электроники и системах теплового обмена.
В строительной отрасли она используется, прежде всего, для создания разного рода конструкций, которые получаются гораздо меньше по массе, чем из любых других аналогичным материалов. Часто ее используют для кровли, так как такие изделия обладают легкостью и пластичностью. Такой материал легко обрабатывается и позволяет менять геометрии профиля, что очень удобно.
Как уже говорилось выше, основное свое применение она находит в изготовлении электрических и иных токопроводящих кабелей, где она используется для изготовления жил проводов и кабелей. Обладая хорошей электропроводностью, она дает достаточное сопротивление электронам тока.
Широко используются также сплавы меди, например, сплав меди и золота повышает прочность последнего в разы.
На стенках медных прокатов никогда не образуются соляные отложения. Такое качество полезно для транспортировки жидкостей и паров.
На основе оксидов меди получают сверхпроводники, а в чистом виде она идет на изготовление гальванических источников питания.
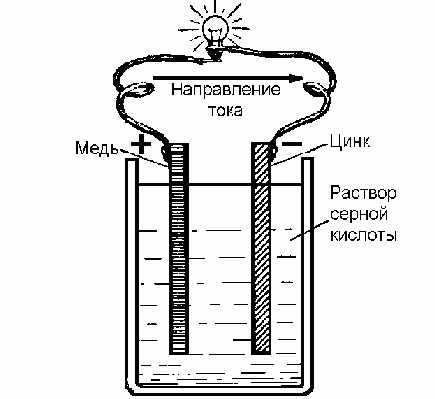
Схема гальванического источника питания
Она входит в состав бронзы, которая обладает стойкостью к агрессивным средам, как морская вода. Поэтому часто ее используют в навигации. Также бронзовые продукты можно увидеть на фасадах домов, как элемент декора, так как такой сплав обрабатывается легко, так как очень пластичен.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
stankiexpert.ru
§3. Физические свойства меди.
Tплавления | Tкипения | Ρ | Rудельное |
1083 0C | 2877 0C | 8,96 г/cм3 | 1,63*10-8 ом*м |
а) Плотность и твердость.
Металлы подгруппы меди, как и щелочные металлы, имеют по одному свободному электрону на один ион-атом металла. Казалось бы, эти металлы не должны особенно сильно отличатся от щелочных. Но они, в отличие от щелочных металлов, обладают довольно высокими температурами плавления. Большое различие в температурах плавления между металлами этих подгрупп объясняется тем, что между ион-атомами металлов подгруппы меди почти нет свободного пространства, и они расположены более близко. Вследствие этого количество свободных электронов в единице объема, электронная плотность, у них больше. Следовательно, и прочность химической связи у них больше. Поэтому металлы подгруппы меди плавятся и кипят при более высоких температурах.
Металлы подгруппы меди обладают, по сравнению с щелочными металлами, обладают большей твердостью. Объясняется это увеличением электронной плотностью и более плотной компоновкой атомов в кристаллической решетке. Необходимо отметить, что твердость и прочность металлов зависят от правильности расположения ион-атомов в кристаллической решетке. В металлах, с которыми мы практически сталкиваемся, имеются различного рода нарушения правильного расположения ион-атомов, например, пустоты в узлах кристаллической решетки. К тому же металл состоит из мелких кристалликов (кристаллитов), между которыми связь ослаблена. В Академии Наук СССР была получена медь без нарушения в кристаллической решетке. Для этого очень чистую медь возгоняли при высокой температуре в глубоком вакууме на глубокую подложку. Медь получалась в виде небольших ниточек – “усов”. Как оказалось, такая медь в сто раз прочнее, чем обычная.
б) Цвет меди и её соединений.
Чистая медь обладает и другой интересной особенностью. Красный цвет обусловлен следами растворенного в ней кислорода. Оказалось, что медь, многократно возогнанная в вакууме (при отсутствии кислорода), имеет желтоватый цвет. Медь в полированном состоянии обладает сильным блеском.
При повышении валентности окраска меди и ее соединений темнеет, например, CuCl – белый, Cu2O – красный, CuCl + H2O – голубой, CuО — черный. Карбонаты характеризуются синим и зеленым цветом при условии содержания воды, чем обусловлен интересный практический признак для поисков.
в) Электропроводимость.
Медь обладает наибольшей (после серебра) электропроводимостью, чем и обусловлено её обширное применение в электронике.
г) Кристаллическая решетка.
Медь кристаллизируется по типу централизованного куба (рис 1).
Рисунок 1. Кристаллическая решетка меди.
д) Изотопы.
Природная медь состоит из двух стабильных изотопов — 63Cu и 65Cu с распространённостью 69,1 и 30,9 атомных процентов соответственно. Известны более двух десятков нестабильных изотопов, самый долгоживущий из которых 67Cu с периодом полураспада 62 часа.
§4. Сплавы меди.
Медные сплавы — первые металлические сплавы, созданные человеком. Примерно до середины XXв. по мировому производству медные сплавы занимали 1-е место среди сплавов цветных металлов, уступив его затем алюминиевым сплавам. Со многими элементами медь образует широкие области твёрдых растворов замещения, в которых атомы добавки занимают места атомов меди в гранецентрированной кубической решётке. Медь в твёрдом состоянии растворяет до 39 % Zn, 15,8 % Sn, 9,4 % Al, a Ni — неограниченно. При образовании твёрдого раствора на основе меди растут её прочность и электросопротивление, снижается температурный коэффициент электросопротивления, может значительно повыситься коррозионная стойкость, а пластичность сохраняется на достаточно высоком уровне.
В настоящее время существуют бесчисленные сплавы на основе меди, здесь я приведу три самые основные и распространенные в технике и быту сплавы:
а) Латунь
Латунь – это медный сплав с добавлением цинка. Цинк, содержание которого в составе может доходить до 40%, повышает прочность и пластичность сплава. Наиболее пластична латунь, с долей цинка около 30%. Она применяется для производства проволоки и тонких листов. В состав также могут входить железо, олово, свинец, никель, марганец и другие компоненты. Они повышаю коррозийную устойчивость и механические свойства сплава. Латунь хорошо подвергается обработке: сварке и прокатке, отлично полируется. Широкий диапазон свойств, низкая себестоимость, легкость в обработке и красивый желтый цвет делают латунь наиболее распространенным медным сплавом с большой областью применения.
б) Бронза
Бро́нзы — сплав меди, обычно с оловом в качестве основного легирующего компонента, но к бронзам также относят медные сплавы с алюминием, кремнием, бериллием, свинцом и другими элементами, за исключением цинка (это латунь) и никеля. Как правило в любой бронзе в незначительных количествах присутствуют добавки: цинк, свинец, фосфор и др.
Традиционную оловянную бронзу человек научился выплавлять ещё в начале Бронзового века и очень длительное время она широко использовалась; даже с приходом века железа бронза не утрачивала своей важности (в частности вплоть до XIX века пушки изготавливались из пушечной бронзы)
Самые широко применимые бронзы это: кремниевые бронзы, бериллиевые бронзы, кремниевые бронзы, хромовые бронзы, но, безусловно, самой известной и наиболее применимой является оловянная бронза.
в) Медно-никелевые сплавы
Сплавы на основе меди, содержащие никель в качестве главного легирующего элемента — Мельхиор, Нейзильбер (сплав меди с 5—35% Ni и 13—45% Zn). Никель образует с медью непрерывный ряд твёрдых растворов. При добавлении никеля к меди возрастают её прочность и электросопротивление, снижается температурный коэффициент электросопротивления, сильно повышается стойкость против коррозии. Медно-никелевые сплавы хорошо обрабатываются давлением в горячем и холодном состоянии.
studfile.net
