Химический состав мела — Справочник химика 21
Химический состав мела и известняков (в весовых процентах) [c.10]ХИМИЧЕСКИЙ СОСТАВ МЕЛА [c.74]
Химический состав мела, известняков и доломитов, применяемых в стекловарении [c.105]
Химический состав мела разных месторождений [c.46]
Химический состав мела (карбоната кальция) различных месторождений [c.707]
Каков химический состав а) гипса б) мела в) негашеной извести г) гашеной извести д) белильной извести натронной извести [c.224]
Работы Данилевского заинтересовали ученых всего мира. Казалось, был найден способ синтеза белка. Реакция образования пластеинов изучалась во многих лабораториях как у нас, так и за рубежом. Но радость ученых была преждевременной. Вскоре выяснилось, что хотя действительно пластеин состоит из аминокислот, соединенных между собой, но собираются они под влиянием пепсина беспорядочно. И, несмотря на то, что химический состав пластеина и белка одинаков, они совершенно не похожи по своим свойствам. Даже по внешнему виду пластеин отличается от белка. Насыпьте толченый мел в воду, и вы представите себе, как выглядит пластеин. Но предположение Данилевского о способах связн аминокислот в белке было подтверждено экспериментами многих ученых. Оказалось, что при таком способе соединения аминокислот друг с другом образуется так называемая пептидная связь и выделяется вода.
Рассмотренный механизм коксования показывает, что на процесс влияют различные факторы химический состав сырья склонность к мел молекулярным взаимодействиям, те.мпература входа вторичного сырья в реактор длительность пребывания продуктов в реакторе, давление в зоне реакции коэффициент рециркуляции и др. Влияние этих факторов подробно описано в работе [112].  186]
186]
Углекислый газ может быть получен сжиганием твердого или жидкого топлива, получается он из мела при воздействии на него кислоты и другими способами, но каким бы способом, из какого бы сырья он ни был получен, химический состав его одинаков. [c.144]
Абразивные вещества обеспечивают очищающее и полирующее действие зубных паст. Традиционно — это химически осажденный мел. Часто используют также фосфорнокислые соли — дикальцийфосфат дигидрат, трикальцийфосфат, пирофосфат кальция, нерастворимый метафосфат натрия. Иногда применяют гидроксид алюминия, различные бентониты, диоксид кремния, некоторые полимерные соединения. Можно использовать смеси нескольких абразивных веществ, например смесь мела и дикальцийфосфата, мела и гидроксида алюминия и др. Каждое абразивное соединение имеет определенную степень дисперсности, твердость, значение pH, от которых зависит истирающая или абразивная способность и щелочность полученных на их основе зубных паст. При выборе абразивного соединения учитывается его индифферентность к другим компонентам, входящим в состав паст, способность реагировать с твердыми тканями зуба, адсорбировать отдушку и смачиваться водно-глицериновым раствором гелеобразующего вещества. Выбор того или иного абразивного вещества обусловливается свойствами и назначением создаваемой зубной пасты.
Примерный химический состав (в %) отбросов после гашения извести, полученной при обжиге мела [c.117]
Мел. Представляет собой аморфную твердую массу химический состав его СаСОд (углекислый кальций). Природный мел встречается во многих районах СССР. [c.25]
При обжиге карбонатного сырья наряду с химическими реакциями разложения карбонатов кальция и магния протекает ряд побочных вредных реакций взаимодействие образующейся окиси кальция СаО с окислами железа, алюминия и кремния, содержащимися в виде примесей в известняке и меле и входящими в состав золы топлива и огнеупорного кирпича, применяемого для футеровки печи.
В результате лабораторных опытов установлено, что наилучшее соответствие всем требованиям к искомому материалу обнаруживает сплав, по составу близкий к тройной эвтектике диопсид — волластонит— тридимит. Шихта, обеспечивающая выбранный химический состав расплава, составляется из доломита, кварцевого песка и известняка (или мела), т. е. из дешевых местных, легкодоступных сырых материалов. Важным преимуществом шихты является малое содержание в ней окислов железа, что позволило получить из этой шихты литые камни белого цвета.
Установлено, что время хранения суспензии химически осажденного мела практически не влияет на ее дисперсный состав. [c.108]
В качестве основных сырьевых материалов использовались невьянский известняк, размолотый мокрым способом до разной дисперсности ВОЛЬСКИЙ мел кварцевый Вольский песок, размолотый мокрым способом до разной дисперсности и отмытый соляной кислотой кремнегель — отход суперфосфатного производства при получении фтористого алюминия по способу УНИХИМа опока и трепел Сухоложского месторождения. В табл. 1 приводится химический состав материалов. Пробы известняка и песка разных дисперсностей мало отличались по составу, а при расчете шихт эти различия учитывались.
В химической промышленности в порядке исключения отдельные виды продукции внутризаводского потребления включают в состав валовой продукции. К ним относятся химические руды (фосфориты, сильвиниты, карналлиты, мел и др.), заготовленная и вывезенная или сплавленная древесина (деловая и дрова), попутно добываемые уголь, торф и другие виды топлива.
Химически осажденный мел (СаСОз) является классическим абразивным компонентом, входящим в состав почти всех отечественных и зарубежных паст и порошков. [c.154]
[c.154]
ЗУБНАЯ ПАСТА ФОСФОДЕНТ благодаря присутствию дикальцийфосфата оказывает более мягкое истирающее действие на эмаль зубов, чем пасты на основе только химически осажденного мела. В качестве полезных добавок в состав пасты введены фтористые соединения, обладающие выраженной антикариесной активностью, и растительный экстракт сельдерея. Паста способствует укреплению твердых тканей зубов, предохраняет эмаль от разрушающего действия органических кислот и снижает воспалительные явления в полости рта. Паста имеет красивый внешний вид, приятный запах и вкус, хорошо очищает и освежает полость рта.
Считаем, что состав мела близок к формуле СаСОо. Так как на 1 г-экв СаСОд, составляющий 50 г, требуется 1 г-экв НС1, т. е. 1000 1 н. раствора НС1, не составляя химического уравнрниа пише т [c.29]
Для этого алюмосиликатное сырье в смеси с мелом обжигали до образования 5СаО ЗАЬОз и 2СаО Si02 последний при охлаждении, переходя в у-модификацию, должен был способствовать рассыпанию продукта обжига [3]. Полученный тонкий порошок продукта обжига мы подвергали выщелачиванию раствором соды и фильтрованию. Из фильтрата, содержащего алюминаты натрия, осаждался углекислотой гидрат окиси алюминия. Осадок после отделения алюмината натрия, состоящий в основном из двухкальциевого силиката и углекислого кальция, подвергали обжигу для получения цемента с повышенным содержанием алита. В качестве сырья для первоначальных исследований была взята огнеупорная глина Суворовского месторождения и химически чистый карбонат кальция. Химический состав глины был следующим (в %)
Охра — кристаллический гидрат окиси железа с примесью алюмосиликатов. Цвет — желтый, малонасыщенный основным красящим началом являются гидратированные окислы Fe +. Содержание РегОз и воды, входящих в состав охр, колеблется в широких пределах кроме того, охры- могут содержать каолин, кремнезем, мел, доломит и другие примеси.
Мы» детально изучили ливийскую нефть из Юнспой Киренаики (нижний мел глубины около 3000 м). Эта нефть содержит 14,3% смол (плюс асфальтены), 17% твердых парафинов и 0,16% серы. Ее общий химический состав примерно следующий (в % на нефть) / [c.144]
Фракционный состав суспензии мела определяли методом седиментационного анализа. Для седиментометрических измерений использовалась стационарная пипетка Андреасена [1—3]. В качестве дисперсионной среды для химически осажденного мела применяли дистиллированную воду. Стабилизатором суспензии служил триэтаноламинолеат, который получали в лаборатории путем смешения 4,97 г триэтаноламина с 9,4 г олеиновой кислоты и последующего их нагревания на водяной бане в течение 10 минут. Триэтаноламинолеат вводили в исследуемые пробы только непосредственно перед определением их фракционного состава.
И. А. Каблуков м]юго внимания уделял изучению химического состава меда, воска и пчелиного клея для этого надо было зпать химический состав и свойства продуктов пчеловодства. Подделкой меда занимались заводчики II продавали его в больших количествах, как указывал Каблуков в докладе О составе русских сортов меда и его фальсификации на IV съезде пчеловодов в 1902 г. В мед добавляли патоку, муку, песок, мел п даже камешки для веса, а для натуральности этого меда — крупинки вощины и мертвых пчел.
Рентгеновский метод также применялся для изучения структуры пленок он особенно пригоден для сравнения ориентировки между окисью и металлом. Мел, Мак Кендлс и Райне например, нашли, что атомы в пленке закиси, полученной на железе, расположены в простом кристаллографическом отношении к атомам металлического основания. Если закись железа разлагается, образуя магнетит, ориентация — соотношение распространяется и на последний. Дженкинс нашёл определенную ориентировку в окисных пленках на расплавленном цинке, свинце, висмуте и олове. При снятии пленок на никелевую сетку ориентировка теряется, хотя химический состав остается без изменений. [c.103]
При снятии пленок на никелевую сетку ориентировка теряется, хотя химический состав остается без изменений. [c.103]
СТЕКЛО (обыкновенное, неорганическое, силикатное) — прозрачный аморфный сплав смеси различных силикатов или силикатов с диоксидом кремния. Сырье для производства стекла должно содержать основные стеклообразующие оксиды 510а, В Оз, Р2О5 и дополнительно оксиды щелочных, щелочноземельных и других металлов. Необходимые для производства С. материалы — кварцевый песок, борная кислота, известняк, мел, сода, сульфат натрия, поташ, магнезит, каолин, оксиды свинца, сульфат или карбонат бария, полевые шпаты, битое стекло, доменные шлаки и др. Кроме того, при варке стекла вводят окислители — натриевую селитру, хлорид аммония осветлители — для удаления газов — хлорид натрия, триоксид мышьяка обесцвечивающие вещества — селен, соединения кобальта и марганца, дополняющие цвет присутствующих оксидов до белого для получения малопрозрачного матового, молочного, опалового стекла или эмалей — криолит, фторид кальция, фосфаты, соединения олова красители — соединения хрома, кадмия, селена, никеля, кобальта, золота и др. Общий состав обыкновенного С. можно выразить условно формулой N3,0-СаО X X65102. Свойства С. зависят от химического состава, условий варки и дальнейшей обработки. [c.237]
Для получения специального стекла изменяют состав исходной смеси. Заменяя соду НагСОз поташом К2СО3, получают тугоплавкое стекло (для химической посуды). Заменяя мел СаСОз оксидом свинца (П) РЬО, а соду — поташом, получают хрустальное стекло. Оно обладает большой лучепреломляющей способностью н применяется для изготовления художественной посуды. [c.148]
Для получения специального стекла изменяют состав исходной смеси. Заменяя соду Naa Os поташом К2СО3, получают тугоплавкое стекло (для химической посуды). Заменяя мел СаСО, оксидом свинца (II) РЬО, получают хрустальное стекло. Добавки оксидов металлов к исходной смеси придают стеклу различную окраску. Так, оксид хрома (III) СгаОз придает зеленую окраску, оксид кобальта (II) СоО — синюю, двуокись марганца МпОа— красновато-лиловую и т. д. [c.251]
Так, оксид хрома (III) СгаОз придает зеленую окраску, оксид кобальта (II) СоО — синюю, двуокись марганца МпОа— красновато-лиловую и т. д. [c.251]
Кальций в природе. Из-за своей высокой химической активности кальций в свободном состоянии в природе не встречается, но он очень распространен и входит в состав различных соединений. Огромные количества его находятся в природе в виде известняка, мела и мрамора, имеющих одинаковый состав СаСОд, но различную кристаллическую структуру. Эти минералы часто образуют целые горные массивы. В СССР имеются большие залежи фосфоритов и апатитов, основной составной частью которых является фосфорнокислый кальций Сад(Р04)2. Встречается также гипс aS04 21 20, плавиковый шпат aFj и др. Соединения кальция играют важную роль и в органической природе. Кости и зубы животных, яичная скорлупа, кораллы и раковины содержат значительное количество солей кальция. [c.252]
Что происходит с нами, когда мы влюбляемся?
Автор фото, Thinkstock
Подпись к фото,Любовь проходит несколько стадий, но не обязательно в одном и том же порядке
Ученые установили, какие химические процессы происходят в нас, когда мы влюблены. Стадии всегда одни и те же — но их последовательность может быть какой угодно.
В отношении любви образно применяют слово «химия», но на самом деле любовь — это действительно ряд химических реакций. Ученые считают, что влюбленность запускает в наших организмах ряд процессов, которые в конечном итоге нацелены на сохранение человеческого рода.
Симптомы любви похожи на болезненное состояние: потеющие ладони, потеря аппетита, эйфория, румянец на лице и учащенное сердцебиение.
Любовь проходит через несколько стадий — каждая из них зависит от определенных химических элементов, запускающих в организме соответствующие реакции.
Автор фото, Thinkstock
Подпись к фото,Первая стадия — стадия желания — определяется действием сексуальных гормонов и выражается в поиске партнера
Но порядок, в котором стадии следуют одна за другой, может быть произвольный, подчеркивает исследователь университета Рутгерса в Нью-Джерси Хелен Фишер.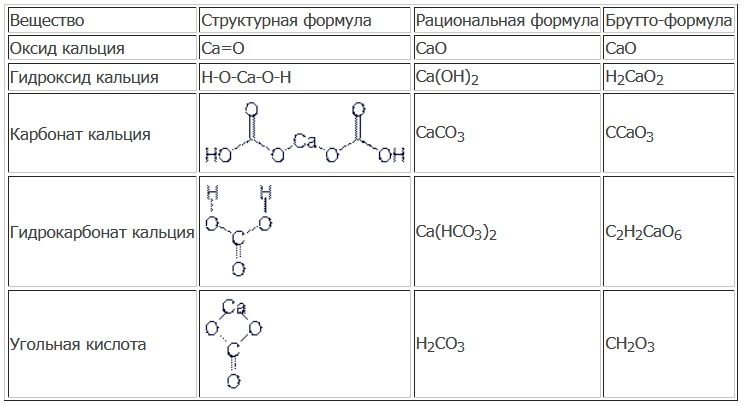
«Вы можете испытывать сильную привязанность к кому-то на работе или в своем круге общения, и лишь спустя многие месяцы или годы что-то происходит, ситуация меняется и неожиданно вы обнаруживаете, что влюбились в этого человека», — объясняет Хелен Фишер.
«То есть сначала идет привязанность, потом приходит романтическая влюбленность, и лишь затем эмоции, связанные с сексуальным влечением. Или мы можете встретить кого-то, кто покажется вам сексуально привлекательным, вы в него влюбляетесь и лишь затем приходите к ощущению глубокой привязанности. Или вы можете внезапно влюбиться, буквально потерять голову из-за кого-то, с кем давным-давно у вас был секс, в тот момент не вызвавший сильных чувств», — продолжает Фишер.
Автор фото, Thinkstock
Подпись к фото,Симптомы любви похожи на болезненное состояние: потеющие ладони, потеря аппетита, эйфория, румянец на лице и учащенное сердцебиение.
На каждой из этих стадий в игру вступают разные химические вещества, и ученые теперь знают, какому процессу какие элементы соответствуют.
Желание (или говоря более грубо, но точно — похоть) вызывается в нас половыми гормонами тестостероном и эстрогеном. Тестостерон — это совсем не исключительно «мужской» гормон. В женском организме он играет такую же важную роль в возбуждении сексуального влечения.
Стадия 2: Влечение
Автор фото, Thinkstock
Подпись к фото,Долгие отношения базируются на инстинкте заботы о детях и обеспечения их будущего
На этой стадии люди влюбляются, теряют голову и не могут думать ни о чем, кроме предмета вожделения, плохо спят и вечно находятся в состоянии блаженных или тревожных размышлений о нем. У них может даже пропасть аппетит.
На стадии влечения в дело вступает группа нейромедиаторов из группы моноаминов:
- Допамин — то самое вещество, ради которого некоторые вводят в свои организмы кокаин и никотин
- Норадреналин — ближайший родственник адреналина.
 Заставляет нас потеть, а сердце — учащенно биться.
Заставляет нас потеть, а сердце — учащенно биться. - Серотонин — главный «двигатель» любви, его недостаток приводит к депрессии, а переизбыток — к натуральному сумасшествию.
Стадия 3: Привязанность
Это чувства, которые возникают в нас, если отношениям суждено продлиться долгое время. Если бы стадия влечения продолжалась бесконечно, вряд ли из них получалось бы что-то путное, кроме кучи детей.
Автор фото, Science Photo Library
Подпись к фото,Окситоцин отвечает за прочную эмоциональную связь между матерью и ребенком
Привязанность — это долговременные добровольные обязательства, это связь между людьми, решающими создать союз и обзавестись потомством.
На этой стадии нервная система выпускает в организм два гормона, которые, как считают ученые, отвечают за социальную связь между людьми:
- Вазопрессин — важный для установления долговременных обязательств химический элемент. Опыты на мышах позволяют сделать вывод, что как только количество вазопрессина уменьшается в организмах самцов, их способность создавать пару с самкой тут же уменьшается. Они перестают заботиться о самке и становятся равнодушны к вниманию к ней со стороны других самцов.
- Окситоцин — выделяется гипоталамусом во время рождения ребенка, а также помогает молочным железам выделять молоко. В социальном отношении помогает укрепить связь между матерью и ребенком. Кроме того, этот гормон выделяется и у мужчин, и у женщин во время оргазма и — как полагают ученые — сближает партнеров эмоционально. Согласно теории, чем больше у вас с партнером секса — тем прочнее ваши отношения!
Угольная кислота и её соли — урок. Химия, 8–9 класс.
Угольная кислота
Угольная кислота h3CO3 — раствор углекислого газа в воде. Это слабая двухосновная кислота. Она образуется при растворении в воде оксида углерода(\(IV\)) и в свободном виде из раствора не выделяется. При попытке выделения кислота легко разлагается на углекислый газ и воду:
При попытке выделения кислота легко разлагается на углекислый газ и воду:
h3CO3⇄CO2↑+h3O.
Угольная кислота диссоциирует ступенчато. На первой ступени образуется гидрокарбонат-ион и ион водорода:
h3CO3⇄HCO3−+H+.
Гидрокарбонат-ион частично распадается на карбонат-ион и ещё один ион водорода:
HCO3−⇄CO32−+H+.
Диссоциация протекает слабо, ионов водорода в растворе содержится немного. Поэтому раствор углекислого газа (угольная кислота) имеет слегка кисловатый вкус и меняет окраску лакмуса на розовую (не красную).
Соли угольной кислоты
Как двухосновная угольная кислота образует два ряда солей: средние — карбонаты (K2CO3, CaCO3) и кислые — гидрокарбонаты (NaHCO3, Ca(HCO3)2).
Из карбонатов растворяются в воде соли натрия, калия и аммония. Гидрокарбонаты растворяются лучше.
Обрати внимание!
Все соли угольной кислоты реагируют с более сильными кислотами.
В результате выделяется углекислый газ, что позволяет использовать эту реакцию как качественную на карбонаты и гидрокарбонаты:
CaCO3+2HCl=CaCl2+h3O+CO2↑,
NaHCO3+HNO3=NaNO3+h3O+CO2↑.
Реакция карбоната с кислотой
Обрати внимание!
Карбонаты и гидрокарбонаты взаимопревращаемы.
Карбонаты превращаются в гидрокарбонаты при пропускании через их раствор или взвесь углекислого газа:
CaCO3+h3O+CO2=Ca(HCO3)2.
Обратное превращение происходит при нагревании:
Ca(HCO3)2=tCaCO3↓+h3O+CO2↑.
С присутствием в воде гидрокарбонатов кальция и магния связана временная жёсткость воды. Временная — потому что при нагревании растворимые кислые соли разлагаются, и ионы металлов связываются в нерастворимые карбонаты.
Применение солей угольной кислоты
Na2CO3 — карбонат натрия, или сода. Применяется в производстве стекла, мыла, бумаги.
NaHCO3 — гидрокарбонат натрия, или питьевая сода. Используется в быту и пищевой промышленности как разрыхлитель теста. Находит применение в медицине.
K2CO3 — карбонат калия, или поташ. Применяется в производстве жидкого мыла, стекла, в качестве удобрения.
CaCO3 — карбонат кальция. В природе встречается в виде мела, мрамора, известняка. Применяются как строительные и отделочные материалы, а также в производстве негашёной извести, цемента, стекла.
Выделить углекислый газ | Химик.ПРО – решение задач по химии бесплатно
Какой объем можно выделить углекислого газа (CO2) при действии 200 грамм 10-процентного раствора азотной кислоты (HNO3) на 90 грамм мела, содержащего 8% нерастворимых в кислоте примесей?
Решение задачи
Напомню, что основу химического состава мела составляет карбонат кальция (CaCO3) с небольшим количеством примесей.
Запишем уравнение реакции выделить углекислый газ (CO2):
Вычислим, сколько азотной кислоты (HNO3) (в граммах) содержится в 200 грамм 10-процентного раствора азотной кислоты (HNO3) по формуле:
m (HNO3) = 200 г ⋅ 0,1 = 20 (г).
Если раствор 10-процентный, то массовая доля азотной кислоты (HNO3) в нем 0,1.
Учитывая, что мел содержит 8% примесей, следовательно, в состав мела входит 92% (0,92) карбоната кальция (CaCO3). Вычислим, сколько карбоната кальция (CaCO3) (в граммах) содержится в 90 грамм мела по формуле:
Вычислим, сколько карбоната кальция (CaCO3) (в граммах) содержится в 90 грамм мела по формуле:
m (CaCO3) = 90 г ⋅ 0,92 = 82,8 (г).
Учитывая, что молярные массы азотной кислоты (HNO3) и карбоната кальция (CaCO3) соответственно равны 63 и 100 г/моль (смотри таблицу Менделеева), найдем химическое количество данных веществ по формуле:
Получаем:
n (HNO3) = 20 г / 63 г/моль = 0,32 (моль),
n (CaCO3) = 82,8 г / 100 г/моль = 0,83 (моль).
По уравнению реакции определим, какое вещество находится в избытке, а какое в недостатке. Напомню, расчет следует вести по недостатку.
Из уравнения реакции следует, что на 1 моль карбоната кальция (CaCO3) требуется в 2 раза больше азотной кислоты (HNO3), то есть на 0,83 моль карбоната кальция (CaCO3) необходимо 1,66 азотной кислоты (HNO3), следовательно, 0,32 моль недостаточно для 0,83 карбоната кальция (CaCO3), который взят в избытке и прореагирует неполностью.
Так как карбонат кальция (CaCO3) взят в избытке, расчет следует вести по числу молей азотной кислоты (HNO3). Составим соотношение:
2 моль HNO3 надо, чтобы выделить углекислый газ 1 моль
0,32 моль HNO3 надо, чтобы выделить углекислый газ х моль
Откуда:
Вычислим объем углекислого газа (CO2), который выделяется в ходе реакции по формуле, устанавливающей связь между химическим количеством вещества и объемом:
V (CO2) = 0,16 моль ⋅ 22,4 л/моль = 3,58 (л).
Ответ:
выделить углекислый газ объемом 3,58 литра.
7 важных советов, как готовиться к ЕГЭ по химии. Все нужные таблицы, формулы и пособия
До ЕГЭ по химии осталось совсем немного — меньше полугода (вот тут календарь ЕГЭ-2018). Но наверстать упущенное и разобраться наконец в таблице растворимости и формулах — не поздно. И не только в них, если составить чёткий план и выбрать правильные материалы. О подготовке к ЕГЭ по химии — преподаватель химии и автор телеграм-канала «ФарСмацевтика» Анна Тихонова.
И не только в них, если составить чёткий план и выбрать правильные материалы. О подготовке к ЕГЭ по химии — преподаватель химии и автор телеграм-канала «ФарСмацевтика» Анна Тихонова.
Рассылка «Мела»
Мы отправляем нашу интересную и очень полезную рассылку два раза в неделю: во вторник и пятницу
В этом году форма экзамена почти не изменилась: вместо 34 заданий их будет 35. Но из-за этого немного изменится система пересчёта первичных баллов в тестовые. Экзамен состоит из двух частей: первая предполагает выбор цифр или последовательности цифр (29 заданий), вторая — ответы с развёрнутым ответом (6 заданий). Максимальное количество первичных баллов, которое можно набрать за первую часть, — 40, за вторую — 20. Обычно мои ученики начинают паниковать уже на этой стадии — когда узнают о заданиях. Но на самом деле всё не так страшно, как кажется.
1. Найдите человека, которому вы сможете задавать вопросыНеобязательно нанимать репетитора. Этим человеком может быть учитель в школе или знакомый студент, который учится на химфаке. Главное — не стесняться задавать даже самые глупые, на ваш взгляд, вопросы и стараться закрывать пробелы, которые возникают во время подготовки. Поверьте, то, что у вас появляются хоть какие-то мысли насчёт химии, уже говорит о том, что процесс запущен. Смело поднимайте руку прямо во время урока, расспрашивайте репетитора, участвуйте в обсуждениях в тематических сообществах и не бойтесь выглядеть глупо в глазах других.
2. На экзамене у вас будет три официальные шпаргалки. И в них нужно разбиратьсяЭто таблица Менделеева, таблица растворимости и ряд напряжения металлов. В них содержится около 70% информации, которая поможет вам успешно сдать экзамен. На остальные 30% от вашего успеха приходится ваше умение пользоваться ими.
Чтобы разобраться с таблицей Менделеева, нужно сначала изучить периодические свойства элементов: строение атомов элементов, электроотрицательность, металлические, неметаллические, окислительные и восстановительные свойства, валентности, степени окисления. Если запомните их — не придётся запоминать свойства каждого отдельного элемента или каждого отдельного вещества в природе. Достаточно взглянуть в таблицу и вспомнить о периодическом законе.
Если запомните их — не придётся запоминать свойства каждого отдельного элемента или каждого отдельного вещества в природе. Достаточно взглянуть в таблицу и вспомнить о периодическом законе.
Подсказка для тех, кто вечно всё забывает: F (Фтор) самый сильный неметалл и самый электроотрицательный элемент, а Fr (Франций) — наоборот (самый сильный металл и наименее электроотрицательный элемент). Это поможет с чего-то начать.
3. Повторяйте математику. Химию без неё не сдатьКонечно, никто не просит вас интегрировать или дифференцировать и вообще на экзамене можно пользоваться непрограммируемым калькулятором. Но повторить темы процентов и пропорций — обязательно. Формул, которые необходимы для решения задач, не так уж и много. Запомнить нужно только основные: формула для расчёта массовой доли, массы вещества, объёма, количества вещества, плотности и выхода продукта. Зная их, вы сможете без проблем выводить другие.
Попробуйте вывести из формулы массовой доли массу раствора или, зная массу и молярную массу вещества, определить его количество. Через несколько недель тренировок вы заметите, что все эти формулы связаны между собой и, если вы что-то забыли, всегда можно вывести нужную вам формулу из другой.
4. Таблица химических реакций — ваш помощникВеществ в химии действительно очень много, их можно систематизировать и выявить закономерности. Вам поможет таблица взаимодействия веществ между собой. Распечатайте её и держите перед глазами, когда только начнёте решать цепочки или реакции.
Фото: chemistrytutor.wordpress.com/15.05.2008/inorgКак ей пользоваться?
- Научитесь определять класс веществ (оксиды, кислоты, соли, основания, металлы и неметаллы) и разберитесь в типах реакций, чем они друг от друга отличаются.
- В реакцию вступает минимум два вещества. Определяете, к какому классу относится первое вещество. Находите соответствующий пункт в таблице справа (или вверху).
- Проделайте то же самое со вторым веществом, ищите пункт сверху таблицы (или справа).

- Смотрите на пересечение этих двух пунктов в таблице — это ответ, который получается в реакции.
На экзамене такой шпаргалкой пользоваться нельзя. Но во время подготовки вы легко запомните, что получается, если, например, реагируют кислота и щелочь, и другие вещества. А это около 80% заданий на ЕГЭ.
5. Берите книжки ФИПИ и идите от простого к сложномуНа самом деле не важно, какой учебник вы выберете для подготовки к ЕГЭ. Берите тот, где вам будет понятен материал и в котором есть все темы, которые встретятся на экзамене. Что касается тестов, здесь тоже не нужно изобретать велосипед: я рекомендую пользоваться книжками ФИПИ. Тот материал, который они дают, максимально приближен к тому, что будет на экзамене. И можно решать тексты по изученным темам прямо на их сайте.
Начать стоит с блоков, которые встречаются чаще всего:
- строение атома, периодические свойства элементов
- типы химической связи
- классы неорганических веществ
- гидролиз
- электролиз
- взаимодействие веществ между собой и классификация химических реакций
- задачи на тему «растворы»
- химическое равновесие
- органическая химия (классы соединений, их способы получения и химические свойства)
Остальные блоки сложнее. После того, как прорешаете задания по основным блокам, вы поймёте, в каких темах у вас пробелы, а какие вы знаете хорошо. Закрепите темы, которые вы знаете лучше остальных, и вернитесь к изучению теоретической базы тех тем, которые даются хуже. Учите тему и выполняйте по 20 упражнений в день. Если времени для подготовки мало, сосредоточьтесь на заданиях, темы которых вам ясны. Лучше целиком решить задание с ОВР (окислительно-восстановительными реакциями), чем не сделать ничего.
6. Теория хорошо, но без тестов всё равно никудаЕсли кажется, что вы всё знаете из теории и вам не нужно тратить время на решение тестов — это не так. Большинство ошибок на экзамене случается из-за того, что ученик неправильно прочитал задание или не понял, что от него хотят. Чем чаще вы будете решать тесты, тем быстрее поймёте структуру экзамена и сложные и загадочные формулировки задания.
Большинство ошибок на экзамене случается из-за того, что ученик неправильно прочитал задание или не понял, что от него хотят. Чем чаще вы будете решать тесты, тем быстрее поймёте структуру экзамена и сложные и загадочные формулировки задания.
Например, в задании № 30 сказано: «Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. В ответе запишите молекулярное, полное и сокращённое ионное уравнения только одной из возможных реакций». Очень часто ученики пропускают стадию написания полного ионного уравнения и пишут сразу сокращённое, потому что так быстрее. Это не ошибка, но за это могу снять один первичный балл.
7. А вот читать лишние статьи и литературу точно не нужноИногда во время подготовки к экзамену ученик настолько увлекается, что начинает читать узкоспециализированную литературу. И при ответе на простой вопрос путает самого себя: вроде бы гидроксид цинка проявляет амфотерные свойства и реагирует и с кислотами, и с основаниями, а вот в такой-то статье говорилось, что новые исследования говорят абсолютно о другом. И это ставит под сомнения все фундаментальные знания о химии! Я, конечно, утрирую, но смысл в том, что цель экзамена — проверить ваши знания школьной программы. И стратегия «чем проще, тем вернее» работает в тестах как нельзя лучше.
Имеет ли запах мел 🚩 Естественные науки
Происхождение мел имеет органическое. Залежи этой породы представляют собой останки скелетов и раковин мелких моллюсков теплых морей Мелового периода. Помимо карбоната кальция, в состав мела в малых количествах входит карбонат магния, а также около 3% оксидов разных металлов.
Представляет собой мел мягкое тонкозернистое достаточно хрупкое вещество белого цвета. Ни один из входящих в состав этой породы основных компонентов запаха не имеет. Соответственно, и сам мел в сухом виде ничем не пахнет. Если просто, к примеру, мести рассыпанный мел в комнате, никакого запаха почувствовать невозможно.
В воде этот материал растворяется плохо, но его все же довольно-таки часто используют для изготовления побелочных растворов. При нанесении на стены меловой раствор, как и известковый, может издавать слабый, достаточно приятный запах свежести.
Однако и в этом случае пахнет не собственно сам мел. Возможно, появление запаха свежести при побелке связано с образованием гидрокарбоната кальция Ca(HCO3)2 в результате реакции CaCO3 с выдыхаемой человеком углекислотой.
- СаСО3+Н2О+СО2=Са(НСО3)2.
В химии считается, к примеру, что эта соль способна придавать воде вкус свежести.
Геологи относят мел к группе жестких полускальных пород. Прочность мела во многом зависит от степени его влажности. Снижаться ее показатели у этой породы начинают уже при влажности 1-2%.
При влажности же в 20-30% прочность мела на сжатие, наоборот, резко увеличивается в 2-3 раза. При этом порода начинает проявлять пластичные свойства. Именно со способностью мела становиться вязким во влажной среде связаны основные трудности в его добыче.
Будучи влажной, эта порода начинает налипать на ковши экскаваторов, кузова самосвалов, ленточные конвейеры. Из-за этого предприятия горнодобывающей промышленности зачастую отказываются вести разработки мела на большой глубине во влажных слоях, несмотря даже на то, что здесь он бывает достаточно качественным.
Помимо не слишком высокой прочности и способности становиться вязкой, к характерным особенностям этой породы можно отнести также неустойчивость к воздействию низких температур. Уже после нескольких циклов заморозки и разморозки мел рассыпается на кусочки размером не более 3 мм.
100 ballov.kz образовательный портал для подготовки к ЕНТ и КТА
В 2021 году казахстанские школьники будут сдавать по-новому Единое национальное тестирование. Помимо того, что главный школьный экзамен будет проходить электронно, выпускникам предоставят возможность испытать свою удачу дважды. Корреспондент zakon.kz побеседовал с вице-министром образования и науки Мирасом Дауленовым и узнал, к чему готовиться будущим абитуриентам.
Корреспондент zakon.kz побеседовал с вице-министром образования и науки Мирасом Дауленовым и узнал, к чему готовиться будущим абитуриентам.
— О переводе ЕНТ на электронный формат говорилось не раз. И вот, с 2021 года тестирование начнут проводить по-новому. Мирас Мухтарович, расскажите, как это будет?
— По содержанию все остается по-прежнему, но меняется формат. Если раньше школьник садился за парту и ему выдавали бумажный вариант книжки и лист ответа, то теперь тест будут сдавать за компьютером в электронном формате. У каждого выпускника будет свое место, огороженное оргстеклом.
Зарегистрироваться можно будет электронно на сайте Национального центра тестирования. Но, удобство в том, что школьник сам сможет выбрать дату, время и место сдачи тестирования.
Кроме того, в этом году ЕНТ для претендующих на грант будет длиться три месяца, и в течение 100 дней сдать его можно будет два раза.
— Расскажите поподробнее?
— В марте пройдет тестирование для желающих поступить на платной основе, а для претендующих на грант мы ввели новые правила. Школьник, чтобы поступить на грант, по желанию может сдать ЕНТ два раза в апреле, мае или в июне, а наилучший результат отправить на конкурс. Но есть ограничение — два раза в один день сдавать тест нельзя. К примеру, если ты сдал ЕНТ в апреле, то потом повторно можно пересдать его через несколько дней или в мае, июне. Мы рекомендуем все-таки брать небольшой перерыв, чтобы еще лучше подготовиться. Но в любом случае это выбор школьника.
— Система оценивания останется прежней?
— Количество предметов остается прежним — три обязательных предмета и два на выбор. Если в бумажном формате закрашенный вариант ответа уже нельзя было исправить, то в электронном формате школьник сможет вернуться к вопросу и поменять ответ, но до того, как завершил тест.
Самое главное — результаты теста можно будет получить сразу же после нажатия кнопки «завершить тестирование». Раньше уходило очень много времени на проверку ответов, дети и родители переживали, ждали вечера, чтобы узнать результат. Сейчас мы все автоматизировали и набранное количество баллов будет выведено на экран сразу же после завершения тестирования.
Раньше уходило очень много времени на проверку ответов, дети и родители переживали, ждали вечера, чтобы узнать результат. Сейчас мы все автоматизировали и набранное количество баллов будет выведено на экран сразу же после завершения тестирования.
Максимальное количество баллов остается прежним — 140.
— А апелляция?
— Если сдающий не будет согласен с какими-то вопросами, посчитает их некорректными, то он сразу же на месте сможет подать заявку на апелляцию. Не нужно будет ждать следующего дня, идти в центр тестирования, вуз или школу, все это будет электронно.
— С учетом того, что школьникам не придется вручную закрашивать листы ответов, будет ли изменено время сдачи тестирования?
— Мы решили оставить прежнее время — 240 минут. Но теперь, как вы отметили, школьникам не нужно будет тратить час на то, чтобы правильно закрасить лист ответов, они спокойно смогут использовать это время на решение задач.
— Не секрет, что в некоторых селах и отдаленных населенных пунктах не хватает компьютеров. Как сельские школьники будут сдавать ЕНТ по новому формату?
— Задача в том, чтобы правильно выбрать время и дату тестирования. Центры тестирования есть во всех регионах, в Нур-Султане, Алматы и Шымкенте их несколько. Школьники, проживающие в отдаленных населенных пунктах, как и раньше смогут приехать в город, где есть эти центры, и сдать тестирование.
— На сколько процентов будет обновлена база вопросов?
— База вопросов ежегодно обновляется как минимум на 30%. В этом году мы добавили контекстные задания, то что школьники всегда просили. Мы уделили большое внимание истории Казахстана и всемирной истории — исключили практически все даты. Для нас главное не зазубривание дат, а понимание значения исторических событий. Но по каждому предмету будут контекстные вопросы.
— По вашему мнению система справится с возможными хакерскими атаками, взломами?
— Информационная безопасность — это первостепенный и приоритетный вопрос. Центральный аппарат всей системы находится в Нур-Султане. Связь с региональными центрами сдачи ЕНТ проводится по закрытому VPN-каналу. Коды правильных ответов только в Национальном центре тестирования.
Центральный аппарат всей системы находится в Нур-Султане. Связь с региональными центрами сдачи ЕНТ проводится по закрытому VPN-каналу. Коды правильных ответов только в Национальном центре тестирования.
Кроме того, дополнительно через ГТС КНБ (Государственная техническая служба) все тесты проходят проверку на предмет возможного вмешательства. Здесь все не просто, это специальные защищенные каналы связи.
— А что с санитарными требованиями? Нужно ли будет школьникам сдавать ПЦР-тест перед ЕНТ?
— ПЦР-тест сдавать не нужно будет. Требование по маскам будет. При необходимости Центр национального тестирования будет выдавать маски школьникам во время сдачи ЕНТ. И, конечно же, будем измерять температуру. Социальная дистанция будет соблюдаться в каждой аудитории.
— Сколько человек будет сидеть в одной аудитории?
— Участники ЕНТ не за семь дней будут сдавать тестирование, как это было раньше, а в течение трех месяцев. Поэтому по заполняемости аудитории вопросов не будет.
— Будут ли ужесточены требования по дисциплине, запрещенным предметам?
— Мы уделяем большое внимание академической честности. На входе в центры тестирования, как и в предыдущие годы, будут стоять металлоискатели. Перечень запрещенных предметов остается прежним — телефоны, шпаргалки и прочее. Но, помимо фронтальной камеры, которая будет транслировать происходящее в аудитории, над каждым столом будет установлена еще одна камера. Она же будет использоваться в качестве идентификации школьника — как Face ID. Сел, зарегистрировался и приступил к заданиям. Мы применеям систему прокторинга.
Понятно, что каждое движение абитуриента нам будет видно. Если во время сдачи ЕНТ обнаружим, что сдающий использовал телефон или шпаргалку, то тестирование автоматически будет прекращено, система отключится.
— А наблюдатели будут присутствовать во время сдачи тестирования?
— Когда в бумажном формате проводили ЕНТ, мы привлекали очень много дежурных. В одной аудитории было по 3-4 человека. При электронной сдаче такого не будет, максимум один наблюдатель, потому что все будет видно по камерам.
В одной аудитории было по 3-4 человека. При электронной сдаче такого не будет, максимум один наблюдатель, потому что все будет видно по камерам.
— По вашим наблюдениям школьники стали меньше использовать запрещенные предметы, к примеру, пользоваться телефонами?
— Практика показывает, что школьники стали ответственнее относиться к ЕНТ. Если в 2019 году на 120 тыс. школьников мы изъяли 120 тыс. запрещенных предметов, по сути у каждого сдающего был телефон. То в прошлом году мы на 120 тыс. школьников обнаружили всего 2,5 тыс. телефонов, и у всех были аннулированы результаты.
Напомню, что в 2020 году мы также начали использовать систему искусственного интеллекта. Это анализ видеозаписей, который проводится после тестирования. Так, в прошлом году 100 абитуриентов лишились грантов за то, что во время сдачи ЕНТ использовали запрещенные предметы.
— Сколько средств выделено на проведение ЕНТ в этом году?
Если раньше на ЕНТ требовалось 1,5 млрд тенге из-за распечатки книжек и листов ответов, то сейчас расходы значительно сокращены за счет перехода на электронный формат. Они будут, но несущественные.
— Все-таки почему именно в 2021 году было принято решение проводить ЕНТ в электронном формате. Это как-то связано с пандемией?
— Это не связано с пандемией. Просто нужно переходить на качественно новый уровень. Мы апробировали данный формат на педагогах школ, вы знаете, что они сдают квалификационный тест, на магистрантах, так почему бы не использовать этот же формат при сдаче ЕНТ. Тем более, что это удобно, и для школьников теперь будет много плюсов.
Классная доска Мел Уравнение
Если вы ищете для классной доски, формула , просто просмотрите наши ссылки ниже:
https://www.quora.com/What-is-the-chemical-formula-of-chalk
7 ответов
Доска мелом не мел
Мел и классные доски, повсеместно распространенные во многих классах с 19 века, знакомы большинству из нас. Белый, пудровый и склонный к прилипанию…
Белый, пудровый и склонный к прилипанию…
https: //en.wikipedia.org / wiki / Мел
Наиболее распространенными формами являются CaCO3 (карбонат кальция) и CaO (оксид кальция). Небольшие дозы мела также можно использовать в качестве антацида.
https://www.shutterstock.com/search/chalkboard+equations
Найдите на доске уравнения: стоковые изображения в формате HD и миллионы других стоковых фотографий, иллюстраций и векторных изображений без лицензионных отчислений в коллекции Shutterstock. Тысячи…
http://www.madehow.com/Volume-1/Chalk.html
Эти маленькие классные доски использовались для практики, особенно среди молодежи… Формулы для каждого цвета и каждое изменение формулы должны получать одобрение.
https://epod.usra.edu/blog/2009/10/sidewalk-chalk-and-the-calcium-cycle.html
Фотограф: Роб Шеридан Краткое содержание Автор: Роб Шеридан Доска и мел для тротуаров изначально были сделаны из осадочной породы…
http://cameo.mfa.org/wiki/Blackboard_chalk
уравнение
https://www.softschools.com/formulas/chemistry/calcium_carbonate_uses_properties_structure_uses_properties_structure_formula/297/
Формула и структура: Химическая формула карбоната кальция — CaCO3… карбоната кальция используются в строительных материалах, керамической плитке, меле для школьных досок,…
https: // www.alamy.com/stock-photo/blackboard-equations.html
Сложная математическая формула волнового уравнения, заканчивающаяся на E = MC2 с мелом на доске — · Дифференциальные уравнения на доске — Stock Image · Доска с…
https://www.123rf.com/stock-photo/chalkboard_formula.html
Загрузите стоковые фотографии с формулой классной доски. Доступный и поиск среди миллионов изображений, фотографий и векторных изображений без лицензионных отчислений.
Доска Сахара Хана в Колумбийском университете. … Начало 1970-х годов, когда Ричард Фейнман разработал уравнение на доске Лайтмана…
https: // химия. stackexchange.com/questions/61408/chalk-and-vinegar
stackexchange.com/questions/61408/chalk-and-vinegar
1 ответ
Просмотры сообщений: 28 год
Химическое выветривание | Канадский музей науки и технологий
Если вы когда-нибудь видели ржавое здание, статую, которая выглядит так, как будто она гниет, или зеленую медную крышу здания парламента в Оттаве, вы видели химическое выветривание в действии. В этом эксперименте узнайте, как размер влияет на реакцию выветривания.
Что вам понадобится
- Уксус
- Мел для тротуаров (убедитесь, что на этикетке указано карбонат кальция)
- Две стеклянные чашки или банки
- Карандаш и бумага
Сделай это
- Возьмите два куска мела одинакового размера и поместите один в одну из банок.
- Разбейте вторую часть на множество более мелких частей и поместите части в другую банку.
- Наполните банки примерно таким же количеством уксуса. Этого должно быть достаточно, чтобы полностью покрыть весь мел, но с оставшимся местом наверху.
Проверить
Понаблюдайте за двумя сосудами около двух минут и запишите свои наблюдения. Что вы замечаете разницы между ними? Как вы думаете, почему это произошло?
Объясни
Мел для тротуаров содержит соединение, называемое карбонатом кальция (CaCO3), которое реагирует с уксусом (уксусная кислота, Ch4COOH) с образованием углекислого газа (CO2).Часть массы мела теряется, чтобы образовать этот газ, что делает его меньше.
Вы могли заметить, что реакция с измельченным мелом происходит намного быстрее, чем с твердым куском мела, о чем можно судить по тому, как быстро образуются пузыри. Это связано с тем, что для завершения реакции молекулы уксуса и мела должны столкнуться вместе. Когда мел разбивается, на мелких кусочках образуется большая поверхность, чтобы могла произойти реакция.
Соблюдайте
Хотя по своей природе это более медленный процесс, та же самая реакция происходит с известняком — с ним реагирует кислотный дождь, образуя углекислый газ. Этот процесс называется химическим выветриванием. Как показано в этом эксперименте, когда известняк состоит из более мелких кусков, он выветривается быстрее, даже с той же массой. Взгляните на статуи в вашем городе или городе; можешь сказать, какие из них старше?
Этот процесс называется химическим выветриванием. Как показано в этом эксперименте, когда известняк состоит из более мелких кусков, он выветривается быстрее, даже с той же массой. Взгляните на статуи в вашем городе или городе; можешь сказать, какие из них старше?
Далее
В природе обычно, когда чему-то требуется поверхность для выполнения чего-либо (например, реакции), структура мала. Это связано с тем, что объекты меньшего размера имеют большую площадь поверхности по сравнению с их объемом.
Это можно показать математически. Представьте, что у вас есть три куба: один размером 1x1x1, второй — 2x2x2 и третий — 3x3x3. Сначала вычислите объем (длина 4), а затем вычислите площадь поверхности (длина 3 x 6) для каждого куба. Затем посмотрите, как быстро площадь поверхности и объем растут от одного куба к другому. Вы заметите, что объем растет быстрее, чем площадь поверхности, поэтому соотношение между ними становится меньше.
Это явление позволяет таким вещам, как клетки, быть такими же эффективными, как они есть; их небольшой размер позволяет им переносить больше еды по своей поверхности, не тратя при этом энергию на большой интерьер!
формула органической химии, нарисованная мелом на доске Фотография, картинки, изображения и сток-фотография без роялти.Изображение 17854149.
формула органической химии, нарисованная мелом на доске Фотография, картинки, изображения и сток-фотография без роялти. Изображение 17854149.Формула органической химии, нарисованная мелом на доске
S M L XLТаблица размеров
| Размер изображения | Идеально подходит для |
| S | Интернет и блоги, социальные сети и мобильные приложения. |
| M | Брошюры и каталоги, журналы и открытки. |
| л | Плакаты и баннеры для дома и улицы. |
| XL | Фоны, рекламные щиты и цифровые экраны. |
Используете это изображение на предмете перепродажи или шаблоне?
Распечатать Электронный Всесторонний
2900 x 2600 пикселей | 24.6 см x 22,0 см | 300 точек на дюйм | JPG
Масштабирование до любого размера • EPS
2900 x 2600 пикселей | 24,6 см x 22,0 см | 300 точек на дюйм | JPG
Скачать
Купить одно изображение
6 кредитов
Самая низкая цена
с планом подписки
- Попробовать 1 месяц на 2209 pyб
- Загрузите 10 фотографий или векторов.
- Нет дневного лимита загрузок, неиспользованные загрузки переносятся на следующий месяц
221 ру
за изображение любой размер
Цена денег
Ключевые слова
Похожие изображения
Нужна помощь? Свяжитесь с вашим персональным менеджером по работе с клиентами
@ +7 499 938-68-54
Мы используем файлы cookie, чтобы вам было удобнее работать.Используя наш веб-сайт, вы соглашаетесь на использование файлов cookie, как описано в нашей Политике использования файлов cookie
. ПриниматьЧто такое карбонат кальция? — Ассоциация промышленных минералов
Карбонат кальция, или CaCO3, составляет более 4% земной коры и встречается во всем мире. Его наиболее распространенными природными формами являются мел, известняк и мрамор, образующиеся в результате осаждения раковин небольших окаменелых улиток, моллюсков и кораллов в течение миллионов лет.Хотя все три формы идентичны по химическому составу, они различаются по многим другим параметрам, включая чистоту, белизну, толщину и однородность. Карбонат кальция — одно из самых полезных и универсальных материалов, известных человеку.
Его наиболее распространенными природными формами являются мел, известняк и мрамор, образующиеся в результате осаждения раковин небольших окаменелых улиток, моллюсков и кораллов в течение миллионов лет.Хотя все три формы идентичны по химическому составу, они различаются по многим другим параметрам, включая чистоту, белизну, толщину и однородность. Карбонат кальция — одно из самых полезных и универсальных материалов, известных человеку.
Многие из нас впервые сталкиваются с карбонатом кальция в школьном классе, где мы используем мел для классной доски. Мел использовался в качестве инструмента для письма более 10 000 лет и представляет собой тонкий микрокристаллический материал. Карбонат кальция, как и известняк, представляет собой биогенную породу, более плотную, чем мел.Как и мрамор, карбонат кальция представляет собой крупнокристаллическую метаморфическую породу, которая образуется при перекристаллизации мела или известняка в условиях высокой температуры и давления. Большие месторождения мрамора находятся в Северной Америке и Европе; например, в Карраре, Италия, доме чисто белых статуй, из которых Микеланджело создавал свои скульптуры.
Карбонат кальция, используемый в промышленных целях, добывается в горнодобывающих или карьерных целях. Чистый карбонат кальция может быть получен из мрамора или его можно получить, пропуская диоксид углерода в раствор гидроксида кальция.В последнем случае карбонат кальция получают из смеси, образуя продукт, называемый «осажденный карбонат кальция» или ОКК. ОКК имеет очень мелкие и контролируемые частицы, порядка 2 микрон в диаметре, что особенно полезно в производстве. бумаги.Другим основным типом промышленного продукта является «измельченный карбонат кальция» или GCC. GCC, как следует из названия, включает дробление и обработку известняка для создания порошкообразной формы, градуированной по размеру и другим свойствам, для многих различных промышленных и фармацевтических применений.
Изучение карбоната кальция дает важные уроки об истории Земли, поскольку мел, известняк и мрамор ведут свое происхождение от мелководья. Таким образом, наблюдение, что большие количества отложений мела одного возраста обнаружены на многих континентах, привело к открытию того, что существовал период, когда во всем мире существовали мелководья, где процветали обитающие в панцире организмы. Некоторые предлагают это как доказательство библейского потопа. Природа возвращает благосклонность, поскольку растворы карбоната кальция из текущих отложений обеспечивают живые организмы материалом, необходимым для роста их защитных панцирей и скелетов.Например, яичная скорлупа состоит примерно на 95% из карбоната кальция.
Таким образом, наблюдение, что большие количества отложений мела одного возраста обнаружены на многих континентах, привело к открытию того, что существовал период, когда во всем мире существовали мелководья, где процветали обитающие в панцире организмы. Некоторые предлагают это как доказательство библейского потопа. Природа возвращает благосклонность, поскольку растворы карбоната кальция из текущих отложений обеспечивают живые организмы материалом, необходимым для роста их защитных панцирей и скелетов.Например, яичная скорлупа состоит примерно на 95% из карбоната кальция.
Карбонат кальция вызывает уникальную реакцию с кислотами. При контакте с кислотой — независимо от ее силы — выделяется углекислый газ. Это дает геологам надежный тест для определения карбоната кальция. Это же явление важно для образования пещер. Кислая дождевая вода стекает и уходит под землю, где растворяется карбонатный известняк. Вода с карбонатом кальция стекает вниз и в конечном итоге достигает заполненной воздухом полости под землей, где может выделяться углекислый газ.Когда он высвобождается, карбонат кальция снова кристаллизуется. Сталактитовые и сталагмитовые образования образуются, когда вода, содержащая карбонат кальция, капает, оставляя некоторый минерал у источника капель на крыше пещеры и некоторых мест, где он падает. Это чрезвычайно долгий процесс, который часто длится многие тысячи лет.
Каким бы интересным ни был карбонат кальция по своей природе, его влияние и ценность для нашей повседневной жизни поистине невероятны.
Бумага, пластмассы, краски и покрытия: карбонат кальция является наиболее широко используемым минералом в бумажной, пластмассовой, лакокрасочной промышленности и в качестве наполнителя — и благодаря своему особому белому цвету — в качестве пигмента для покрытий.В бумажной промышленности он ценится во всем мире за его высокую яркость и характеристики светорассеяния и используется в качестве недорогого наполнителя для изготовления яркой непрозрачной бумаги. Наполнитель используется в мокрой части бумагоделательных машин, а наполнитель из карбоната кальция позволяет бумаге быть яркой и гладкой. В качестве наполнителя карбонат кальция может составлять до 30% по весу в красках. Карбонат кальция также широко используется в качестве наполнителя в клеях и герметиках.
Наполнитель используется в мокрой части бумагоделательных машин, а наполнитель из карбоната кальция позволяет бумаге быть яркой и гладкой. В качестве наполнителя карбонат кальция может составлять до 30% по весу в красках. Карбонат кальция также широко используется в качестве наполнителя в клеях и герметиках.
Личное здоровье и производство продуктов питания: Карбонат кальция широко используется в качестве эффективной пищевой добавки с кальцием, антацида, фосфатного связующего или основного материала для лекарственных таблеток.Его также можно найти на полках многих продуктовых магазинов в таких продуктах, как разрыхлитель, зубная паста, сухие десертные смеси, тесто и вино. Карбонат кальция является активным ингредиентом сельскохозяйственной извести и используется в кормах для животных. Карбонат кальция также приносит пользу окружающей среде за счет очистки воды и отходов.
Строительные материалы и строительство: Карбонат кальция имеет решающее значение для строительной отрасли как сам по себе строительный материал (например, мрамор), так и как компонент цемента.Он способствует получению раствора, используемого для склеивания кирпичей, бетонных блоков, камней, кровельной черепицы, резиновых смесей и черепицы. Карбонат кальция разлагается с образованием диоксида углерода и извести, важных материалов при производстве стали, стекла и бумаги. Благодаря своим антацидным свойствам карбонат кальция используется в промышленных условиях для нейтрализации кислых условий как в почве, так и в воде.
Кристаллы карбоната кальция называют кальцитом. Кристалл кальцита обычно считается ромбоэдром из-за его свойств расщепления.Раскол — это то, что заставляет кристаллы наклоняться там, где силы связи слабы, и они склонны разбиваться на плоскости. Кальцит уникален тем, что его расщепление имеет три различных направления. Существует более 300 форм кристаллов кальцита. Кристаллы кальцита также бывают разных цветов, но обычно белые или прозрачные. Еще одним важным свойством кристалла кальцита является его свойство двойного лучепреломления. Двойное лучепреломление возникает, когда луч света проходит через среду и разделяется на два разных луча: один движется медленно, а другой — быстро.Два разных луча изогнуты под двумя разными углами преломления. В результате этого свойства человек, смотрящий сквозь кальцит, видит два изображения. Это свойство двойного лучепреломления ценно для ряда оптических приложений.
Двойное лучепреломление возникает, когда луч света проходит через среду и разделяется на два разных луча: один движется медленно, а другой — быстро.Два разных луча изогнуты под двумя разными углами преломления. В результате этого свойства человек, смотрящий сквозь кальцит, видит два изображения. Это свойство двойного лучепреломления ценно для ряда оптических приложений.
[PDF] Chalk Lab — My eCoach
Скачать Chalk Lab — My eCoach …
Chalk Lab Honors Chalk — это карбонат кальция. В этой лабораторной работе вы будете писать мелом на тротуаре и подсчитывать, сколько кротов теперь прилипло к тротуару.Порядок действий: 1. Возьмите кусок мела и измерьте его массу на весах; записать массу в таблицу данных. 2. Выйдите на улицу и нарисуйте что-нибудь на тротуаре. 3. Вернитесь в класс и взвесьте неиспользованный мел; записать массу в таблицу данных. 4. Основываясь на начальной массе мела и массе в конце, подсчитайте, сколько граммов мела вы оставили на тротуаре (конечная начальная масса). 5. Запишите химическую формулу мела; мел — это соединение, образующееся при соединении ионов кальция и карбоната.6. Рассчитайте молярную массу мела. ВЫ ДОЛЖНЫ ИСПОЛЬЗОВАТЬ РАЗМЕРНЫЙ АНАЛИЗ. ПОКАЗАТЬ ВСЮ СВОЮ РАБОТУ.
Таблица данных: ****** Скопируйте в свою лабораторную записную книжку: Масса мела до записи Масса мела после записи Масса мела на тротуаре Химическая формула мела Молярная масса мела
Анализ / Заключение: Использование этих данных , рассчитайте: ПОКАЖИТЕ ВСЕ РАБОТЫ ДЛЯ ПОЛУЧЕНИЯ КРЕДИТА !!!! 1. Покажите расчеты, использованные для получения молярной массы мела. 2. Подсчитайте количество использованных молей мела. 3. Сколько единиц (RP) сульфата марганца (IV) имеется, если вам дано 542?32 г? 4. Сколько молей оксида магния содержится в типичных частицах размером 8,25 x 1024? 5. Какова масса хлорида калия в типичных частицах 4,25 x 1023?
Chalk Lab Regular Chalk — это карбонат кальция. В этой лабораторной работе вы будете писать мелом на тротуаре и определять, как кроты теперь прилипают к тротуару.

 Заставляет нас потеть, а сердце — учащенно биться.
Заставляет нас потеть, а сердце — учащенно биться.