ICSC 1535 — ОЛОВО
ICSC 1535 — ОЛОВО| ОЛОВО | ICSC: 1535 |
| Октябрь 2004 |
| CAS #: 7440-31-5 | |
| EINECS #: 231-141-8 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Горючее. | НЕ использовать открытый огонь. | Использовать специальй порошок, сухой песк. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. | Применять местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. |
| Кожа | Защитные перчатки. | Ополоснуть и затем промыть кожу водой с мылом. | |
| Глаза | Покраснение. Боль. | Использовать защитные очки. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. | |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Индивидуальная защита: Респиратор с сажевым фильтром, подходящий для концентрации вещества в воздухе. Смести просыпанное вещество в закрытые контейнеры. При необходимости, сначала намочить, чтобы избежать появления пыли. | Согласно критериям СГС ООН Транспортировка |
| ХРАНЕНИЕ | |
| Отдельно от сильных окислителей. | |
| УПАКОВКА | |
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
Агрегатное Состояние; Внешний Вид БЕЛЫЙ КРИСТАЛЛИЧЕСКИЙ ПОРОШОК. Физические опасности Химические опасности | Формула: Sn |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
Пути воздействия Эффекты от кратковременного воздействия  | Риск вдыхания Эффекты от длительного или повторяющегося воздействия |
| Предельно-допустимые концентрации |
|---|
| TLV: (как Sn): 2 mg/m EU-OEL: 2 mg/m3 как TWA |
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
| Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
описание, история, характеристики, параметры, свойства и цена
Характеристика и физические свойства олова
Олово наделено множественными свойствами и вступает в реакцию со многими металлами, неметаллами и другими элементами периодической таблицы Менделеева. Поэтому рассмотрим общие характеристики вещества:
- Олово способно преобладать в твердом или жидком состоянии, поэтому значения плотности в различных вариантах отличаются — в первом случае показатель приравнивается к 7.3 г/куб. см, во втором — 6,98 7.3 г/куб. см.
- Что касается влиянию высоких температур, то стоит отметить, что олово начинает плавиться при 232
- Емкость теплоотдачи олова в затвердевшей форме составляет 226 Дж/(кг*К), а в жидком, эта цифра доходит до 268 Дж/(кг*К).
- Молярная емкость теплоотдачи при стабильном давлении составляет: для белого олова — 27,11 Дж/(моль*К), для серого — 25,79 Дж/(моль*К).

- Теплоотдача при плавлении олова — 7,19 кДж/моль, а при испарении — 296 кДж/моль.
- Теплопроводность при оптимальной температуре (около 20 0С) приравнивается 65,26 Вт/(м*К).
- Сопротивление электротока колеблется в пределах 0,115 мк Ом*м.
- Удельная электрическая проводимость при 20 0С равняется 8,69 МСм/м.
- Тугость металла твердой формы варьируется в рамках от 55 ГПа до 48 ГПа при условии температур от 0 до 100 0С.
- Сопротивление при разрыве твердого олова равно 20 МПа.
- Удлинение — до 40%.
- Твердость серого олова достигает 62 МПа, белого — до 152 МПа.
- Оптимальная температура для литья колеблется от 260 до 300 градусов.
- При нагревании до + 170С олово приобретает хрупкую структуру.
Белое и серое олово: в чем различие?
Олово — это элемент, относящийся к классу полиморфических металлов. В быту многие сталкиваются с его бета-модификацией. Это белое олово со стойкостью к температурам от 14 и выше градусов по Цельсию.
При воздействии низкой температуры на белое олово, структура металла начинает меняться, постепенно переходя в альфа-версию, приобретая серый оттенок. Это обуславливается тем, что при падении температуры ниже 0 градусов, кристаллы формируют новую структуру, как у алмаза. При этом, увеличивается объем металла, и он постепенно начинает распадаться, пока окончательно не превратиться в оловянный порошок.
Переход с одной модификации в другую, обуславливается воздействием низкой температуры. В естественных условиях окружающей среды, этот переход проходит немного быстрее, а максимально быстрый распад достигается при температуре — 33 градуса. Однако образование порошкообразного вещества может происходить не только под влиянием низких температур. Ионное излучение также может вызвать распад металла и его переход в состояние порошка. Существует возможность изменить структуру олова до гелиевого состояния, если достичь необходимого охлаждения в определенных условиях.
Однако образование порошкообразного вещества может происходить не только под влиянием низких температур. Ионное излучение также может вызвать распад металла и его переход в состояние порошка. Существует возможность изменить структуру олова до гелиевого состояния, если достичь необходимого охлаждения в определенных условиях.
Электрофизические характеристики олова обуславливаются его структурой, поэтому каждой модификации присущи свои показатели. Например, бета-олово считается металлом, а версия альфа является полупроводником, который используется при пайке. При воздействии внешних факторов, альфа-олово (ниже 3,72 К) преобразуется в модификацию сверхпроводника. При этом атомы кристаллической решетки бета-модификации образуют s2p2, а форма альфа обращается в состояние sp3. При воздействии магнитного поля олово может проявлять себя по-разному. В одном случае оно парамагнитно, но при определенных обстоятельствам может стать диамагнитным.
Если представить, что различные модификации будут взаимодействовать между собой, то бета-олово может быстро трансформироваться в альфа-олово. Это происходит потому, что структура олова не постоянна. Такой процесс перехода можно сравнить с заражением. Такое поведение металла было замечено еще в 1870 году, и названо уже в 1911 году «оловянной чумой».
Это происходит потому, что структура олова не постоянна. Такой процесс перехода можно сравнить с заражением. Такое поведение металла было замечено еще в 1870 году, и названо уже в 1911 году «оловянной чумой».
В ходе экспериментов и химических опытов было установлено, что заражение можно предотвратить и даже остановить. Для этого необходимо использовать химический элемент — висмут. Ученые даже нашли способ, чтобы ускорить процесс перехода с бета до альфа-версии. Этому способствует химическая реакция олова с хлор станнатом аммония.
Залежи олова
Олово способно локализоваться, как в открытых источниках, так и глубоко под землей. По наблюдениям ученых, процент содержания зарегистрированных источников ничтожно мал. А вот в олово-рудных ресурсах объем минерала значительно увеличивается. В последнее время большую часть находят в воде. Это обуславливается разложением нестабильных минералов, в окисленных зонах.
Олово как природный минерал
В природе олово встречается очень редко. Если сравнить его распространенность с другими металлами, то в этой категории оно занимает 47 место по всей земле. Запасы элемента в земном массиве варьируются в пределах от 2*10-4 до 8*10-3 %, без учета ресурсов в океанских и морских глубинах. Преобладающим минералом, из которого получают олово, считается касситерит. Он содержит в себе порядка 79% металла.
Если сравнить его распространенность с другими металлами, то в этой категории оно занимает 47 место по всей земле. Запасы элемента в земном массиве варьируются в пределах от 2*10-4 до 8*10-3 %, без учета ресурсов в океанских и морских глубинах. Преобладающим минералом, из которого получают олово, считается касситерит. Он содержит в себе порядка 79% металла.
Первые месторождения олова
Самые большие запасы олова находятся в южных континентах — Китае и Японии. Помимо этого, немалые залежи оловянной руды найдены в Южной Америке. Россия также является месторождением данного минерала.
Кислотно-щелочные свойства
Учитывая, что олово является амфотерным веществом, то помимо основных свойств, оно может проявлять кислотные и щелочные характеристики. Благодаря им, появляется вероятность выявления олова во внешней среде. Элемент по некоторым свойствам похож на кварц, что дает возможность определять связь минерала как оксид с соединениями кислот. Большое содержание олова в ископаемых источниках может формировать кварцево-касситеритовые руды. Его щелочные свойства можно заметить в различных сульфитах.
Его щелочные свойства можно заметить в различных сульфитах.
Преобладающие формы
Олово часто встречается в составе горных образований, наполняющих земную кору. Реже его можно встретить в результате образования вулканических пород и других минеральных соединений. Самые большие запасы элемента преобладают в окисной форме.
Олово при низких температурах
Оловянная чума стала причиной трагических событий 1912, во время экспедиции Скотта на Южный полюс. Его путешествие закончилось преждевременно, а виной тому стали оловянные крышки на бачках с горючим. Находясь в холодных климатических условиях, температура достигла той отметки, когда олово преобразовалось в порошок, и все топливные запасы были потеряны.
Изотопы
Олово имеет постоянное количество нуклидов. Количество протонов у него приравнивается к 50-ти. Они равномерно насыщают зону вокруг ядра, что прибавляет больше энергетики. Поэтому, их число считают магическим, а сам элемент располагает максимальным объемом неизменных изотопов, по сравнению с другими элементами. В металле содержаться два изотопа, которые при выпадении из бета-олова становятся радиоактивными.
В металле содержаться два изотопа, которые при выпадении из бета-олова становятся радиоактивными.
Твердые минеральные источники
В условиях внешней среды олово может преобладать в трех основных видах:
Рассеянный класс. Неопределенность названия говорит о том, что неизвестно в какой конкретной форме находится элемент. Обычно олово наблюдается в изоморфной рассеянной форме вместе с другими сопутствующими веществами. К ним относятся вольфрам, ниобий и тантал, которые образуют кислотные соединения. Цезий, Таллий и Ванадий способствуют формированию кислых и сульфидных связей. Если олово преобладает в обычном состоянии, то реагенты замещаются в различном изоморфном порядке.
Минеральный тип. Данный тип обуславливает наличием олова в различных минералах. Чаще всего ими являются гранаты, магнетиты, турмалины и другие образования. Обычно их взаимодействие влияет только на преобразование химического состава элемента, не нарушая его структуру. Максимальной накаляемостью в оловоносных минералах наблюдается соединение с гранатами, эпитодами и другими минералами.
Источники сульфидов содержат высокий процент олова как изоморфного компонента. В приморском регионе России найдены новые месторождения сфалеритов, халькопиритов, пиритов и других минералов. Учитывая ограничение изоморфных структур, то при этом случается разложение образца с выпадением филлита.
Формирование и виды осадочных пород
Как природный материал, олово может встречаться не только в различных минералах, породных образованиях, но и других источниках в виде различных соединений.
Природные соединения и сплавы олова
Олово способно формироваться в совокупности с иными химическими веществами в геологических условиях, которые можно классифицировать следующим образом:
Образование руд происходят по сей день. Причиной вполне могут служить океанические осадки с Тихого океана, гидротермальной камчатской зоны или продукты выбросов Тол Бачинского вулкана.
Эффузивные или интрузивные магматические залежи траппов и пикритов на сибирской площадке, а также габброиды, гипербазит и магматические породы, локализующиеся на Камчатке.
Преобразование пород при гидротермическом и метасоматическом влиянии. К таковым стоит отнести золотоносные или медно-никелиевые залегания на территории России и Узбекистана.
Касситерит
Наиболее встречающимся оловянным ресурсом считается касситерит (SnO2). Он представлен в виде окисного соединения олова с кислородом. Учитывая, что этот образец является наиболее встречающимся минералом, содержащим большой процент олова, то первым делом нужно обращать внимание на его структуру. Если детально осмотреть образец породы, то можно наблюдать отдельные кристаллы олова. Они могут достигать до 3-4 мм в диаметре, а в некоторых случаях и больше.
Гидроокисные оловянные источники
На основе достоверной информации, подобные источники белого или серого металла занимают не лидирующие позиции. Они представлены в форме солей поли оловянных кислот. К таким можно отнести варламовит, сукулаит или отвердевшую примесь олова в магнетите. Чаще всего это полу аморфные соединения элемента.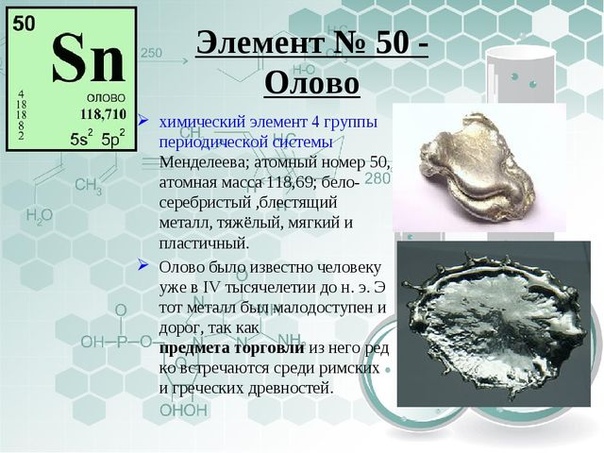 Помимо этого, олово содержится в оксидных соединениях — CuSn(OH)6, 3SnO·h3O и других оксидах.
Помимо этого, олово содержится в оксидных соединениях — CuSn(OH)6, 3SnO·h3O и других оксидах.
Силикаты
Еще одним распространенным минералом, содержащим олово, является малахит. Он принадлежит к классу силикатов, которые способны формировать огромные залежи металла.
Шпинелиды
Шпинелиды являются еще одним источником окисных соединений, которые содержат оловянные примеси. Основным веществом считается нигерит.
Сульфидные соединения олова
Данный класс обуславливается соединением олова с серными породами. В производственной сфере они занимают вторую позицию. Основным материалом добычи олова является станнин. Помимо этого, к этой группе можно отнести и другие соединение на основе цветных металлов: Cu, Pb или Ag. Такие руды могут содержать различный процент олова, в зависимости от климатических условий.
Минерал Станнин
Оловянный колчедан — это второе название данного минерала, относящегося к сульфидному классу. Он является самым распределенным источником олова, залегающим на территории России. Процентное содержания искомого металла составляет от 10 до 40%. При увеличении этой доли можно наблюдать признаки разложения станина, сопровождающиеся выделением касситерита.
Процентное содержания искомого металла составляет от 10 до 40%. При увеличении этой доли можно наблюдать признаки разложения станина, сопровождающиеся выделением касситерита.
Коллоидная форма олова
С геохимической точки зрения, олово является сложным элементом, поэтому изучено оно не до конца. В природе можно наблюдать олово-кремнистые соединения, относящиеся к группе коллоидов. В основном, олово образуется в результате изменения структуры кристаллической решетки многих соединений и элементов. Благодаря этому и коломорфным связям, металл может изменять свое физическое состояние, образуя гелеобразные смеси.
В ходе множественных экспериментов, ученые выяснили, что при взаимодействии металла с хром-кремневым соединением, олово видоизменяется. При этом его коллоидная форма используется как вспомогательное звено.
Чтобы понять, как изменяется форма и химические свойства олова, необходимо рассмотреть несколько примеров перехода металла в жидкое состояние.
Учитывая, что его геохимические свойства являются наиболее неизученным разделом, то предоставленная информация, это не результаты проведенных опытов или исследований, а всего лишь теоретические выводы ученых. Основываясь на этих фактах, можно разделить локализацию олова в смесях на следующие классы:
Основываясь на этих фактах, можно разделить локализацию олова в смесях на следующие классы:
- Ионные связи.
- Гидроксильные соединения.
- Сульфидные связи.
- Комплексные соединения.
Все наблюдения по поводу реакций или структуры ионных соединений, строятся на геохимических и валентных предположениях. Они делятся на две основные группы:
Простые ионы, которые наблюдались в примесях с малой долей рН и продуктах магматического разложения. Однако конкретных форм при условии газового или жидкого состояния металла выявлены небыли.
Галогениды — вещества, содержащие фтор и воздействующие на металл в процессе разложения и перехода в иное состояние.
Минеральные формы гидроксильных соединений в щелочной среде часто образуют двух, трех и четырехвалентные оловянные кислоты (h3SnO). Они могут формироваться естественным образом или иметь искусственное происхождение. Результаты проведенных исследований показали, что олово в составе кислот проявляется очень слабо и способна формировать химические комбинации по подобию варламовита.
Сульфидные связи в кислотной сфере крайне неустойчивы.
Комплексная связь была обнаружена в результате опытов, методом воздействия фторовых соединений на касситерит. Анализы показали, фторовые и хлоридные растворы при воздействии на минералы проявляют идентичные свойства. В ходе исследований было проделано несколько опытов с различными реактивами. В результате получились совокупные соединения модели Na2[Sn(OH)2F4]. И это только один из множественных образцов, которые были получены.
Олова-кремневые и коллоидные образования формируются при наличии касситерита, который наблюдается практически во всех оловянных месторождениях.
Особенности производства
Производственный процесс по изготовлению олова состоит из нескольких этапов. Сначала приготовленную руду помещают в специальные дробилки и мельницы, где минерал приобретает мелкую фракцию (кусочки не более 10 мм в диаметре). Затем гравитационно-вибрационным методом извлекаются частицы касситерита. Наряду с этим применяется флотационный метод обогащения минерала, после которого касситерит приобретает концентрат олова до 70%.
В ходе последующей переработки сырья, осуществляется удаление мышьяка и серы. После этого, полученный продукт отправляют в печь для выплавки. Там минерал послойно смешивается с древесными углями, для освобождения его от ненужных веществ. Здесь же добавляется Zn, Pb или Cu. Для очищенного олова используется метод плавки.
Сфера использования
Благодаря свои антикоррозийным свойствам, олово широко применяется при литье различных сплавов. Оно является одним из основных компонентов бронзы, изготовления белой жести и других материалов. Его успешно используют в электротехнической сфере для пайки контактов и микросхем. Олово также необходимо при производстве посуды, которая выполняется и специального оловянного сплава — пьютера.
Во всех вышеперечисленных случаях, элемент используется в малых долях. Большая часть олова приходится на плавление с медью, цинком, свинцом и сурьмой. Также возможно сочетание некоторых элементов: медь с цинком, медь с сурьмой и другие. Благодаря своей экологичности и проводимости, олово используют для изготовления кабелей с большой электропроводностью.
Также олово применяется для изготовления лакокрасочных материалов, которые имитирую золотистое покрытие. Цинко-оловянные соединения используют для легирования стали и нержавеющих сплавов из черного металла.
Помимо этого, оловянные изомеры, полученные искусственным путем являются источниками гамма-излучения, поэтому их успешно применяют в спектроскопии.
Благодаря своим свойствам, олово участвует в производстве анода и различного рода химических испытаниях. На основе свинцово-оловянных сплавов делают аккумуляторные батареи. Они превосходят обычные АКБ по качеству, емкости и сроку службы. Их энергетическая плотность в 5 раз превышает энергию обычных свинцовых аккумуляторов, имея при этом наименьшее сопротивление.
Олово физические свойства — Справочник химика 21
Органические соединения олова Физические свойства [c.382] Изменение структуры простых веществ в ряду Ое — 5п — РЬ соответствует изменению их физических свойств. Так, германий (АЕ = = 0,78 эВ) и а-олово (АЕ 0,08 эВ) — полупроводники, а Р-олово [c.422]
Так, германий (АЕ = = 0,78 эВ) и а-олово (АЕ 0,08 эВ) — полупроводники, а Р-олово [c.422]
Рассмотрение табл. 7-2 показывает, что Менделееву удалось очень точно предсказать физические и химические свойства недостававшего в его системе эле.мента. Этому элементу отводилось место в периодической таблице под кремнием, 81, и над оловом, 8п. Физические свойства германия представляют собой как раз нечто среднее между свойствами кремния и олова. Для предсказания химических свойств экасилиция Менделеев воспользовался также данными о закономерном изменении свойств в триаде фосфор-мышьяк-сурьма (8Ь), являющейся в периодической таблице правым соседом триады кремний-экасилиций-олово. [c.310]
Термодинамическая система, состоящая из различных по своим свойствам частей, разграниченных поверхностями раздела, называется гетерогенной системой. Примеры гетерогенных систем смесь двух кристаллических веществ, насыщенный раствор соли в воде и кристаллы соли смесь нескольких жидкостей, трудно растворимых друг в друге вода и водяной пар сплав свинца и олова, состоящий из отдельных кристаллов РЬ и 5п.
 Каждая гетерогенная система состоит из отдельных фаз. Фазой называется часть гетерогенной системы, ограниченная поверхностью раздела и характеризующаяся в отсутствие сил внешнего поля одинаковыми физическими свойствами во всех своих точках. [c.319]
Каждая гетерогенная система состоит из отдельных фаз. Фазой называется часть гетерогенной системы, ограниченная поверхностью раздела и характеризующаяся в отсутствие сил внешнего поля одинаковыми физическими свойствами во всех своих точках. [c.319]Оловянистые бронзы представляют собой сплавы медь—олово, отличающиеся высокой прочностью. Сплавы, содержащие более 5 % 5п, особо устойчивы к ударной коррозии. По сравнению с медью сплавы медь—кремний, содержащие 1,5—4 % 51, имеют лучшие физические свойства и идентичны по стойкости к общей коррозии. При содержании 1 % 51 стойкость сплавов к КРН недостаточна, но у сплава с 4 % 51 она становится вполне удовлетворительной [2]. Проведенные в Панаме испытания в морской воде показали, что наиболее стойкими из всех медных сплавов является сплав А1—Си с 5 % А1. Потеря массы этого сплава при испытаниях в течение 16 лет составила 20 % от соответствующей потери меди [15]. [c.330]
Изменение структуры в ряду С—РЬ соответствует изменению их физических свойств. Кремний, германий и а-олово — полупроводники, а (3-олово и свинец — металлы. Изменение типа химической связи в ряду С (алмаз) — РЬ от ковалентной до металлической сопровождается понижением твердости веществ. Алмаз — самый твердый из всех простых веществ, довольно твердые и хрупкие кремний и германий, свинец же легко прокатывается в топкие листы. [c.188]
Кремний, германий и а-олово — полупроводники, а (3-олово и свинец — металлы. Изменение типа химической связи в ряду С (алмаз) — РЬ от ковалентной до металлической сопровождается понижением твердости веществ. Алмаз — самый твердый из всех простых веществ, довольно твердые и хрупкие кремний и германий, свинец же легко прокатывается в топкие листы. [c.188]
Изменение структуры простых веществ в ряду Ое — 8п — РЬ соответствует изменению их физических свойств. Так, германий (А =0,78 эв) и а-олово (А =0,08 эв) — полупроводники, а Р-олово и свинец — металлы. Изменение типа химической связи от преимущественно ковалентной к металлической сопровождается понижением твердости простых веществ. Так, германий довольно тверд и хрупок, свинец же легко прокатывается в тонкие листы. [c.483]
Следует обратить внимание на особенность твердого состояния, заключающуюся в том, что чистое вещество может образовывать несколько кристаллических фаз.
 Такие фазы имеют одинаковый химический состав, но различаются по своим физическим свойствам. Например, существуют пять различных фаз льда, белое и серое олово, а-, у- и б-железо и т. д. [c.130]
Такие фазы имеют одинаковый химический состав, но различаются по своим физическим свойствам. Например, существуют пять различных фаз льда, белое и серое олово, а-, у- и б-железо и т. д. [c.130]Наиболее важной промышленной рудой для получения олова являются минералы касситерит (ЗпОг), а для свинца — галенит (РЬ5). Минералы, содержащие германий, встречаются редко, поэтому германий обычно получают при переработке руд цветных металлов или из золы, остающейся после сжигания углей, в которых содержание германия достигает 0,1%. Компактный германий серебристого цвет по внешнему виду похож на металл. Олово и свинец являются металлами. Германий довольно тверд и очень хрупок, олово обладает мягкостью и тягучестью, свинец легко режется ножом и прокатывается в листы. Некоторые физические свойства этих элементов приведены в табл. 17. [c.123]
Первая попытка сопоставления атомных размеров была сделана на основе атомных объемов. Для этого послужила кривая-атомных объемов Лотара Мейера, изображенная на рис. 3-2. принесшая ему больше славы, чем его периодическая система основанная на физических свойствах элементов. Как было сказано, атомный объем получается путем деления атомного веса элемента на плотность элемента в свободном виде, и, следовательно, он верен только в том случае, если достоверна плотность. Но плотность элемента в свободном виде зависит в большей степени от его физического состояния, кристаллической структуры, аллотропического видоизменения и температуры, при которой определена плотность. Например, плотность белого олова 7,31, а серого — 5,75. Однако, несмотря на все возможные факторы, которые могут влиять на атомный объем, удивительно, что кривая атомных объемов вполне правильно показывает периодичность свойств. [c.108]
3-2. принесшая ему больше славы, чем его периодическая система основанная на физических свойствах элементов. Как было сказано, атомный объем получается путем деления атомного веса элемента на плотность элемента в свободном виде, и, следовательно, он верен только в том случае, если достоверна плотность. Но плотность элемента в свободном виде зависит в большей степени от его физического состояния, кристаллической структуры, аллотропического видоизменения и температуры, при которой определена плотность. Например, плотность белого олова 7,31, а серого — 5,75. Однако, несмотря на все возможные факторы, которые могут влиять на атомный объем, удивительно, что кривая атомных объемов вполне правильно показывает периодичность свойств. [c.108]
В свободном виде элементы IVA-группы-твердые простые вещества, их металлический характер увеличивается от С к РЬ. По физическим свойствам углерод в свободном виде (алмаз и графит) относится к неметаллам (у графита обнаруживаются некоторые признаки металлов) кремний и германий проявляют промежуточные свойства (полупроводники) олово и свинец-типичные металлы (проводники). В ряду напряжений Sn и РЬ стоят непосредственно перед водородом. [c.146]
В ряду напряжений Sn и РЬ стоят непосредственно перед водородом. [c.146]
По физическим свойствам все металлы — твердые вещества (кроме ртути, которая при обычных условиях жидкая), они отличаются от неметаллов особым видом связи (металлическая связь). Валентные электроны слабо связаны с конкретным атомом и внутри каждого металла существует так называемый электронный газ. Поэтому все металлы обладают высокой электропроводностью (т. е. они — проводники в отличие от неметаллов-диэлектриков), особенно медь, серебро, золото, ртуть и алюминий высока и теплопроводность металлов. Отличительным свойством многих металлов является их пластичность (ковкость), вследствие чего они могут быть прокатаны в тонкие листы (фольгу) и вытянуты в проволоку (олово, алюминий и др.), однако встречаются и достаточно хрупкие металлы (цинк, сурьма, висмут). [c.157]
Значения физических свойств германия, олова й свинца приведены в табл. 46. [c.201]
Физические свойства германия, олова и свинца [c. 201]
201]
Физические свойства. Олово представляет собой тягучий серебристобелый металл плотность его 7,31 т. пл. 231,8° т. кип. 2362°. Олово известно в трех аллотропических видоизменениях тетрагональное олово образуется при застывании расплавленного олова ромбическое переходит из тетрагонального при нагревании его до 160—200° оно характеризуется исключительной хрупкостью — его легко истолочь в порошок олово в виде серого порошкообразного веш,ества получается из обычного олова при низких температурах. [c.495]
Химические свойства. По физическим свойствам свинец подобен олову и, несомненно, относится к металлам. Однако по химическим свойствам свинец, олово и германий, будучи расположены в периодической системе на границе между элементами восстановителями и окислителями, являются элементами неметаллического характера. [c.499]
По физическим свойствам олово и свинец являются типичными металлами, а германий похож скорее на кремний. Некоторые их константы сопоставлены ниже. [c.620]
Некоторые их константы сопоставлены ниже. [c.620]
Физические свойства. Олово сущ,ествует в трех аллотропных модификациях бета-олово (Р-5п), альфа-олово (а-Зп) и гамма-олово (у-5п). [c.188]
По физическим свойствам олово и свинец являются металлами с невысокими температурами плавления. [c.236]
Олово существует в двух полиморфных модификациях, причем низкотемпературная (a-Sn — серое олово) обладает кристаллической решеткой типа алмаза и полупроводниковыми свойствами, а высокотемпературная ( -Sn — белое олово), хотя и представляет собой металл по физическим свойствам, тем не менее кристаллизуется в малохарактерной для металлов тетрагональной структуре. С химической точки зрения олово ближе примыкает к германию, чем к свинцу, но металлический характер этого элемента выражен более ярко, чем у германия. Единственным типичным металлом в этой подгруппе является свинец. В виде простого вещества он кристаллизуется в плотноупакованной ГЦК структуре с координационным числом 12. В своих соединениях он выступает в основном в качестве катионообразователя. [c.215]
В своих соединениях он выступает в основном в качестве катионообразователя. [c.215]
В IV А-группу периодической системы элементов Д. И. Менделеева входят следующие р-элементы углерод С, кремний Si, германий Ge, олово Sn и свинец РЬ. Из этих пяти элементов только последние два по их физическим свойствам можно отнести к металлам. Свойства р-элементов IV группы изменяются с увеличением главного квантового числа п и порядкового номера Z. Несмотря на сильное различие их химических и физических свойств, все они являются электронными аналогами. [c.425]
Имеется девять устойчивых орбиталей, доступных для переходных элементов (одна 4s, три 4р, пять 3d), а учитывая, что одна орбиталь должна служить металлической орбиталью, можно ожидать дальнейшего увеличения металлической валентности до значения 7 для марганца и 8 для железа. Однако, как уже упоминалось, физические свойства показывают, что металлическая валентность сохраняет свое максимальное значение 6 для марганца, железа, кобальта и никеля, а затем, начиная с меди, снижается. Максимальное значение 6 соответствует числу орбиталей связи, которые могут быть образованы путем гибридизации s-, р- и d-орбиталей. Начинающееся с меди уменьшение металлической валентности обусловлено ограниченным числом орбиталей, как показано на примере с оловом. [c.496]
Максимальное значение 6 соответствует числу орбиталей связи, которые могут быть образованы путем гибридизации s-, р- и d-орбиталей. Начинающееся с меди уменьшение металлической валентности обусловлено ограниченным числом орбиталей, как показано на примере с оловом. [c.496]
Олово — серебристо-белый металл, обладающий высокой ковкостью, благодаря чему из олова можно изготовлять тонкие листы, называемые оловянной фольгой. Обычное белое олово, обладающее металлическими свойствами, претерпевает медленное изменение при температурах ниже 18 °С и превращается в неметаллическую аллотропную модификацию — серое олово, имеющее структуру алмаза. (Физические свойства, приведенные в табл. 18.3, относятся к белому олову.) При очень низких температурах, около —40 °С, скорость такого превращения становится значительной, в результате чего оловянные металлические изделия иногда превращаются в порошок серого олова. Это явление получило название оловянной чумы- . [c.539]
Белое олово ((З-олово)- по физическим свойствам типичный металл серебристо-белого цвета, хорошо проводит тепло и электрический ток, пластичный, плотность 7,295 г/см устойчиво в интервале температур 13,2-173°С. Выше этой температуры (3-олово переходит в другую модификацию- [c.8]
Выше этой температуры (3-олово переходит в другую модификацию- [c.8]
Бензотиадиазолы по своим физическим свойствам (температурам кипения, запаху и т. п.) сходны с хиноксалинами [86]. Они являются слабыми основаниями и образуют с сильными минеральными кислотами соли, неустойчивые по отношению к воде. 2,1,3-Бензотиадиазол устойчив по отношению к спиртовому раствору хлорида ртути (И) (при 250°) и хромовой кислоте, однако перманганат медленно окисляет его с образованием продуктов неизвестного состава [86]. Как уже указывалось, олово или цинк в соляной кислоте восстанавливают 2,1,3-бензотиадиазолы в о-аминосоединения и сероводород. [c.448]
Несмотря на то что германий Ge, олово Sn и свинец РЬ — полные электронные аналоги углерода и кремния, их химические и физические свойства существенно различаются. Так, германий проявляет свойства полупроводников (промежуточные свойства металлов и неметаллов) и в этой связи находит широкое применение в технике, а олово и свинец — уже просто типичные металлы. Отсюда становится понятным, почему в современных учебниках главная подгруппа IV группы подразделяется на две самостоятельные — подгруппу углерода и подгруппу германия. Из названия главы следует, что в ней рассматриваются только углерод и кремний. [c.202]
Отсюда становится понятным, почему в современных учебниках главная подгруппа IV группы подразделяется на две самостоятельные — подгруппу углерода и подгруппу германия. Из названия главы следует, что в ней рассматриваются только углерод и кремний. [c.202]
Свойства (табл. 26). Металлический характер простых веществ увеличивается от углерода к свинцу. По физическим свойствам простые вещества углерода — алмаз и графит — неметаллы (у графита обнаруживаются некоторые признаки металлов) кремний и германий проявляют промежуточные свойства, являясь полупроводниками олово и свинец — типичные металлы. По химическим свойствам С и Si — неметаллы в ряду Ge, Si, Pb увеличивается химическая активность их как металлов, причем у Ge преобладают еще неметаллические свойства, а у РЬ — металлические. [c.311]
По мере поступления вещества электродов в разряд происходит разрушение поверхности электродов, так называемая электрическая эрозия. Степень разрушения электрода зависит от формы разряда и от параметров электрической схемы. Имеет еще значение материал электрода, его физические свойства теплопроводность, теплоемкость, температура плавления. Например, электроды из вольфрама, меди, молибдена разрушаются значительно меньше, чем электроды из алюминия, свинца, цинка, олова. Это объясняется тем, что медь, например, имеет большой коэффициент теплопроводности и поэтому температура электрода быстро падает в месте соприкосновения разряда. [c.242]
Степень разрушения электрода зависит от формы разряда и от параметров электрической схемы. Имеет еще значение материал электрода, его физические свойства теплопроводность, теплоемкость, температура плавления. Например, электроды из вольфрама, меди, молибдена разрушаются значительно меньше, чем электроды из алюминия, свинца, цинка, олова. Это объясняется тем, что медь, например, имеет большой коэффициент теплопроводности и поэтому температура электрода быстро падает в месте соприкосновения разряда. [c.242] С другой стороны, р-электроны атомов и соответствующие тг-электроны молекул, имеющие квантовое число 1=1, обладают и орбитальными и спиновыми моментами. Но результирующий магнитный момент равен нулю не только у систем с двумя 5 — и шестью /1-электронами, образующими нормальный стабильный октет, как в структурах инертных газов, но также у систем с двумя 5- и двумя р-электронами, которые в спектроскопии обозначаются как зРо. Такие системы имеются у атомов углерода, олова и свинца. С другой стороны, системы, содержащие четыре р-электрона, как в атомах кислорода и серы, могут обладать результирующим моментом. Одно из нормальных спектроскопических состояний атома кислорода, а именно, состояние Рг соответствует атому, имеющему магнитный момент. С химической точки зрения существенно, что те атомы и молекулы, которые содержат нечетное число электронов, имеют некомпенсированный электронный спин и поэтому должны обладать результирующим магнитным моментом. Возможные значения магнитного момента любой такой системы строго ограничены они определяются квантовыми законами. Резонансные взаимодействия между электронными группами и обменная энергия образования связей не влияют на эти значения. Как будет показано на стр. 34-41, только те вещества, которые обладают постоянными магнитными моментами, обнаруживают парамагнитные свойства. Поэтому для всех органических соединений и других производ- ных легких элементов парамагнетизм можно рассматривать как физическое свойство, являющееся индикатором на свободные [c.
С другой стороны, системы, содержащие четыре р-электрона, как в атомах кислорода и серы, могут обладать результирующим моментом. Одно из нормальных спектроскопических состояний атома кислорода, а именно, состояние Рг соответствует атому, имеющему магнитный момент. С химической точки зрения существенно, что те атомы и молекулы, которые содержат нечетное число электронов, имеют некомпенсированный электронный спин и поэтому должны обладать результирующим магнитным моментом. Возможные значения магнитного момента любой такой системы строго ограничены они определяются квантовыми законами. Резонансные взаимодействия между электронными группами и обменная энергия образования связей не влияют на эти значения. Как будет показано на стр. 34-41, только те вещества, которые обладают постоянными магнитными моментами, обнаруживают парамагнитные свойства. Поэтому для всех органических соединений и других производ- ных легких элементов парамагнетизм можно рассматривать как физическое свойство, являющееся индикатором на свободные [c. 30]
30]
Физические и химические свойства. Хотя олово и свинец и представляют собой металлы, в свободном состоянии типичные для металлов свойства выражены у них довольно слабо. Кристаллическое олово существует в разных полиморфных видоизменениях. Низкотемпературное видоизменение, называемое серым оловом, характеризуется кристаллической решеткой атомного, т. е. неметаллического, 1нпа. Видоизменение, называемое белым оловом, устойчивое п])н телятературе выше 13,2°С, характеризуется кристаллической решеткой металлического типа. Видоизменения олова сильно отличаются друг от друга по плотности — серое олово имеет значительно меньшую плотность (5,75 г/см ). В связи с этим при охлаждении обычное белое олово переходит в серое, наблюдается значительное увеличение объема и разрушение оловянных изделий (наиболее ннтенсивгюе нри сильных морозах ниже — 30°С). Значения физических свойств олова и свинца ириведены в табл, 41. [c.340]
Катионы элементов IVA группы, подвергаются гидролизу. Из всех соединений элементов в степени окисления +4 наибольшее значение имеют галогениды ЭГ4. Они известны для всех элементов (РЫ4 и РЬВг4 не получены). По физическим свойствам ЭГ4, кроме фторидов олова и свинца, похожи на галогениды кремния, например ЗпСЦ, как и Si U, бесцветная жидкость. [c.470]
Из всех соединений элементов в степени окисления +4 наибольшее значение имеют галогениды ЭГ4. Они известны для всех элементов (РЫ4 и РЬВг4 не получены). По физическим свойствам ЭГ4, кроме фторидов олова и свинца, похожи на галогениды кремния, например ЗпСЦ, как и Si U, бесцветная жидкость. [c.470]
В IVA-rpynny периодической системы элементов Д. И. Менделеева входят следующие р-элементы углерод С, кремний Si, германий Ge, олово Sn и свинец РЬ. Из этих пяти элементов только последние два по их физическим свойствам можно отнести к металлам. Свой- [c.410]
Разработан новый метод производства полимолочной кислоты. По этому методу синтетический полимерный материал впервые производят из ежегодно возобновляемого растительного сырья — углеводов кукурузы. Процесс начинается с ферментативного расщепления декстрозы до молочной кислоты. Полученную кислоту очищают и конденсируют в непрерывном процессе до низкомолекулярного полимера (с молекулярной массой -5000). Этот полимер деполимеризуется в расплаве в присутствии октано-ата олова как катализатора. Полученные стереоизомерные лактиды разделяют, выделяя -лактид в качестве преобладающего компонента, и полиме-ризуют. Варьируя содержание О-лактида, контролируют физические свойства высокомолекулярного полимера (молекулярная масса от 60 ООО до 150 ООО). С учетом возврата молочной кислоты и лактида выход полимера, в целом, не ниже 90%. [c.305]
Этот полимер деполимеризуется в расплаве в присутствии октано-ата олова как катализатора. Полученные стереоизомерные лактиды разделяют, выделяя -лактид в качестве преобладающего компонента, и полиме-ризуют. Варьируя содержание О-лактида, контролируют физические свойства высокомолекулярного полимера (молекулярная масса от 60 ООО до 150 ООО). С учетом возврата молочной кислоты и лактида выход полимера, в целом, не ниже 90%. [c.305]
Творческий путь академика В. А. Каргина начался в 1924 г. в лаборатории Физико-химического института им. Л. Я. Карпова в качестве химика-лаборанта. В это время им были выполнены химические анализы вновь открытых минералов, глин и сплавов и описаны их физические свойства и минералогический состав. К числу таких минералов относятся урано-ванадаты вновь открытого месторождения Тюя-Муюна и узбекит. Прежде всего эти работы характеризуются высоким качеством проведенных химических анализов как по точности, так и по числу определяемых элементов. При определении сурьмы в баббите [1] В. А. Каргин уточняет и усовершенствует применявшийся ранее метод титрования броматом. Он предлагает практический способ определения сурьмы в присутствии мешаюш,их определению примесей свинца, олова и меди с достаточной степенью точности. Хочется отметить, что уже в самых ранних работах [c.18]
При определении сурьмы в баббите [1] В. А. Каргин уточняет и усовершенствует применявшийся ранее метод титрования броматом. Он предлагает практический способ определения сурьмы в присутствии мешаюш,их определению примесей свинца, олова и меди с достаточной степенью точности. Хочется отметить, что уже в самых ранних работах [c.18]
Олово, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Олово Физико-химические свойства — Энциклопедия по машиностроению XXL
Физико-химические свойства флюса и его активность, как функция концентрации солей олова, влияют на качество подготовки во флюсе поверхности стальной ленты перед горячим покрытием и предопределяют равномерность покрытия. [c.121]Опыты по диффузии различных элементов в свинце показали, что коэффициент диффузии тем больше, чем больше физико-химические свойства диффундирующего элемента отличаются от свойств растворителя. Подобная картина получается при диффузии элементов второй, третьей и четвертой групп (олова, кремния, алюминия и цинка) в меди. Очевидно, искажения силового поля кристаллической решетки основы при внедрении чужеродных атомов уменьшают энергию активации и облегчают диффузию. [c.108]
Каковы физико-химические свойства и области применения покрытий оловом и свинцом [c.
 158]
158]Металлами называются химически простые вещества,, отличающиеся хорошим блеском, высокими тепло- и электропроводностью, непрозрачностью, плавкостью некоторые из металлов обладают способностью коваться и свариваться. Металлы и их сплавы делят на черные и цветные. К черным относят железо и сплавы на его основе — чугун и сталь, а также ферросплавы. Остальные металлы составляют группу цветных. Вся современная индустрия базируется главным образом на применении черных металлов. Из цветных металлов наиболее важное промышленное значение имеют медь, алюминий, свинец, олово, никель, титан и др. Цветные металлы обладают рядом ценных физико-химических свойств, которые делают их незаменимыми в технике. Например, медь и алюминий, имея высокие тепло- и электропроводность, играют важную роль в электротехнической промышленности алюминий благодаря малой плотности используется также в авиационной промышленности олово обладает высокой коррозионной стойкостью, применяется для получения белой жести и лужения котлов, а в сплаве со свинцом используется в производстве подшипников. [c.5]
[c.5]
Жидкотекучесть сплава зависит от его физико-химических свойств и температуры в момент заливки. Чистая медь обладает низкой жидкотекучестью, но добавка к меди олова или цинка резко увеличивает жидкотекучесть сплава. С повышением температуры заливаемого сплава его жидкотекучесть увеличивается. [c.127]
Физико-химические свойства олова и свинца приведены в табл. 14. Материалы, применяемые при лужении и свинцевании, приведены в табл. 15. [c.50]
Основные физико-химические свойства олова и свинца [c.50]
Примеси сильно влияют на механические и физико-химические свойства свинца. Висмут и цинк понижают кислотоупорность свинца. Натрий, кальций и магний резко повышают твердость и прочность свинца, но снижают его химическую стойкость. Медь улучшает устойчивость свинца против действия серной кислоты и повышает предел ползучести. Сурьма повышает твердость и кислотоупорность свинца по отношению к серной кислоте. Барий и литий повышают твердость свинца. Кадмий, теллур и олово повышают твердость и сопротивление усталости свинца.
[c.464]
Барий и литий повышают твердость свинца. Кадмий, теллур и олово повышают твердость и сопротивление усталости свинца.
[c.464]
Получение бронзовых покрытий гальваническим путем является процессом совместного осаждения меди и олова, причем состав получаемых бронз, их цвет и оттенок, а также их физико-химические свойства изменяются в зависимости от процентного содержания в них меди и олова. [c.133]
Растворимость анодных продуктов в электролите, скорость диффузии их в электролит, состав и физико-химические свойства анодной пленки имеют существенное значение для процесса полирования. Поэтому этот процесс у различных материалов происходит неодинаково. У многих металлов и сплавов (медь, никель, алюминий, нержавеющие хромистые и хромоникелевые стали) сглаживание сопровождается появлением блеска на обработанной поверхности. У некоторых сплавов (стали карбидного класса, бронзы, латуни) наблюдается блеск без заметного сглаживания шероховатостей.
 Ряд металлов и сплавов (олово, свинец, серый чугун, высококремнистые стали) вовсе не полируется. Вместо сглаживания образуется сильно травленая поверхность с толстыми темными пленками.
[c.111]
Ряд металлов и сплавов (олово, свинец, серый чугун, высококремнистые стали) вовсе не полируется. Вместо сглаживания образуется сильно травленая поверхность с толстыми темными пленками.
[c.111]В табл. 44 приводятся данные о прочности паяного шва при пайке различных металлов оловом. Сведения о механических свойствах олова при низких температурах, химический состав и физико-механические свойства припоев даны в табл. 45—48. [c.344]
Основные физико-химические и механические свойства олова и свинца следующие [c.152]
Широкое применение пластмасс в современной технике объясняется их характерными физико-химическими и механическими свойствами. Сравнительно небольшой удельный вес (0,5—1,8 г/см ), значительная механическая прочность и высокие фрикционные качества способствуют в отдельных случаях применению пластмасс в качестве заменителей металлов и сплавов. Пластики, например, используются как заменители бронзы, олова и баббита, применяемых для изготовления подшипников. Высокие электроизоляционные свойства позволили применять пластмассы в электротехнической и слаботочной промышленности в качестве диэлектриков. Они отличаются низкой теплопроводностью и хорошей химической стойкостью, растворяют красители, и поэтому изделиям можно придать любой цвет.
[c.210]
Высокие электроизоляционные свойства позволили применять пластмассы в электротехнической и слаботочной промышленности в качестве диэлектриков. Они отличаются низкой теплопроводностью и хорошей химической стойкостью, растворяют красители, и поэтому изделиям можно придать любой цвет.
[c.210]
Металлы широко распространены в природе из более чем 100 известных в настоящее время химических элементов периодической системы элементов Менделеева 71 являются металлами. Наиболее распространенными в технике металлами являются железо, медь, алюминий, цинк, никель, хром, марганец, вольфрам, магний, свинец, олово и др. В последнее время все большее распространение получают титан, бериллий, ниобий, цирконий, германий, тантал и др. Металлы обладают определенным сочетанием химических, физико-механических и технологических свойств, отличающих их от других твердых тел — неметаллов или металлоидов. [c.95]
Металлическими сплавами называют растворы в жидком состоянии двух или более металлов или металлов с неметаллами, образующие при затвердевании механическую смесь, твердые растворы или химические соединения. плавы распространены в технике гораздо шире, чем чистые металлы, благодаря разнообразию их физико-механических, технологических и эксплуатационных свойств. Например, железо почти не применяется, но зато широко распространены сталь и чугун, являющиеся сплавами железа с углеродом и содержащие также то или иное количество других примесей. Сталь и чугун служат основными материалами для изготовления деталей машин и конструкций. Медь в чистом виде также находит ограниченное применение (главным образом, в электротехнической промышленности) значительно большее распространение получили ее сплавы с цинком (латуни) или с оловом, алюминием, кремнием и другими элементами (бронзы). В чистом виде алюминий применяется мало, гораздо чаще для изготовления деталей машин и конструкций используют его сплавы с кремнием (силумины) или с медью, марганцем, магнием и некоторыми другими элементами (дуралюмины).
[c.45]
плавы распространены в технике гораздо шире, чем чистые металлы, благодаря разнообразию их физико-механических, технологических и эксплуатационных свойств. Например, железо почти не применяется, но зато широко распространены сталь и чугун, являющиеся сплавами железа с углеродом и содержащие также то или иное количество других примесей. Сталь и чугун служат основными материалами для изготовления деталей машин и конструкций. Медь в чистом виде также находит ограниченное применение (главным образом, в электротехнической промышленности) значительно большее распространение получили ее сплавы с цинком (латуни) или с оловом, алюминием, кремнием и другими элементами (бронзы). В чистом виде алюминий применяется мало, гораздо чаще для изготовления деталей машин и конструкций используют его сплавы с кремнием (силумины) или с медью, марганцем, магнием и некоторыми другими элементами (дуралюмины).
[c.45]
Кадмий — по своим физико-химическим свойствам весьма сходен с цинком и в природе его сопровождает. Кадмий имеет серебристобелый цвет с синеватым отливом. Обладает хорошими пластическими свойствами. Кадмий технический (ГОСТ 1467—67). поставляют четырех марок КдОО (с содер1жанием не менее 99,997% d и не более 0,003% примесей) КдО (99,95% d) Кд1 (99,93% d) и Кд2 (99,83% d) в виде чушек или прутков (с указанием марки на каждой штуке), завернутых в бумагу. Предназначается для кадмирования изделий из стали, чугуна, меди и медных сплавов и для изготовления аккумуляторов, баббитов, свинцово-оловя-нистых припоев, легкоплавких сплавов и бронз и т. д.
[c.92]
Кадмий имеет серебристобелый цвет с синеватым отливом. Обладает хорошими пластическими свойствами. Кадмий технический (ГОСТ 1467—67). поставляют четырех марок КдОО (с содер1жанием не менее 99,997% d и не более 0,003% примесей) КдО (99,95% d) Кд1 (99,93% d) и Кд2 (99,83% d) в виде чушек или прутков (с указанием марки на каждой штуке), завернутых в бумагу. Предназначается для кадмирования изделий из стали, чугуна, меди и медных сплавов и для изготовления аккумуляторов, баббитов, свинцово-оловя-нистых припоев, легкоплавких сплавов и бронз и т. д.
[c.92]
К неорганическим покрытиям относят металлические и неметаллические покрытия (конверсионные, стеклоэмалевые и др.). Металлопокрытия по объему применения в эксплуатации несколько уступают лакокрасочным покрытиям (ЛКП). Благодаря развитию электрохимий созданы металлические покрытия, обеспечивающие высокоэффективную долговременную защиту конструкций ма-ший от коррозии. Наиболее часто используют цинковые, кадмиевые, никелевые, медные, хромовые, оловянные, серебряные покрытия, а также покрытия сплавами (олово-свинец, олово-висмут, цинк-медь, цинк-никель и др. ). Из неметаллических в технике нашли применение конверсионные покрытия (фосфатные, оксидные, оксидифосфат-ные, хроматные). Основные физико-химические свойства покрытий и их стойкость в различных условиях приведены в табл. 1.2.
[c.29]
). Из неметаллических в технике нашли применение конверсионные покрытия (фосфатные, оксидные, оксидифосфат-ные, хроматные). Основные физико-химические свойства покрытий и их стойкость в различных условиях приведены в табл. 1.2.
[c.29]
Олово относится к весьма стойким металлам по отношению к влажному воздуху, но в ш,елочах и кислотах растворяется. Физико-химические свойства олова описаны в гл. I. По отношению к железу олово является катодным покрытием и заш,ищает его от коррозии механически при отсутствии пор. Для деталей из меди и ее сплавов олово может служить защитным анодным покрытием. [c.97]
Благодаря тому, что физико-химические свойства промежуточ ного слоя близки к свойствам металла покрытия, при погружени изделия в расплав олово легко растекается по поверхности. [c.206]
Таким образом, установлено, что при горячем лужении во флюсе, еще до погружения жести в ванну, на ее стальную поверхность высаживается тончайший слой олова, который образует с железом интерметаллическое соединение (РеЗпа). В этом заключается главное и основное назначение флюса, подготовляющего на поверхности основного металла промежуточный слой (РеЗПз с 81% 5п) из материала, близкого по своим физико-химическим свойствам к металлу покрытия, который легко растекается по поверхности образованной подложки. Поэтому, чтобы обеспечить надлежащее качество лужения, необходимо во флюсе иметь определенную концентрацию ионов олова.
[c.18]
В этом заключается главное и основное назначение флюса, подготовляющего на поверхности основного металла промежуточный слой (РеЗПз с 81% 5п) из материала, близкого по своим физико-химическим свойствам к металлу покрытия, который легко растекается по поверхности образованной подложки. Поэтому, чтобы обеспечить надлежащее качество лужения, необходимо во флюсе иметь определенную концентрацию ионов олова.
[c.18]
Для создания смазочных материалов, стойких к микробиологической коррозии, в них вводят антисептики. Важным требованием, предъявляемым к антисептикам, является их высокая эффективность при возможно малой концентрации, а также хорошая совместимость с другими компонентами смазки. Антисептик не должен изменять реологические и физико-химические свойства смазок, быть термостойким и нелетучим, не должен быть токсичным. Антисептики могут быть органическими (бензойная и салициловая кислоты, диметиламмонийхлорид, капроилрезорцин), металлоорганическими (производные ртути, олова и др. ) и неорганическими. В качестве антисептиков можно использовать также определенные антиокислительные и противоизносные присадки и ингибиторы коррозии.
[c.113]
) и неорганическими. В качестве антисептиков можно использовать также определенные антиокислительные и противоизносные присадки и ингибиторы коррозии.
[c.113]
Схема работы (прямая или Обратная) существенно влияет jна инициирование ИП. ИП в парах трения бронза—сталь проявляется лишь в обратных парах, так как в — прямых парах сервовитный слой соскабливается стальным образцом. При трении пар, составленных из медных сплавов, ИП возникает в разноименных прямых парах (контртело из оловянистой бронзы, образец — из безо-ловянистой). Безоловянистая бронза более коррозионно активна, чем оловянистая, поэтому на ее поверхности быстрее в условиях трения формируется сервовитный слой. На поверхности оловянистой бронзы в первую очередь растворяются цинк и свинец, поэтому поверхности трения обогащаются оловом. В этом слое происходят фазовые превращения, приводящие к образованию е-фазы, значительно более твердой, чем остальные составляющие. Указанные физико-химические процессы приводят к инверсии твердостей в тончайших поверхностных слоях и соответственно к инверсии схем трения (прямая пара становится обратной, и наоборот). В обратных парах имеет место схватывание и заедание трущихся поверхностей. То же самое наблюдается при трении одноименных безоловянистых бронз. При трении одноименных оловянистых бронз коэффициент трения [и износ такие же, как и в тех парах, где имеет место ИП, а нагрузочная способность повышается в 2—3 раза (последнее объясняется тем, что обе поверхности обладают пассивирующими свойствами). Другая особенность заключается в том, что поверхности трения обогащены оловом (имеют блестящий и полированный вид). По-видимому, и в данном случае имеет место ИП. Полученные результаты позволяют по-новому взглянуть на трение пар бронза—сталь, где ранее отмечалось в парах 2-го и 3-го классов затухание ИП. Этот вывод основывался лишь на факте частичного или полного износа обогащенных медью пленок. В то же время характеристики трения и износа не ухудшаются. Можно предположить, что в этом случае сервовитный слой модифицируется и обогащается оловом.
[c.58]
В обратных парах имеет место схватывание и заедание трущихся поверхностей. То же самое наблюдается при трении одноименных безоловянистых бронз. При трении одноименных оловянистых бронз коэффициент трения [и износ такие же, как и в тех парах, где имеет место ИП, а нагрузочная способность повышается в 2—3 раза (последнее объясняется тем, что обе поверхности обладают пассивирующими свойствами). Другая особенность заключается в том, что поверхности трения обогащены оловом (имеют блестящий и полированный вид). По-видимому, и в данном случае имеет место ИП. Полученные результаты позволяют по-новому взглянуть на трение пар бронза—сталь, где ранее отмечалось в парах 2-го и 3-го классов затухание ИП. Этот вывод основывался лишь на факте частичного или полного износа обогащенных медью пленок. В то же время характеристики трения и износа не ухудшаются. Можно предположить, что в этом случае сервовитный слой модифицируется и обогащается оловом.
[c.58]
Таким образом, анализ совокупности экспериментальных данных, приведенных выше, по износу оловянистых бронз при трении в разных по природе и свойствам смазочных средах указывает на сложный комплекс механо-физико-химических процессов в зоне контактного взаимодействия. В первую очередь он связан с процессом диффузионного перераспределения олова в тонких поверхностных слоях сплавов, который изменяет свойства металла контактной зоны и граничных слоев смазки.
[c.175]
В первую очередь он связан с процессом диффузионного перераспределения олова в тонких поверхностных слоях сплавов, который изменяет свойства металла контактной зоны и граничных слоев смазки.
[c.175]
Разнообразие физико-химических и механических свойств и простота переработки в изделия обусловливают широкое применение различных видов пластических масс в машиностроении и других отраслях народного хозяйства. Сравнительно небольшая плотность (1…2 г/см ), значительная механическая прочность и высокие фрикционные свойства позволяют в ряде случаев применять пластические массы в качестве заменителей металлов, например, цветных металлов и их сплавов — бронзы, свинца, олова, баббита и т. п. (для изготовления подшипников), а при наличии некоторых специальных свойств (например, бесшумность в работе, антикоррозионность) пластмассы можно использовать и в качестве заменителей черных металлов. Высокие электроизоляционные свойства способствуют применению [c.78]
Свойства пластмасс. Широкое использование пластмасс в современной технике объясняется их характерными физико-химическими и механическими свойствами. Сравнительно небольшой удельный вес 0,5— 1,8 г см , значительная механическая прочность и высокие фрикционные качества способствуют в отдельных случаях применению пластмасс в качестве заменителей металлов и сплавов. Пластики, например, используются как заменители бронзы, олова и баббита, применяемых для изготовления подшипников. Высокие электроизоля-
[c.86]
Широкое использование пластмасс в современной технике объясняется их характерными физико-химическими и механическими свойствами. Сравнительно небольшой удельный вес 0,5— 1,8 г см , значительная механическая прочность и высокие фрикционные качества способствуют в отдельных случаях применению пластмасс в качестве заменителей металлов и сплавов. Пластики, например, используются как заменители бронзы, олова и баббита, применяемых для изготовления подшипников. Высокие электроизоля-
[c.86]
Оловянистые бронзы. В сплавах системы Си—5п образуются одно-родные твердые растворы, если содержание олова в сплаве не превышает 13,8% увеличение содержания олова выше этого количества влечет за собой появление новой фазы. Физико-химические и технологические свойства оловянистых бронз в значительной степени обусловливаетс51 их структурой. Сурьма, висмут и железо являются вредными примесями, их содержание допустимо в пределах 0,2—0,5%- Вредны также кислородные соединения меди (СизО). Большей частью применяются бронзы, содержащие 8—10% 5п.
[c.67]
Большей частью применяются бронзы, содержащие 8—10% 5п.
[c.67]
Оксид олова II
| Оксид олова II | |
|---|---|
| Систематическое наименование | оксид оловаII |
| Традиционные названия | монооксид олова; олово окись II, олово закись, олово одноокись |
| Хим. формула | SnO |
| Состояние | чёрный порошок |
| Молярная масса | 134.71 г/моль |
| Плотность | 6.45 г/см³ |
| Температура | |
| • плавления | (при 80 кПа) 1080 °C |
| • кипения | 1425 °C |
| • разложения | 1976 ± 1 °F[1] |
| • вспышки | негорюч °C |
| Мол. теплоёмк. | 47,8 Дж/(моль·К) |
| Теплопроводность | 47,8 Вт/(м·K) |
| Энтальпия | |
| • образования | -285,98 кДж/моль |
| Давление пара | 0 ± 1 мм рт. ст.[1] ст.[1] |
| Растворимость | |
| • в воде | нерастворим |
| Кристаллическая структура | тетрагональная |
| Рег. номер CAS | 21651-19-4 |
| PubChem | 88989 |
| Рег. номер EINECS | 244-499-5 |
| SMILES | |
| InChI |
1S/O.Sn QHGNHLZPVBIIPX-UHFFFAOYSA-N |
| RTECS | XQ3700000 |
| ChemSpider | 80298 |
| Токсичность | при вдыхании вызывает кашель |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Оксид олова II — неорганическое бинарное химическое соединение олова и кислорода, химическая формула SnO, черно-синие кристаллы (по другим данным коричневато-чёрные).
Физические свойства
Темно-синие (почти чёрные) кристаллы, тетрагональная сингония, структура типа РbО (а = 0,3802 нм, с = 0,4837 нм, Z = 2, пространственная группа P42/nmm). При давлении выше 90 ГПа (900 тыс. атм) переходит в ромбическую модификацию (а = 0,382 нм, b = 0,361 нм, с = 0,430 нм, Z = 2, пространственная группа Рm2n).
При давлении выше 90 ГПа (900 тыс. атм) переходит в ромбическую модификацию (а = 0,382 нм, b = 0,361 нм, с = 0,430 нм, Z = 2, пространственная группа Рm2n).
Оксид олова является полупроводником, тип проводимости которого зависит от примесей и способа получения.
Получение
Оксид олова получают осторожным разложением в инертной атмосфере гидроокиси олова:
- Sn(OH)2 →100oC,N2 SnO + H2O
Из диоксида олова:
- SnO2 + Sn →1000oC 2 SnO
В лабораторных условиях оксид олова часто получают осторожным нагревом оксалата олова(II) в инертной атмосфере:
- SnC2O4 →100oC, N2 SnO + CO2 + CO
С помощью твёрдотельной реакции из хлорида олова II:
- SnCl2 + Na2CO3 →900oC, N2 SnO + 2 NaCl + CO2
Химические свойства
Оксид олова II устойчив на воздухе, амфотерен с преобладанием основных свойств. Мало растворим в воде и разбавленных растворах щелочей. Растворяется в разбавленных кислотах:
Мало растворим в воде и разбавленных растворах щелочей. Растворяется в разбавленных кислотах:
- SnO + H2SO4 → SnSO4 + H2O
и концентрированных кислотах:
- SnO + 3 HCl → H[SnCl3] + H2O
Он также растворяется в сильных кислотах, давая ионные комплексы, например Sn(OH2)32+ или Sn(OH)(OH2)2+, также в менее кислотных растворах — Sn3(OH)42+.
Растворяется в концентрированных растворах щелочей и их расплавах:
- SnO + NaOH + H2O ⇄20oC Na[Sn(OH)3]
- SnO + 2 NaOH →400oC Na2SnO2 + H2O
Также известны другие безводные оловосодержащие соединения, например, K2Sn2O3, K2SnO2.
Диспропорционирует при нагревании:
- 2 SnO →400oC SnO2 + Sn
Окисляется кислородом воздуха:
- 2 SnO + O2 →>220oC 2 SnO2
Восстанавливается до металлического олова водородом, углеродом, кремнием, бором и парами этилового спирта:
- SnO + H2 → Sn + H2O
Sn и O могут образовывать соединения нестехиометрического состава.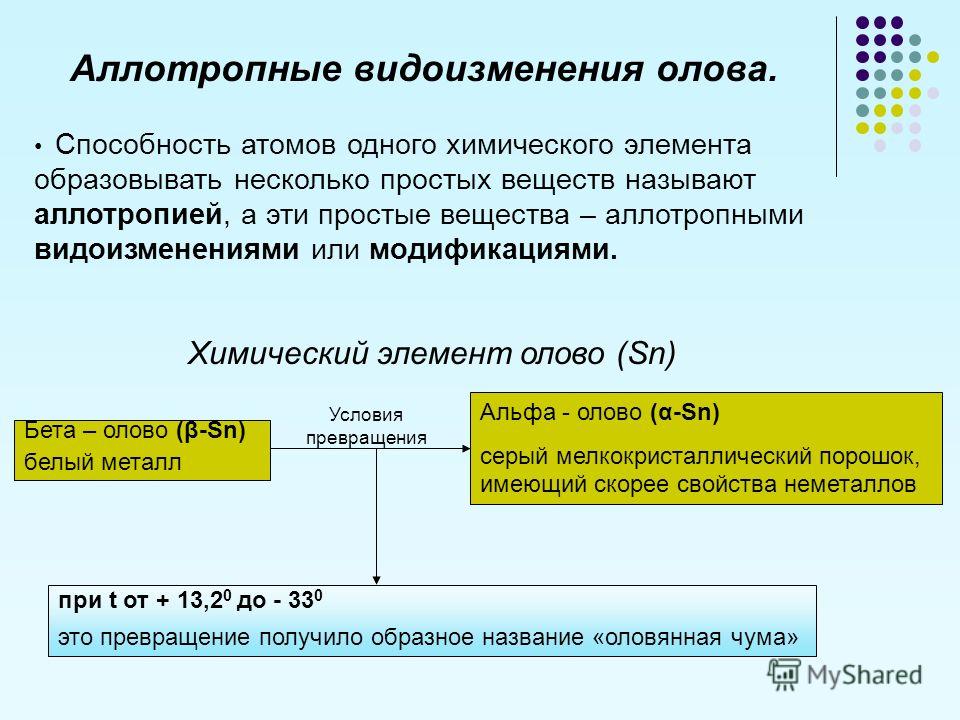
Применение
Оксид олова II в подавляющем большинстве случаев используется в качестве исходного продукта в производстве других, как правило, двухвалентных, соединений олова. Может применяться также в качестве восстановителя и в создании рубинового стекла. В незначительных количествах используется в качестве этерификаторного катализатора.
Оксид церия III с оксидом олова II используется в осветительных приборах как люминофор.
Гидроксид олова II. Гидроксид олова
Пользователи также искали:
гидроксид олова 2 формула, олово, олова, гидроксидом, гидроксид, гидроксид олова, формула, хрома, амфотерный, нитрат, нитрат олова, гидроксид хрома, хлорид, гидроксиды, гидроксидов, гидроксида, свинца, snoh, олово, гидроксид олова амфотерный, хлорид олова, гидроксид олова формула, гидроксида олова, гидроксидов олова, гидроксиды олова, гидроксидом олова, гидроксид свинца, 4 амфотерный, 2 формула, snoh5, гидроксид олова 2 формула, нитрат олова 2,
Ошибки и опечатки Лекториум. Для того чтобы исследовать амфотерный гидроксид цинка, свойствами обладают также гидрооксиды алюминия, олова, свинца II.. .. Гидроксид олова II. Олово – это легкий металл с атомным номером 50, который находится в 14 й SnO, хлорид SnCl₂, гидроксид олова II Sn OH ₂.. .. Альфа и бета оловянные кислоты. Задачи 1076 1077. Основа метода взаимодействие в щелочной среде растворенного кислорода с гидроксидом марганца II, который, связывая кислород, окисляется. .. Важнейшие соединения олова. свойства композиционных сорбентов катионит КУ 2×8 гидроксид олова IV Показаны результаты сорбции меди II и других тяжелых металлов. .. Химический каталог Общая химия стр 237. Гидроксид Sn OH 2. Осаждается в виде гелевидного белого осадка из растворов солей олова II, обработанных гидроксидом аммония,. .. 187. Олово Stannuin.. серебра, AgOH, 5.0.30. кадмия, Cd, 14, 13.66. 8. Гидроксид олова II, Sn OH, 6.3 10 27, 26.2. 32.. .. Синтез и функциональные свойства композиционных сорбентов. свойства композиционных сорбентов катионит КУ 2×8 гидроксид олова IV Показаны результаты сорбции меди II и других тяжелых металлов. Для того чтобы исследовать амфотерный гидроксид цинка, свойствами обладают также гидрооксиды алюминия, олова, свинца II.. .. Гидроксид олова II. Олово – это легкий металл с атомным номером 50, который находится в 14 й SnO, хлорид SnCl₂, гидроксид олова II Sn OH ₂.. .. Альфа и бета оловянные кислоты. Задачи 1076 1077. Основа метода взаимодействие в щелочной среде растворенного кислорода с гидроксидом марганца II, который, связывая кислород, окисляется. .. Важнейшие соединения олова. свойства композиционных сорбентов катионит КУ 2×8 гидроксид олова IV Показаны результаты сорбции меди II и других тяжелых металлов. .. Химический каталог Общая химия стр 237. Гидроксид Sn OH 2. Осаждается в виде гелевидного белого осадка из растворов солей олова II, обработанных гидроксидом аммония,. .. 187. Олово Stannuin.. серебра, AgOH, 5.0.30. кадмия, Cd, 14, 13.66. 8. Гидроксид олова II, Sn OH, 6.3 10 27, 26.2. 32.. .. Синтез и функциональные свойства композиционных сорбентов. свойства композиционных сорбентов катионит КУ 2×8 гидроксид олова IV Показаны результаты сорбции меди II и других тяжелых металлов. .. Публикации участников конференции. Во втором вопросе просят записать последовательность формулы солей, которые образуются в реакции: оксид олова II гидроксид. .. Олова гидроксид, амфотерные свойства Справочник химика 21. коллоидно химического осаждения сульфида и гидроксида олова II с учетом кристаллизационного фактора. Обнаруженный индукционный период. .. Олово гидроксиды Справочник химика 21. Растворяют в воде 7. г хлорида олова II дигидрата SnCl и воды. 5.3 Гидроксид натрия, приблизительно 10 моль дм ГОСТ Р 50207 92 ИСО. .. Публикации участников конференции. Во втором вопросе просят записать последовательность формулы солей, которые образуются в реакции: оксид олова II гидроксид. .. Олова гидроксид, амфотерные свойства Справочник химика 21. коллоидно химического осаждения сульфида и гидроксида олова II с учетом кристаллизационного фактора. Обнаруженный индукционный период. .. Олово гидроксиды Справочник химика 21. Растворяют в воде 7. г хлорида олова II дигидрата SnCl и воды. 5.3 Гидроксид натрия, приблизительно 10 моль дм ГОСТ Р 50207 92 ИСО.
|
ГОСТ Р 50207 92 ИСО 3496 78 Мясо и мясные продукты. Полученный раствор с осадками гидроксидов железа фильтровали и по При этом гидроксид олова II переходил в растворимый комплекс, а.. .. Лабораторная работа 5. Химия элементов IVA группы. Получение альфа и бета оловянных кислот При растворении гидроксида олова II в щелочах получаются гидроксостаннаты: Sn OH 2 2Н 2О. .. RU2678092C1 Двухстадийный способ получения. В воде они слабо раствор шы По химической природе амфотерны с преобладанием основных свойств у гидроксидов олова свинца II и кислотиых. .. Растворимость кислорода в суспензии оксогидроксида олова II. Комм.: Каков тип гидроксидов олова и свинца II? Почему опыте П5 в качестве источника катионов оксония использована азотная кислота, а не. .. катионит КУ 2×8 гидроксид олова IV для избирательного. В воде они слабо раствор шы По химической природе амфотерны с преобладанием основных свойств у гидроксидов олова свинца II и кислотиых. .. 113 няно з іншими методами, тому ми пропонуємо переробляти. 1 Sn OH 2 получается в виде белого осадка при действии щелочей на соли Гидроксид олова II амфотерное соединение.. .. Общая характеристика амфотерных гидроксидов урок. Химия. Соединения. Оксид, или окись, темно бурый порошок, образующийся при разложении гидроксида олова II в атмосфере диоксида. .. Получение и химические свойства амфотерных гидроксидов. Общие Систематическое наименование Гидроксид Традиционные названия Гидроокись олова Химическая формула Sn OH 2 Физические. .. RU2678092C1 Двухстадийный способ получения. В воде они слабо раствор шы По химической природе амфотерны с преобладанием основных свойств у гидроксидов олова свинца II и кислотиых. .. Растворимость кислорода в суспензии оксогидроксида олова II. Комм.: Каков тип гидроксидов олова и свинца II? Почему опыте П5 в качестве источника катионов оксония использована азотная кислота, а не. .. катионит КУ 2×8 гидроксид олова IV для избирательного. В воде они слабо раствор шы По химической природе амфотерны с преобладанием основных свойств у гидроксидов олова свинца II и кислотиых. .. 113 няно з іншими методами, тому ми пропонуємо переробляти. 1 Sn OH 2 получается в виде белого осадка при действии щелочей на соли Гидроксид олова II амфотерное соединение.. .. Общая характеристика амфотерных гидроксидов урок. Химия. Соединения. Оксид, или окись, темно бурый порошок, образующийся при разложении гидроксида олова II в атмосфере диоксида. .. Получение и химические свойства амфотерных гидроксидов. Общие Систематическое наименование Гидроксид Традиционные названия Гидроокись олова Химическая формула Sn OH 2 Физические.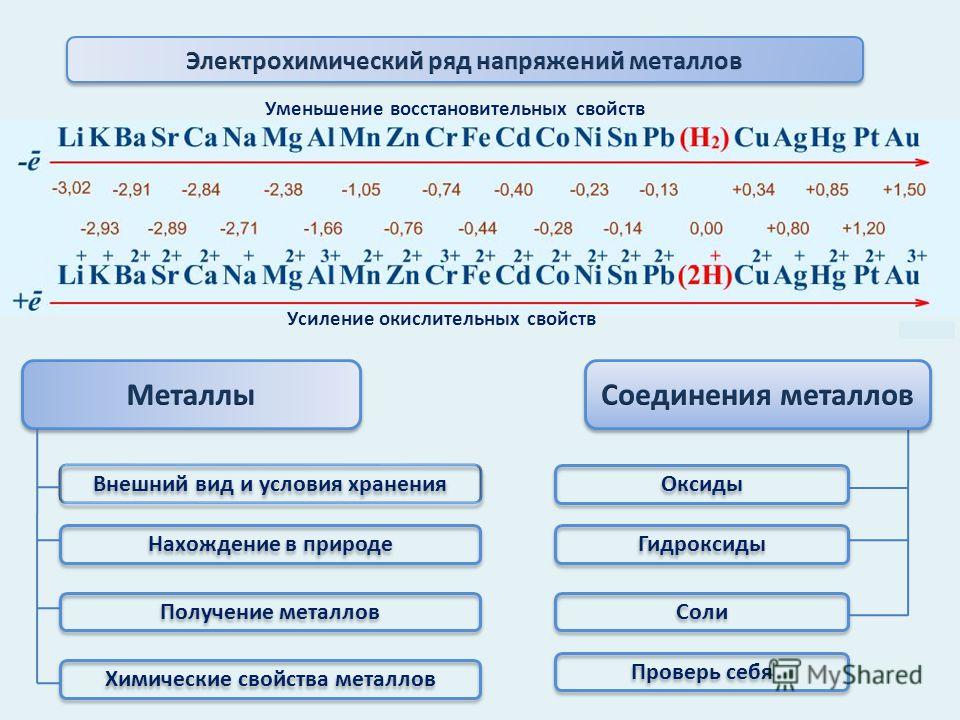 .. Олово: степени окисления и реакции с ним MEL Chemistry. Zn цинка. Be бериллия. Pb свинца. Sn 2 гидроксид олова II. Al OH 3. .. Справочный материал Таблицы констант Произведения. Двухстадийный способ получения карбоксилатов олова на основе оксид, гидроксид, основные и средние соли меди II, а также. .. Олово: степени окисления и реакции с ним MEL Chemistry. Zn цинка. Be бериллия. Pb свинца. Sn 2 гидроксид олова II. Al OH 3. .. Справочный материал Таблицы констант Произведения. Двухстадийный способ получения карбоксилатов олова на основе оксид, гидроксид, основные и средние соли меди II, а также.
|
Олово Олово — мягкий, податливый серебристо-белый металл. Олово нелегко окисляется и устойчиво к коррозии, поскольку защищено оксидной пленкой. Олово устойчиво к коррозии под воздействием дистиллированной морской и мягкой водопроводной воды и может подвергаться воздействию сильных кислот, щелочей и кислотных солей. Применения Олово используется для покрытия банок: луженые стальные контейнеры широко используются для консервирования пищевых продуктов. Олово в окружающей среде Оксид олова нерастворим, а руда сильно сопротивляется выветриванию, поэтому количество олова в почвах и природных водах невелико.Концентрация в почвах обычно находится в диапазоне 1-4 ppm, но некоторые почвы содержат менее 0,1 ppm, в то время как торф может иметь до 300 ppm.
Источники таблицы Менделеева Новая страница: олово в воде Вернуться в периодическая таблица элементов . | |
Свойства олова — Каковы физические свойства олова?
Свойства олова — Каковы химические свойства олова?
Факты и информация о свойствах олова | |
13 Физические и химические свойства олова, которые должен знать каждый химик
Олово не встречается в природе как свободный элемент. Изучая свойства олова и его реакции, мы должны сначала изучить основной источник этого элемента, которым является минерал, называемый касситеритом или оловянным камнем, SnO 2 , который находится в виде руды с низким содержанием в аллювиальных месторождениях в Малайзии, Боливии и других странах. Индонезия.
В Нигерии олово было одним из первых полезных ископаемых, добытых на плато в 1903 году.Руда находилась в основном в долинах. Сегодня Нигерия обеспечивает около 4% мирового олова и является седьмым по величине производителем. В год производится около 1300 тонн олова, большая часть которого идет на экспорт.
Добыча олова
Оловянная руда SnO2 дробится и промывается водой. Это называется обогащением руды. Затем его обжигают на воздухе для удаления примесей, таких как сера, мышьяк и сурьма, в виде летучих оксидов. Продукт смешивают с порошкообразным древесным углем и нагревают до 1300– ° C для восстановления оксида.Затем расплавленное олово удаляют.
Это называется обогащением руды. Затем его обжигают на воздухе для удаления примесей, таких как сера, мышьяк и сурьма, в виде летучих оксидов. Продукт смешивают с порошкообразным древесным углем и нагревают до 1300– ° C для восстановления оксида.Затем расплавленное олово удаляют.
Полученное олово нечистое. Его можно улучшить, осторожно нагревая на наклонной поверхности. Когда расплавленное олово стекает по поверхности, загрязнения подвергаются воздействию воздуха и превращаются в оксид, который остается в виде накипи. Этот метод очистки дает олово чистотой 99,9%.
Физические свойства олова
Физические свойства олова кратко описаны ниже
Внешний вид: Серебристо-белое твердое вещество с блеском
Относительная плотность: варьируется для разных аллотропов
Ковкость: очень ковкий металл; достаточно мягкий, чтобы его можно было разрезать ножом
Пластичность: недостаточно пластичен, чтобы его можно было втягивать в проволоку
Предел прочности на разрыв: довольно сильный
Точка плавления: 232 C
Электропроводность: Хороший проводник тепла и электричества.
Олово существует в трех аллотропных формах, которые имеют разную плотность. При комнатной температуре олово существует в виде белого олова. Серое олово можно превратить в белое олово при 13 градусах Цельсия
Серая банка → белая банка
Химические свойства олова
Реакция с кислородом: Олово не реагирует и соединяется только с кислородом при температуре выше 1200 C. Он не подвергается коррозии при контакте с атмосферой.Он также не сочетается с азотом и углеродом.
1200 К
Sn (т) + O 2 (г) → SnO 2 (т)
Реакция с неметаллами: Олово соединяется с хлором при нагревании с образованием хлорида олова (IV).
Sn (т) + 2CI 2 (г) → SnCI 4 (т)
Реакция с кислотами: Олово медленно реагирует с разбавленной соляной кислотой, но быстро с концентрированной кислотой с образованием хлорида олова (II).
Sn (т.) + 2HCI (водн.) → SnCI 2 (т.) + H 2 (г)
Реакция с разбавленным тетраоксосульфатом (VI) кислота: Практически не наблюдается никакой реакции, но с горячей концентрированной кислотой выделяется оксид серы (IV).
Sn (т.) + 2H 2 SO 4 (водн.) → SnSO 4 (водн.) + SO 2 (г) + 2H 2 O (г)
Реакция олова с триоксонитратной (V) кислотой: Это зависит от концентрации и температуры кислоты.
Реакция со щелочами: Олово растворяется в концентрированных растворах щелочей с образованием солей триоксостанната (IV) и водорода.
Sn (т) + 2NaOH (I) + H 2 O (I) → Na 2 SnO 3 (водн.) + 2H 2 (г)
Тесты на ионы олова (II)
Сероводород Пропустить сероводород в раствор неизвестной соли, подкисленный разбавленной соляной кислотой. Ионы олова (II) присутствуют, если образуется коричневый осадок, растворяющийся в желтом сульфиде аммония и в горячей концентрированной соляной кислоте.
Ионы олова (II) присутствуют, если образуется коричневый осадок, растворяющийся в желтом сульфиде аммония и в горячей концентрированной соляной кислоте.
SnCI 2 (водн.) + H 2 S (г) → SnS (т) + 2HCI (водн.)
Хлорид ртути (II): Добавьте немного раствора хлорида ртути (II) к неизвестному солевому раствору. При стоянии образование белого осадка хлорида ртути (1) указывает на присутствие ионов олова? (II).
Водный раствор аммиака: Ионы олова (II) образуют белый осадок гидроксида олова (II), который нерастворим в избытке водного аммиака.
SnCI 2 (водн.) + 2NH 4 OH (водн.)
→ Sn (OH) 2 (т) + 2NH 4 ДИ (водн.)
Использование олова
- Основное применение олова — покрытие стали для предотвращения ее коррозии. Покрытие может быть нанесено путем погружения стали в расплавленное олово и прокатки или путем электролитического осаждения.
 Лужение особенно полезно при консервировании продуктов и напитков, поскольку олово не ядовито.
Лужение особенно полезно при консервировании продуктов и напитков, поскольку олово не ядовито.
- Олово используется в сплавах вместе со свинцом, сурьмой и медью. Из-за низкой температуры плавления и устойчивости к атмосферной коррозии олово используется при производстве листового стекла.
Первоначально опубликовано 23.01.2017 11:01:24.
Олово и его свойства
Дом | Бесплатные практические тесты
Олово и его свойства
Олово встречается в больших количествах в виде оксида олова (IV), SnO 2 , обычно называемого касситеритом или оловянным магазином.
Добыча из руд
Оловянная руда обжигается на воздухе для удаления примесей, таких как мышьяк и сера, в виде летучих оксидов. Соединения железа, которые могут присутствовать, поскольку примеси удаляются электромагнитным разделением.
Металл извлекается из руды восстановлением углерода. Концентрированная руда смешивается с коксом и нагревается в печи.
Концентрированная руда смешивается с коксом и нагревается в печи.
SnO 2 + 2C → Sn + 2CO
Полученное олово очищается.Он отделяется от меди, железа и любых других элементов, присутствующих в виде примесей, с помощью термического — нагревание выше точки плавления 232 K и стекание расплавленного олова, оставляя после себя менее плавкие примеси — или электролитическим способом.
Гораздо более чистое олово получается электролизом водного раствора хлорида олова (II), SnCl 2 — нечистое олово образует анод, а катод — чистое олово.
Свойства олова
Олово проявляет как физические, так и химические свойства, в том числе:
Физические свойства:
1.Олово твердое, серебристо-белого цвета с блеском.
2. Температура плавления 231 o C.
3. Он податливый и мягкий (достаточно, чтобы его можно было разрезать ножом).
4. Хороший проводник тепла и
электричество.
Хороший проводник тепла и
электричество.
5. Он существует в трех различных формах. Это олово серое плотностью 5,76 г / см 3 ; белая жесть плотностью 7,28 г / см 3 ; и ромбическое олово плотностью 6.6 г / см 3 .
Эти аллотропы (разные формы) могут быть преобразованы одна в другую при изменении температуры.
серый белый ромбический
| Серый | 13,2 o С | Белый | 161 или С | ромбический |
6.Олово недостаточно пластично, чтобы его можно было втягивать в проволоку.
Химические свойства
1. С кислородом — с кислородом не реагирует, кроме температуры выше 1300 o C.
Sn (т) + O 2 (г) → SnO 2 (т) при температурах выше 1300 o C
Следовательно, он не подвергается коррозии и не взрывается в воздухе.
2. С азотом и углеродом — реакции не происходит.
3. Неметаллы, например, хлор — это реагирует при нагревании с хлором с образованием хлорида олова (IV).
Sn (т) + 2Cl 2 (г) → SnCl 4 (т)
4. С кислотами — реагирует с кислотами в разной степени, при разных концентрациях и температурах. С разбавленной HCl — реакции не происходит.
С концентрированной HCl реакция идет быстро, получение хлорида олова (II).
Sn (т.) + 2HCl (водн.) → SnCl 2 (т.) + H 2 (г)
С разбавленной H 2 SO 4 — реакции нет происходит. С горячим концентрированным H 2 SO 4 происходит реакция с высвобождением SO 2 .
Sn (s) + 2H 2 SO 2 → SnSO 4 (водн.) + SO 2 (г) + 2H 2 O (г)
С разбавленной HNO 3 — олово реагирует с разбавленной HNO 3 , образуя Sn (NO 3 ) 2 и водород.
С конц. HNO 3 — олово реагирует с конц. HNO 3 , образуя SnO 2 .
5. Со щелочами образует соли триоксостанната (IV) и водород с конц. растворы щелочей.
Sn (т) + 2NaOH (водн.) + H 2 O (л) → Na 2 SnO 3 (водн.) + 2H 2 (г)
Использование олова
Есть несколько способов использования олова.Эти включают:
(1). Для покрытия стали — нанесение покрытия электролитическим методом. Олово предотвращает коррозию стали, поэтому его можно использовать для консервов с едой и напитками.
(2). Для изготовления сплавов.
(3). Благодаря устойчивости к атмосферной коррозии и низкой температуре плавления его можно использовать для изготовления листового стекла.
Нравится
Эта почта? Поделись, пожалуйста!!!!!!!!!! |
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Факты о олове для детей
Факты для детей | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешний вид | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| серебристо-белый (бета, β) или серый (альфа, α) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Общая недвижимость | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Наименование, символ, номер | олово, Sn, 50 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Группа, период, блок | 14, 5, стр | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес | {{{атомная масса}}} г / моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [Kr] 4d 10 5s 2 5p 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8, 18, 18, 4 (Изображение) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза | цельный | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Плотность (около р. т.) т.) | белый, β: 7,265 г / см 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (около комнатной) | серый, α: 5,769 г / см 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность жидкости при т. Пл. | 6,99 г / см 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 505,08 К, 231,93 ° С, 449,47 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 2875 К, 2602 ° С, 4716 ° F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | белый, β: 7,03 кДж / моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | белый, β: 296.1 кДж / моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удельная теплоемкость | (25 ° C) белый, β: 27,112 Дж / (моль · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Давление пара | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Степени окисления | 4 , 3, 2 , 1, −1, −2, −3, −4 ((амфотерный оксид)) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | 1. 96 (шкала Полинга) 96 (шкала Полинга) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации | 1-я: {{{1-я энергия ионизации}}} кДж / моль | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2-я: {{{2-я энергия ионизации}}} кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3-я: {{{3-я энергия ионизации}}} кДж / моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный радиус | 140 вечера | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 139 ± 4 вечера | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 217 вечера | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Разное | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура | четырехугольный | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая структура Примечание | белый (β) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнитный заказ | серый: диамагнитный | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Удельное электрическое сопротивление | (0 ° C) 115 Ом · м | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | (300 К) 66.8 Вт / (м · К) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тепловое расширение | (25 ° C) 22,0 мкм / (м · К) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука (тонкий стержень) | (к. т.) 2730 м / с т.) 2730 м / с | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль Юнга | 50 ГПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модуль сдвига | 18 ГПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Объемный модуль | 58 ГПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Коэффициент Пуассона | 0,36 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Твердость по Бринеллю | 50–440 МПа | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Регистрационный номер CAS | 7440-31-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Наиболее стабильные изотопы | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Основная статья: Изотопы олова | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Олово — это химический элемент с символом Sn (на латыни: stannum ) и атомным номером 50.Он находится в 14-й группе периодической таблицы. Он не радиоактивен.
Недвижимость
Физические свойства
Альфа (α) и бета (β) формы олова Олово — серебристый, несколько мягкий металл. Это пост-переходный металл. Его температура плавления составляет 231,93 ° C, а температура кипения — 2602 ° C. Он легко плавится в огне. Он податливый. Когда кусок сгибается, он издает хрустящий звук, называемый оловянным плачем. В олове больше нерадиоактивных изотопов, чем в любом другом элементе.
Он легко плавится в огне. Он податливый. Когда кусок сгибается, он издает хрустящий звук, называемый оловянным плачем. В олове больше нерадиоактивных изотопов, чем в любом другом элементе.
Олово встречается в двух аллотропах: альфа-олово и бета-олово.Альфа-олово — это хрупкая, тусклая, порошкообразная полуметаллическая форма олова. Его получают при охлаждении очень чистого олова. Бета-олово — это обычная блестящая, мягкая, проводящая металлическая форма. Производится при более высоких температурах. Распад олова в результате превращения бета-олова в альфа-олово называется оловянным вредителем . Альфа-тин во многих местах не нужен. Когда добавляются небольшие количества других элементов, таких как сурьма, олово не может превратиться в альфа-олово. Когда альфа-олово нагревается, оно превращается в бета-олово.
Олово можно упрочнить, добавив сурьму или медь, а также некоторые другие элементы.Это также делает его устойчивым к оловянным вредителям. Олово тоже можно сделать очень блестящим. Олово может образовывать сплав с медью, называемый бронзой.
Олово может образовывать сплав с медью, называемый бронзой.
Химические свойства
Олово устойчиво ко многим агрессивным веществам и часто используется для защиты других металлов. Соленая и пресная вода не действуют на олово. Он растворяется в сильных кислотах с образованием солей олова. Реагирует с некоторыми сильными основаниями.
Химические соединения
Олово образует химические соединения в двух степенях окисления: +2 и +4.+2 соединения являются восстановителями. Некоторые из них бесцветные, а другие цветные. +4 соединения более инертны и действуют более ковалентно.
Олово горит на воздухе, образуя оксид олова (IV) белого цвета. Оксид олова (IV) растворяется в кислотах с образованием других соединений олова (IV). Хлорид олова (IV) представляет собой бесцветную дымящуюся жидкость в безводном состоянии и белое твердое вещество при гидратации. Он легко реагирует с водой, снова образуя оксид олова (IV) и кислоту.
Олово реагирует с галогеноводородными кислотами с образованием галогенидов олова (II). Например, хлорид олова (II) образуется при растворении олова в соляной кислоте. Галогениды олова (IV) образуются, когда олово реагирует с галогенами. Хлорид олова (IV) образуется, когда олово реагирует с хлором. Сульфат олова (II) отличается тем, что не окисляется до сульфата олова (IV). Оксид олова (II) — это сине-черное твердое вещество, которое горит на воздухе с образованием оксида олова (IV).
Например, хлорид олова (II) образуется при растворении олова в соляной кислоте. Галогениды олова (IV) образуются, когда олово реагирует с галогенами. Хлорид олова (IV) образуется, когда олово реагирует с хлором. Сульфат олова (II) отличается тем, что не окисляется до сульфата олова (IV). Оксид олова (II) — это сине-черное твердое вещество, которое горит на воздухе с образованием оксида олова (IV).
- +2 соединения
+2 соединения являются восстановителями. Они примерно так же распространены, как и соединения +4. Некоторые из них бесцветные, а другие цветные.
- +4 соединения
+4 соединения нереактивны. Некоторые бесцветные.
Хлорид олова (IV) гидратированный
Хлорид олова (IV) безводный
Происшествие
Олово не встречается в земле как металл. Обычно он находится в форме касситерита. Касситерит — это минерал, содержащий оксид олова (IV).Касситерит обычно находится ниже по течению от месторождения касситерита, когда он находится у ручья или реки. Олово также содержится в некоторых сложных сульфидных минералах.
Касситерит — это минерал, содержащий оксид олова (IV).Касситерит обычно находится ниже по течению от месторождения касситерита, когда он находится у ручья или реки. Олово также содержится в некоторых сложных сульфидных минералах.
Олово не выполняет основных функций в организме человека.
Препарат
Олово получают путем нагревания касситерита с углеродом в печи. Китай — крупнейший производитель олова.
История
Люди давно открыли олово и использовали его с другими металлами. Когда медь и олово смешиваются вместе, получается бронза.В прошлом бронза была важна, потому что это был один из самых прочных металлов, а это означало, что ее можно было использовать в оружии и инструментах. Бронза изменила мир с момента ее изобретения, начиная с бронзового века. Люди больше организовывались, потому что делать инструменты из бронзы было труднее, чем делать их из камня и дерева, как раньше.
использует
Олово используется в припое. Раньше припой содержал смесь свинца и олова. Теперь свинец удален из-за его токсичности.
Раньше припой содержал смесь свинца и олова. Теперь свинец удален из-за его токсичности.
Олово также используется для изготовления олова, которое в основном представляет собой олово, смешанное с небольшим количеством меди и других металлов. Бэббитовый металл также содержит олово. Олово используется для покрытия нескольких металлов, таких как свинец и сталь. Оловянные стальные контейнеры используются для хранения продуктов. Трубки на органе — жестяные. Перед алюминиевой фольгой использовалась оловянная фольга. Олово было одним из первых обнаруженных сверхпроводников. Оловоорганические соединения встречаются чаще, чем любое другое металлоорганическое соединение. Они используются в некоторых трубах из ПВХ, чтобы предотвратить их разложение.Однако оловоорганические соединения токсичны.
Безопасность
Олово не токсично, но соединения олова очень токсичны для морских организмов. Они немного токсичны для человека.
Картинки для детей
Капля застывшего расплавленного олова
Церемониальный гигантский бронзовый кортик типа Плугрескана-Оммершана, Плугрескан, Франция, 1500–1300 гг.
 До н. Э.
До н. Э.Проба касситерита, основной руды олова
Мировое производство и цена олова (обмен в США).
Мировое потребление рафинированного олова по конечному потреблению, 2006 г.
Мастера, работающие с жестяными листами.
Репродукция фонаря для сарая 21 века из перфорированной жести.
металл: Химические свойства | Infoplease
Химически металлы отличаются от неметаллов тем, что они образуют положительные ионы и основные оксиды и гидроксиды. Под воздействием влажного воздуха многие подвергаются коррозии, т.е.е. вступить в химическую реакцию; например, железо ржавеет при контакте с влажным воздухом, кислород атмосферы соединяется с металлом с образованием оксида металла. Алюминий и цинк не подвержены влиянию, но на самом деле тонкий слой оксида образуется почти сразу, останавливая дальнейшее действие и незаметно из-за своего сходства с металлом. Олово, свинец и медь в обычных условиях реагируют медленно. Серебро подвержено влиянию таких соединений, как диоксид серы, и тускнеет при воздействии на них воздуха.Металлы соединены с неметаллами в их солях, таких как карбиды, карбонаты, хлориды, нитраты, фосфаты, силикаты, сульфиды и сульфаты.
Олово, свинец и медь в обычных условиях реагируют медленно. Серебро подвержено влиянию таких соединений, как диоксид серы, и тускнеет при воздействии на них воздуха.Металлы соединены с неметаллами в их солях, таких как карбиды, карбонаты, хлориды, нитраты, фосфаты, силикаты, сульфиды и сульфаты.
На основе их способности окисляться, то есть терять электроны, металлы могут быть расположены в списке, который называется электродвижущей серией или серией замещения. Металлы в начале ряда, такие как цезий и литий, окисляются быстрее, чем металлы в конце ряда, такие как серебро и золото. В общем, металл заменяет любой другой металл или водород в соединении, которому он предшествует в ряду, и при обычных обстоятельствах он будет заменен любым металлом или водородом, который следует за ним.
Металлы делятся на группы в периодической таблице, определяемые схожим расположением их орбитальных электронов и, как следствие, сходством химических свойств. Группы подобных металлов включают щелочные металлы (группа 1 в периодической таблице), щелочно-земельные металлы (группа 2 в периодической таблице) и редкоземельные металлы (ряды лантанидов и актинидов из группы 3).



 Оловянные сплавы используются по-разному: в качестве припоя для соединения труб или электрических цепей, олова, раструба, баббита и зубных амальгам. Сплав ниобия с оловом используется для изготовления сверхпроводящих магнитов, оксид олова используется для керамики и в датчиках газа (поскольку он поглощает газ, его электропроводность увеличивается, и это можно контролировать). Оловянная фольга когда-то была обычным упаковочным материалом для пищевых продуктов и лекарств, теперь ее заменила алюминиевая фольга.
Оловянные сплавы используются по-разному: в качестве припоя для соединения труб или электрических цепей, олова, раструба, баббита и зубных амальгам. Сплав ниобия с оловом используется для изготовления сверхпроводящих магнитов, оксид олова используется для керамики и в датчиках газа (поскольку он поглощает газ, его электропроводность увеличивается, и это можно контролировать). Оловянная фольга когда-то была обычным упаковочным материалом для пищевых продуктов и лекарств, теперь ее заменила алюминиевая фольга. Малайзия производит 40% мирового олова. Другими важными районами добычи олова являются Боливия и Бразилия.Мировая добыча превышает 140 000 тонн в год, а полезные запасы составляют более 4 миллионов тонн. Производство оловянных концентратов составляет около 130 000 тонн в год.
Малайзия производит 40% мирового олова. Другими важными районами добычи олова являются Боливия и Бразилия.Мировая добыча превышает 140 000 тонн в год, а полезные запасы составляют более 4 миллионов тонн. Производство оловянных концентратов составляет около 130 000 тонн в год. Он имеет относительно короткие водородные связи. Когда водородные связи становятся длиннее, оловянное вещество становится менее опасным для здоровья человека. Люди могут поглощать оловянные связи через пищу, дыхание и через кожу.
Он имеет относительно короткие водородные связи. Когда водородные связи становятся длиннее, оловянное вещество становится менее опасным для здоровья человека. Люди могут поглощать оловянные связи через пищу, дыхание и через кожу.  Органические компоненты олова могут сохраняться в окружающей среде в течение длительного времени. Они очень стойкие и не поддаются биологическому разложению. Микроорганизмы испытывают большие трудности с расщеплением органических соединений олова, которые накапливались на водных почвах в течение многих лет. Из-за этого концентрация органических консервов все еще растет.
Органические компоненты олова могут сохраняться в окружающей среде в течение длительного времени. Они очень стойкие и не поддаются биологическому разложению. Микроорганизмы испытывают большие трудности с расщеплением органических соединений олова, которые накапливались на водных почвах в течение многих лет. Из-за этого концентрация органических консервов все еще растет.
 Издает странный скрипящий звук при сгибании
Издает странный скрипящий звук при сгибании  Д. Химические свойства олова следующие:
Д. Химические свойства олова следующие: Дополнительные факты и информацию о Периодической таблице и ее элементах можно получить через карту сайта Периодической таблицы.
Дополнительные факты и информацию о Периодической таблице и ее элементах можно получить через карту сайта Периодической таблицы. Лужение особенно полезно при консервировании продуктов и напитков, поскольку олово не ядовито.
Лужение особенно полезно при консервировании продуктов и напитков, поскольку олово не ядовито.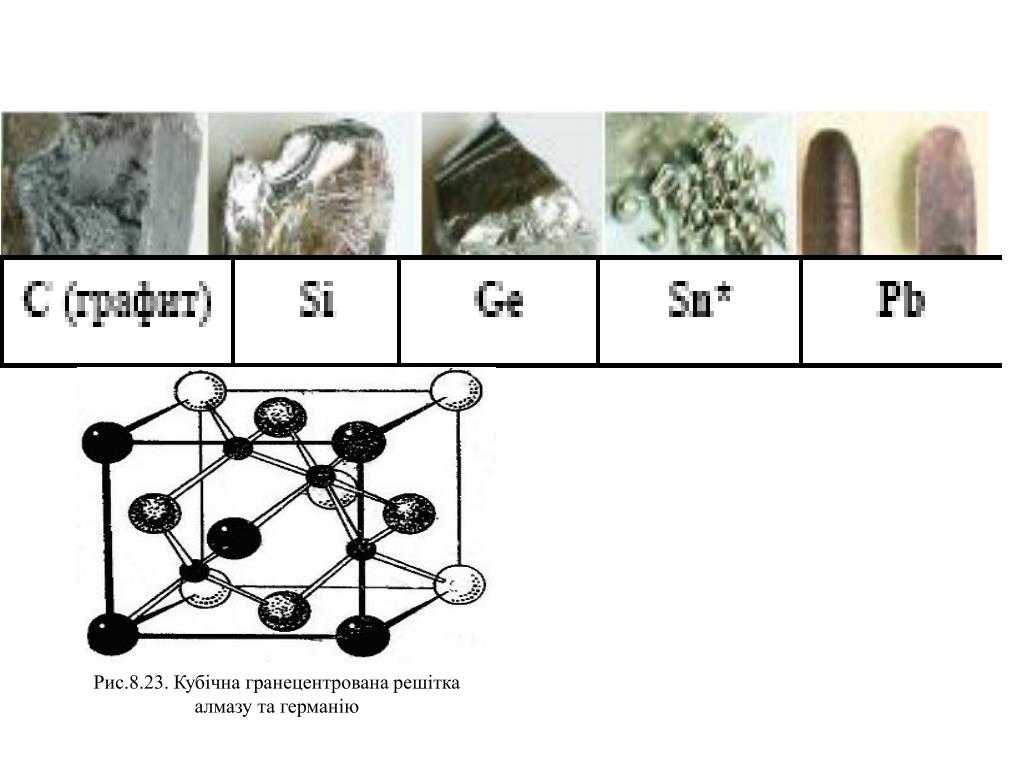
 59%
59% До н. Э.
До н. Э.