ХиМиК.ru — ИЗВЕСТНЯК — Химическая энциклопедия
ИЗВЕСТНЯК, наиб. распространенная осадочная карбонатная горная порода, состоящая гл. обр. из кальцита СаСО3. Составляет 12% от всей массы осадочных пород. Хим. состав чистого известняка близок к кальциту (СаО 56%, СО2 44,0%). В состав карбонатной части известняка входят также доломит CaMg(CO3)2, FeCO3 и МnСО3 (менее 1%), некарбонатные примеси — глинистые алюмосиликаты и минералы кремнезема (опал, халцедон, кварц), в небольших кол-вах оксиды, гидроксиды и сульфиды Fe, Са3(РО4)2, CaSO4, орг. в-во. Пром. классификация известняков построена на соотношениях содержаний кальцита и главных примесей, доломита и глинистого в-ва, кол-ва к-рых могут варьировать непрерывно вплоть до полного преобладания. К известнякам принято относить породы с содержанием кальцита не менее 50%.
 Его применяют при очистке нефтепродуктов, при изготовлении красок, замазок, резины, пластмасс, мыла, лекарств, минер. ваты, для очистки тканей и обработки кожи, известковании почвы (см. Известковые удобрения).
Его применяют при очистке нефтепродуктов, при изготовлении красок, замазок, резины, пластмасс, мыла, лекарств, минер. ваты, для очистки тканей и обработки кожи, известковании почвы (см. Известковые удобрения). Исп. литература для статьи «ИЗВЕСТНЯК»: Требования промышленности к качеству минерального сырья, в. 10. Известняк, 2 изд., М., 1961; Карбонатные породы, пер. с англ., т. 2, М., 1971. П. П. Смолин.
Страница «ИЗВЕСТНЯК» подготовлена по материалам химической энциклопедии.
Известняк (получение углекислого газа) | Химик.ПРО – решение задач по химии бесплатно
Рассчитайте объем 20-процентного раствора соляной кислоты (HCl) (плотность=1,1 г/мл), необходимого для получения 5,6 литров углекислого газа (CO2) из известняка (CaCO3) с 5-процентной примесью.
Решение задачи
Запишем уравнение реакции воздействия соляной кислоты (HCl) на известняк (CaCO3), в результате чего получается углекислый газ (CO2):
В ходе реакции образуется угольная кислота (h3CO3) – слабая кислота, которая разлагается на воду (h3O) и диоксид углерода (CO2) – углекислый газ.
Учитывая, что углекислый газ (CO2) – газ, вычислим химическое количество углекислого газа (CO2), полученного из известняка (CaCO3), по формуле, устанавливающей связь между химическим количеством вещества и объемом:
Получаем:
n (CO2) = 5,6 / 22,4 = 0,25 (моль).
По уравнению реакции рассчитаем химическое количество соляной кислоты (HCl), которая вступила в реакцию с
x моль HCl вступает в реакцию с 0,25 моль CO2
2 моль HCl вступает в реакцию с 1 моль CO2
Откуда:
известнякУчитывая, что молярная масса соляной кислоты (HCl) равна 36,5 г/моль, найдем массу соляной кислоты (HCl) по формуле, устанавливающей связь между массой и химическим количеством вещества:
Получаем:
m (HCl) = 0,5 ∙ 36,5 = 18,25 (г).
Используя формулу нахождения массовой доли растворенного вещества:
выразим массу раствора:
Получаем:
m (раствора HCl) = 18,25 / 0,2 = 91,25 (г).
Если раствор 20-процентный, то массовая доля соляной кислоты (HCl) в нем 0,2.
Рассчитаем объем раствора соляной кислоты (HCl), которая вступила в реакцию с известняком (CaCO3), по формуле, устанавливающей связь между объемом и массой:
Получаем:
V (раствора HCl) = 91,25 / 1,1 = 82,95 (мл).
Ответ:
объем раствора соляной кислоты (HCl) равен 82,95 мл.
Сведения о составе минералов и горных пород — урок. Химия, 8–9 класс.
Соли в составе минералов
Минералом называют однородное природное тело, состоящее из вещества природного происхождения.
Подавляющее большинство минералов имеет кристаллическое строение.
Исторически сложилось так, что единый подход к присвоению названий минералам отсутствует. Какие-то из них получили название по месту открытия, какие-то — в честь исследователей, их открывших, в названиях некоторых минералов отображён их состав или какие-то существенные свойства и т. п.
п.
Сведения о солях, образующих некоторые минералы, а также о названиях этих минералов, приведены в таблице.
Формула соли | Название минерала |
| \(BaSO_4\) | барит |
| \(Ca_5(PO_4)_3(Cl, F, OH)\) | апатит (соответственно — хлорапатит, фторапатит, гидроксиапатит) |
| \(Ca_3(PO_4)_2\cdot Ca(OH)_2\) | фосфорит |
| \(CaCO_3\) | кальцит |
| \(CaCO_3\cdot MgCO_3\) | доломит |
| \(CaF_2\) | флюорит |
| \(CaSO_4\) | ангидрит |
| \(CaSO_4\cdot 2H_2O\) | гипс, селенит |
| \(Cu_2S\) | халькозин |
| \(2CuCO_3\cdot Cu(OH)_2\) | азурит |
| \(CuCO_3\cdot Cu(OH)_2\) | малахит |
| \(CuFeS_2\) | халькопирит |
| \(FeCO_3\) | сидерит |
| \(FeS_2\) | пирит |
| \(Hg_2Cl_2\) | каломель |
| \(HgS\) | киноварь |
| \(KCl\) | сильвин |
| \(KCl\cdot MgCl_2\cdot 6H_2O\) | карналлит |
| \(KCl\cdot NaCl\) | сильвинит |
| \(MgCl_2\cdot 6H_2O\) | бишофит |
| \(MgCO_3\) | магнезит |
| \(MgSO_4\cdot 7H_2O\) | эпсомит |
| \(3NaF\cdot AlF_3\) | криолит |
| \(Na_2B_4O_7\cdot 10H_2O\) | бура |
| \(Na_2CO_3\cdot 10H_2O\) | сода |
| \(Na_2SO_4\cdot 10H_2O\) | мирабилит |
| \(NaCl\) | галит |
| \(PbS\) | галенит |
| \(ZnS\) | сфалерит |
Соли в составе горных пород
Горные породы — плотные или рыхлые природные тела, слагающие земную кору и состоящие из одного или нескольких минералов (или органических веществ).
Горные породы образуются в результате процессов, протекающих в природе.
Как и в случае минералов, названия горных пород слагались исторически. В таблице приведены сведения о составе и названиях некоторых горных пород, главными образующими соединениями которых являются соли.
Формула соли | Название горной породы |
| \(Ca_3(PO_4)_2\) | фосфорит |
| \(CaCO_3\) | известковые сланцы |
| \(CaCO_3\) | известняк |
| \(CaCO_3\) | мрамор |
| \(CaCO_3\) | мел |
| \(CaCO_3\cdot MgCO_3\) | доломит |
| \(CaSO_4\cdot 2H_2O\) | гипс |
| \(NaCl\) | каменная соль |
Карбонат кальция (МЕЛ, углекислый кальций, известняк, CaCO3) в регионе Ташкент, Узбекистан, цена от Химия и Технология ТОО
Формула: CaCO3.
Карбонат кальция (мел) — химическое соединение, соль угольной кислоты В природе встречается в виде минералов кальцита, арагонита и ватерита. Карбонат кальция является главной составной частью известняка, мела и мрамора.
Карбонат кальция является главной составной частью известняка, мела и мрамора.
Нерастворим в воде и этаноле.
Зарегистрирован как белый пищевой краситель (E170) .
Очищенный от посторонних примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве. Производители бумаги используют карбонат кальция одновременно в качестве отбеливателя, наполнителя (заменяя им дорогостоящие волокна и красители), а также раскислителя. Производители стеклянной посуды, бутылок, стекловолокна используют карбонат кальция в огромных количествах в качестве источника кальция — одного из основных элементов, необходимых для производства стекла.
Минимальный объем заказа 5 000 кг.
Подробную информацию о товаре просим уточнять у продавца,
связавшись с ним по указанному выше телефону или посредством
электронного запроса через форму обратной связи.
Отзывы о Химия и Технология ТОО
Вы можете оставить свой отзыв.
Известняк разложение — Справочник химика 21
 34]
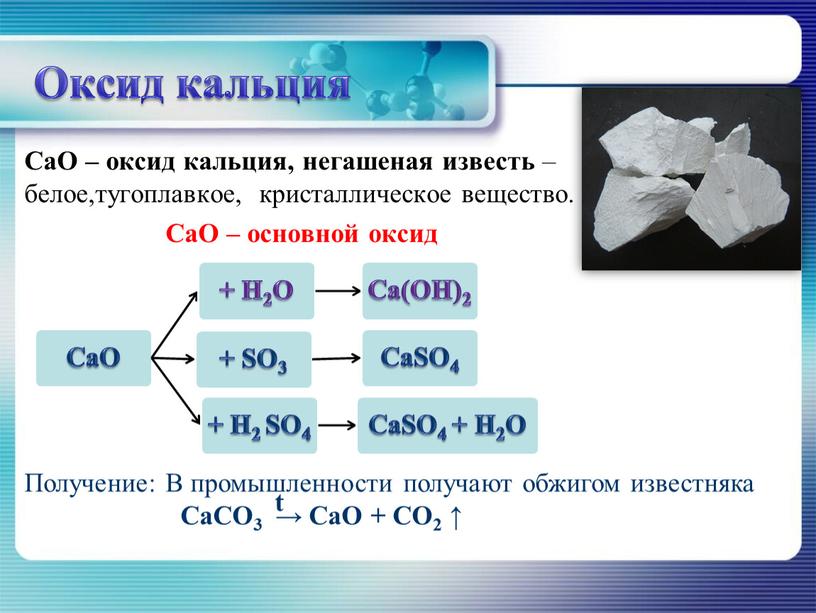
34]Если в реакции принимает участие чистое твердое или жидкое вещество, оно выступает в роли бесконечно большого резервуара вещества и поэтому количество чистого твердого или жидкого вещества не оказывает влияния на равновесие до тех пор, пока это вещество имеется в наличии. Например, при разложении известняка на негашеную известь и диоксид углерода [c.98]
Температуру диссоциации СаСОд принято считать равной 898 °С. При этой температуре парциальное давление СОа равновесной системе равно 101 Па. При более низких температурах значительные выходы СаО и СОа Достигаются только при достаточном разрежении. Температура в зоне обжига 1100—1250 °С, так как для полного разложения необходимо прогреть весь кусок известняка для того, чтобы в середине его не оставалось необожженой извести. Зависимость продолжительности обжига известняка от величины кусков и температуры приведена на рис. 53. [c.179]
Для получения соды из поваренной соли аммиачным способом (рис.
Разложение пробы и удаление мешающих элементов. Кальций чаще всего приходится определять при анализе известняков, доломитов, различных силикатов (в том числе шлаков), а также природных вод. [c.164]
Отношение количества разложившегося карбоната кальция (СаСОдд .
 ) к количеству загрунсенного в печь (СаСОд д р) называется степенью обжига или разложения известняка. Неразложившийся известняк называют недожегом или недопалом. [c.558]
) к количеству загрунсенного в печь (СаСОд д р) называется степенью обжига или разложения известняка. Неразложившийся известняк называют недожегом или недопалом. [c.558]При горении углерода выделяется 412 кДж теплоты. Какую массу угля необходимо сжечь, чтобы путем разложения известняка получить 11,2 кг негашеной извести [c.244]
В качестве углеродистых материалов для синтеза используются кокс или антрацит. Для снижения содержания в ацетилене вредных примесей к сырью предъявляются жесткие требования по чистоте. Так, известняк должен содержать не менее 97% карбоната кальция, а углеродистые материалы — не более 6—8% летучих веществ и минимальные количества серы и фосфора. Соотношение оксида кальция и углеродистого материала зависит от заданного литража . Литражом карбида кальция называется объем ацетилена в литрах, приведенный к 20°С и 0,1 МПа, полученный при полном разложении 1 кг карбида кальция водой. Теоретический литраж 100%-го СаСг равен 377,73 л. С увеличением количества углерода в шихте литраж карбида кальция повышается, но выход его падает. Обычно применяется шихта с содержанием углерода 40—50%. При этом литраж колеблется в пределах 230—300 л. При образова- [c.247]
С увеличением количества углерода в шихте литраж карбида кальция повышается, но выход его падает. Обычно применяется шихта с содержанием углерода 40—50%. При этом литраж колеблется в пределах 230—300 л. При образова- [c.247]
Процессы диссоциации карбонатов имеют довольно большое распространение в металлургии — обжиг известняка, разложение известняка в доменной печи (где он применяется в качестве флюса), известковое кипение в мартеновской печи и т. д. [c.222]
До сих пор мы рассматривали химические реакции, условно полагая, что они идут до конца, т. е. реагенты полностью превращаются в продукты реакции. В действительности же такое положение справедливо лишь для некоторых реакций, называемых необратимыми. Примером необратимых реакций могут служить реакции разложения известняка, реакции в растворах, сопровождающиеся образованием газообразного или труднорастворимого продукта, и др. [c.60]
В качестве примера рассмотрим более детально процесс разложения известняка. Рассчитаем температуру его разложения при атмосферном давлении. В этом случае величины [c.137]
Рассчитаем температуру его разложения при атмосферном давлении. В этом случае величины [c.137]
Химический и гранулометрический состав материалов, поступающих на переработку в печи, влияет на скорость и полноту проведения процесса. Рассмотрим, например, реакцию разложения СаСОз, протекающую при обжиге известняка. Эта реакция сопровождается поглощением теплоты и поэтому невозможна без ее подвода. Так как в результате реакции на поверхности кусков известняка образуется пористая корка СаО, плохо проводящая теплоту, то время, необходимое для обжига, определяется скоростью переноса теплоты через эту корку к неразложившейся сердцевине. В этих условиях скорость обжига увеличивается при уменьшении кусков известняка. [c.23]
При обжиге 1 т известняка образуется 168 м диоксида углерода. Содержание СаСОз в известняке 94%. Определить степень диссоциации известняка и расход известняка на 1000 м СОг при данных условиях -I при полном разложении СаСОз. [c.28]
[c.28]
Оксид кальция образуется при разложении известняка или доломита [c.180]
В шахтной печи производится обжиг известняка. Расход топлива, загружаемого в печь, составляет 10 /о от веса известняка. Разложение известняка полное. Определить а) сколько СО2 получится и.з известняка, если последний содержит 100 /о СаСОз б) сколько СО2 получится от сгорания топли-на, если весь углерод его сгорает до СО2 и содержание углерода в топливе равно 84 /о а) теоретический расход воздуха г) процентное содержание СО2 в газе иа выходе нз печи. Расчет вести иа 100 кг СаСОз, [c.324]
Данный метод получения оксида кальция и углекислого газа заключается в том, что нагрев известняка (мела) до температуры разложения осуществляют электромагнитным излучением сверхвысокочастотного диапазона, без внесения, в отличие от применяемого в промышленности метода, дополнительных компонентов в сырьевую смесь. [c.9]
Этой ситуации отвечает реакция разложения известняка [c. 136]
136]
Сколько должно получиться килограммов негашеной извести, кубических метров углекислого газа (в пересчете на н. у.) при разложении 50 кг известняка [c.33]
Из последнего уравнения, подставляя зависимости от температуры для изменения энтальпии и энтропии, находим, что температура разложения известняка равна 1162 К. [c.137]
ИЗВЕСТНЯКИ — осадочные горные породы, состоящие в основном из минерала кальцита СаСОз. И. всегда содержат значительное количество различных примесей, обусловливающих чистоту цвета и температуру разложения И. при обжиге. Увеличивая постепенно количество примесей магния, И. переходит через ряд промежуточных разновидностей в доломиты с увеличением содержания глинистых частичек —в мергели, а затем в известковистые глины с увеличением количества грубых частичек— в песчаники. При перекристаллизации под воздействием высокой температуры И. превращаются в мрамор. И. чаще всего образуются на дне морей в результате накопления органических остатков или осаждения СаСОз из морской воды. И. составляют приблизительно 20% от общего количества осадочных пород. И. широко используются в различных отраслях народного хозяйства как сырье для производства извести, как строительный материал, флюсы в металлургическом производстве, для производства цементов, известкования кислых почв, получения углекислого газа СО2, в производстве соды, для скульптурных работ, в полиграфическом производстве для изготовления литографского камня и др. [c.102]
И. составляют приблизительно 20% от общего количества осадочных пород. И. широко используются в различных отраслях народного хозяйства как сырье для производства извести, как строительный материал, флюсы в металлургическом производстве, для производства цементов, известкования кислых почв, получения углекислого газа СО2, в производстве соды, для скульптурных работ, в полиграфическом производстве для изготовления литографского камня и др. [c.102]
Многие такие реакции имеют важное прикладное значение, например получение негашеной извести СаО термическим разложением известняка СаСОа при 900—1000 °С и термическое разложение сульфата кальция [c.433]
Диоксид углерода образуется при восстановлении оксида железа [уравнение (22.20)], а также при разложении известняка. Но известняк играет в выплавке железа не только роль поставщика диоксида углерода. Обычно в восстанавливаемой руде содержится [c.356]
Пример. Химический анализ природного известняка показал следуюи1е е. Из навески известняка 1,0312 путем се растворения, последующего осаждения ионов Са » щавелевокислым аммонием и прокаливанием осадка СаС204 получено 0,5384 г СаО, г из навески 0,3220 г путем разложения кислотой получено 68,5 см СО2 (приведенных к нор.мальным условиям). Подсчитать содержание углекислого кальция и магния в известняке, если весь кальций в нем находится только в виде a Oj, а угольная кислота — в виде карбонатов кальция и магния. [c.30]
Из навески известняка 1,0312 путем се растворения, последующего осаждения ионов Са » щавелевокислым аммонием и прокаливанием осадка СаС204 получено 0,5384 г СаО, г из навески 0,3220 г путем разложения кислотой получено 68,5 см СО2 (приведенных к нор.мальным условиям). Подсчитать содержание углекислого кальция и магния в известняке, если весь кальций в нем находится только в виде a Oj, а угольная кислота — в виде карбонатов кальция и магния. [c.30]
На рис. Х1-12 представлена непрерывнодействующая обжиговая печь для получения извести. Такие печи имеют диаметр 2,4—4,6 м и высоту 15—24 м. Максимальные температуры при обжиге известняка составляют около 1200 °С, хотя разложение хорошо идет и при 1000 °С. В качестве топлива может быть применен кокс, который подается вместе с известняком (если в образующейся извести допускается примесь золы), генераторный или какой-либо другой газ или мазут. Нагрузка равна 12,8—24 кг СаО в час на 1 Л1 объема печи или 220—490 кг СаО в час на 1 поперечного сечения печи, в зависимости от размеров и степени модернизации печи, способа подачи и сжигания топлива и размеров кусков известняка, которые обычно составляют от 100 до 250 мм. [c.366]
[c.366]
Среди сторонников органического происхождения нефти, как уже указано, выделяется особая группа ученых, которая исходит из представления о всякой залежи нефти как о первичном ее скоплении, т. е. если нефть в данное время мы находим в песках или пористых известняках, значит, в этих породах она и возникла. Известный геолог-нефтяник К. П. Калицкий выявляет в этом отношении наиболее крайнюю точку зрения. В своей книге Миграция нефти он говорит, что все сторонники теории передвижки нефти из одного пласта в другой исходят из одной основной мысли, по которой образование нефти в песках невозможно, так как в силу аэрации (проникновение воздуха) органический материал подвергается в них процессу окончательного разложения под действием кислорода воздуха. Он приводит ряд фактов, говорящих за возможное сохранение органического вещества в песках, и, следовательно, за возможность возникновения в них нефти. А раз это так, то нет, по мнению К. П. Калицкого, никакой нужды строить всякого рода предположения о перемещении нефти из одного п. таста в другой, тем более о передвижении ее с неведомых глубин. Для того чтобы подобное предположение оказалось соответствующим действительности, необходимо доказать, что в песках или известняках может происходить наконле- [c.184]
таста в другой, тем более о передвижении ее с неведомых глубин. Для того чтобы подобное предположение оказалось соответствующим действительности, необходимо доказать, что в песках или известняках может происходить наконле- [c.184]
Если в равновесной системе присутствует какое-либо чистое твердое либо жидкое вещество, то его количество не должно влиять на равновесие. Концентрацию чистого твердого или жидкого вещества можно считать постоянной, поэтому в выражении для константы равновесия все такие постоянные члены удобно перенести в левую часть и включить в саму константу равновесия. В качестве примера рассмотрим разложение известняка (карбоната кальция, a Oj) на негашеную известь (оксид кальция, СаО) и диоксид углерода, Oj [c.185]
В каких условиях обжига разложение известняка будет происходить с большей полнотой в лечах, позволяющих отводить газ, или в герметически закрытых печах Почему [c.120]
Способы, применяемые для определения механических примесей и наполнителей, не всегда дают возможность различать их между собой. Наиболее распространенный в СССР способ определения механических примесей с разложением смазки кислотой (ГОСТ С479-53) не дает возможности открыть такие механические примеси, растворимые в соляной кислоте, как, например, известняк, мел, часто присутствующие в кальциевых консистентных смазках, приготовляемых с омылением известью, а также гипс, железо и пр. Поэтому за последнее время получили распространение и некоторые другие способы (в том числе и без разложения соляной кислотой), также впрочем не свободные от недостатков. [c.743]
Наиболее распространенный в СССР способ определения механических примесей с разложением смазки кислотой (ГОСТ С479-53) не дает возможности открыть такие механические примеси, растворимые в соляной кислоте, как, например, известняк, мел, часто присутствующие в кальциевых консистентных смазках, приготовляемых с омылением известью, а также гипс, железо и пр. Поэтому за последнее время получили распространение и некоторые другие способы (в том числе и без разложения соляной кислотой), также впрочем не свободные от недостатков. [c.743]
Обычно централизованное предприятие по переработке фенолятов включает также установку для обжига известняка с целью приготовления оксида кальция и диоксида углерода, а также установку для переработки раствора соды, полученного при разложении фенолятов, путем обработки его оксидом кальция с получением раствора NaOH. [c.351]
При температуре около 900 К начинается разложение СаСОз, входящего в состав известняка или мела [c. 83]
83]
Использо1,ание электромагнитного излучения в данном процессе способствует повышению конверсии сырья, увеличению скорости разложения, созданию энергосберегающего, экологически безопасного процесса разложения известняка (мела) с образованием оксида кальция и углекислого газа. [c.9]
Образование карбоната кальция с очень низкой растворимостью происходит на всех открытых поверхностях гидроокиси кальция, которая в результате покрывается плотной коркой компактного зернистого карбоната. Эта корка действует как защитный изолирующий инертный слой, который под влиянием дальнейшей диффузии двуокиси углерода увеличивается в толщине твердой массы. Реакция с двуокисью углерода образует кальцит или известняк, являющийся естественным и безвредным компонентом окружающей среды. Процесс карбонизации in-situ имеет решающее значение для долгосрочных характеристик мест, обработанных методом D R, а та1 же для микробиологического разложения определенных загрязнявзщих веществ, осумкованных и связанных внутри материала D R. Гидрофобные свойства реагента D R противостоят растворению 1 идроокиси кальция с края обработанной массы материала, хотя карбонизация продолжается по мере поглощения двуокиси углеро а. Это означает, что вокруг обработанной массы образуется слой очень низкой растворимости. Соответственно, по мере развития карбонизации значение pH, будучи первоначально высоким (свыше 12), снижается. [c.246]
Гидрофобные свойства реагента D R противостоят растворению 1 идроокиси кальция с края обработанной массы материала, хотя карбонизация продолжается по мере поглощения двуокиси углеро а. Это означает, что вокруг обработанной массы образуется слой очень низкой растворимости. Соответственно, по мере развития карбонизации значение pH, будучи первоначально высоким (свыше 12), снижается. [c.246]
А. М. Дымов. Технический анализ руд и металлов. Металлургиздат, 1949, (483 стр.). Автор описывает экспрессные и арбитражные методы анализа различных материалов металлургического производства. Рассма риваются методы анализа железных, титиноиых и вольфрамовых руд, известняков п шлаков, ферросплавов, чугунов, спе-циал ,иых и обычных сталей. Рассмотрены методы анализа иикеля, медных и алюминиевых снланов и баббитов. В книге, кроме того, излагаются некоторые оби(ие вопросы, связанные с химико-аналитическим контролем производства, способы разложения материала и подготовки проб, а также краткие сведения о 1])изико-химических методах, применяе. мых ири анализе металлов и руд. [c.491]
мых ири анализе металлов и руд. [c.491]
Химический состав гранита. Каков минеральный состав гранита
Вы удивитесь, если узнаете, что гранитные массы составляют большую часть всего твердого вещества на планете Земля. Но являясь основанием земной коры, почти полностью сокрыты от наших глаз. Лишь гранитные скалы и открытые месторождения этой ценной породы дарят нам удовольствие использовать прочный, красивый материал в строительстве и отделке. Интересен и удивителен также сам состав гранита и физико-химические процессы его кристаллизации.
В образовании гранитной горной породы участвовало много стихий: высокое давление, температура в тысячи градусов и постепенное остывание в течении тысячелетий в глубинах земной коры. Именно благодаря уникальному процессу кристаллизации мы имеем удовольствие любоваться непревзойденной красотой этого натурального камня.
Каков же химический состав гранита?
В образовании гранитного массива, прочнейшей горной породы после алмаза, корунда и топаза, участвует множество химических элементов, среди которых выделяют основные, определяющие состав гранита:
- Железо
- Калий
- Марганец
- Алюминий
- Кремний
- Натрий
- Кальций
- Кислород
- Водород
В незначительных количествах встречаются также литий, хром, титан, вольфрам.
Входя в состав сложных химических соединений, перечисленные элементы образуют минералы, которые в виде спрессованных мелких зерен формируют знакомый нам гранит.
Минеральный состав гранита
Минералами принято называть однородные природные соединения (говоря простым языком, камни), имеющие в своем химическом составе только одно вещество.
В составе гранита мы находим:
Биотит — его меньше всего, от 5 до 10% от общей массы. Биотиты являются основным украшением гранитной породы: это знакомые всем блестящие слюды. Их вкрапления как раз и дарят взгляду волшебные переливы при изменении угла обзора. Формула биотита очень сложная, в его состав входят калий, марганец, железо, алюминий, водород и кислород.
В незначительном количестве в составе гранита встречается также мусковит (это тоже слюда) — камень самых разных оттенков, от молочно-желтого до серебристого и зеленого.
Кварц — те, кто хорошо помнит уроки химии, сразу скажут: это «природное стекло», или оксид кремния. Кварц составляет примерно 25-35% вещества гранитной породы.
Кварц составляет примерно 25-35% вещества гранитной породы.
Полевые шпаты — это собирательная группа, в которую входят кислые плагиоклазы и преимущественно калиевые полевые шпаты. Процентное содержание этой группы камней самое большое и составляет от 60 до 65%. В состав гранита минералы этой группы попали не зря: это наиболее распространенный камень, составляющий примерно 50% от всей массы земной коры.
Плагиоклаз — довольно интересный минерал в составе гранита. В чистом виде это камень с острыми косыми плоскостями спайности, благодаря чему греки его так и назвали: «косой камень». Формула его также очень интересна: Ca[Al2Si2O8]. Получается, большей частью это просто окислившиеся металлы и кремний.
Группа калиевых полевых шпатов — это четыре минерала, имеющих одинаковую формулу KAlSi3O8, но, благодаря разным условиям кристаллизации, получившим разную упорядоченность кристаллической решетки.
Что входит в состав гранита, можно примерно определить по его цвету и текстуре: ведь на каждом месторождении встречается абсолютно неповторимая горная порода со своим уникальным минеральным строением и химическим составом.
Как влияет состав гранита на его декоративность?
Марок гранита огромное множество, и каждый камень обладает уникальной расцветкой, структурой, зернистостью и текстурой.
Геологи условно разделяют гранитные породы на группы:
- Плагиограниты — в минеральном составе гранита преобладают именно плагиоклазы, «отвечающие» за светло-серый цвет камня. Малое количество полевых шпатов лишь слегка может окрасить камень в светло-розовый оттенок.
- Аляскиты — преимущественно минеральный состав гранита сложен из калиево-натриевых полевых шпатов с небольшими примесями биотитов. Аляскиты в чистом виде имеют розовый цвет.
Однако мы знаем на практике, что цветовая гамма гранитных пород значительно шире. Все верно, разнообразнейшие цвета и оттенки получаются благодаря незначительным примесям окислов металлов, окрашивающих минералы в несвойственные им цвета.
Благодаря таким «добавкам» в минеральный состав гранита мы можем видеть породы всех цветов:
- Черные — марки Absolut Black или Black Galaxy, Габбро.

- Красные — Империал Рэд, Капустинский, Лезниковский.
- Желтые — Сансет Голд, Кристал Еллоу.
- Зеленые — Green Ukraine, Маславский (Verde Oliva), Батерфляй Грин.
- Синие — Ультрамарин, Содалит Блю, Азул Макаубас.
- Цветные — крупнозернистые или мелкозернистые, с самыми неожиданными сочетаниями цветов. Например, Дидковичский, Южно-Султаевский, Бэйнбук Браун.
Огромное разнообразие натуральных камней в месторождениях по всему миру получено благодаря уникальному химическому составу гранита. Природа создавала кристаллизовавшиеся массы по особым «рецептам» и для каждой марки минеральный состав гранита совершенно неповторим.
А что еще входит в состав гранита?
Альтернативная классификация гранитов по принципу, что входит в состав гранита — магма или осадочные породы, широко используется за рубежом и сводится к выделению 4 групп:
- S — считается, что гранитные породы этой группы сложены из продуктов плавления метаосадочных субстратов.

- I — эту группу составляют оплавленные метамагматические субстраты.
- M — кристаллизовавшиеся толеит-базальтовые магмы.
- А — к дифференциатам магмы щелочно-бальзатоидного состава добавляются оплавленные нижнекоровые гранулиты.
Ученые до настоящего времени ведут жаркие споры по поводу происхождения удивительного в самом деле камня, который, кстати, встречается только на Земле. До сих пор досконально не изучены физико-химические процессы кристаллизации, а также истинное происхождение кристаллизовавшихся масс.
Но будь это видоизмененные осадочные породы или застывшие магматические массы, граниты поражают своей неповторимой красотой и высокой прочностью, благодаря чему широко используются в декоративной отделке.
Великая загадка: почему минералы в составе гранита имеют именно такое соотношение?
Еще один удивительный факт, ставящий в тупик практически всех геологов и химиков, может поразить кого угодно. Ведь если следовать общепринятой теории плавления твердого корового вещества, при образовании низкокалиевого гранитного материала, который составляет всего 20% от общей массы, должно остаться 80% твердого остатка, в котором нет воды. Это должны быть минералы: пироксен, тот же плагиоклаз или гранат. Но при исследованиях такие слои не обнаружены!
Ведь если следовать общепринятой теории плавления твердого корового вещества, при образовании низкокалиевого гранитного материала, который составляет всего 20% от общей массы, должно остаться 80% твердого остатка, в котором нет воды. Это должны быть минералы: пироксен, тот же плагиоклаз или гранат. Но при исследованиях такие слои не обнаружены!
Что таят глубины земной коры с огромными слоями гранитной породы, остается только предполагать. Одно только неоспоримо: состав гранита поистине неповторим, если найти похожие породы на других планетах ученым до сих пор не удалось.
Производство | Иссинский КСМ
Производство
Иссинский карьер представляет собой внушительную горную выработку с залежами известняка с примесью доломита.
Размер карьера — 1,2 км х 0,6 км. Глубина достигает 89 м.
Запасы месторождения превышают 93 834 тыс. куб.м.
По оценке специалистов запасов должно хватить не менее, чем на 300 лет работы.
Известня́к представляет собой горно-осадочную породу органического происхождения ( реже хемогенного происхождения), состоящую преимущественно из карбоната кальция (CaCO3) в виде кристаллов кальцита различного размера.
Является одним из наиболее востребованных строительных материалов и широко применяется для производства известнякового щебня.
Доломит представляет собой карбонат магния и кальция. Его формула — CaCO3•MgCO3.
Реальный состав практически полностью соответствует теоретическому: 45% углекислого газа, 30% оксида кальция и 20% оксида магния.
Также в нем могут присутствовать примеси железа, калия и других металлов.
Свое название он получил по фамилии первооткрывателя – француза Д. Доломье.
Доломит с химической точки зрения похож на кальцит. От последнего он отличается более интенсивным блеском и плохой растворимостью. Окончательно отличить доломит от известняка можно только с помощью специальных химических опытов.
Разработка карьера и добыча известняка.
Добыча известняка осуществляется методом карьерных разработок.
Разработка карьера ведется открытым способом с применением буро-взрывных работ в соответствии с планом горных работ.
Для улучшения качества продукции проводится селективная выемка горной массы на этапе добычи.
Добыча сырья, как и удаление верхних наносных пород (вскрышные работы), производятся экскаваторами. Полученная масса вывозится с карьера грузовым автотранспортом.
Наличие собственного парка современной специальной карьерной техники позволяет осуществлять круглогодичную добычу и перемещение горной массы с минимальными затратами.
Транспортировка
Разрыхленные взрывом карбонатные породы транспортируется из карьера на самосвалах в места его дальнейшей переработки – дробильно-сортировочные площадки.
Дробильно-сортировочный цех
Количество площадок дробильно-сортировочного цеха — 4.
В дробильно –сортировочном цехе получаем первый товарный продукт – щебень.
Объем производства достигает – 600 000 тн/год ( данные на 2019 г. )
Объем переработанной горной массы достигает — 480 000 куб.м./год ( данные на 2019 г. )
Продукт выпускается согласно ГОСТ 8267-93 и ГОСТ 32703-2014
Отсев, получаемый в процессе производства выступает сырьем для высококачественных продуктов: минерального порошка и известняковой доломитовой муки.
Объем производства минерального порошка достигает более 70 000 тн/год ( данные на 2019 г. )
Продукт выпускается с четким соблюдением требований ГОСТ 32761-2014 путем помола и высушивания отсева дробления фракции 0-10 мм.
Доломитовая мука выпускается согласно ГОСТ 14050-93 и ТУ 21-РСФСР-557-87
Отгрузка происходит:
- В биг-бэги (от 200 кг до 1000 кг)
Хранение и складирование
Для хранения большого объема продуктов предусмотрены складские площади:
- склады открытого типа для хранения щебня
Объем 25 000 тн - силосы для минерального порошка
Объем 1 500 куб. м.
м.
Склады расположены на территории производства, что обеспечивает бесперебойную ежедневную отгрузку партнерам.
Руководство компании большое внимание уделяет обновлению и модернизации материально-технической базы.
За последние 5 лет приобретено значительное количество современной карьерной спецтехники:
- погрузчики
- бульдозеры
- гидравлические экскаваторы
- самосвалы
- автокран
Британская ассоциация извести (BLA), входящая в Ассоциацию минеральных продуктов (MPA)
Известняк / мел
- Химическая формула: CaCO 3 (карбонат кальция)
- Молекулярная масса: 100,09
- Разлагается при прокаливании при 900 ° C с образованием оксида кальция
Прокаливание (или сжигание)
Горение известняка / мела происходит примерно при 1000 ° C. Реакция термического разложения карбоната кальция следующая:
Реакция термического разложения карбоната кальция следующая:
CaCO 3 + тепло ↔CaO + CO 2
100 г 56 г 44 г
В результате химической реакции образуется негашеная известь.Разные печи используются для разных типов известняка / мела и для разных типов продуктов (подробнее см. «Как производится извести»).
Известь негашеная
- Химическая формула: CaO
- Молекулярная масса: 56,08
- Плавится при 2614 ° C, кипит при 2850 ° C
- Гидратация (или гашение)
Основным компонентом негашеной извести является оксид кальция. Его качество часто зависит от ряда определенных факторов, включая физические свойства, реактивность по отношению к воде и химический состав.Как наиболее доступная и недорогая щелочь, негашеная известь играет важную роль в широком спектре промышленных процессов.
Известь гидратированная
- Химическая формула: Ca (OH) 2
- Молекулярная масса: 74,09
- Разлагается при 580 ° C с образованием оксида кальция
Добавление воды к негашеной извести вызывает экзотермическую реакцию (выделяет тепло) и гашеная известь.
Реакция гидратации негашеной извести следующая:
CaO + H 2 0 = Ca (OH) 2 + тепло
Гидравлические установки относительно сложны и могут загружаться негашеной известью излишков. Гашеная известь, несмотря на свое название, по существу сухая и обычно содержит менее 1% непрореагировавшей воды. Приблизительно от 10% до 15% негашеной извести, производимой в развитых странах, превращается в гашеную известь (процент, который, вероятно, больше для стран, в которых нет крупной сталелитейной промышленности). Гашение извести включает в себя образование дисперсии гидроксида кальция в воде, в результате чего образуется продукт, известный как известковое молоко или известковая замазка.
Гашение извести включает в себя образование дисперсии гидроксида кальция в воде, в результате чего образуется продукт, известный как известковое молоко или известковая замазка.
Перекарбонизация
Процесс повторного карбонизации по существу противоположен процессу прокаливания / обжига. И негашеная, и гашеная известь при длительном воздействии воздуха начинают втягивать углекислый газ из атмосферы. Таким образом, это заменяет оксидный компонент химического вещества и возвращает известь примерно в исходное состояние — известняк или мел.
Формула выглядит следующим образом:
Ca (OH) 2 + CO 2 = CaCO 3 + H 2 O
Рикарбонизация может происходить в ряде продуктов на основе извести и во многих случаях оказывает положительное влияние. Например, когда процесс происходит в известковом растворе, он эффективно увеличивает прочность окончательного соединения и действует как самовосстанавливающийся раствор в случае появления трещин.
Формула карбоната кальция — использование, свойства, структура и формула карбоната кальция
Формула и структура: Химическая формула карбоната кальция — CaCO 3 , а его молярная масса равна 100.1 г / моль. Это соль, состоящая из двухвалентного катиона кальция (Ca 2+ ) и бидентатного карбонатного аниона (CO 3 2- ), в которой углерод связан с двумя атомами кислорода одинарными связями и одним атомом кислорода. через двойную связь.
Происхождение: Карбонат кальция в природе встречается в нескольких минеральных формах, включая чистый кальцит, арагонит и минералы ватерита, а также нечистые минералы — известняк, мел, мрамор и травертин.Он также является основным химическим компонентом яичной скорлупы, морских раковин, раковин устриц, раковин улиток, кораллов и т. Д.
Приготовление: Карбонат кальция получают в основном из различных природных минеральных источников при добыче и переработке. Его также получают путем химического синтеза путем реакции негашеной извести (оксида кальция, CaO) с водой с получением гидроксида кальция (Ca (OH) 2 ), который затем обрабатывают диоксидом углерода для осаждения соли карбоната кальция.
CaO + H 2 O → Ca (OH) 2
Ca (OH) 2 + CO 2 → CaCO 3 + H 2 O
Физические свойства: Чистый CaCO 3 представляет собой мелкий белый порошок без запаха.Он имеет плотность 2,71 г / мл и температуру плавления 1339 ° C в виде кальцита. Другая распространенная минеральная форма, арагонит, имеет плотность 2,83 г / мл и температуру плавления 825 ° C.
Химические свойства: Карбонат кальция не растворяется в воде и стабилен при нормальных температурах. При нагревании до высоких температур он разлагается с образованием оксида кальция с выделением диоксида углерода.
CaCO 3 → CaO + CO 2
CaCO 3 также выделяет диоксид углерода при реакции с кислотами.Карбонат кальция реагирует с водой, содержащей диоксид углерода, с образованием водорастворимой соли бикарбоната кальция (Ca (HCO 3 ) 2 ).
Использование: Основное применение карбоната кальция — это строительные материалы, керамическая плитка, мел для школьных досок, очистка железной руды, жидкости для бурения нефтяных скважин, краски, клеи и герметики. Он также имеет несколько медицинских применений, таких как антацид, пищевая добавка с кальцием, фармацевтический наполнитель в таблетках и лечение гемодиализом. Он также используется в качестве пищевого консерванта и в зубных пастах.
Он также имеет несколько медицинских применений, таких как антацид, пищевая добавка с кальцием, фармацевтический наполнитель в таблетках и лечение гемодиализом. Он также используется в качестве пищевого консерванта и в зубных пастах.
Воздействие на здоровье / опасность для здоровья: Карбонат кальция не токсичен и безопасен для употребления. Однако избыточное потребление кальция может привести к гиперкальциемии или молочно-щелочному синдрому, который включает такие симптомы, как боль в животе и рвота, а в серьезных случаях может привести к летальному исходу.
Известняковый цикл — Известняк [только для GCSE Chemistry] — GCSE Chemistry (Single Science) Revision — WJEC
Карбонат кальция
Карбонат кальция, оксид кальция и гидроксид кальция — все они производятся из известняка и имеют важные применения, поэтому важно: знаю, как они сделаны.
22dcql4stes.0.0.0.1:0.1.0.$0.$1.$3″> Карбонат кальция содержится в известняке. Когда известняк сильно нагревается, карбонат кальция, который он содержит, поглощает тепло (эндотермический) и разлагается с образованием оксида кальция. На это указывает оранжевое свечение, когда известняк нагревается.карбонат кальция → оксид кальция + диоксид углерода
CaCO 3 (s) → CaO (s) + CO 2 (г)
Оксид кальция (также известный как негашеная известь ) является ключевым ингредиентом изготовление цемента, а также используется для изготовления некоторых видов штукатурки.
Оксид кальция
22dcql4stes.0.0.0.1:0.1.0.$0.$2.$1″> Оксид кальция реагирует с несколькими каплями воды с образованием гидроксида кальция, который является щелочью. Это экзотермическая реакция, на которую указывает превращение воды в пар. Твердое вещество остается белым, но при добавлении воды рассыпается в порошок.оксид кальция + вода → гидроксид кальция
CaO (s) + H 2 O (l) → Ca (OH) 2 (s)
гидроксид кальция
гидроксид кальция (также известный как гашеная известь ) используется для нейтрализации избыточной кислотности, например, в озерах и почвах, пострадавших от кислотных дождей.
Гидроксид кальция растворяется в избытке воды с образованием раствора гидроксида кальция ( известковая вода ), который используется для проверки на диоксид углерода. Двуокись углерода реагирует с гидроксидом кальция с образованием белого карбоната кальция, который нерастворим, и поэтому известковая вода становится «молочной».
гидроксид кальция + диоксид углерода → карбонат кальция + вода
Ca (OH) 2 (водн.) + CO 2 (г) → CaCO 3 (т) + H 2 O (л)
0.0.1:0.1.0.$0.$3.$6″> Все эти реакции связаны вместе и образуют цикл известняка .Известняк Химические компоненты | Sciencing
Известняк — это осадочная порода, состоящая в основном из карбоната кальция (CaCO3). Однако, согласно Британской энциклопедии, он также может содержать карбонат магния, глину, карбонат железа, полевой шпат, пирит и кварц в незначительных количествах. Большинство видов известняка имеют зернистую структуру. Часто зерна представляют собой микроскопические фрагменты панцирей ископаемых животных. Кальцит, арагонит, травертин, туф, калиш, мел, спарит и микрит — это некоторые разновидности известняка.
Карбонат кальция
Карбонат кальция составляет более 4 процентов земной коры, по данным Ассоциации промышленных минералов Северной Америки. Карбонат кальция реагирует с кислотами с образованием диоксида углерода. Соединение также является основным компонентом сталактитов и сталагмитов, которые представляют собой пещерные образования, созданные капающей водой. Карбонат кальция широко используется в производстве бумаги, пластмасс, красок и покрытий. Он может составлять до 30 процентов красок по весу.Карбонат кальция также важен в строительной отрасли как компонент цемента.
Карбонат кальция широко используется в производстве бумаги, пластмасс, красок и покрытий. Он может составлять до 30 процентов красок по весу.Карбонат кальция также важен в строительной отрасли как компонент цемента.
Карбонат магния
Карбонат магния — это соединение, которое в основном встречается в природе как минеральный магнезит. Это также важный компонент доломитового или магнезиального известняка, составляющий от 4,4 до 22 процентов этих известняков. Доломитовый известняк используется в сталелитейной промышленности. Он используется как нейтрализующий агент при очистке воды и как источник извести и магнезии в промышленности стекловолокна.
Карбонат железа
Карбонат железа, также называемый сидеритом, представляет собой соединение, которое можно найти в известняке, но только в небольших количествах. Это часто связано с карбонатом кальция. Карбонат железа — ценный источник железа, содержащий 48 процентов этого элемента. Он часто встречается в осадочных отложениях и в метаморфизованных осадочных породах. В чистом виде он имеет стекловидное тело и шелковистый вид.
Он часто встречается в осадочных отложениях и в метаморфизованных осадочных породах. В чистом виде он имеет стекловидное тело и шелковистый вид.
Прочие компоненты
Незначительные химические компоненты известняка включают глину, полевой шпат, пирит и кварц.Полевой шпат кристаллизуется из магмы, поэтому чаще встречается в вулканических породах. Полевой шпат широко используется в керамической, клеевой и стекольной промышленности. Известняк, содержащий пирит, встречается редко, но был обнаружен в Падапакара, Индия. Кварц и глина чаще ассоциируются с известняком.
Химия карбонатов — Science Learning Hub
Карбонат кальция является основным минеральным компонентом известняка. Его химические и физические свойства лежат в основе современного использования известняка, а также уникальных известняковых пейзажей сельской местности.
Карбонат кальция — минеральные формы
Основным минеральным компонентом известняка является кристаллическая форма карбоната кальция, известная как кальцит. Хотя кристаллы кальцита принадлежат к тригональной кристаллической системе, показанной ниже, обнаружено большое разнообразие форм кристаллов.
Хотя кристаллы кальцита принадлежат к тригональной кристаллической системе, показанной ниже, обнаружено большое разнообразие форм кристаллов.
Одиночные кристаллы кальцита обладают оптическим свойством, называемым двойным лучепреломлением (двойное лучепреломление). Это сильное двойное лучепреломление заставляет объекты, просматриваемые через прозрачный кусок кальцита, казаться двойными.
Другая минеральная форма карбоната кальция называется арагонитом.Его кристаллическая решетка отличается от кристаллической решетки кальцита, что приводит к другой форме кристалла — орторомбической системе с кристаллами игольчатой формы.
Растворимость
Карбонат кальция имеет очень низкую растворимость в чистой воде (15 мг / л при 25 ° C), но в дождевой воде, насыщенной диоксидом углерода, его растворимость увеличивается из-за образования более растворимого бикарбоната кальция. Карбонат кальция необычен тем, что его растворимость увеличивается с понижением температуры воды.
Повышенная растворимость карбоната кальция в дождевой воде, насыщенной углекислым газом, является движущей силой эрозии известняковых пород, приводящей к образованию в течение длительного времени каверн, пещер, сталагмитов и сталактитов.Дождевая вода является слабокислой, и когда она встречается с известняком, часть карбоната кальция вступает в реакцию с образованием раствора бикарбоната кальция.
CaCO 3 ( с ) | + | CO 2 ( г ) | + | 2 O0006 9000 ) | → | Ca (HCO 3 ) 2 ( водн. ) |
В течение долгого времени эта продолжающаяся дождевая вода растворяет часть известняка, образуя подземные части. пещеры и пещеры.Образование сталактитов и сталагмитов фактически является обращением этого процесса растворения в том смысле, что богатая бикарбонатом вода, которая капает с потолка пещеры, частично испаряется, оставляя после себя отложения карбоната кальция. | ||||||
Ca (HCO 3 ) 2 ( вод. ( г ) | + | H 2 O ( л ) | ||||
Термическое разложение
При нагревании выше 840 ° C карбонат кальция разлагается с выделением углекислого газа и оставив после себя оксид кальция — белое твердое вещество.
CaCO 3 ( с ) | → | CO 2 ( г ) | + | с | CaO 9025 |
Оксид кальция известен как известь и является одним из 10 основных химических веществ, ежегодно производимых термическим разложением известняка.
Термическое разложение карбоната кальция до извести — одна из старейших известных химических реакций.В течение нескольких тысяч лет известь использовалась в качестве раствора (пасты из извести, песка и воды) для цементирования камней в зданиях, стенах и дорогах. При схватывании строительного раствора происходит несколько химических реакций.
При схватывании строительного раствора происходит несколько химических реакций.
Сначала известь «гашится» водой с образованием гидроксида кальция (гашеная известь
CaO ( s ) | + | H 2 O ( л ) | → | Ca (OH) 2 ( s ) |
Со временем это реагирует с диоксидом углерода в воздухе с образованием кристаллов карбонат кальция, который соединяет песчинки вместе, образуя твердый скальный материал.
Ca (OH) 2 ( с ) | + | CO 2 ( г ) |
Реакция с кислотами, как карбонаты всех металлов карбонат кальция реагирует с кислыми растворами с образованием газообразного диоксида углерода.
Карбонат известняка, в основном состоящий из карбоната кальция веками использовался в сельском хозяйстве.Его разбрасывают на полях, чтобы нейтрализовать кислотные соединения в почве и обеспечить кальций, который является важным питательным веществом для растений. Сегодня, в зависимости от требований к почве, фермерам доступны следующие варианты:
В медицине антациды, содержащие небольшое количество карбоната кальция, используются для лечения «кислого желудка».
Что такое известь: лайм против известнякаРазница между известью и известняком Известь — это универсальный химикат, имеющий множество применений. Что такое лайм? Известь обычно обозначается несколькими терминами, включая негашеную известь, оксид кальция, известь с высоким содержанием кальция или доломитовую известь.Все относятся к одному и тому же материалу — извести. Доломитовая известь содержит оксид магния (MgO), полученный из-за присутствия карбоната магния (MgCO3) в исходном камне, называемом доломитовым известняком. Доломитовый известняк содержит две формы карбоната: карбонат кальция и карбонат магния. Известь с высоким содержанием кальция — это почти чистый карбонат кальция. Приступим.Запрос цитаты. Использование известиЕще в 4000 г. до н.э. древние египтяне использовали негашеную известь после смешивания ее с водой в качестве строительного материала для строительства пирамид.Сегодня негашеная известь — это широко используемое химическое соединение. Использование извести окружает нашу повседневную жизнь, делая воду, которую мы пьем, безопасной, воздух, которым мы дышим, чище, нашу сталь чище, а строительные проекты более стабильными. Это касается производства стекла, бумаги, сельскохозяйственных технологий, химических процессов, штукатурки, строительного раствора и других строительных материалов и многих других. В строительстве реагенты на основе извести и извести могут сушить влажную почву, чтобы исключить простои, повысить производительность и сохранить выполнение проектов.Они быстро модифицируют слабые почвы, делая работу чище, безопаснее, быстрее и проще. Модификация почвы обеспечивает улучшенную рабочую платформу, которая удерживает материалы на рабочем месте. При восстановлении окружающей среды реагенты на основе извести и извести сушат, отверждают и фиксируют потоки опасных и неопасных отходов.Они регулируют pH для захвата тяжелых металлов, снижая растворимость. В продуктах, полученных из извести, образуется пуццолановая матрица, которая предотвращает подвижность металлов, а регулировка высокого pH захватывает тяжелые металлы, снижая их растворимость. Потоки отходов можно сушить и укреплять с помощью известковых продуктов, чтобы соответствовать требованиям для захоронения мусора (RCRA). Как делают лаймВ начале Перед добычей известняка необходимо сначала провести геологический и химический анализ, чтобы определить, подходит ли интересующий камень для производства извести. КалибрПосле того, как известняк добыт, его необходимо измельчить и получить однородный размер, чтобы конечный продукт был однородным. ПрокаливаниеПосле измельчения и калибровки известняк подается в печи, где его кальцинируют, в основном варят, при температурах до 2000 градусов по Фаренгейту.Во время этого процесса сильная жара заставляет известняк химически выделять диоксид углерода (CO2). Конечный результат — лайм. ПродуктыИзвести можно производить в различных конечных продуктах.
ХранилищеЕсть несколько способов хранения извести. В зависимости от необходимого объема продукта, доступного пространства и конкретных требований на рабочем месте продукты на основе извести можно хранить в: силосах, переносных хранилищах, называемых PIGS, бункерах, супер мешках или мешках 40 # и 80 #. Независимо от условий хранения, воздух и воду следует держать вдали от продуктов, поскольку они вступают в реакцию с диоксидом углерода и влагой. Меры предосторожностиКак и с любым химическим веществом, с известью нужно обращаться осторожно. При правильном обращении известь — очень безопасный продукт. При работе с известью необходимо соблюдать несколько мер предосторожности.
|



 м.
м. Именно эта реакция вызывает шипение известняка, когда на его поверхность наносится разбавленная соляная кислота.
Именно эта реакция вызывает шипение известняка, когда на его поверхность наносится разбавленная соляная кислота. Происходящая химическая реакция включает нейтрализацию избытка кислоты карбонатом кальция. Такие бренды, как Quick-Eze и TUMS, используют карбонат кальция в качестве «активного» ингредиента.
Происходящая химическая реакция включает нейтрализацию избытка кислоты карбонатом кальция. Такие бренды, как Quick-Eze и TUMS, используют карбонат кальция в качестве «активного» ингредиента. Эти названия часто основаны на том, как образовалась скала, ее
внешний вид, состав или физические свойства.Вот некоторые из наиболее часто встречающихся типов известняка.
Эти названия часто основаны на том, как образовалась скала, ее
внешний вид, состав или физические свойства.Вот некоторые из наиболее часто встречающихся типов известняка.
 Некоторые могут назвать этот материал «кристаллическим известняком», однако собственное название — мрамор. Если вы внимательно посмотрите на этот камень на глаз или, что лучше, в ручную линзу, вы ясно увидите грани спайности кальцита, пересекающиеся под ромбическими углами.Показанный здесь камень имеет диаметр около четырех дюймов (десять сантиметров).
Некоторые могут назвать этот материал «кристаллическим известняком», однако собственное название — мрамор. Если вы внимательно посмотрите на этот камень на глаз или, что лучше, в ручную линзу, вы ясно увидите грани спайности кальцита, пересекающиеся под ромбическими углами.Показанный здесь камень имеет диаметр около четырех дюймов (десять сантиметров). Он состоит из карбоната кальция (CaCO 3 ) и обычно содержит другие минералы, которые могут включать глинистые минералы, слюды, кварц, пирит, оксид железа и графит.
Он состоит из карбоната кальция (CaCO 3 ) и обычно содержит другие минералы, которые могут включать глинистые минералы, слюды, кварц, пирит, оксид железа и графит.
 В 1900 году NOAA выпустила около 100 000 литографических отпечатков с использованием этого метода. Кадр из изображения в архиве NOAA.
В 1900 году NOAA выпустила около 100 000 литографических отпечатков с использованием этого метода. Кадр из изображения в архиве NOAA. В конечном итоге литографическая печать была сделана с использованием высокоскоростных печатных машин, в которых изображение наносилось на металлические ролики и переносилось на листы или рулоны бумаги по мере их прохождения через печатную машину.
В конечном итоге литографическая печать была сделана с использованием высокоскоростных печатных машин, в которых изображение наносилось на металлические ролики и переносилось на листы или рулоны бумаги по мере их прохождения через печатную машину.

 Иногда на качественный материал можно нанести полироль. Материал можно узнать по его низкой твердости (3 балла по шкале Мооса), полосатому виду и пористой текстуре.
Иногда на качественный материал можно нанести полироль. Материал можно узнать по его низкой твердости (3 балла по шкале Мооса), полосатому виду и пористой текстуре. Самые впечатляющие элементы из туфа на озере известны как «башни из туфа». Они образуются в результате взаимодействия пресноводных источников и щелочной воды озера.
Самые впечатляющие элементы из туфа на озере известны как «башни из туфа». Они образуются в результате взаимодействия пресноводных источников и щелочной воды озера. Из этих образцов можно сделать необычные и красивые органические драгоценные камни. Этот кабошон имеет площадь около 39 квадратных миллиметров и вырезан из материала, найденного в Китае.
Из этих образцов можно сделать необычные и красивые органические драгоценные камни. Этот кабошон имеет площадь около 39 квадратных миллиметров и вырезан из материала, найденного в Китае.

 Он также добавляется в корм некоторым молочным скотам, которым необходимо восполнить большое количество кальция, теряемого при доении животного.
Он также добавляется в корм некоторым молочным скотам, которым необходимо восполнить большое количество кальция, теряемого при доении животного.
 Это жизненно важно при производстве бесчисленных материалов. Известь или оксид кальция (CaO) получают из высококачественных природных отложений известняка или карбоната кальция (CaCO3). Известняк — это осадочная порода, образовавшаяся миллионы лет назад в результате накопления ракушек, кораллов, водорослей и других обломков океана. Известь образуется, когда известняк подвергается воздействию высоких температур, в результате чего карбонат кальция превращается в оксид кальция.
Это жизненно важно при производстве бесчисленных материалов. Известь или оксид кальция (CaO) получают из высококачественных природных отложений известняка или карбоната кальция (CaCO3). Известняк — это осадочная порода, образовавшаяся миллионы лет назад в результате накопления ракушек, кораллов, водорослей и других обломков океана. Известь образуется, когда известняк подвергается воздействию высоких температур, в результате чего карбонат кальция превращается в оксид кальция.
 Продукты, полученные на основе извести, также можно использовать для стабилизации почв, обеспечивая длительный и постоянный прирост прочности. Такое увеличение прочности может привести к более тонкому слою дорожного покрытия, если это будет учтено в проекте, что сэкономит деньги подрядчикам и позволит DOT, генеральным подрядчикам и владельцам проектов использовать средства в других местах.
Продукты, полученные на основе извести, также можно использовать для стабилизации почв, обеспечивая длительный и постоянный прирост прочности. Такое увеличение прочности может привести к более тонкому слою дорожного покрытия, если это будет учтено в проекте, что сэкономит деньги подрядчикам и позволит DOT, генеральным подрядчикам и владельцам проектов использовать средства в других местах. Известняк, не отвечающий требованиям химического состава, предназначен для использования в качестве заполнителя и наполнителя на ряде других рынков. Известняк, который считается приемлемым, затем добывается в карьере или добывается из земли, прежде чем он будет измельчен и калиброван.
Известняк, не отвечающий требованиям химического состава, предназначен для использования в качестве заполнителя и наполнителя на ряде других рынков. Известняк, который считается приемлемым, затем добывается в карьере или добывается из земли, прежде чем он будет измельчен и калиброван.
 Этот сыпучий продукт предлагает решение для клиентов, которым требуется жидкость или если они особенно озабочены пылью.
Этот сыпучий продукт предлагает решение для клиентов, которым требуется жидкость или если они особенно озабочены пылью.