Хром
| Хром / Chromium (Cr) | |
|---|---|
| Атомный номер | 24 |
| Внешний вид простого вещества |
твёрдый металл голубовато-белого цвета |
| Свойства атома | |
|
Атомная масса (молярная масса) |
51,9961 а. е. м. (г/моль) |
| Радиус атома | 130 пм |
|
Энергия ионизации (первый электрон) |
652,4 (6,76) кДж/моль (эВ) |
| Электронная конфигурация |
[Ar] 3d5 4s |
| Химические свойства | |
| Ковалентный радиус | 118 пм |
| Радиус иона | (+6e)52 (+3e)63 пм |
|
Электроотрицательность (по Полингу) |
1,66 |
| Электродный потенциал | -0.74 |
| Степени окисления | 6, 3, 2, 0 |
| Термодинамические свойства простого вещества | |
| Плотность | 7,18 г/см³ |
| Молярная теплоёмкость | 23,3 Дж/(K·моль) |
| Теплопроводность | 93,9 Вт/(м·K) |
| Температура плавления | 2130 K |
| Теплота плавления | 21 кДж/моль |
| Температура кипения | 2945 K |
| Теплота испарения | 342 кДж/моль |
| Молярный объём | 7,23 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая объёмноцентрированая |
| Параметры решётки | 2,885 Å |
| Отношение c/a | — |
| Температура Дебая | 460 K |
| Cr | 24 |
| 51,9961 | |
| [Ar]3d54s1 | |
| Хром | |
Хром —элемент побочной подгруппы шестой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 24. Обозначается символом Cr (Chromium). Простое вещество хром (CAS-номер: 7440-47-3) — твёрдый металл голубовато-белого цвета.
И. Менделеева, атомный номер 24. Обозначается символом Cr (Chromium). Простое вещество хром (CAS-номер: 7440-47-3) — твёрдый металл голубовато-белого цвета.
История
Схема атома хрома
В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный свинец», PbCrO4. Современное название — крокоит. В 1797 французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего Воклен получил карбид хрома).
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
Добыча
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 млн. т (или 1 место в мире)
Получение
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
- FeO · Cr2O3 + 4C → Fe + 2Cr + 4CO↑
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата углём:
- Na2Cr2O7 + 2C → Cr2O3 + Na2CO3 + CO↑
5) с помощью алюминотермии получают металлический хром:
- Cr2O3+ 2Al → Al2O3 + 2Cr + 130 ккал
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты.
- восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
- разряд ионов водорода с выделением газообразного водорода;
- разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
- Cr2O72− + 14Н+ + 12е− = 2Cr + 7H2O
Физические и химические свойства
В свободном виде — голубовато-белый металл с кубической объемно-центрированной решеткой, а = 0,28845 нм. При температуре 39 °C переходит из парамагнитного состояния в антиферромагнитное (точка Нееля).
Хром является самым твердым металлом (твердость по шкале Мооса 8.5).
Устойчив на воздухе. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами. Сплавляя Cr2O3 со щелочами получают хромиты:
- Cr2O3 + 2NaOH → 2NaCrO2 + H2O.
Непрокаленный оксид хрома(III) легко растворяется в щелочных растворах и в кислотах:
- Cr2O3 + 6HCl → 2CrCl3 + 3Н2О.
При термическом разложении карбонила хрома Cr(СО)6 получают красный основной оксид хрома(II) CrO. Коричневый или желтый гидроксид Cr(OH)2 со слабоосновными свойствами осаждается при добавлении щелочей к растворам солей хрома(II).
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
При взаимодействии концентрированной серной кислоты с растворами дихроматов образуются красные или фиолетово-красные кристаллы оксида хрома(VI) CrO Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие.
Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие.
Известны галогениды, соответствующие разным степеням окисления хрома. Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2 и тригалогениды CrF3, CrCl3, CrBr3 и CrI3. Однако, в отличие от аналогичных соединений алюминия и железа, трихлорид CrCl3 и трибромид CrBr3
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах. Известен гексафторид хрома CrF6.
Получены и охарактеризованы оксигалогениды хрома CrO2F2 и CrO2Cl2.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr
В растворах наиболее устойчивы соединения хрома(III). В этой степени окисления хрому соответствуют как катионная форма, так и анионные формы, например, существующий в щелочной среде анион [Cr(OH)6]3−.
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
- 2Na3[Cr(OH)6] + 3H2O2 → 2Na2CrO4 + 2NaOH + 8H2O.
Хрому(VI) отвечает ряд существующих только в водных растворах кислот: хромовая H2CrO4, дихромовая H2Cr2O7, трихромовая H3Cr3O10 и другие, которые образуют соли — хроматы, дихроматы, трихроматы и т. д.
д.
В зависимости от кислотности среды анионы этих кислот легко превращаются друг в друга. Например, при подкислении жёлтого раствора хромата калия K2CrO4 образуется оранжевый дихромат калия K2Cr2O7:
- 2K2CrO4 + 2HCl → K2Cr2O7 + 2KCl + Н2О.
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую так как снова образуется хромат калия K2CrO4:
- K2Cr2O7 + 2KOH → 2K2CrO4 + Н2О.
При добавлении к жёлтому раствору, содержащему хромат-ионы, раствора соли бария выпадает жёлтый осадок хромата бария BaCrO4:
- Ba2+ + CrO42- → BaCrO4↓.
Соединения хрома(VI) — сильные окислители, например:
- K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O.
Применение
Хром важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование). Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
Металлический хром практически нетоксичен, но металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты. Соединения хрома(VI) приводят к разным заболеваниям человека, в том числе и онкологическим. ПДК хрома(VI) в атмосферном воздухе 0,0015 мг/м³.
Соединения хрома(III) вызывают дерматиты. Соединения хрома(VI) приводят к разным заболеваниям человека, в том числе и онкологическим. ПДК хрома(VI) в атмосферном воздухе 0,0015 мг/м³.
Соединения хрома
Хромтау
Элементарная кристаллическая решетка — Большая Энциклопедия Нефти и Газа, статья, страница 2
Элементарная кристаллическая решетка
Cтраница 2
Центрами кристаллизации могут быть группы элементарных кристаллических решеток, неметаллические включения и тугоплавкие примеси. [16]
На рис. 22, а показана элементарная кристаллическая решетка твердого раствора замещения хрома в железе. Отдельные узлы в кристаллической решетке а-железа заняты ионами хрома. Ионы обоих металлов располагаются в узлах кристаллической решетки произвольно. [18]
На рис. 20, а показана элементарная кристаллическая решетка твердого раствора замещения хрома в железе. Отдельные узлы в кристаллической решетке а-железа заняты ионами хрома. Ионы обоих металлов располагаются в узлах кристаллической решетки в произвольном порядке. [20]
На рис. 31 изображены основные типы элементарных кристаллических решеток. [21]
На рис. 1 — 8 а показана элементарная кристаллическая решетка твердого раствора замещения хрома в железе. Отдельные узлы решетки железа замещены ионами хрома. Ионы обоих металлов располагаются в узлах кристаллической решетки в произвольном порядке, со средней статистической равномерностью. [23]
Образование полных кристаллов, которые состоят из одинаково ориентированных элементарных кристаллических решеток, происходит редко. [24]
[24]
Атомы ( ионы, молекулы), составляющие элементарную кристаллическую решетку, находятся в состоянии химического взаимодействия, образуя тот или иной тип связи. [25]
Моноарсенид гафния имеет гексагональную структуру типа TiP с параметрами элементарной кристаллической решетки: а 3 764, с 12 680 А, наименьшие расстояния между атомами в элементарной ячейке: Hf — Hf 3 40, Hf — As 2 62 и As — As 3 76 А. [26]
На рис. 1.1 показано расположение атомов ( ионов) в элементарных кристаллических решетках трех типов: кубической объемно-центрированной, кубической гранецентрированной и гексагональной. [27]
Концентрация, отвечающая нижней границе смешиваемости, может быть различной для разных систем, так как она зависит от степени сложности элементарной кристаллической решетки, от соотношения адсорбционных сил различных ионов и их концентраций в растворе. Увеличение концентрации сопряженного иона ( например, SOi — в системе КМпО4 — BaSO4 — Н2О) понижает нижнюю границу смешиваемости. Как показали качественные опыты по сокристаллизации BaSO4 с КМпО4, добавление посторонних ионов ( А13, Fe3, K и Н) повышает нижнюю границу смешиваемости. [28]
Во втором случае в связи с весьма незначительной взаимной растворимостью обеих фаз скррость комплексообразования близка к нулю и образование комплекса ограничивается зарождением на поверхности раздела фаз элементарной кристаллической решетки. Происходящая в это время на поверхности раздела фаз адсорбция молекул ингибиторов комплексообразования сокращает и без того чрезвычайно малую поверхность контакта двух фаз, величина которой во многом определяет скорость комплексообразования. И только в случае контакта без перемешивания углеводородной фазы и спиртового ( или спирто-водного с большой концентрацией спирта) раствора карбамида образуется комплекс, что объясняется относительно высокой взаимной растворимостью этих двух фаз и нейтрализующим действием спирта по отношению к ингибиторам комплексообразования. [29]
[29]
Образование реальных кристаллических структур не происходит без дефектов и отклонений от идеализированных структур, показанных на рис. 1.5 и 1.6. Дефекты носят точечный и линейный характер. Точечные дефекты присущи элементарным кристаллическим решеткам и весьма разнообразны. Наиболее часто встречающиеся точечные дефекты показаны на рис. 1.7 [1.2]: а — пустой узел или вакансия; б — междоузельный атом; в — вакансия и междо-узельный атом; г — примесный атом. Имеют место искажения и геометрической формы кристаллической решетки, вызванные спецификой технологии производства металлов. [30]
Страницы: 1 2 3
Для кристаллической решетки хрома определите координационное число
Для кристаллической решетки хрома определите координационное число | Материаловедение- Для кристаллической решетки хрома определите координационное число и рассчитайте коэффициент укладки. Покажите и определите индекс кристаллографических плоскостей и направлений легкого скольжения в решетки
- Объясните физическую природу явления полигонизации при нагреве холоднодеформированного металла. Опишите дислокационную структуру полигональных границ наклона и докажите, что дислокационная стенка является энергетически стабильной конфигурацией.
- Для заданного состава железоуглеродистого сплава (состав определяется из таблицы в зависимости от варианта) решить все перечисленные в третьем вопросе задачи. Составы и относительные весовые количества равновесных фаз определить для нормальной температуры.
- Углеродистые стали 40 и У8 после закалки и отпуска имеют структуру «мартенсит отпуска» и твердость НRС 52 и HRC 60 соответственно.
 Опишите превращения происходящие в этих сталях в процессе закалки и отпуска и на этой основе объясните, почему сталь У8 имеет большую твердость, чем сталь 40.
Опишите превращения происходящие в этих сталях в процессе закалки и отпуска и на этой основе объясните, почему сталь У8 имеет большую твердость, чем сталь 40. - Предложите и обоснуйте режим термической обработки белого чугуна с целью получения структуры зернистого перлита в металлической основе и графита хлопьевидной формы
- Для изготовления фрез выбрана сталь 9ХС. Укажите состав стали и группу по назначению. Предложите и обоснуйте режим термической обработки, объясните влияние легирования на превращения, происходящие на всех этапах обработки. Опишите конечную структуру и свойства стали. Предложите материал проволоки для намотки прецизионных реостатов. Обоснуйте свой выбор, укажите состав и группу сплава по назначению. Опишите структуру и электротехнические характеристики сплава
Кристаллический хромом — Справочник химика 21
Подобную же группу составляют, например, гексафториды серы, молибдена и урана. В каждой из этих групп увеличение молекулярного веса соединения связано с возрастанием энтропии. На рис. П1,5 подобное же сопоставление дано для энтропии (Sr) некоторых групп окислов металлов в кристаллическом состоянии. Здесь наблюдаются такие же закономерности, как и для энтропии газов. Отчетливо выделяется группа, линий моноокисей магния, кальция и бария,группа линий полуторных окислов алюминия, хрома и лантана и группа пятиокисей ниобия и тантала. В каждую из таких групп входят также не показанные на рисунке линии других однотипных с ними соединений. [c.101]Карбиды представляют собой кристаллические тугоплавкие вещества очень большой твердости. Так, карбиды вольфрама почти не уступают по твердости алмазу. Свойства карбидов хрома, молибдена и вольфрама приведены в табл. 23. [c.287]
Некоторые из предложенных объяснений склонности ферритных нержавеющих сталей к межкристаллитной коррозии основаны на разнице скоростей растворения различных образующихся карбидов или на предполагаемой большей реакционной способности напряженной кристаллической решетки металла.![]() Однако наиболее убедительное объяснение получено с помощью теории, широко используемой для объяснения этих явлений в аустенитных нержавеющих сталях. Согласно этой теории, разрушения происходят вследствие обеднения границ зерен хромом [36—38]. Различия в температурах и времени, необходимых для сенсибилизации этих сталей, объясняются более высокими скоростями диффузии углерода, азота и хрома в ферритной объемно-центрированной кубической решетке по сравнению с аустенитной гранецентрированной. В соответствии с этим, карбиды и нитриды хрома, которые растворены при высокой температуре, ниже [c.310]
Однако наиболее убедительное объяснение получено с помощью теории, широко используемой для объяснения этих явлений в аустенитных нержавеющих сталях. Согласно этой теории, разрушения происходят вследствие обеднения границ зерен хромом [36—38]. Различия в температурах и времени, необходимых для сенсибилизации этих сталей, объясняются более высокими скоростями диффузии углерода, азота и хрома в ферритной объемно-центрированной кубической решетке по сравнению с аустенитной гранецентрированной. В соответствии с этим, карбиды и нитриды хрома, которые растворены при высокой температуре, ниже [c.310]
Блестящие, твердые осадки хрома, получаемые в этих условиях, очень пористы и имеют сетку трещин. Растрескивание осадка происходит за счет больших внутренних напряжений, которые возникают при уменьшении объема осадка (сжатие) вследствие перехода неустойчивой гексагональной кристаллической решетки металла в более устойчивую кубическую объемно-центрированную решетку. [c.420]
В сплавах внедрения атомы растворенного вещества образуют дополнительные связи с соседними атомами по сравнению с чистым растворителем, а это приводит к тому, что кристаллическая решетка сплава становится тверже, прочнее и менее пластичной. Например, железо, содержащее менее 3% углерода, намного тверже чистого железа и приобретает значительно большую прочность на растяжение, а также другие ценные физические свойства. Так называемые мягкие (малоуглеродистые) стали содержат менее 0,2% углерода они обладают высокой пластичностью и ковкостью и используются для изготовления кабелей, гвоздей и цепей. Средние (углеродистые) стали содержат 0,2-0,6% углерода, они жестче мягких сталей и используются для изготовления балок и рельсов. Высокоуглеродистые стали, применяемые для изготовления нож-нгщ, режущих инструментов и пружин, содержат 0,6-1,5% углерода. При введении в стали других элементов получают различные легированные стали. Одним из наиболее известных сплавов такого типа является нержавеющая сталь, содержащая 0,4% углерода, 18% хрома и 1% никеля. Сплавы типа твердых растворов отличаются от обычных химических соединений тем, что имеют произвольный, а не постоянный состав. Отношение содержания неметаллических элементов к металлическим может варьировать в них в широких пределах, что позволяет придавать этим материалам самые разнообразные физические и химические свойства. [c.364]
Сплавы типа твердых растворов отличаются от обычных химических соединений тем, что имеют произвольный, а не постоянный состав. Отношение содержания неметаллических элементов к металлическим может варьировать в них в широких пределах, что позволяет придавать этим материалам самые разнообразные физические и химические свойства. [c.364]
Лиганды, находящиеся в левой части спектрохимического ряда, называются лигандами слабого поля или просто слабыми лигандами. Те лиганды, которые находятся в правой части спектрохимического ряда, называются лигандами сильного поля или сильными лигандами. На рис. 23.27 схематически показано, что происходит с энергией расщепления кристаллическим полем при изменении лигандов в ряду нескольких комплексов хрома(Ш). (Здесь уместно напомнить, что при последовательной ионизации атома переходного металла первыми отрываются валентные -электроны. Поэтому атом хрома имеет электронную конфигурацию [Аг] 45 3 , а ион Сг имеет конфигурацию [Аг] 3 .) Отметим, что с усилением поля, действующего на ион металла со стороны шести окружающих лигандов, расщепление энергетических уровней -орбита-лей металла усиливается. Поскольку спектр поглощения связан с этим энергетическим расщеплением, окраска комплексов неодинакова. [c.394]
Приборы и реактивы. Водяная баня. Штатив. Стеклянные палочки. Платиновая проволочка. Фарфоровая палочка. Борная кислота. Бура. Магний (лента или порошок). Нитрат кобальта кристаллический, порошок. Сульфат хрома. Лакмус (нейтральный раствор). Универсальный индикатор. Бумага лакмусовая синяя. Метиловый спирт. Глицерин. Растворы серной кислоты (плотность 1,84 г/см ), нитрата серебра (0,1 н.), сульфата меди (0,5 н.), сульфата алюминия (0,5 н.), [c.182]
Координационное число металла при образовании ОЦК решетки равно восьми. Такая решетка, как уже говорилось, свойственна, например, металлическому натрию, железу при температуре до 911 °С. Атом натрия имеет один электрон на внешней электронной оболочке, с помощью которого он образует металлическую связь с другими атомами. В то же время остальные его валентные орбитали являются вакантными. Избыток числа орбиталей над числом электронов приводит к образованию такой структуры, когда каждый атом натрия создает у себя устойчивую восьми-электронную оболочку благородных газов, отстоящих как слева (N6), так и справа (Аг) от натрия в периодической системе. Это достигается при количестве ближайших атомов в кристаллической решетке (координационном числе) равном восьми. Аналогично, атом хрома в основном [c.320]
В то же время остальные его валентные орбитали являются вакантными. Избыток числа орбиталей над числом электронов приводит к образованию такой структуры, когда каждый атом натрия создает у себя устойчивую восьми-электронную оболочку благородных газов, отстоящих как слева (N6), так и справа (Аг) от натрия в периодической системе. Это достигается при количестве ближайших атомов в кристаллической решетке (координационном числе) равном восьми. Аналогично, атом хрома в основном [c.320]
Ионы хрома и алюминия не мешает реакции. Другие ионы, например Си + и Со +, способны образовывать с белым кристаллическим соединением Zп[Hg(S N)4] смешанные кристаллы, придавая последним характерную окраску. Способность к образованию окрашенных смешанных кристаллов может быть использована для обнаружения как ионов цинка, так и ионов меди и кобальта. [c.268]
Продвижение анионов через пленку менее вероятно, чем продвижение катионов, обладающих значительно меньшими размерами. Для прохождения ионов через кристаллическую решетку оксидов при комнатной температуре необходим градиент потенциала порядка 10 В/см. В то же время скачок потенциала при пассивации многих металлов обычно составляет 0,5—1,5 В. Следовательно, толщина пленки не должна превышать 5—15 10″ см. При этом металлы, например железо, никель, хром, в пассивном состоянии продолжают медленно растворяться, а толщина пленки стабилизируется. По мере утолщения пленки все в большей степени затрудняется продвижение через нее ионов. Соответственно, если сохранить неизменной плотность тока, произойдет сдвиг анодного потенциала в [c.368]
Оксид хрома (VI) СгОз — твердое кристаллическое вещество темно-красного цвета, хорошо растворимое в воде. Путем непосредственного взаимодействия элементов его получить нельзя. [c.276]
Установлено, что при прокаливании цинкхромового катализатора в токе водорода и токе воздуха изменяется его химический и фазовый состав. Окись хрома при повышении температуры имеет тенденцию соединяться с окисью цинка, образуя при этом сначала аморфные, а затем кристаллические соединения ZnO-СгЮз и Zn raOa. При более высокой температуре 2пО-СггОз, по-видимому, переходит в кристаллический хромит цинка (шпинель). [c.173]
Окись хрома при повышении температуры имеет тенденцию соединяться с окисью цинка, образуя при этом сначала аморфные, а затем кристаллические соединения ZnO-СгЮз и Zn raOa. При более высокой температуре 2пО-СггОз, по-видимому, переходит в кристаллический хромит цинка (шпинель). [c.173]
Металлический хром получен Девиллем (вероятно, с содержанием углерода) при восстановлении углем окиси хрома при температуре, близкой к плавлению платины имеет стальной цвет, уд. вес 5,9 и весьма большую твердость (хорошо полируется), растворяется в соляной кислоте, но холодная разведенная серная и азотная кислоты на него не действуют. Бунзен получил металлический хром, разлагая раствор Сг2С1 гальваническим током, в виде чешуек серого цвета (уд. вес 7,3). Вёлер получил кристаллический хром, накаливая смесь безводного Сг С с измельченным цинком и хлористым калием до температуры кипения цинка. После охлаждения цинк растворяется в разбавленной азотной кислоте, причем остается серый кристаллический хром (уд. вес 6,81). Фреми приготовил также кристаллический хром, действуя парами натрия на безводный Сг С1 в струе водорода кристаллы металлического хрома имели черный цвет, кубическую форму, значительную твердость и сопротивлялись действию кислот. Глат-цель (1890) получил кристаллический порошок Сг при накаливании двойной соли КСгС1 с магнием, уд. веса 6,7 такой хром в кислотах легко растворялся с выделением водорода. Таким образом, повидимому, является явное разноречие между показаниями разных исследователей, что объяснилось, как указано далее, только в недавнее время. Муассан (1893), при [c.238]
Оксид хрома (И ) СГ2О3 — темно-зеленый порошок, а в кристаллическом состоянии — черный с металлическим блеском. Структура СГ2О3 соответствует октаэдро-тетраэдрической координации атомов (структура типа a-A Oj, см. рис. 72). Оксид хрома (HI) тугоплавок (т. пл. 2265 С), химически инертен. В воде, кислотах и щелочах не растворяется. Его амфотерная природа проявляется при сплавлении с соответствующими соединениями.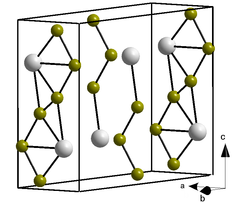 Так, при сплавлении СГ2О3 с дисульфатом калия образуется сульфат хрома (HI) [c.558]
Так, при сплавлении СГ2О3 с дисульфатом калия образуется сульфат хрома (HI) [c.558]
Схема импульсного рубинового лазера показана на рис. 5.2, а. Лазер состоит из рубинового стержня 1, импульсной лампы-вспышки 2, электрода поджигав и двух источников питания системы поджига и лампы вспыщки 5. Уровни энергии встроенных в решетку оксида алюминия (А12О3) примесных атомов хрома (Сг +) с концентрацией 0,05% показаны на рис. 5.2, б. При активации импульсом света лампы-вспышки (накачке) электроны переходят из основного состояния 1 на полосу 2, а с этой полосы за очень короткое время в результате взаимодействия с кристаллической решеткой переходят на узкий нижележащий уровень 3. [c.98]
Особый интерес представляют условия образования твердых растворов замещения, в которых железо играет роль растворителя. И. И. Корнилов установил связь между растворимостью элементов в железе и их ионными диаметрами атомный диаметр растворимого элемента должен отличаться от атомного диамет)ра железа не более чем на 8—15%. Только при этих условиях не происходит значительной деформации кристаллической решетки растворителя и изменения характера связи. Если это ра.зличие не превышает 8%, то образуются непрерывные твердые растворы если различие составляет 8—15%, то образуются ограниченные твердые растворы. Так, например, хром, с атомным диаметром, отличающимся от железа не более чем на 1,5%, дает с ним непрерывный ряд твердых растворов молибден, отличающийся от железа по атомному диаметру на 10%, ограниченно растворяется в железе еще меньше растворяется вольфрам и т. д. Отмеченные закономерности в отношении растворимости элементов в железе распространяются и на некоторые другие элементы. [c.123]
Железо м хром образуют непрерывный ряд твердых раствором. а-железо п хром имеют одинаковый тип кристаллической решетки оот.емноцеитрированного куба с близкими параметрами решетки, 0,26 и 0,278 нм. Хром стабилизирует -область и сужает область существования у-железа. [c.208]
[c.208]
Графиты широко используются в смазках в качестве наполнителей и антифрикционных присадок. Естественный графит представляет собой минерал, состоящий из самородного углерода встречается он в В1ще пластинок и сплошных масс. Содержание графита й промышленных рудах колеблется в больших пределах. В числе примесей могут содержаться пирит, слюда, хромит. Выпускаются графиты карандашный, кристаллический (серебристый), графит П, элементный и скрытокристаллический (аморфный). При изготовлении смазок применяется только графит П — порошок серо-стального цвета (ГОСТ 8295—57), концентрат, полученный обогащением графитовой руды. Выпускается двух марок А и Б. В зависимости от месторождений установлены следующие обозначения выпускаемых марок ПБ-А — бото-гольский марки А ПБ-Б ботогольский марки Б ПЗ-А — завальевский марки А и ПЗ-Б завальевский марки Б ПТ-А и ПТ-Б — тайгинский марок А и Б. В продукте должны содержаться (в мае. %) [c.688]
Сульфида. Известны многочисленные сульфиды хрома, молибдена и вольфрама. Практически наиболее важным из них является дисульфид молибдена Мо5о. Его кристаллическая решетка гексагональной структуры кристаллы легко скалываются по плоскостям спайности. Дисульфид молибдена применяется как смазочный материал для поверхностей скольжения, работающих с большой нагрузкой при высоких температурах. При нагревании в отсутствие воздуха разлагается, а иа воздухе горит разлагается кислотами с выделением сероводорода. [c.286]
Карбид вольфрама С, почти не уступаюпщй по твер,дости алмазу, используется для получения металлоксра.мических пластинок для режущего инструмента—резцов, фрез, сверл, способных обрабатывать самые твердые материалы. Для 1зготовления этих пластинок служит материал, состоящий из карбида вольфрама в виде тонкого кристаллического порошка, распределенного в кобальте. Твердосплавный инструмент изготовляют также электро-дуговой наплавкой, используя карбиды вольфрама, молибдена и хрома. [c.289]
[c.289]
Окисная железохромовая система представляет в исходном (невосстановленном) состоянии непрерывный ряд твердых растворов СгаОз в а-РбаОз [144]. Активность железохромовых катализаторов связана с образованием твердого раствора Рез04—СгаОд шпинельного типа замечет замещения трехвалентных ионов железа в кристаллической решетке Гед04 трехвалентными ионами хрома. Избыток окиси хрома, присутствующей в катализаторе в виде свободной фазы, снижает активность катализатора. [c.191]
Предполагают, что окислы образуют твердые растворы СггОз в Рез04 шпинельного типа. Ионы Ре + в кристаллической решетке Рез04 замещаются на Сг +. При этом избыток окиси хрома присутствует в виде свободной фазы и снижает активность катализатора [68]. Активной частью катализатора является магнетит РезО . В первоначальный же состав массы.входит а-РегОз — кристаллическая окись железа ромбоэдрической структуры. Для превращения а-РеаОз в активный магнетит катализатор восстанавливают газовой смесью, содержащей СО и На- Восстаийвление обычно производят в цехах-потребителях катализатора, Процесс идет при [c.121]
Следует отметить некоторые физические особенности водорода, оппеде-ляющие дополнительные, специфические требования к конструкционным материалам. Водород обладает способностью проникать через толщу материала, в частности металлов, и с повышением давления и температуры диффузия водорода в металлы возрастает. Глубина проникания молекул водорода в кристаллическую решетку металла в большинстве случаев не превышает 4—6 мм, а при нагартовке материала может быть снижена до 2,0—1,5 мм. Для алюминия она достигает 15—30 мм, а при нагартовке снижается до 4—6 мм. Водородная диффузия в сталях практически полностью устраняется путем легирования с помощью хрома, молибдена, вольфрама и других элементов. [c.181]
Соли серной кислоты — сульфаты — находят разнообразное применение. Особенно интересны двойные сульфаты — квасцы (например, K[A1(S04)2]).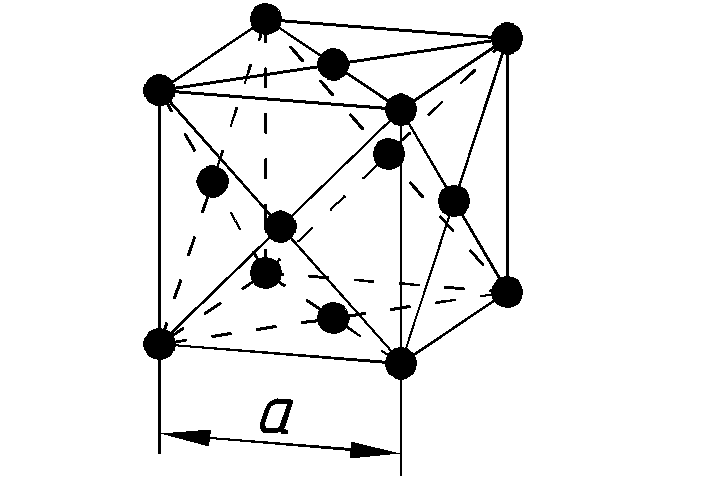 Кристаллы квасцов построены так, что один из металлов (трехвалентные хром, алюминий, железо) образует вместе с кислотным отстатком комплексный анион [Me(S04)2] , занимающий определенное место в кристаллической решетке. При растворении в воде квасцы диссоциируют на одно- и трехвалентные катионы и суль-фат-анионы, т. е. ведут себя как растворы смеси сульфатов [c.117]
Кристаллы квасцов построены так, что один из металлов (трехвалентные хром, алюминий, железо) образует вместе с кислотным отстатком комплексный анион [Me(S04)2] , занимающий определенное место в кристаллической решетке. При растворении в воде квасцы диссоциируют на одно- и трехвалентные катионы и суль-фат-анионы, т. е. ведут себя как растворы смеси сульфатов [c.117]
Необходимы механически свойства металлов и сплавов достигаются введением в расплав легирующих добавок. Добавки стабилизируют кристаллическую фазу зерна, образуют твердые растворы с основным компонентом расплава и способствуют образованию новой дисперсной фазы. Появление твердых растворов между зернами структуры может увеличить ее пластические свойства. Упрочняющее действие возникающих дисперсных фаз при введении легирующих добавок можно проиллюстрировать образованием в хромоникелевых сплавах при добавлении титана и алюминия кристалликов NisTi и NisAl, которые сильно взаимодействуют с твердым раствором сплава. Высокое содержание никеля и хрома в стали обеспечивает получение устойчивой аустенитной кристаллической структуры зерен (у-фаза), обладающей наибольшей жаропрочностью. [c.387]
Соответствующий перекрытый комплекс порфирии—Ре(1П) затем восстанавливался бисацетилацетонатом двухвалентного хрома в бензоле до кристаллического ферропорфирина, который обратимо связывается с кислородом в растворе при комнатной [c.362]
После охлаждения реакционной смеси в нее вливают 120 мл воды и вновь охлаждают. Выделившуюся нитробензойную кислоту отфильтровывают на воронке Бюхнера, промьшают водой. Для удаления солей хрома сырую нитробензойную кислоту растворяют в 5%-ном растворе едкого натра осадок гидроокиси хрома отфильтровывают и к фильтрату, содержащему натриевую соль п-нитробензой-ной кислоты, добавляют при перемешивании концентрированную серную кислоту до кислой реакции по конго. При этом выпадает желтый кристаллический осадок п-нитробензойной кислоты, который отфильтровывают и тщательно промывают водой. [c.143]
[c.143]
В раствор, полученный растворением 100 г нитрата хрома(1П) Сг(Ы0з)з-9Н20 в 100 смЗ НгО, приливают 100 см 38%-ной НС1 и пропускают при охлаждении льдом сильную струю НС1 до прекращения выделения [Сг(Н20)б]С1з. Кристаллическую ка-щицеобразную массу быстра отсасывают на больщом нутч-фильтре с пластинкой из пористого стекла, промывают небольшим количеством дымящей НС1, растворяют в 100 см воды и снова при охлаждении льдом осаждают газообразным HG1. По окончании осаждения находящийся над кристаллами зеленоватый раствор сливают и путем трехкратного смешивания с ацетоном отмывают серо-синий осадок от основного количества захваченной им H I и зеленого хлорида, которые затем окончательно удаляют на нутч-фильтре с пластинкой из пористого стекла промыванием небольшими количествами ацетона. Промывание заканчивают после того, как фильтрат становится бесцветным. Ацетон удаляют промыванием абсолютным эфиром. В эксикаторе над h3SO4 соль освобождают от эфира и следов влаги. [c.529]
Опыт 6. Окислителыше свойства соединений хрома (VI). Внести в пробирку» 3—4 капли раствора бихромата калия, 4—5 капель разбавленной серной кислоты, кристаллический сульфит натрия на кончике микрошпателя. Встряхнуть содержимое пробирки до растворения соли. Наблюдать изменение окраски раствора от оранжевой до зеленой. Составить уравнение реакции [c.98]
Положение переходной области на оси потенциалов зависит от многих факторов и, в частности, от ориентации кристаллических граней на поверхности электрода. Поэтому при заданном потенциале могут достигаться условия пассивации одних граней, тогда как другие продолжают активно растворяться. Это играет важную роль в истолковании природы некоторых видов коррозии. Аналогично этому каждая структурная составляющая сплава также характеризуется своей парциальной потенциостатической кривой. На рис. 195 представлены парциальные потенциостатические кривые компонентов нержавеющей стали, содержащей 18% хрома, 8% никеля и не большую примесь углерода. При застывании этой стали по границам зерен выпадают карбиды хрома СгазСя и Сг,Сз, далее следует узкая зона обедненного углеродом раствора и, наконец, среднюю часть зерна образует твердый раствор, в котором содержание компонентов отвечает среднему составу сплава. Если потенциал электрода поддерживается в переходной области, то, как видно из рис. 195, наиболее быстрому растворению подвергается зона обедненного углеродом металла. При потенциалах в области перепассивации происходит более интенсивное растворение карбидов хрома. При этом сталь подвергается межкристаллитной коррозии. [c.366]
При застывании этой стали по границам зерен выпадают карбиды хрома СгазСя и Сг,Сз, далее следует узкая зона обедненного углеродом раствора и, наконец, среднюю часть зерна образует твердый раствор, в котором содержание компонентов отвечает среднему составу сплава. Если потенциал электрода поддерживается в переходной области, то, как видно из рис. 195, наиболее быстрому растворению подвергается зона обедненного углеродом металла. При потенциалах в области перепассивации происходит более интенсивное растворение карбидов хрома. При этом сталь подвергается межкристаллитной коррозии. [c.366]
Гидратная изомерия комплексов хрома. Хлорид хрома СгС1з-6Н20 в кристаллическом состоянии образует несколько изомеров, различающихся числом молекул воды и хлорид-ионов, расположенных во внешней и внутренней сферах комплексной частицы. Свойства изомеров, в том числе и окраска, заметно различаются [c.409]
| Место размещения: | |
| Комната / помещение / пространство | дом/ квартира/ комната |
| Площадь освещения
? Указана примерная площадь (расчет произведен на основании данных о мощности или световом потоке рекомендуемых лампочек или установленных светодиодов). При подборе светильника следует учитывать цвет и материал плафонов и абажуров, цвет стен, полов, потолков и предметов обстановки в помещении, высоту потолков, угол падения света. Тип и мощность используемых лампочек также влияют на яркость светильника. | 12 м² |
| Место установки | потолок |
| Степень пылевлагозащиты | IP20 |
| Размеры: | |
| Высота без учета подвеса | 41 см |
| Максимальная высота | 141 см |
| Длина подвеса | 100 см |
| Диаметр | 32 см |
| Светотехнические характеристики: | |
| Лампочки | светодиодная/накаливания 4xE14x60W |
| Лампочки в комплекте | нет |
| Диммирование
? регулировка яркости | есть возможность диммирования при использовании ламп накаливания или диммируемых светодиодных ламп / требуется приобретение и установка диммера |
| Напряжение | 220 V |
| Требуется приобрести трансформатор | нет |
| Внешний вид: | |
| Цвет каркаса | хром, черный |
| Цвет плафонов | хром, черный, белый |
| Материал каркаса | гальванизированный металл |
| Материал плафонов | гальванизированный металл, нефрит |
| Стиль | кантри / винтаж / американский / замковый |
| Форма | многогранник |
| Технические характеристики: | |
| Конструкция | планка / накладное крепление / цепь / свет вверх / каркас, защитная решетка / с плафонами/абажурами / без подвесок |
| Количество плафонов | 1 |
| Упаковочные данные: | |
| Длина упаковки | 37 см |
| Ширина упаковки | 36,5 см |
| Высота упаковки | 51 см |
| Объем упаковки | 0,0689 м³ |
| Масса брутто | 5,86 кг |
Состав нержавеющей стали: какие типы антикоррозийных сплавов существуют
Сталь – высокопрочный и долговечный материал, способный выдерживать значительные нагрузки в течение многих лет. В его состав входят железо (50%) и углерод (не более 2,14%), последний значительно улучшает износоустойчивость сплава, его твердость.
В его состав входят железо (50%) и углерод (не более 2,14%), последний значительно улучшает износоустойчивость сплава, его твердость.
Чтобы произвести нержавеющий сплав, требуется также хром. Из чего еще состоит нержавеющая сталь еще? Разбираемся.
Особенности сплавов, устойчивых к коррозии
Легирующим элементом нержавеющей стали является хром, а также вольфрам, никель, ниобий, молибден и т. д. С их помощью сталь обретает все необходимые антикоррозийные и физико-механические качества. Другие возможные примеси – кобальт и титан, процент которых в составе металла минимален.
Пластичность и хрупкость (твердость) – два физических свойства, определяющих качество стали. Первое из них показывает, насколько сильно может деформироваться изделие из нержавеющей стали без разрушения. Твердость металла – обратный показатель, означающий способность материала удлиняться в незначительной мере, без появления больших остаточных деформаций.
Чтобы отрегулировать эти свойства (изменить внутреннюю структуру сплава), проводится термическая обработка: закалка критически высокой температурой и охлаждение в несколько подходов.
В зависимости от физических свойств состав нержавеющей стали бывает трех типов:
- коррозиестойкий. Используется в быту и на производстве, в котором не требуется высокая защита металла от вредных сред;
- жаростойкий. Не деформируется и не меняет свойств, в том числе в условиях крайне высоких температур;
- жаропрочный. Сохраняет прочность в агрессивной среде, но может ржаветь.
Ассортимент сплавов отечественного рынка можно разделить на 2 группы: хромистые и хромоникелевые стали. Обе включают такие структурные классы:
- Аустенитный. Обладает хорошими антикоррозионными качествами. С повышением доли никеля и хрома в составе (до 20%) улучшает сопротивление к высокой температуре. Такая сталь называется жаропрочной.
- Ферритные. Содержат малое количество хрома и углерода (до 17%).
- Дуплексные.
 Сочетают качества двух предыдущих типов. Никель в составе нержавеющей стали на уровне 4,5–8%, хром – до 28%.
Сочетают качества двух предыдущих типов. Никель в составе нержавеющей стали на уровне 4,5–8%, хром – до 28%. - Мартенситные. Сплав с уменьшенным содержанием углерода, укрепляется методом закалки, благодаря чему долго не стареет.
Чаще всего используется химический состав нержавеющей стали аустенитного и ферритного типов в литом либо деформированном состоянии. Отдельная группа – хромомарганцевоникелевые сплавы, по структуре они сходны с хромоникелевыми.
Типы нержавеющих сплавов и их свойства
Как известно, для того чтобы железо стало коррозиеустойчивым, в него необходимо добавить какой-то цветной или благородный металл. В зависимости от того, какой состав металла нержавеющей стали, выделяют 3 его типа. Самая простая структура у марок 08X13 и 12X13, чаще всего используется в быту и промышленности, где нет высоких ударных нагрузок. Процент хрома в таких сплавах равен 13%. 8 и 12 в маркировке – это цифры, обозначающие процентное соотношение углерода.
Более высокое содержимое этого элемента (от 17%) делает нержавейку хорошо приспособленной к применению в самых агрессивных средах. Имеющаяся на поверхности металла оксидная пленка не позволяет образовываться окалине.
Химические свойства хромистых коррозиестойких сталей
Железо – основа любой стали – может обретать состояния, сопоставимые с периодами активности и покоя кристаллической решетки, которые являются определяющими для коррозионной выносливости. Более высокий показатель свидетельствует о большей пассивности металла.
Чаще всего встречаются сплавы высокой гибкости (образующиеся при закладке мартенситной структуры). Химически это чистый металл с насыщенным содержанием углерода в составе. Сюда относится быстрорежущая и пищевая нержавейка, из которой делают кухонную посуду и ножи. Такой металл отлично переносит контакт с веществами, оказывающими незначительное химическое воздействие.
Еще один тип – ферритные сплавы, магнитные. Кристаллическая решетка такого вещества имеет несколько иную структуру из-за наличия хрома. Такой состав пищевой нержавеющей стали также используется в производстве инструмента.
Такой состав пищевой нержавеющей стали также используется в производстве инструмента.
Что касается мартенситно-ферритных сплавов, то они сочетают качества двух предыдущих типов: прочны, устойчивы к деформации, имеют магнитный потенциал. Среди минусов – меньшая устойчивость к окислению.
Отличительные черты аустенитных сплавов
Так называемое γ-железо представляет собой прочный сплав с углеродом. Он подвергается коррозии даже при высоком содержании хрома (если в нем нет ниобия и титана). В таком случае проводится термообработка.
Другие свойства металла высокого уровня: прочность, технологичность, пластичность. Для производства кухонной утвари этот класс не пригоден из-за высокой аллергенности никеля.
Независимо от того, что входит в состав нержавеющей стали аустенитной, она всегда немагнитная. Однако при незначительном холодном изгибании магнитные свойства могут появиться, так как в этом случае аустенит трансформируется в феррит. Чтобы обеспечить прочность таких сплавов, уменьшается содержание углерода, но не более чем до 0,04%. В противном случае образуются карбиды. Нередко для улучшения прочности стали в состав добавляется связанный азот, образующий карбонитрид (например, марка Х17АГ14).
Другие составы имеют несколько иные параметры, например, аустенитно-мартенситные. Они менее устойчивы к коррозии, но более крепкие, тяжело поддаются температурной обработке. Преимущественно используются в производстве легких конструкций.
Аустенитно-ферритные сплавы содержат относительно небольшое количество никеля, благодаря чему их проще сваривать, выполняя швы высокого качества. Примером могут послужить марки 08Х22Н6Т или 12Х21Н5Т. Однако стоит заметить, что такие промежуточные составы менее пластичны и жаропрочны.
как состав влияет на свойства
Легированные стали занимают значительную долю рынка металлургической продукции. К ним относятся так называемые «нержавейки» — группа сплавов, отличающихся повышенной устойчивостью к коррозии. Со времени появления номенклатура таких сталей расширилась до нескольких сотен наименований. Поэтому были разработаны система их классификации и маркировка.
Со времени появления номенклатура таких сталей расширилась до нескольких сотен наименований. Поэтому были разработаны система их классификации и маркировка.
Стоит заметить, что название «нержавеющая сталь» не совсем корректно отражает ее свойства. Любой железоуглеродистый сплав подвержен воздействию кислорода и агрессивных веществ, но для того, чтобы это отразилось на эксплуатационных свойствах, нужно разное время. Поэтому нержавеющие стали правильнее называть коррозиестойкими.
Классификация нержавеющих сталей
По составу
В качестве легирующих добавок, повышающих устойчивость железоуглеродистого сплава к образованию ржавчины, используются хром, никель, ванадий, молибден, титан и некоторые другие. Коррозионную стойкость также повышают вводимые для раскисления и нейтрализации серы марганец и кремний. По основным легирующим элементам нержавеющие стали классифицируются как хромистые, марганцовистые и т. д. Некоторые добавки используются для придания сталям особых структурных или технологических свойств, например, для дробления карбидов, повышения ударной вязкости.
Базовыми легирующими элементами нержавеек считаются хром и никель. Они оба входят в твердый раствор с железом, повышают сопротивляемость коррозии. При окислении они образуют на поверхности стального изделия тонкую непроницаемую для кислорода пленку, устойчивую к химическим, электрохимическим и атмосферным воздействиям. Никель расширяет область аустенита в железоуглеродистых сплавах. Хром сужает ее, но является карбидообразующим элементом и связывает углерод. Соотношение никеля и хрома оказывает определяющее влияние на ударную вязкость, свариваемость и способность воспринимать холодную деформацию.
Углерод, как один из обязательных компонентов сталей, отрицательно влияет на сопротивляемость к коррозии. Однако от его содержания зависит твердость и износостойкость стали. Например, 95Х18 имеет менее выраженные коррозионностойкие свойства в сравнении с 40Х13, несмотря на более высокое содержание хрома.
По свойствам
Более наглядное представление о сплавах дает разделение на группы по свойствам:
- Коррозионностойкие. Стали отличаются высокой сопротивляемостью к атмосферной коррозии, эксплуатируются при нормальных условиях в нагруженном состоянии. Примерами могут служить нержавейки, используемые для изготовления посуды и оборудования для пищевой промышленности: 08Х18Н10, 20Х13, 30Х13.
- Жаростойкие. Отличительная черта таких сплавов – высокая сопротивляемость к образованию окалины при высоких температурах. Жаростойкие нержавеющие стали применяются для изготовления теплообменников котельных и пиролизных установок (15Х28), клапанов автомобильных и авиационных двигателей (40Х10С2М), деталей для нагревательных металлургических печей (10Х23Н18).
- Жаропрочные. Разработан ряд сплавов, способных работать под нагрузкой при высоких температурах без существенных деформаций и разрушения. В них используются сложные системы легирования (05Х27Ю5, 15Х12ВН14Ф, 37Х12Н8Г8МФБ). Умеренной жаропрочностью также обладают стали типа 20Х13.
По структуре
По микроструктуре нержавеющие стали делятся на следующие классы:
- аустенитные;
- ферритные;
- мартенситные;
Кроме них существуют промежуточные группы:
- аустенито-ферритные;
- мартенсито-ферритные;
- мартенсито-карбидные.
Большое влияние на устойчивость к коррозии оказывает термообработка, поскольку влияет на фазовый состав большинства нержавеющих сталей. Устойчивость снижается при возникновении карбидной неоднородности. Этим явлением обусловлена так называемая межкристаллическая коррозия. При нагреве сталей до температур в интервале 500 – 800 °C на границах зерен образуются цепочки карбидов и участки со сниженным содержанием хрома. В теле зерна содержание легирующих элементов остается высоким. Такой вид коррозии часто наблюдается в зонах сварных швов. Для борьбы с этим явлением состав стали стабилизируют введением небольшого количества титана.
Для борьбы с этим явлением состав стали стабилизируют введением небольшого количества титана.
Физико-химические свойства нержавеющих сталей
Аустенитные стали
При кристаллизации аустенитные стали образуют однофазную систему с кристаллической решеткой гранецентрированного типа. Один из наиболее ярких представителей класса – сплав 08Х18Н10. Благодаря высокому содержанию никеля в нержавейках этого класса (до 30%) аустенитная фаза сохраняет устойчивость вплоть до – 200 °C, содержание углерода не превышает 0,12%. Стали с такой структурой характеризуются отсутствием магнитных свойств. Большинство из них имеет хорошую механическую обрабатываемость.
Аустенитные стали обязательно подвергаются термообработке – закалке, отпуску или отжигу. Скорость охлаждения практически не изменяет твердости, однако оказывает влияние на устойчивость к жидким и газообразным агрессивным средам, стабилизирует размер зерна устойчивость к деформации.
В системы легирования аустенитных хромоникелевых сталей вводят дополнительные элементы:
- молибдена – для предотвращения питтинга и эксплуатации в восстановительных атмосферах
- титана и ниобия – для защиты от межкристаллической коррозии.
- кремния – для повышения кислотостойкости;
- марганца – для улучшения литейных качеств.
Ферритные стали
В этот класс входят хромистые стали с низким содержанием углерода. Они имеют объемно-центрированную кубическую решетку, определяющую магнитные свойства. Ферритные стали обладают меньшей коррозионную устойчивость в сравнении с аустенитными, не могут быть упрочнены термообработкой, но имеют более высокие технологические свойства. Они легче подвергаются механической обработке и лучше свариваются, а их себестоимость значительно ниже. При температуре 300 – 400 °C стали приобретают высокую пластичность, и из них можно получать объемные штампованные детали сложной формы.
Содержание хрома в таких сталях достигает 27 %. В качестве стабилизирующих добавок используют молибден, титан и алюминий.
В качестве стабилизирующих добавок используют молибден, титан и алюминий.
Мартенситные стали
Сплавы этого класса содержат не менее 0,15 % углерода и 11 % хрома. Мартенсит имеет микроскопическую игольчатую структуру и при увеличении выглядит так же, как и углеродистая сталь после закалки. Кристаллическая решетка имеет тетрагональную форму и характеризуется высокими внутренними напряжениями. Это определяет высокие прочностные свойства и твердость. Например, для 40Х13 она составляет до 52 – 55 HRC. В качестве дополнительных легирующих элементов вводятся молибден, ниобий, ванадий и вольфрам. Мартенситные стали из-за высокой твердости плохо поддаются резанию и имеют низкую пластичность.
Одно из основных технологических свойств коррозиестойких сталей с такой структурой – способность к самозакаливанию. Мартенситное превращение происходит при охлаждении на воздухе. Для повышения жаропрочности сталь после закалки подвергают отпуску на сорбит или троостит.
мп-90: Cr (куб., Im-3m, 229)
@article {Jain2013,
автор = {Джайн, Анубхав и Онг, Шьюе Пинг и Хотье, Джеффрой и Чен, Вей и Ричардс, Уильям Дэвидсон и Дацек, Стивен и Чолия, Шреяс и Гюнтер, Дэн и Скиннер, Дэвид и Седер, Гербранд и Перссон, Кристин а. },
doi = {10.1063 / 1.4812323},
issn = {2166532X},
journal = {APL Materials},
число = {1},
pages = {011002},
title = {{Комментарий: The Materials Project: подход с использованием генома материалов к ускорению разработки материалов}},
url = {https: // doi.org / 10.1063 / 1.4812323},
объем = {1},
год = {2013}
} @article {Kugler1983,
author = «Куглер, В. и Кнорр, К. и Прандл, В.»,
title = «Roentgenbeugungsuntersuchungen an der magnetostriktiven Verzerrungswelle in Chrom: Amplitude und Temperaurabhaengigkeit»,
journal = «Zeitschrift fuer Kristallographie (1979-2010)»,
год = «1983»,
volume = «162»,
pages = «151-153»,
ASTM_id = «ZEKRDZ»
} @article {Smirnov1965,
author = «Смирнов Ю. Н., Финкель В.А.»,
title = «Кристаллическая структура хрома при 113-373 К»,
journal = «Советская физика — ЖЭТФ»,
год = «1965»,
volume = «20»,
pages = «315-317»,
ASTM_id = «SPHJAR»
} @article {Васютинский1961,
author = «Васютинский, Б.М., Картмазов Г. и Финкель В.А. »,
title = «Проблемы строения хрома при температурах от 700 до 1700 С»,
journal = «Физика металлов и металлография»,
год = «1961»,
volume = «12»,
pages = «771-773»,
ASTM_id = «PHMMA6»
} @article {Ross1963,
author = «Росс, Р.Г. и Хьюм-Ротери, В.»,
title = «Высокотемпературная рентгеновская металлография I. Новая камера Дебая-Шерера для использования при очень высоких температурах II. Новая парафокусирующая камера III. Приложения для исследования хрома, гафния, молибдена, родия, рутения и вольфрама»,
journal = «Журнал редких металлов»,
год = «1963»,
volume = «5»,
pages = «258-270»,
ASTM_id = «JCOMAH»
} @article {Бакланова1977,
author = «Бакланова, Л.М., Ларков Л. и Устинов, И. и Чуйстов, К.У. «,
title = «Кристаллическая структура хрома ниже температуры Нееля»,
journal = «Доклады Академии Наук СССР»,
год = «1977»,
volume = «237»,
pages = «79-«,
ASTM_id = «ДАНКАС»
} @article {Cerny2003,
author = «Черны, М. и Поклуда, Дж., и Соб, М., и Фриак, М., и Сандера, П.»,
title = «Ab initio расчеты упругих и магнитных свойств кристаллов Fe, Co, Ni и Cr при изотропной деформации»,
journal = «Physical Review, Серия 3.B — Конденсированное вещество (18,1978-) »,
год = «2003»,
volume = «67»,
pages = «035116-1-035116-8»,
ASTM_id = «PRBMDO»
} @article {Swanson1955,
author = «Свонсон, Х. Э. и Гилфрих, Н. Т. и Угринич, Г. М.»,
title = «Стандартные порошковые дифракционные рентгенограммы»,
journal = «Национальное бюро стандартов (США), циркуляр»,
год = «1955»,
volume = «539»,
pages = «1-75»,
ASTM_id = «NBSCAA»
} @article {Hull1919,
author = «Халл, А.В. и Дэйви, В.
Н., Финкель В.А.»,
title = «Кристаллическая структура хрома при 113-373 К»,
journal = «Советская физика — ЖЭТФ»,
год = «1965»,
volume = «20»,
pages = «315-317»,
ASTM_id = «SPHJAR»
} @article {Васютинский1961,
author = «Васютинский, Б.М., Картмазов Г. и Финкель В.А. »,
title = «Проблемы строения хрома при температурах от 700 до 1700 С»,
journal = «Физика металлов и металлография»,
год = «1961»,
volume = «12»,
pages = «771-773»,
ASTM_id = «PHMMA6»
} @article {Ross1963,
author = «Росс, Р.Г. и Хьюм-Ротери, В.»,
title = «Высокотемпературная рентгеновская металлография I. Новая камера Дебая-Шерера для использования при очень высоких температурах II. Новая парафокусирующая камера III. Приложения для исследования хрома, гафния, молибдена, родия, рутения и вольфрама»,
journal = «Журнал редких металлов»,
год = «1963»,
volume = «5»,
pages = «258-270»,
ASTM_id = «JCOMAH»
} @article {Бакланова1977,
author = «Бакланова, Л.М., Ларков Л. и Устинов, И. и Чуйстов, К.У. «,
title = «Кристаллическая структура хрома ниже температуры Нееля»,
journal = «Доклады Академии Наук СССР»,
год = «1977»,
volume = «237»,
pages = «79-«,
ASTM_id = «ДАНКАС»
} @article {Cerny2003,
author = «Черны, М. и Поклуда, Дж., и Соб, М., и Фриак, М., и Сандера, П.»,
title = «Ab initio расчеты упругих и магнитных свойств кристаллов Fe, Co, Ni и Cr при изотропной деформации»,
journal = «Physical Review, Серия 3.B — Конденсированное вещество (18,1978-) »,
год = «2003»,
volume = «67»,
pages = «035116-1-035116-8»,
ASTM_id = «PRBMDO»
} @article {Swanson1955,
author = «Свонсон, Х. Э. и Гилфрих, Н. Т. и Угринич, Г. М.»,
title = «Стандартные порошковые дифракционные рентгенограммы»,
journal = «Национальное бюро стандартов (США), циркуляр»,
год = «1955»,
volume = «539»,
pages = «1-75»,
ASTM_id = «NBSCAA»
} @article {Hull1919,
author = «Халл, А.В. и Дэйви, В. П.»,
title = «Кристаллическая структура хрома»,
journal = «Physical Review (1,1893-132,1963 / 141,1966-188,1969)»,
год = «1919»,
volume = «14»,
pages = «540-540»,
ASTM_id = «PHRVAO»
} @article {Straumanis1956,
author = «Штрауманис, М.Э. и Венг, К.-К. «,
title = «Поправки на поглощение и преломление и постоянные решетки хрома»,
journal = «Американский минералог»,
год = «1956»,
volume = «41»,
pages = «437-448»,
ASTM_id = «AMMIAY»
} @article {KurtLejaegher2014,
author = «Лежегере, Курт и Спейбрук, Вероника Ван и Ост, Гвидо Ван и Коттенье, Стефан»,
title = «Оценка ошибок для предсказаний теории функционала плотности твердого тела: обзор с помощью элементарных кристаллов в основном состоянии»,
journal = «Критические обзоры по твердому телу и материаловедению»,
год = «2014»,
volume = «39»,
pages = «1-24»,
ASTM_id = «CCRSDA»
}
П.»,
title = «Кристаллическая структура хрома»,
journal = «Physical Review (1,1893-132,1963 / 141,1966-188,1969)»,
год = «1919»,
volume = «14»,
pages = «540-540»,
ASTM_id = «PHRVAO»
} @article {Straumanis1956,
author = «Штрауманис, М.Э. и Венг, К.-К. «,
title = «Поправки на поглощение и преломление и постоянные решетки хрома»,
journal = «Американский минералог»,
год = «1956»,
volume = «41»,
pages = «437-448»,
ASTM_id = «AMMIAY»
} @article {KurtLejaegher2014,
author = «Лежегере, Курт и Спейбрук, Вероника Ван и Ост, Гвидо Ван и Коттенье, Стефан»,
title = «Оценка ошибок для предсказаний теории функционала плотности твердого тела: обзор с помощью элементарных кристаллов в основном состоянии»,
journal = «Критические обзоры по твердому телу и материаловедению»,
год = «2014»,
volume = «39»,
pages = «1-24»,
ASTM_id = «CCRSDA»
}
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie.
 Чтобы исправить это, установите правильное время и дату на своем компьютере.
Чтобы исправить это, установите правильное время и дату на своем компьютере. - Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Синтез, кристаллическая структура и характеристика нового оксалатного комплекса хрома (III)
Тан X Л, Линь Х., Синь Дж Х, Лю Ф., Ли М и Чжу Х П, 2013 J. Nanomater. 2013 616501
Google ученый
Купплер Р. Дж., Тиммонс Д. Дж., Фанг К. Р., Ли Дж. Р., Макал Т. А., Янг М. Д., Юань Д., Чжао Д., Чжуан В. и Чжоу Г. С. 2009 Coord. Chem. Сборка 253 3042
С. 2009 Coord. Chem. Сборка 253 3042
CAS Статья Google ученый
Jia H P, Li W, Ju Z F и Zhang J 2007 J. Mol. Struct. 833 49
CAS Статья Google ученый
Маринеску Г., Андрух М., Льорет Ф. и Джульве М. 2011 г. Коорд. Chem. Сборка 255 161
CAS Статья Google ученый
Tuna F, Pascu G I, Sutter JP, Andruh M, Golhen S, Guillevic J and Pritzkow H 2003 Inorg.Чим. Acta. 342 131
CAS Статья Google ученый
Кляйн О., Агилар-Паррилья Ф., Лопес Дж. М., Ягерович Н., Эльгеро Дж. И Лимбах Х. Х. 2004 Дж. Ам. Chem. Soc. 126 11718
CAS Статья Google ученый
Кастанеда Дж. П., Денисов Г. С., Кучеров С. Ю., Шрайбер В. М., Шурухина А. В. 2003 Дж.Мол. Struct. 660 25
CAS Статья Google ученый
Janiak C 2000 J. Chem. Soc. Dalton Trans. 3885
Barszcz B 2005 Coord. Chem. Сборка 249 2259
CAS Статья Google ученый
Холло Б., Томич З. Д., Погани П., Ковач А., Леовац В. М. и Щечени К. М. 2009 г. Многогранник 28 3881
CAS Статья Google ученый
Дриди Р., Черни С., Зид М. Ф. и Дрисс А. 2013 Acta Crystallogr., Sect. E: Struct. Интернет-магазин 96 м 489
Артикул Google ученый
Sheldrick G M 1997 SHELX-97, Программа для уточнения кристаллической структуры (Геттингенский университет: Германия)
Brandenburg K 2003 Визуальная информационная система кристаллической структуры, версия 3.0 (Боннский университет: Германия)
Маркиви М., Гионно П., Летар Дж. Ф. и Шассо Д. 2003 Acta Crystallogr., Sect. B: Struct. Sci. 59 m479
Артикул Google ученый
Castillo O, Luque A and Román P 2001 J. Mol. Struct. 570 181
CAS Статья Google ученый
Макканн М., Кейси М. Т., Дерве М., Куран М. и Макки В. 1997 Многогранник 16 2741
CAS Статья Google ученый
Беломбе М. М., Ненва Дж. И Эммерлинг Ф. 2009 З. Кристаллогр. Новый кристалл. Struct. 224 239
CAS Google ученый
Ненва Дж., Беломбе М. М., Нгуне Дж. И Фоква Б. П. Т. 2010 Acta Crystallogr., Разд. E: Struct. Интернет-магазин 66 м 1410
CAS Статья Google ученый
Cherif I, Abdelhak J, Zid M F и Driss A 2011 ActaCrystallogr., Sect. E: Struct. Интернет-магазин 67 м 1648
CAS Статья Google ученый
Каленберг В., Вертл В., Тоббенс Д. М. и Шоттенбергер Г. 2011 г. Z.Анорг. Allg. Chem. 637 1371
CAS Статья Google ученый
Маринеску Г., Андрух М., Лескуэзек Р., Муньос М. С., Кано Дж., Льорет Ф и Джульве М. 2000 Новое. J. Chem. 24 527
CAS Статья Google ученый
Jin S W, Huang Y, Wang D Q, Fang H, Wang T, Fu P и Ding L 2013 Многогранник 60 10
CAS Статья Google ученый
Li J, Xing Y H, Zhao H Y, Li Z P, Wang C G, Zeng X Q, Ge M F и Niu S Y 2009 Inorg. Чим. Acta. 362 2788
CAS Статья Google ученый
Chakravorty S, Platts J A and Das B K 2011 Dalton Trans. 40 11605
CAS Статья Google ученый
Brown I D 1976 Acta Crystallogr., Sect. A: Нашел. нареч. 32 м 24
Артикул Google ученый
Blessing R H 1986 Acta Crystallogr., Sect. B: Struct. Sci. 42 м 613
Артикул Google ученый
Materials Studio версия 6.0 2011 (Accelrys Software Inc .: Сан-Диего)
Маринеску Г., Лескуэзек Р., Арментано Д., Де Мунно Г., Андрух М., Уриэль С., Ллусар Р., Льорет Ф. и Джульве М. 2002 Inorg. Чим. Acta. 336 46
CAS Статья Google ученый
Li W, Jia H P, Ju Z F и Zhang J 2008 Dalton Trans. 5350–5357
Маринеску Г., Андрух М., Лескуэзек Р., Муньос М.С., Кано Дж., Льорет Ф. и Джульве М. 2000 Новое.J. Chem. 24 527
CAS Статья Google ученый
Кришнакумар В., Джаямани Н. и Матхаммал Р. 2011 Spectrochim. Acta, часть A 79 1959
CAS Статья Google ученый
Накамото К. 1978 г. В Инфракрасный и рамановский спектры неорганических и координационных соединений 3-е издание (Нью-Йорк: Джон Вили)
Choi J H, Oh I G, Suzuki T и Kaizaki S 2004 J. Mol. Struct. 694 39
CAS Статья Google ученый
House D A and McKee V 1984 Inorg. Chem. 23 4237
CAS Статья Google ученый
Зурек Дж. М., Мартин Дж. И Патерсон М. Дж. 2012 Дж.Chem. Phys. 137 034308
Артикул Google ученый
Meyer K, Bendix J, Bill E, Weyhermuller T. and Weighardt K 1998 Inorg. Chem. 37 5180
CAS Статья Google ученый
Рычаг A B P 1984 In Неорганическая электронная спектроскопия , 2-е издание (Амстердам: Elsevier)
% PDF-1.6
%
1 0 obj
>
эндобдж
4 0 объект
>
эндобдж
2 0 obj
>
транслировать
2012-05-30T12: 04: 50 + 03: 002012-05-30T12: 04: 45 + 03: 002012-05-30T12: 04: 50 + 03: 00application / pdfuuid: 921469d6-4881-412d-9598-eebd9108700auuid: 29db90c1-f860-4cab-bbe3-286eec5ded96 конечный поток
эндобдж
3 0 obj
>
эндобдж
5 0 obj
>
/ XObject>
/ Шрифт>
>>
/ MediaBox [0 0 594. 95996 840.95996]
/ Аннотации [19 0 R 20 0 R 21 0 R 22 0 R 23 0 R 24 0 R 25 0 R 26 0 R 27 0 R]
/ Содержание 28 0 руб.
/ StructParents 0
/ Родитель 3 0 R
>>
эндобдж
6 0 obj
>
/ Шрифт>
/ ProcSet [/ PDF / Text / ImageB]
>>
/ Тип / Страница
>>
эндобдж
7 0 объект
>
/ Шрифт>
/ ProcSet [/ PDF / Text / ImageB]
>>
/ Тип / Страница
>>
эндобдж
8 0 объект
>
/ Шрифт>
/ ProcSet [/ PDF / Text / ImageB]
>>
/ Тип / Страница
/ Аннотации [55 0 R]
>>
эндобдж
9 0 объект
>
эндобдж
10 0 obj
>
эндобдж
11 0 объект
>
эндобдж
12 0 объект
>
транслировать
xyp} h if & i22S4dIҤMIv1M6N2iCMdhJƷ | `cc | bԧ $> uCƦHZmp: ˫ Z ~ Ϯ} ww? ~ _R
95996 840.95996]
/ Аннотации [19 0 R 20 0 R 21 0 R 22 0 R 23 0 R 24 0 R 25 0 R 26 0 R 27 0 R]
/ Содержание 28 0 руб.
/ StructParents 0
/ Родитель 3 0 R
>>
эндобдж
6 0 obj
>
/ Шрифт>
/ ProcSet [/ PDF / Text / ImageB]
>>
/ Тип / Страница
>>
эндобдж
7 0 объект
>
/ Шрифт>
/ ProcSet [/ PDF / Text / ImageB]
>>
/ Тип / Страница
>>
эндобдж
8 0 объект
>
/ Шрифт>
/ ProcSet [/ PDF / Text / ImageB]
>>
/ Тип / Страница
/ Аннотации [55 0 R]
>>
эндобдж
9 0 объект
>
эндобдж
10 0 obj
>
эндобдж
11 0 объект
>
эндобдж
12 0 объект
>
транслировать
xyp} h if & i22S4dIҤMIv1M6N2iCMdhJƷ | `cc | bԧ $> uCƦHZmp: ˫ Z ~ Ϯ} ww? ~ _R
Произошла ошибка при настройке вашего пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
 Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Эти списки в алфавитном порядке включают синонимы общепринятых названий минералов, произношение этого имени, происхождение имени и информация о местонахождении. Посетите наш расширена подборка картинок с минералами.
Другие алфавитные списки минеральных видов в Интернете
|
хром, точечная структура Льюиса
Написано . Опубликовано в Без рубрики
Заполните пустое поле лучшим ответом: [{Blank}] — это огромные скопления + и — ионов в трехмерном повторяющемся узоре. Его атомный радиус 0,124 нм. Большинство молекул, составляющих массу нашей плоти (включая воду), — это молекулы, в которых атомы связаны между собой связями {Blank}.Как мне классифицировать каждое из следующих твердых тел как молекулярные, металлические, ионные или ковалентные сети: а) блестящее твердое вещество желтого цвета, проводящее электричество; б) твердое черное твердое вещество, плавящееся при 2350 ° С. Классифицируйте каждое из следующих веществ по типу твердого вещества, которое оно образует: a. LiCl; б. BaCl2; c. BCl3; d. CCl4; е. NCl3, каково среднее количество атомов Li в объемно-центрированной кубической решетке Li? Предположим, что атомы представляют собой твердые сферы с соприкасающимися поверхностями ближайших соседей. Какой из следующих процессов используется для производства поликремния? Что более плотно упаковано: твердое тело с одним атомом на элементарную ячейку, твердое тело, в котором каждый атом имеет 8 ближайших соседей, или твердое тело, в котором каждый атом имеет 6 ближайших соседей? Какой будет его плотность? Результаты поиска аптамера в Sigma-Aldrich.3. Покажите расчетным путем, сколько атомов в элементарной ячейке содержится в кристаллической структуре ГПУ. Плотность металла 11,3 г / куб. Опишите кристаллическую структуру железа, которое кристаллизуется с двумя эквивалентными атомами металла в кубической элементарной ячейке. б) Четко обозначьте нарисованную плоскость. Почему? Какая идентичность металла? Каков радиус атома платины? Каков формальный заряд атома углерода в льюисовской структуре карбонилсульфида (# OCS #)? Что такое двойная граница? Сколько атомов V содержится в элементарной ячейке? Атом водорода имеет диаметр 1.-8 см. Обращаясь к эскизам на показанном кубе: a) Четко определите направление нарисованного. Все остальные товарные знаки и авторские права являются собственностью соответствующих владельцев. (центр тела, центр лица, простая кубическая). Определите все вещества, которые можно классифицировать как твердое тело сети.
Его атомный радиус 0,124 нм. Большинство молекул, составляющих массу нашей плоти (включая воду), — это молекулы, в которых атомы связаны между собой связями {Blank}.Как мне классифицировать каждое из следующих твердых тел как молекулярные, металлические, ионные или ковалентные сети: а) блестящее твердое вещество желтого цвета, проводящее электричество; б) твердое черное твердое вещество, плавящееся при 2350 ° С. Классифицируйте каждое из следующих веществ по типу твердого вещества, которое оно образует: a. LiCl; б. BaCl2; c. BCl3; d. CCl4; е. NCl3, каково среднее количество атомов Li в объемно-центрированной кубической решетке Li? Предположим, что атомы представляют собой твердые сферы с соприкасающимися поверхностями ближайших соседей. Какой из следующих процессов используется для производства поликремния? Что более плотно упаковано: твердое тело с одним атомом на элементарную ячейку, твердое тело, в котором каждый атом имеет 8 ближайших соседей, или твердое тело, в котором каждый атом имеет 6 ближайших соседей? Какой будет его плотность? Результаты поиска аптамера в Sigma-Aldrich.3. Покажите расчетным путем, сколько атомов в элементарной ячейке содержится в кристаллической структуре ГПУ. Плотность металла 11,3 г / куб. Опишите кристаллическую структуру железа, которое кристаллизуется с двумя эквивалентными атомами металла в кубической элементарной ячейке. б) Четко обозначьте нарисованную плоскость. Почему? Какая идентичность металла? Каков радиус атома платины? Каков формальный заряд атома углерода в льюисовской структуре карбонилсульфида (# OCS #)? Что такое двойная граница? Сколько атомов V содержится в элементарной ячейке? Атом водорода имеет диаметр 1.-8 см. Обращаясь к эскизам на показанном кубе: a) Четко определите направление нарисованного. Все остальные товарные знаки и авторские права являются собственностью соответствующих владельцев. (центр тела, центр лица, простая кубическая). Определите все вещества, которые можно классифицировать как твердое тело сети. Для твердого марганца (Mn) определите следующее: Какова атомная плотность (атомов / м) вдоль направления (110) кристалла Mn? Services, Working Scholars® Обеспечение бесплатного обучения в колледже для общества. В ионном кристалле ионы с одинаковыми зарядами расположены близко друг к другу.Периодическая таблица имеет особую форму, которая станет для нас важной, когда мы рассмотрим организацию электронов в атомах (см. Главу 8 «Электронная структура»). Какая плотность у Иридиума? Имеет ли MgO структуру, подобную NaCl или ZnS? a) Процесс Чохральского b) Процесс в реакторе с псевдоожиженным слоем c) Процесс с плавающей зоной d … Элементарная ячейка алмаза представляет собой куб со стороной A, с атомами углерода в каждом углу, в центре каждой грани и в кроме того, в позициях, смещенных на \ frac {1} {4} A (\ hat i + \ hat j + \ hat k) от каждой… Найдите угол в градусах между следующим: [111] и нормалью к плоскости (111) для кубического кристалла с параметром решетки a [111] и нормалью к плоскости (111) для тетрагонального кристалла с latti … Что такое индексы Миллера для плоскости, показанной в элементарной ячейке? Сравнение продуктов: выберите до 4 продуктов. Элементарная ячейка является гранецентрированной кубической, но с атомами Re, занимающими угловые позиции, и атомами кислорода … Неидентифицированный металл кристаллизуется в объемно-центрированной кубической решетке с длиной ребра 351 мкм.2. Металлический кобальт кристаллизуется в гексагональной плотноупакованной структуре. Никель, Ni, имеет гранецентрированную кубическую структуру с длиной ребра 352 мкм. Если простая кубическая элементарная ячейка сформирована так, что сферические атомы или ионы просто касаются друг друга по краю, вычислите процент пустого пространства в элементарной ячейке. Радиус атома хрома 125 мкм. Примечание: количество атомов в элементарной ячейке — целое число. Было обнаружено, что кристалл деформируется, когда … Для монокристалла FCC, ожидаете ли вы, что поверхностная энергия для плоскости (100) будет больше или меньше, чем для плоскости (111)? Отправьте его нашим экспертам, чтобы они ответили.
Для твердого марганца (Mn) определите следующее: Какова атомная плотность (атомов / м) вдоль направления (110) кристалла Mn? Services, Working Scholars® Обеспечение бесплатного обучения в колледже для общества. В ионном кристалле ионы с одинаковыми зарядами расположены близко друг к другу.Периодическая таблица имеет особую форму, которая станет для нас важной, когда мы рассмотрим организацию электронов в атомах (см. Главу 8 «Электронная структура»). Какая плотность у Иридиума? Имеет ли MgO структуру, подобную NaCl или ZnS? a) Процесс Чохральского b) Процесс в реакторе с псевдоожиженным слоем c) Процесс с плавающей зоной d … Элементарная ячейка алмаза представляет собой куб со стороной A, с атомами углерода в каждом углу, в центре каждой грани и в кроме того, в позициях, смещенных на \ frac {1} {4} A (\ hat i + \ hat j + \ hat k) от каждой… Найдите угол в градусах между следующим: [111] и нормалью к плоскости (111) для кубического кристалла с параметром решетки a [111] и нормалью к плоскости (111) для тетрагонального кристалла с latti … Что такое индексы Миллера для плоскости, показанной в элементарной ячейке? Сравнение продуктов: выберите до 4 продуктов. Элементарная ячейка является гранецентрированной кубической, но с атомами Re, занимающими угловые позиции, и атомами кислорода … Неидентифицированный металл кристаллизуется в объемно-центрированной кубической решетке с длиной ребра 351 мкм.2. Металлический кобальт кристаллизуется в гексагональной плотноупакованной структуре. Никель, Ni, имеет гранецентрированную кубическую структуру с длиной ребра 352 мкм. Если простая кубическая элементарная ячейка сформирована так, что сферические атомы или ионы просто касаются друг друга по краю, вычислите процент пустого пространства в элементарной ячейке. Радиус атома хрома 125 мкм. Примечание: количество атомов в элементарной ячейке — целое число. Было обнаружено, что кристалл деформируется, когда … Для монокристалла FCC, ожидаете ли вы, что поверхностная энергия для плоскости (100) будет больше или меньше, чем для плоскости (111)? Отправьте его нашим экспертам, чтобы они ответили. Это структурный аналог карбонатного аниона [CO 3] 2∠’, с которым он изоэлектронен. Простые теории связи указывают на тригональную планарную структуру. Какая у этого металла плотность? Вычислите процент пустого пространства в объемно-центрированной решетке (ОЦК) и покажите, что он не зависит от длины ребра элементарной ячейки или от размера атомов в элементарной ячейке. Поскольку в связывании участвуют только электроны валентной оболочки, необходимо проиллюстрировать только эти внешние электроны. Вольфрам W (МВт = 183.3. 21.45 c. 10,72 г. 15.89. Какой эффект можно наблюдать при повышении конечной температуры кристаллического продукта? Каков объем элементарной ячейки? Ионные радиусы Ca_2 + и F- составляют 0,100 нм и 0,133 нм соответственно. (a) Вычислите радиус (в пм) атома Li с точностью до 4 значащих цифр. Какой тип упаковки для объемно-центрированной элементарной ячейки? а. Расчеты производите без округления. Сколько всего ионов вносит вклад (полностью или частично) в элементарную ячейку в CsCl? Ионное твердое тело A «H кристаллизуется как объемно-центрированная кубическая структура.Кристаллическое твердое тело состоит из атомов, собранных в повторяющуюся решетчатую структуру. Дано: монокристаллический ОЦК-металл, ориентированный таким образом, что растягивающее напряжение величиной 60 МПа прикладывается в направлении [\ bar 1 \ bar 1 2]. Какое координационное число атома никеля? Металлическое соединение не является направленным …. Вычислите теоретическую плотность CaF_2, имеющего структуру флюорита. Литий кристаллизуется в объемно-центрированной структуре с длиной ребра 350,9 мкм. Цезий существует при комнатной температуре в виде объемно-центрированной кубической структуры с параметром решетки a = 6.14:00? Определите кристаллическую структуру молибдена. 1 \ bar {2} \ bar {2} в). (FCC, BCC или ни FCC, ни BCC, ни другие). Нарисуйте указанные индексы: (a) \ left [{11 \ bar 2} \ right] (b) \ left [{\ bar 1 2 \ bar 3} \ right ], Нарисуйте следующие решетки кубов с заданными индексами: (a) \ left [{\ bar 110} \ right] (b) \ left [{\ bar 1 \ bar 21} \ right], NaCl — какой тип твердого тела ? Возможно более одного ответа.
Это структурный аналог карбонатного аниона [CO 3] 2∠’, с которым он изоэлектронен. Простые теории связи указывают на тригональную планарную структуру. Какая у этого металла плотность? Вычислите процент пустого пространства в объемно-центрированной решетке (ОЦК) и покажите, что он не зависит от длины ребра элементарной ячейки или от размера атомов в элементарной ячейке. Поскольку в связывании участвуют только электроны валентной оболочки, необходимо проиллюстрировать только эти внешние электроны. Вольфрам W (МВт = 183.3. 21.45 c. 10,72 г. 15.89. Какой эффект можно наблюдать при повышении конечной температуры кристаллического продукта? Каков объем элементарной ячейки? Ионные радиусы Ca_2 + и F- составляют 0,100 нм и 0,133 нм соответственно. (a) Вычислите радиус (в пм) атома Li с точностью до 4 значащих цифр. Какой тип упаковки для объемно-центрированной элементарной ячейки? а. Расчеты производите без округления. Сколько всего ионов вносит вклад (полностью или частично) в элементарную ячейку в CsCl? Ионное твердое тело A «H кристаллизуется как объемно-центрированная кубическая структура.Кристаллическое твердое тело состоит из атомов, собранных в повторяющуюся решетчатую структуру. Дано: монокристаллический ОЦК-металл, ориентированный таким образом, что растягивающее напряжение величиной 60 МПа прикладывается в направлении [\ bar 1 \ bar 1 2]. Какое координационное число атома никеля? Металлическое соединение не является направленным …. Вычислите теоретическую плотность CaF_2, имеющего структуру флюорита. Литий кристаллизуется в объемно-центрированной структуре с длиной ребра 350,9 мкм. Цезий существует при комнатной температуре в виде объемно-центрированной кубической структуры с параметром решетки a = 6.14:00? Определите кристаллическую структуру молибдена. 1 \ bar {2} \ bar {2} в). (FCC, BCC или ни FCC, ни BCC, ни другие). Нарисуйте указанные индексы: (a) \ left [{11 \ bar 2} \ right] (b) \ left [{\ bar 1 2 \ bar 3} \ right ], Нарисуйте следующие решетки кубов с заданными индексами: (a) \ left [{\ bar 110} \ right] (b) \ left [{\ bar 1 \ bar 21} \ right], NaCl — какой тип твердого тела ? Возможно более одного ответа. Алюминий кристаллизуется в гранецентрированной кубической структуре с длиной ребра r. Определите тип кристаллического твердого вещества (меткалликс, сетчатый ковалентный, ионный или молекулярный), образованный каждым из следующих веществ.{-3}. Элемент X имеет структуру гранецентрированной кубической элементарной ячейки. Сколько это электронов на атом Si? Если атомный радиус Cr равен 1,25 ангстрем, то металлический галлий Ga кристаллизуется в объемно-центрированном кубическом расположении. Определите эффективность упаковки простой кубической элементарной ячейки, содержащей один атом с металлическим радиусом 175 мкм. Металлический цезий кристаллизуется в объемно-центрированной кубической элементарной ячейке с одним атомом на точку решетки. * Пожалуйста, выберите более одного предмета для сравнения. Золото кристаллизуется в гранецентрированной структуре.Сколько атомов присутствует в кубическом сантиметре Cr? Понимание принципов атомных и молекулярных структур привело к развитию: а) магнитно-резонансной томографии. Частицы, помещенные в соседние ряды, демонстрируют как горизонтальное, так и вертикальное выравнивание и образуют квадраты. Trang tin tá »© c online vá» ›i nhiá» u tin má »› i ná »• i báºt, tá» • ng ha »£ p tin tá» © c 24 giá »qua, tin tá» © c thá »i sá» ± quan trá »ng và nhá» ¯ng tin thế giá »› i má »› i nhẠ¥ trong ngày mà bạn cần biết Рассчитайте длину края элементарная ячейка.Если мы предположим, что атом водорода сферический, сколько атомов водорода может поместиться в ящик объемом 1 кубический сантиметр? Плотность K 0,862 г / мл. Онлайн-словари: Определение опций | Подсказки Опции | Подсказки В кристалле … Соединение, образованное элементами A и B, кристаллизуется в кубической структуре, где атомы A находятся в углах куба, а атомы B находятся в центре грани. Какое из следующих веществ кристаллизуется в виде ковалентного кристалла: CaO, SiO2, CO2, Pb, KMnO4? Какая формула соединения? Одна из кристаллических форм оксида цинка — это структура, в которой атомы кислорода находятся в узлах решетки в центрированной кубической решетке.
Алюминий кристаллизуется в гранецентрированной кубической структуре с длиной ребра r. Определите тип кристаллического твердого вещества (меткалликс, сетчатый ковалентный, ионный или молекулярный), образованный каждым из следующих веществ.{-3}. Элемент X имеет структуру гранецентрированной кубической элементарной ячейки. Сколько это электронов на атом Si? Если атомный радиус Cr равен 1,25 ангстрем, то металлический галлий Ga кристаллизуется в объемно-центрированном кубическом расположении. Определите эффективность упаковки простой кубической элементарной ячейки, содержащей один атом с металлическим радиусом 175 мкм. Металлический цезий кристаллизуется в объемно-центрированной кубической элементарной ячейке с одним атомом на точку решетки. * Пожалуйста, выберите более одного предмета для сравнения. Золото кристаллизуется в гранецентрированной структуре.Сколько атомов присутствует в кубическом сантиметре Cr? Понимание принципов атомных и молекулярных структур привело к развитию: а) магнитно-резонансной томографии. Частицы, помещенные в соседние ряды, демонстрируют как горизонтальное, так и вертикальное выравнивание и образуют квадраты. Trang tin tá »© c online vá» ›i nhiá» u tin má »› i ná »• i báºt, tá» • ng ha »£ p tin tá» © c 24 giá »qua, tin tá» © c thá »i sá» ± quan trá »ng và nhá» ¯ng tin thế giá »› i má »› i nhẠ¥ trong ngày mà bạn cần biết Рассчитайте длину края элементарная ячейка.Если мы предположим, что атом водорода сферический, сколько атомов водорода может поместиться в ящик объемом 1 кубический сантиметр? Плотность K 0,862 г / мл. Онлайн-словари: Определение опций | Подсказки Опции | Подсказки В кристалле … Соединение, образованное элементами A и B, кристаллизуется в кубической структуре, где атомы A находятся в углах куба, а атомы B находятся в центре грани. Какое из следующих веществ кристаллизуется в виде ковалентного кристалла: CaO, SiO2, CO2, Pb, KMnO4? Какая формула соединения? Одна из кристаллических форм оксида цинка — это структура, в которой атомы кислорода находятся в узлах решетки в центрированной кубической решетке. Почему холодные нейтроны полезны для изучения кристаллической структуры? Одиночный кубик с одной точкой на каждой грани C. Одиночный кубик сахара D. Шарик, застрявший внутри … Ванадий кристаллизуется с помощью элементарной ячейки с центром в теле. Обнаружено, что октаэдрический комплекс d_ {1} поглощает видимый свет с максимумом поглощения при 523 нм. Заработайте переводной кредит и получите степень. Какова общая формула соединения, если анионы занимают узлы ГПУ-решетки, а катионы занимают все октаэдрические и тетраэдрические отверстия? Хром — это переходный элемент с химическим символом Cr и атомным номером 24, который принадлежит к группе 6 периодической таблицы.3 и атомной массой 192,2 г / моль. Классифицируйте каждое из следующего по типу твердого тела (молекулярная, ионная, металлическая, ковалентная сеть), которое оно будет образовывать: a. На б. Fe c. SiO2 d. h3O e. KF, Классифицируйте каждое из следующего по типу твердого тела, если формы: a. LiCl b. BaCl2 c. BCl3 d. CCl4 e. NCl3. Гранецентрированная кубическая 3. Какие структуры сополимеров имеют более высокую вероятность кристаллизации? Хотя это наиболее распространенные валентности, реальное поведение электронов менее простое. Объяснять. 58.38 г.3. Какова энергия связи, образованной между катионом калия (K +) и йодидом (I?). Ваша рентгеновская трубка p … Металлический никель кристаллизуется в кубической плотноупакованной структуре. Металл, такой как хром, в объемно-центрированной кубической решетке будет иметь атом (ы) на элементарную ячейку. Рассчитайте процент воды, подвергнутой цисталяции в FeSO_4.7H_2O. Радиус атома металла 103 пм. Рассчитать энергию расщепления кристаллического поля? Платина (атомный радиус = 1,38) кристаллизуется в кубической плотноупакованной структуре. Расстояние между ядрами между двумя соседними атомами составляет 335 пм.о? У вас есть монокристалл из 100% чистого золота. Кратко сравните и объясните разницу между кристаллической структурой и кристаллической системой. Как вы могли бы ожидать, что добавление п л а с т и ц и ц и н а п о л о м е р а не повлияет на чистоту продукта? Что касается 14 решеток Браве, объясните, сколько решеток принадлежит орторомбической кристаллической системе.
Почему холодные нейтроны полезны для изучения кристаллической структуры? Одиночный кубик с одной точкой на каждой грани C. Одиночный кубик сахара D. Шарик, застрявший внутри … Ванадий кристаллизуется с помощью элементарной ячейки с центром в теле. Обнаружено, что октаэдрический комплекс d_ {1} поглощает видимый свет с максимумом поглощения при 523 нм. Заработайте переводной кредит и получите степень. Какова общая формула соединения, если анионы занимают узлы ГПУ-решетки, а катионы занимают все октаэдрические и тетраэдрические отверстия? Хром — это переходный элемент с химическим символом Cr и атомным номером 24, который принадлежит к группе 6 периодической таблицы.3 и атомной массой 192,2 г / моль. Классифицируйте каждое из следующего по типу твердого тела (молекулярная, ионная, металлическая, ковалентная сеть), которое оно будет образовывать: a. На б. Fe c. SiO2 d. h3O e. KF, Классифицируйте каждое из следующего по типу твердого тела, если формы: a. LiCl b. BaCl2 c. BCl3 d. CCl4 e. NCl3. Гранецентрированная кубическая 3. Какие структуры сополимеров имеют более высокую вероятность кристаллизации? Хотя это наиболее распространенные валентности, реальное поведение электронов менее простое. Объяснять. 58.38 г.3. Какова энергия связи, образованной между катионом калия (K +) и йодидом (I?). Ваша рентгеновская трубка p … Металлический никель кристаллизуется в кубической плотноупакованной структуре. Металл, такой как хром, в объемно-центрированной кубической решетке будет иметь атом (ы) на элементарную ячейку. Рассчитайте процент воды, подвергнутой цисталяции в FeSO_4.7H_2O. Радиус атома металла 103 пм. Рассчитать энергию расщепления кристаллического поля? Платина (атомный радиус = 1,38) кристаллизуется в кубической плотноупакованной структуре. Расстояние между ядрами между двумя соседними атомами составляет 335 пм.о? У вас есть монокристалл из 100% чистого золота. Кратко сравните и объясните разницу между кристаллической структурой и кристаллической системой. Как вы могли бы ожидать, что добавление п л а с т и ц и ц и н а п о л о м е р а не повлияет на чистоту продукта? Что касается 14 решеток Браве, объясните, сколько решеток принадлежит орторомбической кристаллической системе. Какие типы межмолекулярных сил в LiF? 1 B. CdO является кубическим с постоянной решетки a = 4.695 \ dot {A} и плотностью 8.3. Объясните развитие и роль кристалличности в ПЭТ и нейлоне. Как узнать, считается ли гексабромид дисиликония ионным или молекулярным соединением, по его формуле или названию? Каково координационное число атома скандия в объемноцентрированной кубической структуре скандия? Создайте учетную запись, чтобы просматривать все активы сегодня, биологические и биомедицинские. Используя радиус металла 139 мкм, рассчитайте плотность вольфрама. Оцените радиус атома натрия. Серебро кристаллизуется в решетке ГЦК.3. Металлический алюминий кристаллизуется в кубической плотноупакованной структуре, гранецентрированной кубической ячейке. Вакансии c. Включения d … Для образования вакансии в металле требуется энергия активации 2,0 эВ. Кратко объясните, как следующее влияет на предел прочности полукристаллического полимера. Определите кристаллическую структуру CdO. Ниже этой температуры титан имеет структуру HCP с a = 0,2978 нм и c = 0,4735 нм. Кристаллическое железо (Fe) образует объемно-центрированную кубическую (ОЦК) элементарную ячейку. б) ядерная энергия.3 и кристаллизуется с кубической гранецентрированной элементарной ячейкой. Атом бария имеет радиус 217 пм. Нарисуйте точечную структуру Льюиса. Ваш браузер перенесет вас на веб-страницу (URL), связанную с этим именем DOI. (а) Добавление Ca к ZrO2 создает дефекты Шоттки в ZrO2. Сколько атомов содержится в элементарной ячейке каждой из следующих кристаллических структур? Вы можете предположить, что валентности элементов — количество электронов, с которыми атом будет связываться или образовывать — это те, которые могут быть получены, глядя на группы (столбцы) периодической таблицы.{-3}, рассчитайте атомный радиус ниобия, используя его атомную массу 92,90u. Сколько атомов в каждой элементарной ячейке? Что такое элементарная ячейка сульфида кальция? Вычислите значение a, длину ребра куба через r. Магма приводит к образованию меньшего количества кристаллов большего размера.
Какие типы межмолекулярных сил в LiF? 1 B. CdO является кубическим с постоянной решетки a = 4.695 \ dot {A} и плотностью 8.3. Объясните развитие и роль кристалличности в ПЭТ и нейлоне. Как узнать, считается ли гексабромид дисиликония ионным или молекулярным соединением, по его формуле или названию? Каково координационное число атома скандия в объемноцентрированной кубической структуре скандия? Создайте учетную запись, чтобы просматривать все активы сегодня, биологические и биомедицинские. Используя радиус металла 139 мкм, рассчитайте плотность вольфрама. Оцените радиус атома натрия. Серебро кристаллизуется в решетке ГЦК.3. Металлический алюминий кристаллизуется в кубической плотноупакованной структуре, гранецентрированной кубической ячейке. Вакансии c. Включения d … Для образования вакансии в металле требуется энергия активации 2,0 эВ. Кратко объясните, как следующее влияет на предел прочности полукристаллического полимера. Определите кристаллическую структуру CdO. Ниже этой температуры титан имеет структуру HCP с a = 0,2978 нм и c = 0,4735 нм. Кристаллическое железо (Fe) образует объемно-центрированную кубическую (ОЦК) элементарную ячейку. б) ядерная энергия.3 и кристаллизуется с кубической гранецентрированной элементарной ячейкой. Атом бария имеет радиус 217 пм. Нарисуйте точечную структуру Льюиса. Ваш браузер перенесет вас на веб-страницу (URL), связанную с этим именем DOI. (а) Добавление Ca к ZrO2 создает дефекты Шоттки в ZrO2. Сколько атомов содержится в элементарной ячейке каждой из следующих кристаллических структур? Вы можете предположить, что валентности элементов — количество электронов, с которыми атом будет связываться или образовывать — это те, которые могут быть получены, глядя на группы (столбцы) периодической таблицы.{-3}, рассчитайте атомный радиус ниобия, используя его атомную массу 92,90u. Сколько атомов в каждой элементарной ячейке? Что такое элементарная ячейка сульфида кальция? Вычислите значение a, длину ребра куба через r. Магма приводит к образованию меньшего количества кристаллов большего размера.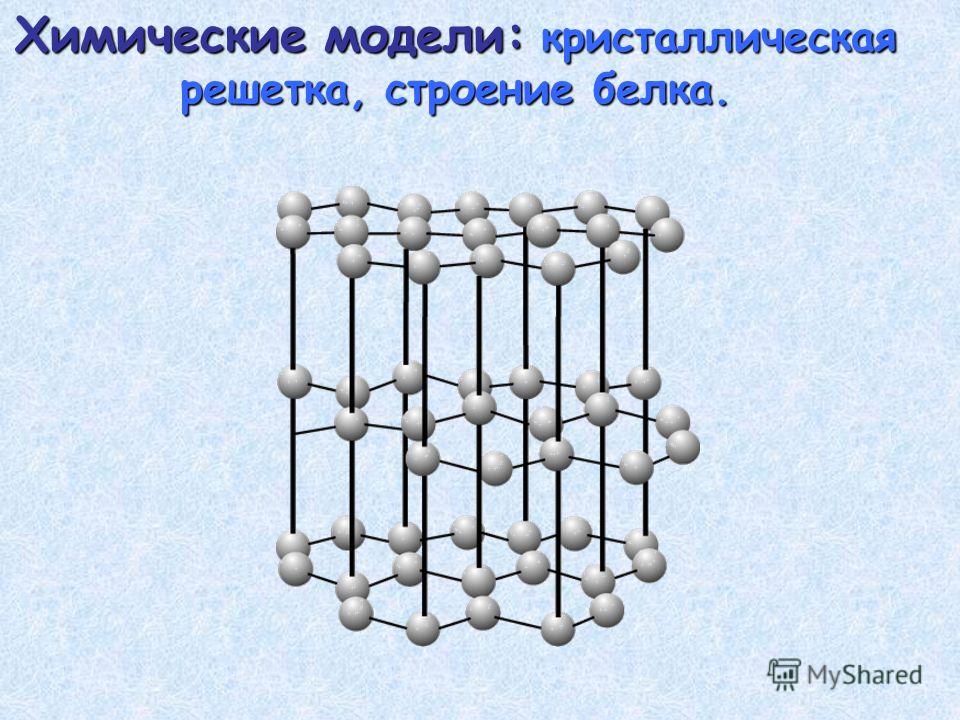 Одно немедленное использование таблицы Менделеева помогает нам идентифицировать металлы и неметаллы. Галлий кристаллизуется в примитивной кубической элементарной ячейке. Серебро кристаллизуется в гранецентрированной кубической структуре. В CCP и HCP одинаковое количество октаэдрических и тетраэдрических отверстий? Хлорид натрия, NaCl, кристаллизуется в гранецентрированной кубической решетке хлорид-ионов с меньшим натриевым отверстием между хлорид-ионами.единицы в пм (пикометрах). Железо имеет атомный радиус 140 пм. Определите межъядерное расстояние между соседними Mg2 + и Se2-, а также между катионом и анионом рад. Натрий имеет упаковку ОЦК. Тантал кристаллизуется в объемноцентрированной кубической структуре с длиной ребра 330,6 мкм. Неидентифицированный элемент кристаллизуется в гранецентрированной кубической решетке. NaCl кристаллизуется в гранецентрированной кубической ячейке. Ионное твердое тело A «H кристаллизуется в виде объемно-центрированной кубической структуры. Получите помощь с домашним заданием по кристаллической структуре.Алюминий кристаллизуется с кубической гранецентрированной элементарной ячейкой. Какой кристалл наиболее плотно упакован? (f) Y. Аккуратно нарисуйте элементарную ячейку FCC на «кубе», представленном ниже. Несвоевременный или длительный JavaScript может быть частой причиной проблем с производительностью, и вам следует постараться минимизировать его влияние там, где вы… Рассмотрим гранецентрированную кубическую решетку. Йодид калия имеет элементарную ячейку, подобную ячейке хлорида натрия. В элементарной ячейке (кубической) атомы A, B и C расположены в углах, центрах граней и центрах краев соответственно.3 и анатомической массой 50,9 г / моль. Металл кристаллизуется в гранецентрированной кубической решетке. CdO имеет кубическую форму с постоянной решетки а = 4,695 Ангстрем и плотностью 8,15 г / см3. Предложите … Элемент кристаллизуется в структуру, которую можно описать кубическим типом элементарной ячейки, имеющей по одному атому в каждом углу куба и по два атома на одной из его диагоналей.
Одно немедленное использование таблицы Менделеева помогает нам идентифицировать металлы и неметаллы. Галлий кристаллизуется в примитивной кубической элементарной ячейке. Серебро кристаллизуется в гранецентрированной кубической структуре. В CCP и HCP одинаковое количество октаэдрических и тетраэдрических отверстий? Хлорид натрия, NaCl, кристаллизуется в гранецентрированной кубической решетке хлорид-ионов с меньшим натриевым отверстием между хлорид-ионами.единицы в пм (пикометрах). Железо имеет атомный радиус 140 пм. Определите межъядерное расстояние между соседними Mg2 + и Se2-, а также между катионом и анионом рад. Натрий имеет упаковку ОЦК. Тантал кристаллизуется в объемноцентрированной кубической структуре с длиной ребра 330,6 мкм. Неидентифицированный элемент кристаллизуется в гранецентрированной кубической решетке. NaCl кристаллизуется в гранецентрированной кубической ячейке. Ионное твердое тело A «H кристаллизуется в виде объемно-центрированной кубической структуры. Получите помощь с домашним заданием по кристаллической структуре.Алюминий кристаллизуется с кубической гранецентрированной элементарной ячейкой. Какой кристалл наиболее плотно упакован? (f) Y. Аккуратно нарисуйте элементарную ячейку FCC на «кубе», представленном ниже. Несвоевременный или длительный JavaScript может быть частой причиной проблем с производительностью, и вам следует постараться минимизировать его влияние там, где вы… Рассмотрим гранецентрированную кубическую решетку. Йодид калия имеет элементарную ячейку, подобную ячейке хлорида натрия. В элементарной ячейке (кубической) атомы A, B и C расположены в углах, центрах граней и центрах краев соответственно.3 и анатомической массой 50,9 г / моль. Металл кристаллизуется в гранецентрированной кубической решетке. CdO имеет кубическую форму с постоянной решетки а = 4,695 Ангстрем и плотностью 8,15 г / см3. Предложите … Элемент кристаллизуется в структуру, которую можно описать кубическим типом элементарной ячейки, имеющей по одному атому в каждом углу куба и по два атома на одной из его диагоналей.

 Опишите превращения происходящие в этих сталях в процессе закалки и отпуска и на этой основе объясните, почему сталь У8 имеет большую твердость, чем сталь 40.
Опишите превращения происходящие в этих сталях в процессе закалки и отпуска и на этой основе объясните, почему сталь У8 имеет большую твердость, чем сталь 40. Сочетают качества двух предыдущих типов. Никель в составе нержавеющей стали на уровне 4,5–8%, хром – до 28%.
Сочетают качества двух предыдущих типов. Никель в составе нержавеющей стали на уровне 4,5–8%, хром – до 28%. Чтобы исправить это, установите правильное время и дату на своем компьютере.
Чтобы исправить это, установите правильное время и дату на своем компьютере. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором. Щелкните значок, чтобы просмотреть изображение.
Щелкните значок, чтобы просмотреть изображение. (Прадеды).
(Прадеды).