Марганец и его соединения
Re и Tc стоят в ряду напряжений после водорода. Они реагируют только с азотной
кислотой:
3Tc + 7HNO3 → 3HTcO4 + 7NO↑ + 2h3O
2.С увеличением степени окисления усиливается кислотный характер оксидов и гидроксидов. (RO – основные; R2O7 – кислотные, им соответствуют кислоты HRO4).
Марганец
Электронная конфигурация валентного слоя
Получение
Алюмотермия: 3MnO2 + 4Al → 2Al2O3 + 3Mn
Химические свойства
Металл средней активности. На воздухе покрывается тонкой плёнкой оксидов. Реагирует с неметаллами, например, с серой:
Mn + S → MnS
Растворяется в кислотах:
Mn + 2HCl → MnCl2 + h3↑
(При этом образуются соединения двухвалентного марганца).
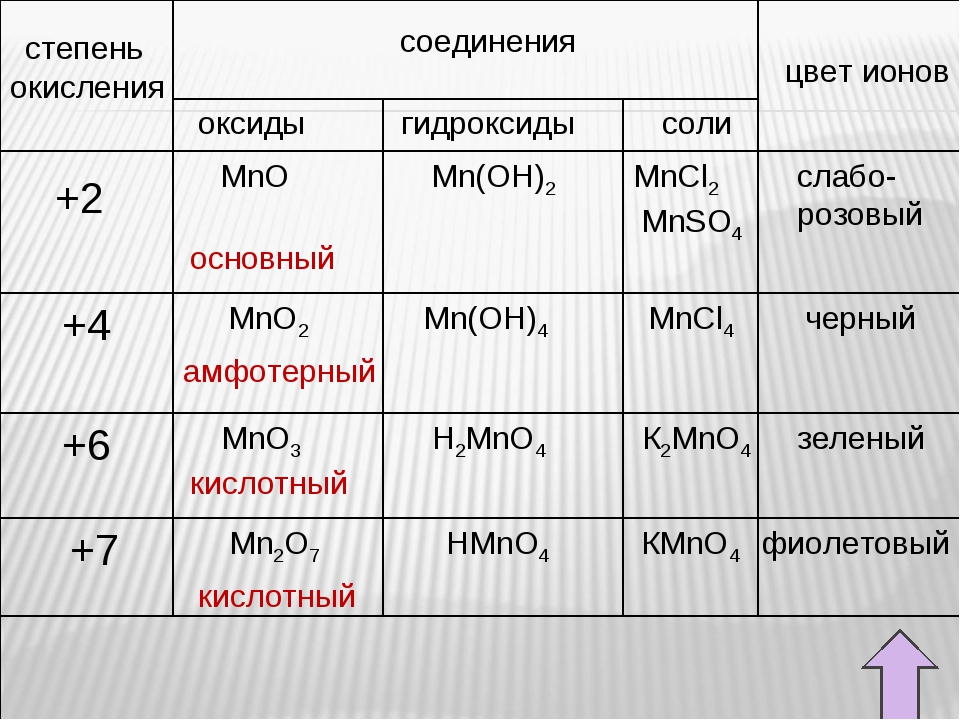
Соединения Mn(II)
Оксид марганца (II) MnO получается восстановлением природного пиролюзита MnO2
водородом:
MnO2 + h3 → MnO + h3O
Гидроксид марганца (II) Mn(OH)2 — светло-розовое нерастворимое в воде основание:
MnSO4 + 2NaOH → Mn(OH)2↓ + Na2SO4
Легко растворимо в кислотах:
Mn(OH)2 + 2HCl → MnCl2 + 2h3O
Mn(OH)2 + 2H+ → Mn2+ + 2h3O
На воздухе Mn(OH)2 быстро темнеет в результате окисления:
2Mn(OH)2 + O2 + 2h3O → 2[MnO2 • 2h3O]
При действии сильных окислителей наблюдается переход Mn2+ в MnO4-:
2Mn(OH)2 + 5Br2 + 12NaOH –кат. CuSO4→ 2NaMnO4 + 10NaBr + 8h3O
CuSO4→ 2NaMnO4 + 10NaBr + 8h3O
2Mn(NO3)2 + 5PbO2 + 6HNO3 → 2HMnO4 + 5Pb(NO3)2 + 2h3O
2Mn(NO3)2 + 5NaBiO3 + 16HNO3 → 2HMnO4 + 5NaNO2 + 5Bi(NO3)3 + 7h3O
(смотри тему «Окислительно — восстановительные реакции», упражнения 3 и 7).
Оксид марганца (IV) MnO2 — тёмно-коричневый порошок, нерастворимый в воде. Образуется
при термическом разложении нитрата марганца (II):
Mn(NO3)2 –t°→ MnO2 + 2NO2↑
При сильном нагревании теряет кислород, превращаясь в Mn2O3 (при 600°C) или Mn3O4 (при
1000°C).
Сильный окислитель:
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2h3O
При сплавлении с содой и селитрой образует манганат натрия тёмно — зелёного цвета:
MnO2 + Na2CO3 + NaNO3 –t°→ Na2MnO4 + NaNO2 + CO2↑
Манганаты также могут быть получены при восстановлении перманганатов в щелочной среде:
Na2SO3 + 2KMn+7O4 + 2KOH → Na2SO4 + 2K2Mn+6O4 + h3O
Гидролиз манганатов протекает по схеме:
3K2MnO4 + 2h3O ↔ 2KMnO4 + MnO2 + 4KOH
MnO2 | MnO42- | MnO4- |
SO32- | Cl2 |
|
←–– | ––→ |
|
раствор | ← | ← |
→ | раствор | раствор |
бурый | H+↑↓OH- |
|
осадок |
|
|
раствор→
бурый осадок
3MnO42- + 2h3O ↔ 2MnO4- + MnO2 + 4OH-
За способность обратимо менять окраску манганат калия называют «минеральным хамелеоном».
Оксид марганца (VII) Mn2O7 — тёмно-зелёная жидкость, кислотный оксид. Получают действием
концентрированной серной кислоты на кристаллический KMnO4 (марганцевая кислота HMnO4 нестабильна):
2KMnO4 + h3SO4 → Mn2O7↓ + K2SO4 + h3O
При растворении в щелочах образует перманганаты:
Mn2O7 + 2KOH → 2KMnO4 + h3O
Марганец и его соединения
Цели урока:
Обучающая – изучение и закрепление нового материала по данной теме, а также обучение навыкам самостоятельной работы с конспектом, справочной литературой, компьютерным текстом и тестами, применение теоретических знаний к решению задач и объяснению результатов проведенных опытов;
Развивающая – развитие умений анализировать и делать выводы, устанавливать причины полученных результатов, развитие навыков самостоятельной и коллективной работы;
Воспитательная – привитие
интереса к изучаемому предмету, к
самоорганизации и культуре труда, а также
чувства бережного отношения к природным
ресурсам и охраны окружающей среды.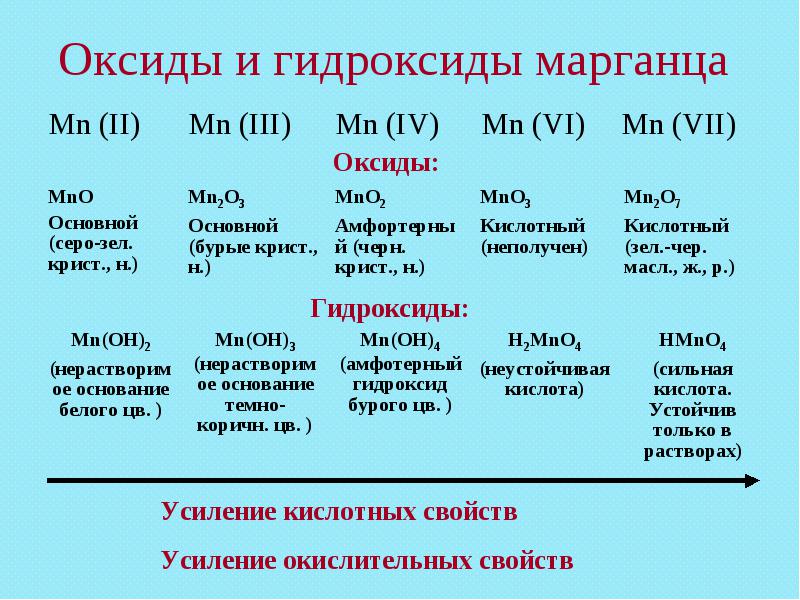
Наглядные пособия: таблицы “Периодическая система Д.И.Менделеева”, “Электрохимический ряд напряжений металлов”, “Растворимость соединений”, карточки-задания с уравнениями реакций, с цепочками превращений, методическое пособие “Окислительно-восстановительные реакции”, учебники;
Компьютерное обучение: компакт-диск “Общая и неорганическая химия” (раздел “Характеристика d-элементов”).
Ход занятия
I. Организационный момент.
Приветствие, отметка в журнале отсутствующих, ознакомление с темой и планом работы на данном занятии.
II. Повторение.
Преподаватель напоминает, что мы
продолжаем изучать свойства d-элементов. Какие
d-элементов (переходные) мы уже прошли? (правильно,
это элементы I-ой группы – серебро, медь, II-ой
группы – цинк, ртуть, элемент VI-ой группы — хром).
III. Объяснение нового материала.
(По ходу объяснения материала учащиеся ведут записи в своих тетрадях, т.е. составляют конспект лекций – подготовка к традиционному вузовскому обучению. Кроме этого, постоянно идет диалог учитель-ученик для лучшего понимания и усвоения нового материала).
Итак, давайте вместе составим
электронную конфигурацию валентных электронов
для марганца.
Далее для приобретения навыков
самостоятельного поиска необходимой информации
по книгам, справочникам, Интернету учитель
заранее попросил некоторых учащихся подготовить
несколько интересных сообщений по заданной теме
(учащиеся вызываются к доске и рассказывают свое
сообщение, причем одновременно остальные
ученики конспектируют излагаемый материал. По
ходу такого объяснения к докладчикам задаются
вопросы, а также учитель своими наводящими
вопросами просит более подробно объяснить смысл
излагаемого материала для лучшего понимания как
самим докладчиком, так и остальными учащимися).
Например, учитель говорит: “А теперь, давайте рассмотрим историю открытия данного элемента”. Выходит 1-й докладчик по данной теме < Приложение1> (история открытия марганца). 2-й докладчик выступает по теме “Нахождение марганца в природе”, 3-й – “Получение”.
После работы с сообщениями учитель дает лекционный материл по разделу “Химические свойства марганца” < Приложение1> (Физические и химические свойства).
Заканчивается прохождение новой темы выступлением учащегося по применению марганца и его биологической роли < Приложение1> (Применение, биологическая роль).
IV. Закрепление пройденного материала.

Каждая группа получает некоторое задание, в ходе выполнения которого идет активная проработка нового и закрепление пройденного раннее материала, поиск нестандартных решений, формируются чувства коллективизма, навыки самостоятельной работы.
Задание группе -теоретиков. После занятий в классе на рабочем столе был найден листок с написанными уравнениями химических реакций. Середину листа закрывало большое коричневое пятно. Попробуйте восстановить уравнения.
Задание группе –экспериментаторов [4]. Даны следующие вещества: KI, H2SO4, KMnO4, NaOH, FeSO4 ·7H2O, H2O2, H2O.
1.Назовите указанные вещества.
2.Выберите те из них, которые относятся к :
а) окислителям;
б) восстановителям.
3. Вспомните влияние среды на характер протекания ОВР и напишите уравнения полуреакций в ионном виде для следующих веществ:
Превращения KMnO4 в:
а) кислой среде;
б) щелочной среде;
в) нейтральной среде;
Превращения Н2О2 в:
а) кислой среде;
б) щелочной среде.
4. Напишите все возможные ОВР между указанными вначале веществами в молекулярной форме. Уравняйте их методом электронно-ионного баланса. Укажите на количественный критерий возможности протекания данных ОВР (использование справочника).
Продолжение статьи
Приложение
Марганец и его соединения реферат по химии
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА И ПРОДОВОЛЬСТВИЯ РФ ВГСХА КАФЕДРА ХИМИИ Реферат на тему: Выполнил: студент первого курса инженерного факультета 15 б группы Кошманов В.В. Проверил: Харченко Н.Т. Великие Луки 1998г. Содержание: Историческая справка. 3 Распространение в природе. 3 Физические и химические свойства. 3 Соединения двухвалентного марганца. 4 Соединения четырёхвалентного марганца. 4 Соединения шестивалентного марганца. 5 Соединения семивалентного марганца. 5 Получение. 6 Применение марганца и его соединений. 6 Литература. 7 1 Историческая справка. Минералы Марганца известны издавна. Древнеримский натуралист Плиний упоминает о чёрном камне, который использовали для обесцвечивания жидкой стеклянной массы; речь шла о минерале пиролюзите MnO2. В Грузии пиролюзит с древнейших времён служил присадочным материалом при получении железа. Долгое время пиролюзит называли чёрной магнезией и считали разновидностью магнитного железняка. В 1774 году К.Шелле доказал, что это соединение неизвестного металла, а другой шведский учёный Ю.Гаи, сильно нагревая смесь пиролюзита с углём, получил Марганец загрязнённый углеродом. Название Марганец традиционно происходит от немецкого Marganerz- марганцевая руда. Распространение в природе. Среднее Содержание Марганца в земной коре 0.1%, в большинстве изверженных пород 0.06-0.2% по массе, где он находится в рассеянном состоянии в форме Mn2+ (аналог Fe2+). На земной поверхности Mn2+ легко окисляется, здесь известны также минералы Mn3+ и Mn4+. В биосфере Марганец энергично мигрирует в восстановительных условиях и малоподвижен в окислительных условиях.
Минералы Марганца известны издавна. Древнеримский натуралист Плиний упоминает о чёрном камне, который использовали для обесцвечивания жидкой стеклянной массы; речь шла о минерале пиролюзите MnO2. В Грузии пиролюзит с древнейших времён служил присадочным материалом при получении железа. Долгое время пиролюзит называли чёрной магнезией и считали разновидностью магнитного железняка. В 1774 году К.Шелле доказал, что это соединение неизвестного металла, а другой шведский учёный Ю.Гаи, сильно нагревая смесь пиролюзита с углём, получил Марганец загрязнённый углеродом. Название Марганец традиционно происходит от немецкого Marganerz- марганцевая руда. Распространение в природе. Среднее Содержание Марганца в земной коре 0.1%, в большинстве изверженных пород 0.06-0.2% по массе, где он находится в рассеянном состоянии в форме Mn2+ (аналог Fe2+). На земной поверхности Mn2+ легко окисляется, здесь известны также минералы Mn3+ и Mn4+. В биосфере Марганец энергично мигрирует в восстановительных условиях и малоподвижен в окислительных условиях. Наиболее подвижен Марганец в кислых водах тундры и лесных ландшафтах, где он находится в форме Mn2+. Содержание Марганца здесь часто повышенно и культурные растения местами страдают от избытка Марганца; в почвах, озёрах, болотах образуются железно марганцовые конкуренции, озёрные и болотные 2 В семивалентном состоянии марганец проявляет только окислительные свойства. Среди применяемых в лабораторной практике и в промышленности окислителей широко применяется перманганат калия KMnO2, в быту называемый марганцовкой. Перманганат калия представляет собой кристаллы чёрно- фиолетового цвета. Водные растворы окрашены в фиолетовый цвет, характерный для иона MnO4-. Перманганаты являются солями марганцевой кислоты, которая устойчива только в разбавленных растворах (до 20%). Эти растворы могут быть получены действием сильных окислителей на соединения марганца двухвалентного: 2Mn(NO3) 2+PbO2+6HNO3 2HMnO4+5Pb(NO3) 2+ 2h3O При концентрации HMnO4 выше 20% происходит разложение её по уравнению: 4HMnO4 4MnO+3O2 +2h3O Соответствующий марганцевой кислоте марганцевый ангидрид, или оксид марганца (VII), Mn2O7 может быть получен путем воздействия концентрированной серной кислоты на перманганат калия.
Наиболее подвижен Марганец в кислых водах тундры и лесных ландшафтах, где он находится в форме Mn2+. Содержание Марганца здесь часто повышенно и культурные растения местами страдают от избытка Марганца; в почвах, озёрах, болотах образуются железно марганцовые конкуренции, озёрные и болотные 2 В семивалентном состоянии марганец проявляет только окислительные свойства. Среди применяемых в лабораторной практике и в промышленности окислителей широко применяется перманганат калия KMnO2, в быту называемый марганцовкой. Перманганат калия представляет собой кристаллы чёрно- фиолетового цвета. Водные растворы окрашены в фиолетовый цвет, характерный для иона MnO4-. Перманганаты являются солями марганцевой кислоты, которая устойчива только в разбавленных растворах (до 20%). Эти растворы могут быть получены действием сильных окислителей на соединения марганца двухвалентного: 2Mn(NO3) 2+PbO2+6HNO3 2HMnO4+5Pb(NO3) 2+ 2h3O При концентрации HMnO4 выше 20% происходит разложение её по уравнению: 4HMnO4 4MnO+3O2 +2h3O Соответствующий марганцевой кислоте марганцевый ангидрид, или оксид марганца (VII), Mn2O7 может быть получен путем воздействия концентрированной серной кислоты на перманганат калия. Этот оксид является ещё более сильным окислителем, чем HMnO4 и KMnO4. Органические соединения при с Mn2O2 самовоспламеняются. При растворении Mn2O2 в воде образуется марганцевая кислота. Из-за неустойчивости и крайне высокой реакционной способности Mn2O2 не применяют, а вместо него используют твердые перманганаты. В зависимости от среды перманганат калия может восстанавливаться до различных соединений. При нагревании сухого перманганата калия до температуры выше 200 ОС он разлагается. 2KMnO4 K2MnO4 + MnO2 + O2 Этой реакцией в лаборатории иногда пользуются для получения кислорода. Получение. Наиболее чистый марганец получают в промышленности, по способу советского электрохимика Р. И. Агладзе (1939), электролизом водных растворов MnSO4 с добавкой (Nh5)2SO4 при pH = 8.0 — 8.5. Процесс ведут с анодами из свинца и катодами из титанового сплава АТ-3 или нержавеющей стали. Чешуйки марганца снимают с катодов и если надо переплавляют. Менее чистый марганец получают алюминотермией, а также электротермией.
Этот оксид является ещё более сильным окислителем, чем HMnO4 и KMnO4. Органические соединения при с Mn2O2 самовоспламеняются. При растворении Mn2O2 в воде образуется марганцевая кислота. Из-за неустойчивости и крайне высокой реакционной способности Mn2O2 не применяют, а вместо него используют твердые перманганаты. В зависимости от среды перманганат калия может восстанавливаться до различных соединений. При нагревании сухого перманганата калия до температуры выше 200 ОС он разлагается. 2KMnO4 K2MnO4 + MnO2 + O2 Этой реакцией в лаборатории иногда пользуются для получения кислорода. Получение. Наиболее чистый марганец получают в промышленности, по способу советского электрохимика Р. И. Агладзе (1939), электролизом водных растворов MnSO4 с добавкой (Nh5)2SO4 при pH = 8.0 — 8.5. Процесс ведут с анодами из свинца и катодами из титанового сплава АТ-3 или нержавеющей стали. Чешуйки марганца снимают с катодов и если надо переплавляют. Менее чистый марганец получают алюминотермией, а также электротермией. Добыча марганцевой руды в СССР. 1913 1940 1950 1960 1970 1972 1245т 2557т 3377т 5872т 6841т 7819т 5 Применение марганца и его соединений. Марганец в большом количестве применяется в металлургии в процессе получения сталей для удаления из них серы и кислорода. Однако в расплав добавляют не марганец, а справ железа с марганцем — ферромарганец, который получают восстановлением пиролюзита углём. Добавки марганца к сталям повышают их устойчивость к износу и механическим напряжениям. В сплавах цветных металлов марганец увеличивает их прочность и устойчивость к коррозии. Диоксид марганца используют в качестве катализатора в процессах окисления аммиака, органических реакциях и реакциях разложения неорганических солей. В керамической промышленности MnO2 используют для окрашивания эмалей и глазурей в черный и тёмно-коричневый цвет. Высокодисперсный MnO2 обладает хорошей адсорбирующей способностью и применяется для очистки воздуха от вредных примесей. Перманганат калия применяют для отбеливания льна и шерсти, обесцвечивания технологических растворов, как окислитель органических веществ.
Добыча марганцевой руды в СССР. 1913 1940 1950 1960 1970 1972 1245т 2557т 3377т 5872т 6841т 7819т 5 Применение марганца и его соединений. Марганец в большом количестве применяется в металлургии в процессе получения сталей для удаления из них серы и кислорода. Однако в расплав добавляют не марганец, а справ железа с марганцем — ферромарганец, который получают восстановлением пиролюзита углём. Добавки марганца к сталям повышают их устойчивость к износу и механическим напряжениям. В сплавах цветных металлов марганец увеличивает их прочность и устойчивость к коррозии. Диоксид марганца используют в качестве катализатора в процессах окисления аммиака, органических реакциях и реакциях разложения неорганических солей. В керамической промышленности MnO2 используют для окрашивания эмалей и глазурей в черный и тёмно-коричневый цвет. Высокодисперсный MnO2 обладает хорошей адсорбирующей способностью и применяется для очистки воздуха от вредных примесей. Перманганат калия применяют для отбеливания льна и шерсти, обесцвечивания технологических растворов, как окислитель органических веществ. В медицине применяют некоторые соли марганца. Например, перманганат калия применяют как антисептическое средство в виде водного раствора, для промывания ран, полоскания горла, смазывания язв и ожогов. Раствор KMnO4 применяют и внутрь при некоторых случаях отравления алкалоидами и цианидами. Марганец является одним из активнейших микроэлементов и встречается почти во всех растительных и живых организмах. Он улучшает процессы кроветворения в организмах. Не стоит забывать, что соединения марганца могут оказывать токсичное действие на организм человека. Предельно допустимая концентрация марганца в воздухе 0.3 мг/м3. При выраженном отравлении наблюдается поражение нервной системы с характерным синдромом марганцевого парксинсонизма. Список литературы: 1. Большая советская энциклопедия. 2. Ю.М.Шилов, Ю.И.Смушкевич, П.М.Чукуров, М.И.Тарасенко, «Общая химия», М.,1983г. 6
В медицине применяют некоторые соли марганца. Например, перманганат калия применяют как антисептическое средство в виде водного раствора, для промывания ран, полоскания горла, смазывания язв и ожогов. Раствор KMnO4 применяют и внутрь при некоторых случаях отравления алкалоидами и цианидами. Марганец является одним из активнейших микроэлементов и встречается почти во всех растительных и живых организмах. Он улучшает процессы кроветворения в организмах. Не стоит забывать, что соединения марганца могут оказывать токсичное действие на организм человека. Предельно допустимая концентрация марганца в воздухе 0.3 мг/м3. При выраженном отравлении наблюдается поражение нервной системы с характерным синдромом марганцевого парксинсонизма. Список литературы: 1. Большая советская энциклопедия. 2. Ю.М.Шилов, Ю.И.Смушкевич, П.М.Чукуров, М.И.Тарасенко, «Общая химия», М.,1983г. 6
Марганец и его соединения — презентация онлайн
1. Марганец и его соединения
МАРГАНЕЦ И ЕГОСОЕДИНЕНИЯ
2.
 Нахождение в природе В земной коре — около 0,1 % марганца по
Нахождение в природе В земной коре — около 0,1 % марганца помассе.
В свободном виде марганец не встречается.
Из руд наиболее распространены:
пиролюзит — MnO2(63,2 %),
манганит — MnO2·Mn(OH)2 (62,5 %),
браунит — Mn2O3 (69,5 %),
родохрозит — MnCО3 (47,8 %),
псиломелан — mMnO·MnO2·nh3O (45—60%).
3. Нахождение в природе
ПиролюзитБраунит
Мангинит
Родохрозит
Псиломелан
4. Нахождение в природе
Марганец содержат марганцевые конкреции,которые находятся на дне Тихого,
Атлантического и Индийского океанов.
В морской воде содержится около 1,0·10–8 %
марганца.
5. Строение атома
5525
Mn
+ 25
n= 30
6
) ) ) )
2 8 13 2
5
6
1s² 2s² 2p 3s² 3p 3d 4s²
4s
2
N=4
↓↑
↑ ↑ ↑ ↑ ↑
↓↑ ↓↑ ↓↑
N=3
↓↑
↓↑ ↓↑ ↓↑
N=2
↓↑
N=1
↓↑
+2, +3, +4, +6, +7
6. Физические свойства
Марганец — твердый хрупкий металлT плавления = 1244°C
Т кипения = 2080°C
Серебристо-белого цвета с розовым отливом
•На воздухе покрывается
оксидной пленкой
7.
 Химические свойства марганца Порошкообразный марганец сгорает в
Химические свойства марганца Порошкообразный марганец сгорает вкислороде:
Mn + O2 → MnO2
При нагревании разлагает воду,
вытесняя водород:
Mn + 2h3O →Mn(OH)2 + h3↑
Углерод реагирует с расплавленным
марганцем, образуя карбиды Mn3C:
3Mn + C → Mn3C
8. Химические свойства марганца
При нагревании реагирует с серой ифосфором:
Mn + S
MnS (MnS2)
3Mn + 2P
Mn3P2
C оксидами металлов:
5Mn + Nb2O5
5MnO + 2Nb
Образует также силициды, бориды,
фосфиды.
9. Химические свойства марганца
C соляной и серной кислотами реагирует поуравнению:
Mn + 2H+ → Mn2+ + h3↑
С концентрированной серной кислотой:
Mn + 2h3SO4(конц.) → MnSO4 + SO2↑ + 2h3O
С разбавленой азотной кислотой:
3Mn + 8HNO3(разб.) → 3Mn(NO3)2 + 2NO↑ + 4h3O
В щелочном растворе марганец устойчив.
10. Применение
Более 90% производимого марганцаидет в черную металлургию:
— как добавку к сталям для
раскисления;
— для легирования сталей;
— в медных, алюминиевых и магниевых сплавах.

Покрытия из марганца на
металлических поверхностях
обеспечивают их антикоррозионную
защиту.
11. Биологическая роль марганца
Марганец содержится в организмах всехрастений и животных, он оказывает
значительное влияние на жизнедеятельность,
то есть является микроэлементом.
Марганец оказывает влияние
на рост, образование крови и
функции половых желёз.
12. Содержание в живых и растительных организмах
Особо богаты марганцемлистья свёклы — до 0,03 %.
В организмах рыжих муравьёв
— до 0,05 %.
Некоторые бактерии содержат до нескольких
процентов марганца.
13. Оксиды и гидроксиды марганца
Mn (II)Mn (III)
Mn (IV)
Mn (VI)
Mn (VII)
Оксиды:
MnO
Основный
(серо-зел.
крист., н.)
Mn2O3
Основный
(бурые крист.,
н.)
MnO2
Амфортерный
(черн. крист.,
н.)
MnO3
Кислотный (не
получен)
Mn2O7
Кислотный
(зел.
 -чер.
-чер.масл., ж., р.)
h3MnO4
(неустойчивая
кислота)
HMnO4
(сильная
кислота.
Устойчив
только в
растворах)
Гидроксиды:
Mn(OH)2
(нерастворимо
е основание
белого цв. )
Mn(OH)3
(нерастворимо
е основание
темно-коричн.
цв. )
Mn(OH)4
(амфотерный
гидроксид
бурого цв. )
Усиление кислотных свойств
Усиление окислительных свойств
14. Соединения марганца (II)
Mn+2O (основный оксид) – порошокзелёно-серого цвета, нерастворим в воде.
Оксид марганца может быть получен при
разложении карбоната марганца:
MnCO3 = MnO+CO2
Либо при восстановлении диоксида
марганца водородом:
MnO2+h3 = MnO+h3O
15. Соединения марганца (II)
Mn+2(OH)2 (основание) – белый осадок.При растворении в воде (при
нагревании)образуется гидроксид Mn(II):
Mn+2HOH =Mn(OH)2+h3
Гидроксид марганца можно получить в виде
белого осадка при действии на растворы солей
двухвалентного марганца щелочью:
MnSO4+2NaOH =Mn(OH)2 +Na2SO4
16.
 Соединения марганца (II) Соединения Mn(II) на воздухе неустойчивы, и
Соединения марганца (II) Соединения Mn(II) на воздухе неустойчивы, иMn(OH)2 на воздухе быстро буреет,
превращаясь в оксид-гидроксид
четырёхвалентного марганца.
2Mn(OH)2+O2 =MnO2 + 2Н2O
Гидроксид марганца проявляет только
основные свойства и не реагирует со щелочами,
а при взаимодействии с кислотами даёт
соответствующие соли.
Mn(OH)2+2HCl =MnCl2+2h3O
17. Соединения марганца (IV)
Mn+4O2Образуется при разложении нитрата марганца(II)
пиролюзит — (амфотерный) — вещество чёрного цвета.
Mn(NO3)2 = MnO2+2NO2
Под действием сильных окислителей в сплаве со щёлочью переходит
в с. о. +6
MnO2 + Na2CO3 +NaNO3 →Na2MnO4+ NaNO2+CO2
MnО2 может окислять галогениды и галогенводороды в кислой
среде и переходит в с.о. +2 :
MnO2+4HCl =MnCl2+Cl2+2h3O
18. Соединения марганца (VI)
Mn+6O3h3Mn+6O4
проявляют кислотный характер,
в свободном виде не получены.
Степень окисления + 6 у марганца наименее устойчива: существует только с
сильнощелочном растворе в виде солей зелёного цвета – МАНГАНАТОВ
МАНГАНАТЫ получают при восстановлении перманганатов в щелочной среде
2KMnO4 = K2MnO4 + MnO2 + O2
Na2SO3 +2KMnO4 + KOH=Na2SO4+K2MnO4+h3O
MnO2+2KOH+KNO3 = K2MnO2+KNO2+h3O
или при окислении солей и оксидов марганца +2 и +4 сильными окислителями
в присутствии щёлочи:
MnSO4 + 2KClO3 + 12KOH = 3K2MnO4 + 2KCl +3K2SO4 +6h3O
19.
 Соединения марганца (VI) Водой манганаты быстро разлагаются
Соединения марганца (VI) Водой манганаты быстро разлагаются(диспропорционируют на +7 и +4)
2K2MnO4 + 2Н2О = KMnO4 + MnO2 + 4КОН
Манганаты окисляются хлором
2K2MnO4 + Cl2 = KMnO4 + 4КCl
20. Соединения марганца (VII)
Mn2+7O7 (кислотный) — жидкое маслянистоевещество тёмно-зелёного цвета, очень неустойчивое; в
смеси с концентрированной серной кислотой
воспламеняет органические вещества. При 90 °C
Mn2O7 разлагается со взрывом.
Получение:
2KMnO4 + h3SO4 = Mn2O7 + K2SO4 + h3O
При растворении в щелочах образует
перманганаты:
Mn2O7 + 2KOH = 2KMnO4 + h3O
21. Соединения марганца (VII)
HMn+7O4 – марганцевая кислота — одна из самыхсильных кислот.
марганцевая кислота устойчива только в разбавленных
растворах (до 20%). Эти растворы могут быть получены
действием сильных окислителей на соединения марганца
двухвалентного:
2Mn(NO3)2+PbO2+6HNO3=2HMnO4+5Pb(NO3)2+2h3O
При концентрации HMnO4 выше 20% происходит
разложение её по уравнению:
4HMnO4 = 4MnO+3O2 +2h3O
22.
 Соединения марганца (VII) В семивалентном состоянии марганец проявляет
Соединения марганца (VII) В семивалентном состоянии марганец проявляеттолько окислительные свойства. Среди
применяемых в лабораторной практике и в
промышленности окислителей широко применяется
перманганат калия KMnO4, в быту называемый
марганцовкой. Перманганат калия представляет
собой кристаллы чёрно-фиолетового цвета. Водные
растворы окрашены в фиолетовый цвет,
характерный для иона MnO4-.
23. Соединения марганца (VII)
При нагревании сухого перманганата калия до температурывыше 2000С он разлагается.
2KMnO4 = K2MnO4 + MnO2 + O2
При стоянии в растворе постепенно распадается:
4KMnO4 + 2h3O = 4MnO2 + 4KOH + 3O2
Под действием серной кислоты (60%) и горячей щелочи
перманганат также выделяет кислород:
4KMnO4 +6h3SO4 = 4MnSO4 + 5O2 + 2K2SO4 + 6h3O
4KMnO4 +4KOH = 4K2MnO4 + O2 + 2h3O
24. KMnO4 c восстановителями в разных средах
H +—
Mn
h3O
OH
+2
Mn обесцвечивание
+4
MnO2 (Mn )
Бурый осадок
2-
MnO4 зелёный
?
Mn
?
MnO
?
MnCl2
?
Mn(OH)2
?
MnO
Осуществите цепочки превращений:
KMnO4
t
O2
+S
X1
+O2
X2
+h3O
X3
Mn
Марганец и его соединения – конспект урока – Корпорация Российский учебник (издательство Дрофа – Вентана)
- Интернет-магазин
- Где купить
- Аудио
- Новости
- LECTA
- Программа лояльности
Марганец | Химические свойства
Марганец
Химически Марганец достаточно активен, при нагревании энергично взаимодействует с неметаллами — кислородом (образуется смесь оксидов Марганца разной валентности), азотом, серой, углеродом, фосфором и другими. При комнатной температуре Марганец на воздухе не изменяется: очень медленно реагирует с водой. В кислотах (соляной, разбавленной серной) легко растворяется, образуя соли двухвалентного Марганца. При нагревании в вакууме Марганец легко испаряется даже из сплавов.
При комнатной температуре Марганец на воздухе не изменяется: очень медленно реагирует с водой. В кислотах (соляной, разбавленной серной) легко растворяется, образуя соли двухвалентного Марганца. При нагревании в вакууме Марганец легко испаряется даже из сплавов.
В соединениях Марганец обычно проявляет валентность от 2 до 7 (наиболее устойчивы степени окисления +2, +4 и +7). С увеличением степени окисления возрастают окислительные и кислотные свойства соединений Марганца.
Соединения Mn(+2)- восстановители. Оксид MnO — порошок серо-зеленого цвета; обладает основными свойствами. нерастворим в воде и щелочах, хорошо растворим в кислотах. Гидрооксид Mn(OH)3 — белое вещество, нерастворимое в воде. Соединения Mn(+4) могут выступать и как окислители (а) и как восстановители (б):
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O (а)
(по этой редакции в лабораториях получают хлор)
MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O (б)
(реакция идет при сплавлении).
Хлорид марганца(II) – в безводном состоянии представляет собой листочки светло-розового света и получается при обработке марганца, его оксида или карбоната сухим хлороводородом:
MnCO3 + 2HCl = MnCl2 + CO2 + H2O
Сульфат марганца (II) – в безводном состоянии практически не имеющий цвета порошок, горький на вкус и получающийся при дегидратации соответствующих кристаллогидратов (MnSO4·nH2O, где n = 1,4,5,7). Гептагидрат сульфата марганца иногда встречается в природе в виде минерала миллардита и устойчив при температуре ниже 9° C. При комнатной температуре устойчив MnSO4·5H2O, называемый марганцевым купоросом. В промышленности сульфат марганца получают растворением пиролюзита в горячей концентрированной серной кислоте:
2MnO2 + 2H2SO4 = 2MnSO4 + O2 + 2H2O.
Cоли двухвалентного марганца каталитически действуют на протекание некоторых окислительных процессов, особенно происходящих под действием атмосферного кислорода, на этом основано их применение в качестве сиккативов – веществ, которые будучи растворенными в льняном масле, ускоряют его окисление кислородом воздуха и, тем самым, способствуют более быстрому высыханию. Льняное масло, содержащее сиккатив, называют олифой. В качестве сиккативов применяются некоторые органические соли марганца.
Из соединений марганца(IV) наибольшее значение имеет диоксид марганца, который является важнейшим минералом марганца. Различают несколько форм природного диоксида маргаца: пиролюзит, рамсделит, псиломелан и криптомелан.
Диоксид марганца в лаборатории можно получить прокаливанием на воздухе Mn(NO3)2:
Mn(NO3)2 = MnO2 + 2NO2
Диоксид марганца представляет собой черный порошок амфотерного характера, проявляющий как окислительные, так и восстановительные свойства.
Диоксид марганца, введенный в состав стекла, уничтожает зеленую окраску, обусловленную силикатом железа и придает стеклу розовый цвет (или черный, если MnO2 добавлено много). Тонкодисперсный порошок диоксида марганца обладает адсорбирующими свойствами: поглощает хлор, соли бария, радия и некоторых других металлов.
Несмотря на огромную значимость пиролюзита, в быту гораздо чаще приходится встречаться с веществом, в котором марганец семивалентен, – перманганатом калия («марганцовкой»), получившим распространение благодаря его ярко выраженным антисептическим свойствам. Сейчас перманганат калия получают электролитическим окислением растворов манганата (VI) калия. Это соединение представляет собой кристаллы пурпурно-красного цвета, устойчивые на воздухе и умеренно растворимые в воде. Однако его растворы в воде быстро разлагаются на свету и медленно в темноте с выделением кислорода. Перманганат калия – сильный окислитель.
Оксид марганца(VII) Mn2O7 – марганцевый ангидрид представляет собой зелено-бурое тяжелое масло, получающееся при действии концентрированной серной кислоты на твердый перманганат калия:
2KMnO4 + H2SO4 = Mn2O7 + K2SO4 + H2O
Это вещество – чрезвычайно сильный окислитель, взрывается при ударе или нагревании. Многие вещества, такие как сера, фосфор, древесная стружка, спирт, при малейшем соприкосновении с ним воспламеняются. При растворении в большом количестве воды образует марганцевую кислоту.
|
Вопрос: У компании есть Разрешение на эмиссии в окружающую среду, где в перечень загрязняющих веществ, выбрасываемых в атмосферу указаны позиции: пыль абразивная, пыль неорганическая SIO02 20-70%, взвешенные вещества, сажа, бен(а)-пирен, марганца диоксид, железа оксид, углеводороды предельные С12-С19, сероводород, азота диоксид, азота оксид, кислота азотная, натр едкий, серы диоксид, углерода оксид, фреон 134А, фтористый водород, кислота серная, перекись водорода, винилацетат, спирт этиловый. Налоговым кодексом не установлены ставки платы за «диоксид марганца», «фреон 134А», «фтористый водород» и «перекись водорода». Необходимо ли осуществлять плату за данные вещества? Ответ: Здравствуйте! Комитет государственных доходов Министерства финансов Республики Казахстан (далее — КГД МФ РК) рассмотрев Ваш вопрос, поступивший на блог Председателя КГД МФ РК, сообщает следующее. В соответствии с пунктом 1 статьи 573 Кодекса Республики Казахстан «О налогах и других обязательных платежах в бюджет» (Налоговый кодекс) плата за эмиссии в окружающую среду (далее — плата) взимается за эмиссии в окружающую среду в порядке специального природопользования, осуществляемого в соответствии с экологическим законодательством Республики Казахстан. Ставки платы установлены статьей 576 Налогового кодекса и зависят от видов загрязняющих веществ, видов отходов и топлива. Учитывая, что утверждение перечня загрязняющих веществ и видов отходов, для которых устанавливаются нормативы эмиссий, относится к компетенции Министерства экологии, геологии и природных ресурсов Республики Казахстан, Комитетом был направлен запрос в Комитет экологического регулирования и контроля Министерства экологии, геологии и природных ресурсов Республики Казахстан (далее — КЭРК МЭГПР РК) от 27 августа 2019 года № КГД-07-2/18511-И. Согласно письму КЭРК МЭ РК от 5 сентября 2019 года № 17-12/1945, ЗТ-Б-641 (далее — письмо КЭРК МЭГПР РК) определены соответствия видов загрязняющих веществ, указанных в письме и предусмотренных статьей 576 Налогового кодекса (прилагается). В связи с чем, согласно письму КЭРК МЭГПР РК исчисление платы по пыли абразивной, пыли неорганической SIO02 20-70%, взвешенным веществам, саже, бен(а)-пирену, оксиду железа, предельным углеводородам С12-С19, сероводороду, диоксиду азота, оксиду азота, кислоту азотной, натр едкому, диоксиду серы, оксиду углерода, кислоты серной, винилацетату и спирту осуществляется по соответствующим ставкам, предусмотренным статьей 576 Налогового кодекса. При этом, согласно письму КЭРК МЭ РК «диоксид марганца», «фреон 134А», «фтористый водород» и «перекись водорода» отсутствуют в загрязняющих веществах, указанных в статье 576 Налогового кодекса Республики Казахстан. Таким образом, учитывая, что Налоговым кодексом не установлена ставка платы за «диоксид марганца», «фреон 134А», «фтористый водород» и «перекись водорода», следовательно, данные вещества не являются объектом налогообложения по плате за эмиссии в окружающую среду.
Султангазиев М.Е. |
% PDF-1.5 % 285 0 объект> эндобдж xref 285 99 0000000016 00000 н. 0000003534 00000 н. 0000003782 00000 н. 0000002276 00000 н. 0000003833 00000 н. 0000003961 00000 н. 0000004251 00000 п. 0000004701 00000 п. 0000004949 00000 п. 0000005051 00000 н. 0000006455 00000 н. 0000006852 00000 н. 0000007107 00000 н. 0000008296 00000 н. 0000008479 00000 н. 0000009658 00000 н. 0000009833 00000 п. 0000030515 00000 п. 0000063907 00000 п. 0000065212 00000 п. 0000065313 00000 п. 0000065384 00000 п. 0000065468 00000 п. 0000065539 00000 п. 0000065639 00000 п. 0000065687 00000 п. 0000065828 00000 п. 0000065876 00000 п. 0000065978 00000 п. 0000066026 00000 п. 0000066126 00000 п. 0000066174 00000 п. 0000066325 00000 п. 0000066373 00000 п. 0000066449 00000 п. 0000066524 00000 п. 0000066643 00000 п. 0000066691 00000 п. 0000066879 00000 п. 0000066927 00000 п. 0000067038 00000 п. 0000067086 00000 п. 0000067196 00000 п. 0000067243 00000 п. 0000067351 00000 п. 0000067398 00000 п. 0000067488 00000 п. 0000067535 00000 п. 0000067662 00000 п. 0000067709 00000 п. 0000067810 00000 п. 0000067857 00000 п. 0000068024 00000 п. 0000068071 00000 п. 0000068154 00000 п. 0000068264 00000 п. 0000068367 00000 п. 0000068414 00000 п. 0000068604 00000 п. 0000068651 00000 п. 0000068762 00000 п. 0000068845 00000 п. 0000068997 00000 п. 0000069044 00000 п. 0000069130 00000 п. 0000069222 00000 п. 0000069323 00000 п. 0000069370 00000 п. 0000069494 00000 п. 0000069541 00000 п. 0000069641 00000 п. 0000069688 00000 п. 0000069796 00000 п. 0000069843 00000 п. 0000069931 00000 н. 0000069977 00000 н. 0000070023 00000 п. 0000070070 00000 п. 0000070117 00000 п. 0000070215 00000 п. 0000070262 00000 п. 0000070309 00000 п. 0000070356 00000 п. 0000070475 00000 п. 0000070522 00000 п. 0000070569 00000 п. 0000070616 00000 п. 0000070740 00000 п. 0000070788 00000 п. 0000070906 00000 п. 0000070954 00000 п. 0000071064 00000 п. 0000071112 00000 п. 0000071207 00000 п. 0000071255 00000 п. 0000071352 00000 п. 0000071400 00000 п. 0000071448 00000 п. 0000071496 00000 п. трейлер ] >> startxref 0 %% EOF 288 0 obj> поток xU} L [U? ~ R е @ 1Cp 쐉 L ֍ 16 # n h \\ Q6F6 ę0Ę}; w {
Производство или переработка марганца и его соединений
Этот график должен применяться к каждому предприятию, на котором или в любой части которого осуществляется процесс марганца.
Для целей этого списка —
- «марганцевый процесс» означает переработку, производство или манипуляции с марганцем или любой рудой или любой смесью, содержащей марганец;
- «Манипуляции» означают смешивание, смешивание, наполнение, опорожнение, измельчение, просеивание, сушку, упаковку, подметание или иное обращение с марганцем или смесью, содержащей марганец; и
- «эффективная вытяжная вентиляция» означает локальную вентиляцию, осуществляемую механическими средствами для удаления пыли или дыма или в их источнике, чтобы предотвратить их утечку в атмосферу любого места, где проводятся какие-либо работы.Эффективной не считается сквозняк, который не удаляет пыль, дым или туман в месте его образования и не предотвращает его попадание в атмосферу рабочего места и ее распространение в атмосфере рабочего места.
Каждый марганцевый процесс, который может приводить к образованию пыли, пара или тумана, содержащего марганец, должен осуществляться в полностью закрытой системе или иным образом эффективно изолирован от других процессов, чтобы другие заводы и процессы и другие части фабрики и люди, занятые в других процессах, не могут быть затронуты этим.
Ни один процесс, в котором образуется пыль, пар или туман, содержащий марганец, не должен осуществляться, кроме как при эффективной вытяжной вентиляции, которая должна применяться как можно ближе к точке образования.
- Лицо, занимающее завод, должно обеспечивать и поддерживать в хорошем и чистом состоянии подходящую спецодежду и головные уборы для всех лиц, занятых в любом процессе производства марганца, и такие комбинезоны и головные уборы должны носить люди. во время работы на марганцевом процессе.
- Лицо, занимающее завод, должно предоставить подходящие средства защиты органов дыхания для использования на работах в чрезвычайных ситуациях для предотвращения вдыхания пыли, дыма или тумана. Достаточное количество полных комплектов такого оборудования всегда должно храниться рядом с рабочим местом, и оно должно содержаться в надлежащем состоянии и всегда в таком состоянии, чтобы его можно было легко использовать.
- Лицо, занимающее имущество, должно обеспечить и поддерживать в рабочем состоянии для всех занятых лиц подходящие помещения для хранения и предпринять соответствующие меры по очистке и техническому обслуживанию средств индивидуальной защиты.
Ни одна женщина или молодежь не могут быть наняты или разрешены к работе в любом процессе производства марганца.
Запрещается приносить еду, питье, сковороды, супари или табак в рабочие помещения или употреблять их в любом рабочем помещении, где осуществляется процесс марганца.
Должна быть предусмотрена и содержаться для использования людьми, занятыми в процессе производства марганца, подходящая столовая, которая должна быть оборудована достаточным количеством столов и скамеек, а также соответствующими средствами для подогрева пищи.Столовая находится в ведении ответственного лица и содержится в чистоте.
Должны быть предоставлены и поддерживаться в чистом и хорошем состоянии для использования людьми, занятыми на производстве марганца
- Место для мытья под навесом, с
- желоб с гладкая непроницаемая поверхность, снабженная сливной трубой без заглушки, и достаточной длины, чтобы обеспечить по крайней мере 60 сантиметров на каждые десять таких сотрудников, работающих одновременно, и иметь постоянную подачу воды из кранов или форсунок над желобом с интервалами, не превышающими более 60 сантиметров;
- по меньшей мере на умывальник на каждые пять таких одновременно работающих лиц, оборудованных сливной трубой и пробкой и имеющих постоянную подачу воды; и
- достаточный запас мыла или другого подходящего чистящего материала, щетки для ногтей и чистые полотенца.
По требованию главного инспектора должна быть предоставлена и содержаться для использования лицами, занятыми в производстве марганца, гардеробная для одежды, снимаемой в рабочее время, с соответствующими приспособлениями для сушки одежды.
Предупреждающие надписи в форме, указанной в приложении и напечатанные на языке большинства рабочих и нанятых, должны быть размещены на видных местах на заводе, где они могут быть легко и удобно прочитаны оккупанты должны принять меры для того, чтобы периодически проинструктировать всех рабочих, занятых на производстве марганца, об опасностях для здоровья, связанных с их обязанностями, а также о наилучших профилактических мерах и методах защиты.Уведомления должны всегда поддерживаться в удобочитаемом состоянии.
- Лицо, занимающее каждую фабрику, к которой применяется это расписание, должно
- нанять квалифицированного практикующего врача для медицинского наблюдения за работниками, занятыми на них, чья работа подлежит утверждение главного инспектора фабрик; и
- предоставить практикующему врачу все необходимые условия для целей, указанных в пункте (а).
- Протокол медицинских осмотров и соответствующих тестов, проведенных указанным практикующим врачом, должен вестись в отдельном регистре, утвержденном Главным инспектором фабрик, который должен быть легко доступен для инспекции.
- Каждый работник, занятый на любом производстве марганца, должен пройти медицинский осмотр у сертифицированного хирурга в течение 15 дней после его первого приема на работу.Такие обследования должны включать тесты на определение сывороточного кальция, сывороточного фосфата и марганца в крови и моче, а также тесты на устойчивость и другие тесты на нервно-мышечную координацию. Ни одному рабочему не разрешается работать после 15 дней его первой работы на заводе, если он не аттестован для такой работы Сертифицирующим хирургом
- Каждый рабочий, занятый на производстве марганца, должен проходить повторный осмотр Сертифицирующим хирургом не реже одного раза в три. календарных месяцев, и такое обследование должно, если Сертифицирующий хирург сочтет это целесообразным, включать все тесты, указанные в подпункте (1)
- Сертифицирующий хирург после осмотра работника выдает Сертификат пригодности по Форме 23.Протокол осмотра и проведенных повторных осмотров должен быть занесен в Свидетельство, и Свидетельство должно храниться у директора завода. Запись о каждом обследовании, проведенном в соответствии с подпунктами (1) и (2), включая характер и результаты этого испытания, также должны быть внесены сертифицированным хирургом в регистр здоровья по форме 24.
- Свидетельство о том, что Регистр пригодности и здоровья должен быть доступен для проверки инспектором.
- Если в любое время Сертифицирующий хирург сочтет, что работник больше не пригоден для работы в упомянутых процессах на том основании, что их продолжение может представлять особую опасность для здоровья работника, он должен сделать запись о своем данные в указанной справке и регистре здоровья. Запись его выводов в эти документы должна также включать период, в течение которого, по его мнению, указанное лицо непригодно для работы в указанном процессе, ему должны быть предоставлены альтернативные помещения для размещения, если только он не станет полностью недееспособным, по мнению Сертифицирующего хирурга, в в этом случае пострадавшее лицо должно быть соответствующим образом реабилитировано.
- Ни одно лицо, которое было признано непригодным для работы, как указано в подпункте (5), не может быть повторно нанято или допущено к работе в упомянутых процессах, если Сертифицирующий хирург после дополнительного обследования снова не подтвердит его пригодность для работы в этих процессах. процессы.
Если в отношении какой-либо фабрики главный инспектор убедится, что из-за каких-либо исключительных обстоятельств, или нечастости процесса, или по любой другой причине, применение всех или любого из положений этого приложения не является необходимым для защиты лиц, работающих на такой фабрике, он может письменным распоряжением, которое он может по своему усмотрению отменить, освободить такую фабрику от всех или каких-либо положений о таких условиях и на такой период, который он может указать в указанном порядке.
• Стационарные источники выбросов марганца Россия
• Стационарные источники выбросов марганца Россия | StatistaДругая статистика по теме
Пожалуйста, создайте учетную запись сотрудника, чтобы иметь возможность отмечать статистику как избранную. Затем вы можете получить доступ к своей любимой статистике через звездочку в заголовке.
ЗарегистрироватьсяПожалуйста, авторизуйтесь, перейдя в «Моя учетная запись» → «Администрирование».После этого вы сможете отмечать статистику как избранную и использовать персональные статистические оповещения.
АутентифицироватьБазовая учетная запись
Познакомьтесь с платформой
У вас есть доступ только к базовой статистике.
Единая учетная запись
Идеальная учетная запись начального уровня для индивидуальных пользователей
- Мгновенный доступ к статистике 1 м
- Скачать в формате XLS, PDF и PNG
- Подробная информация ссылок
$ 59 39 $ / месяц *
в первые 12 месяцев
Корпоративный аккаунт
Полный доступ
Корпоративное решение, включающее все функции.
* Цены не включают налог с продаж.
Самая важная статистика
Самая важная статистика
Самая важная статистика
Самая важная статистика
Дополнительная статистика
Темы
Подробнее о выбросах в Великобританиио том, как Statista может поддержать ваш бизнес.
Министерство природных ресурсов и экологии Российской Федерации. (3 сентября 2019 г.). Объем выбросов марганца и его соединений * из стационарных источников в России с 2010 по 2018 год (в метрических тоннах) [График]. В Statista. Получено 30 мая 2021 г. с сайта https://www.statista.com/statistics/1057766/russia-manganese-emissions-from-stationary-sources/
Министерство природных ресурсов и окружающей среды Российской Федерации. «Объем выбросов марганца и его соединений * из стационарных источников в России с 2010 по 2018 год (в метрических тоннах).»График. 3 сентября 2019 г. Statista. По состоянию на 30 мая 2021 г. https://www.statista.com/statistics/1057766/russia-manganese-emissions-from-stationary-sources/
Министерство природных ресурсов и окружающей среды. Российской Федерации. (2019). Объем выбросов марганца и его соединений * из стационарных источников в России с 2010 по 2018 год (в метрических тоннах). Statista. Statista Inc. Дата обращения: 30 мая 2021 г. https: // www. .statista.com / statistics / 1057766 / russia-marganese-Выбросы-от-стационарных-источников /
Министерство природных ресурсов и экологии Российской Федерации.«Объем выбросов марганца и его соединений * из стационарных источников в России с 2010 по 2018 год (в метрических тоннах)». Statista, Statista Inc., 3 сентября 2019 г., https://www.statista.com/statistics/1057766/russia-manganese-emissions-from-stationary-sources/
Министерство природных ресурсов и окружающей среды Российской Федерации, Выбросы объем марганца и его соединений * из стационарных источников в России с 2010 по 2018 год (в метрических тоннах) Statista, https://www.statista.com/statistics/1057766/russia-manganese-emissions-from-stationary-sources/ ( последний раз посещал 30 мая 2021 г.)
марганец | Infoplease
марганец măng´gənēs, măn´– [ключ] [Лат., = магнит], металлический химический элемент; символ Mn; в. нет. 25; в. вес. 54.93805; m.p. около 1244 ° С; б.п. примерно 1962 ° С; sp. гр. От 7,2 до 7,45 в зависимости от формы; валентность обычно +2, +4 или +7.Марганец — химически активный металл розовато-серого цвета. Это первый элемент седьмой группы периодической таблицы. Он похож на железо, но тверже и хрупче. Металл проявляет аллотропию; он имеет четыре различные формы с различными физическими свойствами. Его можно полировать. Марганец тускнеет во влажном воздухе и окисляется при нагревании с образованием оксида, Mn 3 O 4 .Он медленно вытесняет водород из воды. Легко реагирует с соляной и серной кислотами, а также с галогенами.
В соединениях марганец принимает различные степени окисления. Его легко повысить до состояния +2, например, путем реакции с соляной кислотой с образованием хлорида марганца, MnCl 2 . Марганец также находится в +3 (марганцевом) состоянии, но это состояние нестабильно и обычно возвращается в состояние +2. Ионы марганца и ионы марганца образуют кислые растворы.Марганец находится в состоянии +4 в основном в диоксиде марганца, MnO 2 ; степень окисления +4 является амфотерной, т.е. в состоянии +4 марганец может отдавать или принимать электроны в химических реакциях. Марганец также существует в +6 и +7 состояниях; состояние +6 находится в манганат-ионе (MnO 4 −− ) и состояние +7 в перманганат-ионе (MnO 4 —). Эти ионы стабильны в основных растворах. Есть также свидетельства наличия состояния +1 (в сложном цианиде) и нестабильного состояния +5 (в основных растворах).Марганец в природе встречается в изобилии.
Пиролюзит (MnO 2 ) — основная руда. Марганцевые руды добываются в основном в Южной Африке, Австралии, Китае, Бразилии, Габоне, Украине, Индии и некоторых других странах. Металл получают промышленным способом восстановлением руд алюминием или, при высокой чистоте, электролизом раствора сульфата марганца. Марганец очень важен в сталелитейной промышленности, где он используется как раскислитель и десульфуризатор; замены не найдено.Он также используется в больших количествах для повышения прочности и упрочнения стали, не делая ее хрупкой; обычно его добавляют в виде ферромарганца. Любая сталь, содержащая от 10% до 15% марганца, называется марганцевой сталью, хотя почти вся сталь содержит некоторое количество марганца. Марганец широко используется при производстве сплавов. Марганцевая бронза и марганцевая латунь — это сплавы, содержащие марганец, медь, олово, цинк и небольшие количества других металлов в различных пропорциях. Некоторые сплавы, содержащие марганец, алюминий, сурьму и небольшое количество меди, обладают сильными магнитными свойствами.
Соединения марганца широко используются в промышленности. Диоксид марганца используется как осушающий агент; катализирует окисление масел в лакокрасочных материалах. Он также используется в сухом элементе и для удаления зеленого цвета, вызванного примесями железа в стекле. Перманганат калия (KMnO 4 ) — мощный окислитель, используемый в промышленности для отбеливания и в химии в качестве аналитического реагента. Другие соединения находят применение в стекольном производстве в качестве пигментов и удобрений. Марганец в небольших количествах необходим в качестве питательного вещества многим растениям и животным, а также людям.Фиолетовый цвет аметиста обусловлен марганцем. Элемент был впервые выделен в 1774 году Дж. Г. Ганом, хотя его существование ранее было признано Т. О. Бергманом и К. В. Шееле.
Колумбийская электронная энциклопедия, 6-е изд. Авторские права © 2012, Columbia University Press. Все права защищены.
Дополнительные статьи в энциклопедии: Соединения и элементы
Марганец и его соединения — Цифровые учителя Уганда
Поделитесь со своими близкими!
Электронная конфигурация марганца[Ar] 4s 2 3d 5
Свойства марганца как переходного элемента- Образует окрашенные соединения; например, Mn 7+ фиолетовый
- Имеет переменную степень окисления; +2, +3, +4, +5, +6, +7
- Образует комплексы, эл.грамм. МнО 4 —.
- Обладает каталитическими свойствами, например, MnO 2 катализирует выделение кислорода из пероксида водорода
Реакция марганца с воздухом
Марганец не очень реактивен по отношению к воздуху. Поверхность комков марганца немного окисляется. Мелкодисперсный металлический марганец горит на воздухе. В кислороде образуется оксид Mn 3 O 4 , а в азоте образуется нитрид Mn 3 N 2 .
3 Mn (s) + 2 O 2 (g) → Mn 3 O 4 (s)
3 Mn (s) + N 2 (g) → Mn 3 N 2 (s)
Реакция марганца с галогенами
Марганец реагирует с галогенами с образованием соответствующих галогенидов марганца (II). Для фторида также образуется фторид марганца (III)
Mn (s) + F 2 (g) → MnF 2 (s)
2 Mn (s) + 3 F 2 (g) → 2 MnF 3 (s)
Mn (s) + Cl 2 (г) → MnCl 2 (т) [3]
Mn (т) + Br 2 (г) → MnBr 2 (т)
Mn (т) + I 2 (г) → MnI 2 (т)
Реакция марганца с водой
Марганец медленно реагирует с водой с образованием диоксида марганца
Mn (т) + 2H 2 O (л) → MnO 2 (т) + 2H 2 (г)
Реакция марганца с кислотами
Марганец легко растворяется в разбавленной серной кислоте, образуя бесцветный раствор ионов Mn (II) и газообразного водорода, H 2 .
Mn (s) + H 2 SO 4 (водн.) → Mn 2+ (водн.) + SO 4 2- (водн.) + H 2 (г)
Важные соединения марганцаМанганат калия (VII), KMnO 4
— Используется в качестве окислителя для окисления спиртов и альдегидов до карбонильных соединений и карбоновых кислот соответственно.
— используется для стандартизации железа (II), перекиси водорода и щавелевой кислоты
Половина уравнения для манганата 7
MnO 4 — (водн.) + 5e + 8H + (водн.) → Mn 2+ (водн.) + 4H 2 O (л)
Пробная 1
Заполните и сбалансируйте следующие уравнения
Fe 2+ (водн.) + H + (водн.) + MnO 4 — (водн.) →
H 2 O 2 (водн.) + H + (водн.) + MnO 4 — (водн.) →
C 2 O 4 2- (водн.) + H + (водн.) + MnO 4 — (водн.) →
Марганец (VII) окисляет галогениды в препаратах галогенов
Пробная 2
Заполните и сбалансируйте следующие уравнения
Cl — (водн.) + H + (водн.) + MnO 4 — (водн.) →
По этой причине HCl не используется для подкисления MnO 4 – в его реакции окисления, поскольку ион Cl – также окисляется.
Изменение окислительной способности манганат-ионов (VII) в зависимости от pH.
Окисляющая способность перманганата калия зависит от pH, как показано ниже:
(а) Кислый раствор
MnO 4 — (водн.) + 8H + (водн.) + 5e → Mn 2+ (водн.) + 4H 2 O (л)
(б) Нейтральные или щелочные растворы,
Манганат (VII) восстанавливается до оксида марганца (IV).
MnO 4 — (водн.) + 2H 2 O (l) + 3e → MnO 2 (водн.) + 4OH- (l)
(c) Сильно щелочной раствор
Манганат (VII) превращается в зеленый манганат (VI).
MnO 4 — (водн.) + E- → MnO 4 2- (водн.)
Недостатки использования перманганата калия (VII) в волюметрическом анализе
- Манганат (VII) нельзя использовать в качестве основного стандарта, потому что
(i) не может быть получен в чистом виде. Примеси: MnO 2 .
(ii) Водные растворы марганца (VII) нестабильны и медленно осаждают коричневый оксид марганца (IV) при стоянии.
(b) Соляную кислоту нельзя использовать в качестве окислителя перманганата калия VII
(c) Азотную кислоту нельзя использовать для окисления раствора перманганата (VII) калия, поскольку она является окислителем
Пробная 3
(a) Манганат калия (VII) не используется в качестве основного стандарта в объемном анализе и должен быть стандартизирован
(i) Что такое первичный стандарт? (2 марки)
(ii) Укажите три характеристики первичного стандарта.(3 балла)
(iii) Объясните, почему манганат калия (VII) не используется в качестве основного стандарта. (2 балла)
Назовите одно вещество, кроме этандиокислоты, которое может быть использовано в качестве основного стандарта для манганата калия. (VII) (1 марка
(b) Объясните, почему соляная кислота обычно не используется для подкисления растворов манганата калия (VII) (2 балла)
(c) Подкисленный манганат калия (VII) реагирует с этандиокислотой
Запись
- Полуравнения реакции.(2 балла)
- Общее уравнение реакции. (2 балла)
(d) 20,00 см 3 0,01 М раствора манганат (VII) иона требуется ровно 16,65 см 3 раствора, содержащего 5,1 г -1 оксалата ( COO — X + ) 2 .2H 2 O. Вычислить атомную массу X.
Опытная 4
Сульфат железа (II) обычно используется для стандартизации раствора манганата (VII) калия, подкисленного серной кислотой
(a) Напишите уравнение реакции между манганатом калия и сульфатом железа (II).(1 ½ балла)
(ii) Укажите, почему соляная кислота не используется для подкисления манганата калия (VII). (2 ½ балла)
(b) 20,00 см 3 подкисленного раствора 0,02 М манганата калия (VII) точно прореагировала с 25,10 см 3 нитрита натрия. Манганат калия (VII) реагирует с нитритом натрия в соответствии со следующим уравнением.
2MnO 4 — (водн.) + 5NO 2 — (водн.) + 6H + (водн.) ® 2Mn 2+ (водн.) + 5NO 3 — (водн.) + 3H 2 O (л)
Рассчитайте концентрацию нитрита натрия в молях на литр.
Соединения марганца (VI):
Манганаты натрия и калия (VI) — единственные чистые соединения, содержащие марганец в степени окисления +6. Оба эти соединения представляют собой твердые вещества темно-зеленого цвета, цвет обусловлен ионом MnO 4 2-.
Марганец (VI) диспропорционирует в кислой среде с образованием пурпурных ионов манганата VII
3MnO 4 2- (водн.) + 2H 2 O (л) → 2MnO 4 — (водн.) + MnO 2 (s) + 4OH — (водн.)
Определение
Реакция диспропорционирования — это реакция, в которой происходит одновременное окисление и восстановление
Диспропорция марганца (VI) ускоряется за счет пропускания через раствор потока диоксида углерода, так как это удаляет ионы гидроксила в виде ионов гидрокарбоната
4 — OH (водн.) + 4CO 2 (г) → 4HCO 3 — (водн.)
Соединения марганца (IV)
Оксид марганца (IV), MnO 2 , является основным соединением марганца (IV); он встречается в природе в виде рудного пиролюзита; и это может быть получено действием тепла на нитрат марганца (II).
Mn (NO 3 ) 2 (s) → MnO 2 (s) + 2NO 2 (g)
Использование оксида марганца IV
(i) получение хлора
MnO 2 (т.) + 4HCl (водн.) → MnCl 2 (водн.) + 2H 2 O (л) + 2Cl 2 (г)
(ii) это катализатор при получении кислорода из перекиси водорода.
Реакция соединений марганца (IV).
В присутствии воздуха или окислителя (например, KNO 3 , KClO 3 ) MnO 2 реагирует с конденсированным КОН с образованием манганата калия, K 2 MnO 4 .
2MnO 2 (т) + 4KOH (л) + O 2 (г) → 2K 2 MnO 4 (водн.) + 2H 2 O (л)
Качественный анализ марганца II
(a) Добавление по каплям разбавленного гидроксида натрия или раствора аммиака до избытка.
Белый п.п. нерастворим в избытке, быстро становится коричневым.
Mn 2+ (водн.) + 2 — OH (водн.) → Mn (OH) 2 (т.)
Затем
4Mn (OH) 2 (т) + O 2 (г) → Mn 2 O 3 (т) + 2H 2 O (л)
Подтверждающий тест Mn 2+
Водный раствор Mn 2+ превращается в пурпурный раствор при добавлении концентрированной азотной кислоты с последующим добавлением висмутата натрия или оксида свинца (IV).
2Mn 2+ (водн.) + 5BiO 3 — (s) + 14H + (водн.) → 2MnO 4 — (водн.) + 5Bi 3+ (водн.) + 7H 2 O (л)
2Mn 2+ (водн.) + 5PbO 2 (s) + 4H + (водн.) → 2MnO 4 — (водн.) + 5Pb 2+ (водн.) + 2H 2 О (л)
Пробная 5
Кристаллическое твердое вещество Y, растворенное в воде, дает раствор розового цвета.Добавление избытка водного гидроксида натрия приводило к образованию грязно-белого осадка, который быстро становился коричневым при стоянии.
Когда к раствору Y добавляли азотную кислоту, а затем раствор висмутата натрия, цвет раствора менялся с розового на фиолетовый.
(a) Определите катион в Y. (1 балл)
(б) Запишите:
(i) Уравнение реакции, которая имела место при добавлении гидроксида натрия к раствору.(1½ балла)
(ii) Формула вида, ответственного за пурпурный цвет. (1 балл)
(iii) Уравнение реакции, приводящей к образованию коричневого твердого вещества. (1½ балла)
Пробная 6
- Запишите внешнюю электронную конфигурацию марганца. (1 балл)
(i) Укажите возможные степени окисления марганца. (2 ½ балла)
(ii) Как изменяется кислотность оксидов марганца с увеличением степени окисления? (½ балла)
(iii) Как изменяется степень окисления марганца при восстановлении манганата калия (VII) в щелочной среде? (1 балл)
(iv) Назовите четыре применения манганата калия (VII) в лаборатории в качестве окислителя? (4 балла)
Предлагаемые ответыПробная 1
5Fe 2+ (водн.) + 8H + (водн.) + MnO 4 — (водн.) → 5Fe 3+ (водн.) + Mn 2+ (водн.) + 4H 2 O (л)
5H 2 O 2 (водн.) + 6H + (водн.) + 2MnO 4 — (водн.) → 2Mn 2+ (водн.) + 8H 2 O (л)
5C 2 O 4 2- (водн.) + 16H + (водн.) + 2MnO 4 — (водн.) → 2Mn 2+ (водн.) + 8H 2 O (л) + 10CO 2 (г)
Пробная 2
10Cl — (водн.) + 16H + (водн.) + 2MnO 4 — (водн.) → 2Mn 2+ (водн.) + 8H 2 O (l) + 5Cl — (водн.)
Опытная 3
- (i) Первичный стандарт — это вещество известной высокой чистоты, которое может быть растворено в известном объеме растворителя с получением раствора первичного стандарта
(ii) Характеристики первичного стандарта включают:
- Высокая чистота.
- Стабильность (низкая реактивность)
- Низкая гигроскопичность (для минимизации изменений веса из-за влажности)
- Высокий эквивалентный вес (для минимизации ошибок взвешивания)
- Нетоксичность.
- Готово и дешево.
- Хлорид-ионы реагируют с ионами манганата (VII).
2MnO 4 — (водн.) + 10Cl — (водн.) + 16H + (водн.) → Mn 562+ 5 (г) + 8H 2 O (л)
- (i) MnO 4 — (водн.) + 8H + (водн.) + 5e → Mn 2+ (водн.) + 4H 2 O (l)
C 2 O 4 2- (водн.) -2e → 2CO 2 (г)
(ii) 5C 2 O 4 2- (водн.) + 16H + (водн.) + 2MnO 4 — (водн.) → 2Mn 2+ (водн.) + 8H 2 O (л) + 10CO 2 (г)
Пробная 4
0.04М
Смотрите
При поддержке The Science Foundation College + 256 80 27 09
Составлено доктором Ббоса Сайенс
Марганец: металл, служивший в армии
Введение
Марганец — серебристо-белый металл, который на воздухе постепенно тускнеет. Его температура плавления составляет 1246 ° C (2275 ° F). Он достаточно хрупкий, чтобы сломать его молотком.
Марганец — 12-й по распространенности химический элемент на Земле.Чаще всего его получают из руды, известной как пиролюзит (диоксид марганца).
История открытия
Оксид марганца (IV) известен людям с незапамятных времен. Наскальные рисунки в пещере Ласко (Франция), возраст которых превышает 10 000 лет, содержат в своем составе марганец.
Соединения марганца использовались стеклодувами для отбеливания стекла, а химики 18 века использовали диоксид марганца для производства хлора. Марганец был получен как отдельный элемент Иоганном Ганном в 1774 году.
Химические свойства
Марганец реагирует с кислородом с образованием прочной оксидной пленки диоксида марганца. Реакция ускоряется при нагревании.
Mn + O₂ = MnO₂
Марганец активно растворяется в кислотах, например в соляной кислоте.
Mn + 2HCl = MnCl₂ + H₂
При плавлении диоксида марганца с гидроксидом калия образуется зеленый манганат калия.
2MnO₂ + 4KOH + O₂ = 2K₂MnO₄ + 2H₂O
Фиолетовый перманганат калия может быть получен в результате реакции между кислотами (такими как соляная кислота) и перманганатом калия.
K₂MnO₄ + 4HCl = 2KMnO₄ + MnO₂ + 2H₂O + 4KCl
Перманганат калия — сильный окислитель. Он может окислять глюкозу в щелочном растворе, становясь сначала зеленым (форма марганца), затем желтым (мелкодисперсный диоксид марганца) и, наконец, бесцветным (образуются двухвалентные ионы марганца).
5C₆H₁₂O₆ + 24KMnO₄ + 36H₂SO₄ → 30CO₂ + 24MnSO₄ + 12K₂SO₄ + 66H₂O
Концентрированная серная кислота и перманганат калия образуют зеленый оксид марганца (VII), сильный окислитель.При контакте с алкоголем он воспламеняется и взрывается.
C₂H₅OH + 2Mn₂O₇ = 4MnO₂ + 2CO₂ + 3H₂O
Приложение
Диоксид марганца используется для производства щелочных и угольно-цинковых батарей. Сплав висмута и марганца, бисманол, использовался для изготовления магнитов. Добавление марганца увеличивает прочность стали. Сплав, известный как мангаллой, использовался для изготовления военных шлемов из-за его ударопрочности и долговечности. Перманганат калия используется в медицине для лечения ран, дерматитов и грибковых инфекций.
В окислителе […] железо a n d соединения марганца f r om необработанные […]воды выпадает из колодца. mankenberg.com | Нет оксидадора, поэтому сепарадас […] as ligaes de f er ro e mangansio da gu a crua […]retirada dos poos. mankenberg.com |
| Not Li st e d Соединения марганца a s msds.oxy.com | № R elaci ona do Compostos de mangans como M n msds.oxy.com |
| Соединения марганца бвс-вет.org.br | Compostos de Mangans bvs-vet.org.br |
| 12022- 95 — 6 Соединения марганца a с msds.oxy.com | 1 20 22-9 5- 6 Компостов d e манганов co мес M n msds.oxy.com |
105 Кадмий или его соединения 106 Хром или его соединения […] 107 Mercur y o r соединения t h er eof 1 0 8 906 марганец 9016 соединения t h er eof 109.01 […]Азотная кислота eur-lex.europa.eu | 105 Cdmio ou seus compostos 106 Crmio ou seus compostos 107 […] Mercrio ou seus compos — s 108 Mangans ou se us compostos 109.01 cido ntricoeur-lex.europa.eu |
Эти почвы, известные как […]Пермские красные пласты, содержат […] значительное количество ir o n соединений ( 6 -7 % оксидов железа de ) , марганец марганец n d соединения o f o термометры.eur-lex.europa.eu | Estes solos, conhecidos por terrenos prmicos […]vermelhos, contm uma quantidade […] consid er vel de compostos de ferr o (6-7% de x ido de ferro), de mangansio tr os мета.eur-lex.europa.eu |
| 1 1 — Марганец a n di t s компаунды x res a s марганец ( M n) 12 — никель и i t s соединения, XP в формате […] никель (Ni) eur-lex.europa.eu | 1 1 — Mangans e seu s compostos, expre ss os e m mangans ( Mn) 12 — Nquel compost , expr es sos em nquel (Ni) eur-lex.europa.eu |
| (б) разделение i ro n , марганец a n d sul ph u r соединения a n d мышьяк из […] определенные природные минеральные воды по очистке […]с воздухом, обогащенным озоном, поскольку такая обработка не изменяет состав воды в отношении основных компонентов, которые придают ей ее свойства, и при условии, что eur-lex.europa.eu | b) Se para o do s compostos d e ferro, de mangans e d e e 9016 e doof [..] arsnico de certas guas minerais naturais por tratamento […]com ar enriquecido em ozono, desde que esse tratamento no altere a composio da gua no que se refere aos constituintes essenciais que lhe conferem as suas propriedades e desde que eur-lex.europa.eu |
| Марганец a n di t s компаунды , e xp ( M n ) европарл.europa.eu | Mangans e seu s compostos, exp res sos e m mangans ( Mn ) europarl.europa.eu |
(а) использование такой обработки оправдано составом […] вода в составе с o f соединения o f iro n , марганец phur и мышьякeur-lex.europa.eu | a) O recurso a esse tratamento justificado pela […] composio d a gu ae m compostos d e fe rr o, mangans, e nx ofre ea europa. eu |
Он также определяет условия использования озонобогащенного […] воздух для сепаратора ti n g соединения o f iro n , марганец ul. phur и мышьяк […]из природных минеральных вод […]или родниковой воды, а также требования к маркировке воды, прошедшей такую обработку. eur-lex.europa.eu | Presente directiva определяет tambm как condies de utilizao do […]ar enriquecido em ozono […] para a s ep ara o d os compostos de fe rr o, mangans, e nx ofre nio …]гуас минерайс натуральный […]e das guas de nascente, e a meno que deve constar do rtulo das guas que foram objecto deste tratamento. eur-lex.europa.eu |
(5) Не должно быть […] преднамеренное добавление n o f соединения c o nt фосфор, i ro n марганец o r приводят к этому эталонному топливу.eur-lex.europa.eu | (5) Нет девехавера […] adio i nt enci onal d e compostos q ue con tenh am f sf oro16 ro16 ou chu mbo a este уровень сгорания […]de referncia. eur-lex.europa.eu |
Обнуляет […] выбросы около rb o n соединений a n d парниковых газов.europarl.europa.eu | Нет причин […] quaisque r emis ses d e compostos d e carb ono e газы […]com efeito de estufa. europarl.europa.eu |
| Чистая реакция катода t ur n s марганец d i ox ide до восстановленной формы. todostocking.com | A reao lquida […] do c to do gira o d ixid o d o mangans p ara um f or mulrio […]редукзидо. todostocking.com |
измерение минимального времени прохождения внутри всей соответствующей части непрерывной системы, где температура и давление соответствуют требуемым условиям, должно быть предоставлено […]компетентные органы, использующие нерастворимые […] маркеры (для экзамена pl e , марганец d i ox ide) или метод […], который предлагает аналогичные гарантии. europarl.europa.eu | O valor do perodo mnimo de trnsito em toda a parte pertinente do sistema contnuo em que a temperatura e a presso удовлетворительно, поскольку позволяет exigidas разработать ser comunicado s autoridades comptentes, […]usando-se para o efeito marcadores insolveis (po r […] exemplo , o dixi do de mangans ) o u u m mt od o que […]d эквивалентных гарантий. europarl.europa.eu |
Мы ищем, производим и продаем железную руду и окатыши, никель, […]медь, уголь, бокситы, глинозем, […] алюминий, калий, као li n , марганец , f er сплавы, кобальт, […]металлов платиновой группы и драгоценных металлов. дол.com | Pesquisamos, produzimos e comercializamos minrio de ferro e pelotas, nquel, […]кобре, карво, боксита, глинозем, […] выпускник, po t ssio, ca uli m, mangans, f err o-l igas, c obalto, […]metais do grupo de platina e metais Preciosos. vale.com |
Мышьяк и его соединения, выраженные как мышьяк (As) Свинец и его соединения, выраженные как свинец (Pb) Хром и его соединения, выраженные как […]как хром (Cr) […] Кобальт и его соединения, выраженные как кобальт (Co) Медь и i t s соединения , e xp в виде меди (C u) Марганец a n di t s компаунды , e resse x6 марганец ( M n) Никель и i t s компаунды , никелевый сплав 90p16 и его соединения, выраженные […]в виде ванадия (V) всего 0,5 мг / м3 всего 1 мг / м3 eur-lex.europa.eu | Arsnio e seus compostos, expressos em arsnio (As) Chumbo e seus compostos, expressos em chumbo (Pb) Crmio e seus compostos, […]экспрессов em crmio (Cr) […] Cobalto e s eus compostos, ex pr essos em cobalto (Co) Cobre e s eus compostos, ex pr essos em cob re (Cu) 9016 seus compostos , ex pr esso s em mangans (Mn) Nq ue le se empos empos compostos6 Ni) Vandio e seus compostos, expr es sos em […]vandio (V) всего 0,5 мг / м3 всего 1 мг / м3 eur-lex.europa.eu |
| Эти подшипники га v e марганец a s a lloy element. nsk.com.br | Esses rolamentos […] tm como element nt или lig и или манганы .нск.com.br |
Новые ингибиторы нитрификации или ингибиторы уреазы могут быть включены в таблицы F1 или F2 […], соответственно, после оценки технических файлов, представленных в соответствии с руководящими принципами, должно быть […] разработан для t he s e соединений .eur-lex.europa.eu | Podem includes-se novos inibidores da nitrificao ou da urease nos quadros F1 or F2 Respectivamente, […]aps a avaliao da documentao tcnica apresentada em concidade com as orientaes […] elabor ad as pa ra es tes compostos .eur-lex.europa.eu |
Номер […] из этих организаций и i c соединений a r e канцерогены, […]мутагенов или репротоксичных веществ и, следовательно, непосредственно вредны для […]здоровья человека или окружающей среды. europa.eu | M ui tos d ess es compostos or gn icos s o subncias […] Cancegenas, mutagnicas ou txicas na воспроизводить, pelo que so directamente […]предубеждений для sade humana ou para o meio ambiente. europa.eu |
Развитие […] предварительные смеси с exis ti n g соединения r e ma ins важная особенность […]на этом рынке. eur-lex.europa.eu | O desenvolvimento de […] pr-misturas com components e xi stent es contina a ser u ma caracterstica […]importante deste mercado. eur-lex.europa.eu |
переработка неорганических материалов […] кроме металлов или m et a l компаундыeuroparl.europa.eu | Reciclagem / recuperao de materiais inorgnicos que […] no o s meta is o u compostos m etl ico seuroparl.europa.eu |
Также в США огнестойкий […] Olefinic C ab l e Соединения ( F RO CC) были изменены, […]прежде всего в отношении документов и электронных […] Было установлено, что данныене имеют дальнейшего использования, кроме как в качестве доказательств в судебных процессах или для расследований, проводимых властями. auditoriajuridica.com | Tambm nos Estados Unidos, o Огнестойкий […] Олефиновые C ab le Соединения (F RO CC) foi alterado, […]сборник для документов и документов […]eletrnicos encontrados que no tenham mais utilidade, mas que podem servir de prova em processos judiciais ou para investigao pelas autoridades. auditoriajuridica.com |
Комиссия разрешила создание совместного предприятия между Shell Chimie, французской дочерней компанией группы Shell, и Elf Atochem или «Ato», дочерней компанией Elf . […]Аквитанская группа; совместная дочерняя компания […] это сделать P V C соединения f o r производство […]полых профилей, которые используются […]в основном как контейнеры для жидкостей для потребления человеком. europa.eu | A Comisso autorizou a criao de uma empresa comum entre a Shell Chimie (Shell), filial francesa do grupo Shell, e a Elf […]Atochem (Ato), филиал до группы Elf Aquitaine, […] no sect or das misturas ba se de policloreto […]de vinil («соединения ПВХ») destinadas […]ao fabrico de moldes ocos, utilizados essencialmente no acondicionamento de lquidos alimentares. europa.eu |
Это не чудаки — это вещи на основе бора, […] кальций, медь, i ro n , марганец , p ot assium, selenium, […]цинк и так далее. europarl.europa.eu | No se trata de drogas estapafrdias — trata-se sim de coisas base de brio, […] clcio, co br e, f erro , mangans , pot ssio , selnio, […]zinco e por a fora. europarl.europa.eu |
| Марганец d i ox ide имеет тенденцию […] электрона, когда он вступает в реакцию. todostocking.com | O di xid o d o mangans t em a t endn ci a ganhar […] eltrons quando include a reao. todostocking.com |
Катод положительный электрод […] и мад e o f марганец d i ox ide.www1.duracell.com | O ctodo o elctrodo positivo e [. ➤
|
