Металлы — это… Что такое Металлы?
О соответствующем направлении рок-музыки см. Метал.
Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Из 118[1]химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
6 элементов в группе щелочных металлов,
6 в группе щёлочноземельных металлов,
38 в группе переходных металлов,
11 в группе лёгких металлов,
7 в группе полуметаллов,
14 в группе лантаноиды + лантан,
14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний,
вне определённых групп бериллий и магний.
Таким образом, к металлам, возможно, относится 96 элементов из всех открытых.
В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия (см. Металличность).
Происхождение слова «металл»
Слово «металл» заимствовано из немецкого языка в старорусский период. Отмечается в «Травнике» Николая Любчанина, написанном в 1534 году: «…злато и сребро всех металей одолеваетъ». Окончательно усвоено в Петровскую эпоху. Первоначально имело общее значение «минерал, руда, металл»; разграничение этих понятий произошло в эпоху М.В. Ломоносова.
Немецкое слово «metall» заимствовано из латинского языка, где «metallum» – «рудник, металл». Латинское в свою очередь заимствовано из греческого языка (μεταλλον – «рудник, копь»).
Нахождение в природе
Бо́льшая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам. Кроме того, в малых количествах они присутствуют в морской воде, растениях, живых организмах (играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов[3]. Больше всего в наших клетках кальция и натрия, сконцентрированного в лимфатических системах. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови.
Добыча
Металлы часто извлекают из земли средствами горной промышленности, результат — добытые руды — служат относительно богатым источником необходимых элементов. Для выяснения нахождения руд используются специальные поисковые методы, включающие разведку руд и исследование месторождений. Месторождения, как правило, делятся на карьеры (разработки руд на поверхности), в которых добыча ведётся путем извлечения грунта с использованием тяжелой техники, а также — на подземные шахты.
Из добытой руды металлы извлекаются, как правило, с помощью химического или электролитического восстановления. В пирометаллургии для преобразования руды в металлическое сырьё используются высокие температуры, в гидрометаллургии применяют для тех же целей водную химию. Используемые методы зависят от вида металла и типа загрязнения.
Когда металлическая руда является ионным соединением металла и неметалла, для извлечения чистого металла она обычно подвергается выплавлению — нагреву с восстановителем. Многие распространенные металлы, такие как железо, плавят с использованием в качестве восстановителя углерода (получаемого из сжигания угля). Некоторые металлы, такие как алюминий и натрий, не имеют ни одного экономически оправданного восстановителя и извлекаются с применением электролиза.
Сульфидные руды не улучшаются непосредственно до получения чистого металла, но обжигаются на воздухе, с целью преобразования их в окислы.
Свойства металлов
Характерные свойства металлов
Физические свойства металлов
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже приводится твёрдость некоторых металлов по шкале Мооса.
Твёрдость некоторых металлов по шкале Мооса:[6]
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы такие как золото, серебро, свинец, алюминий, осмий могут срастаться между собой, но на это может уйти десятки лет.
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Гладкая поверхность металлов отражает большой процент света — это явление называется металлическим блеском. Однако в порошкообразном состоянии большинство металлов теряют свой блеск; алюминий и магний, тем не менее, сохраняют свой блеск и в порошке. Наиболее хорошо отражают свет алюминий, серебро и палладий — из этих металлов изготовляют зеркала. Для изготовления зеркал иногда применяется и родий, несмотря на его исключительно высокую цену: благодаря значительно большей, чем у серебра или даже палладия, твёрдости и химической стойкости, родиевый слой может быть значительно тоньше, чем серебряный.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Химические свойства металлов
На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны)
Реакции с простыми веществами
- С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
оксид лития
пероксид натрия
надпероксид калия
Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
Со средними и малоактивными металлами реакция происходит при нагревании:
- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
При нагревании:
- С серой реагируют все металлы, кроме золота и платины:
Железо взаимодействует с серой при нагревании, образуя сульфид:
- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
- С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
Взаимодействие кислот с металлами
С кислотами металлы реагируют по-разному. Металлы, стоящие в электрохимическом ряду активности металлов (ЭРАМ) до водорода, взаимодействуют практически со всеми кислотами.
Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода
Происходит реакция замещения, которая также является окислительно-восстановительной:
Взаимодействие серной кислоты H2SO4 с металлами
Окисляющие кислоты могут взаимодействовать и с металлами, стоящими в ЭРАМ после водорода:
Очень разбавленная кислота реагирует с металлом по классической схеме:
При увеличении концентрации кислоты образуются различные продукты:
Реакции для азотной кислоты (HNO3)
Продукты взаимодействия железа с HNO3 разной концентрацииПри взаимодействии с активными металлами вариантов реакций ещё больше:
Легирование
Легирование — это введение в расплав дополнительных элементов, модифицирующих механические, физические и химические свойства основного материала.
Микроскопическое строение
Характерные свойства металлов можно понять, исходя из их внутреннего строения. Все они имеют слабую связь электронов внешнего энергетического уровня (другими словами, валентных электронов) с ядром. Благодаря этому созданная разность потенциалов в проводнике приводит к лавинообразному движению электронов (называемых электронами проводимости) в кристаллической решётке. Совокупность таких электронов часто называют электронным газом. Вклад в теплопроводность, помимо электронов, дают фононы (колебания решётки). Пластичность обусловлена малым энергетическим барьером для движения дислокаций и сдвига кристаллографических плоскостей. Твёрдость можно объяснить большим числом структурных дефектов (междоузельные атомы, вакансии и др.).
Из-за лёгкой отдачи электронов возможно окисление металлов, что может приводить к коррозии и дальнейшей деградации свойств. Способность к окислению можно узнать по стандартному ряду активности металлов. Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий.
Для более корректного описания электронных свойств металлов необходимо использовать квантовую механику. Во всех твёрдых телах с достаточной симметрией уровни энергии электронов отдельных атомов перекрываются и образуют разрешённые зоны, причём зона, образованная валентными электронами, называется валентной зоной. Слабая связь валентных электронов в металлах приводит к тому, что валентная зона в металлах получается очень широкой, и всех валентных электронов не хватает для её полного заполнения.
Принципиальная особенность такой частично заполненной зоны состоит в том, что даже при минимальном приложенном напряжении в образце начинается перестройка валентных электронов, т. е. течёт электрический ток.
Та же высокая подвижность электронов приводит и к высокой теплопроводности, а также к способности зеркально отражать электромагнитное излучение (что и придаёт металлам характерный блеск).
Некоторые металлы
- Щелочные:
- Щёлочноземельные:
- Переходные:
- Лёгкие:
- Другие:
Применение металлов
Конструкционные материалы
Металлы и их сплавы — одни из главных конструкционных материалов современной цивилизации. Это определяется прежде всего их высокой прочностью, однородностью и непроницаемостью для жидкостей и газов. Кроме того, меняя рецептуру сплавов, можно менять их свойства в очень широких пределах.
Электротехнические материалы
Металлы используются как в качестве хороших проводников электричества (медь, алюминий), так и в качестве материалов с повышенным сопротивлением для резисторов и электронагревательных элементов (нихром и т. п.).
Инструментальные материалы
Металлы и их сплавы широко применяются для изготовления инструментов (их рабочей части). В основном это инструментальные стали и твёрдые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика.
История развития представлений о металлах
Знакомство человека с металлами началось с золота, серебра и меди, то есть с металлов, встречающихся в свободном состоянии на земной поверхности; впоследствии к ним присоединились металлы, значительно распространенные в природе и легко выделяемые из их соединений: олово, свинец, железо и ртуть. Эти семь металлов были знакомы человечеству в глубокой древности. Среди древнеегипетских артефактов встречаются золотые и медные изделия, которые, по некоторым данным, относятся к эпохе, удаленной на 3000—4000 лет от н. э.
К семи известным металлам уже только в средние века прибавились цинк, висмут, сурьма и в начале XVIII столетия мышьяк. С середины XVIII века число открытых металлов быстро возрастает и к началу XX столетия доходит до 65, а к началу XXI века — до 96.
Ни одно из химических производств не способствовало столько развитию химических знаний, как процессы, связанные с получением и обработкой металлов; с историей их связаны важнейшие моменты истории химии. Свойства металлов так характерны, что уже в самую раннюю эпоху золото, серебро, медь, свинец, олово, железо и ртуть составляли одну естественную группу однородных веществ, и понятие о «металле» относится к древнейшим химическим понятиям. Однако воззрения на их натуру в более или менее определенной форме появляются только в средние века у алхимиков. Правда, идеи Аристотеля о природе: образовании всего существующего из четырёх элементов (огня, земли, воды и воздуха) уже тем самым указывали на сложность металлов; но эти идеи были слишком туманны и абстрактны. У алхимиков понятие о сложности металлов и, как результат этого, вера в возможность превращать одни металлы в другие, создавать их искусственно, является основным понятием их миросозерцания. Это понятие есть естественный вывод из той массы фактов, относящихся до химических превращений металлов, которые накопились к тому времени. В самом деле, превращение металла в совершенно непохожую на них окись простым прокаливанием на воздухе и обратное получение металла из окиси, выделение одних металлов из других, образование сплавов, обладающих другими свойствами, чем первоначально взятые металлы, и прочее — всё это как будто должно было указывать на сложность их натуры.
Что касается собственно до превращения металлов в золото, то вера в возможность этого была основана на многих видимых фактах. В первое время образование сплавов, цветом похожих на золото, например из меди и цинка, в глазах алхимиков уже было превращением их в золото. Им казалось, что нужно изменить только цвет, и свойства металла также станут другими. В особенности много способствовали этой вере плохо поставленные опыты, когда для превращения неблагородного металла в золото брались вещества, содержавшие примесь этого золота. Например, уже в конце XVIII столетия один копенгагенский аптекарь уверял, что химически чистое серебро при сплавлении с мышьяком отчасти превращается в золото. Этот факт был подтвержден известным химиком Гитоном де Морво и наделал много шума. Вскорости потом было показано, что мышьяк, служивший для опыта, содержал следы серебра с золотом.
Так как из семи известных тогда металлов одни легче подвергались химическим превращениям, другие труднее, то алхимики делили их на благородные — совершенные, и неблагородные — несовершенные. К первым принадлежали золото и серебро, ко вторым медь, олово, свинец, железо и ртуть. Последняя, обладая свойствами благородных металлов, но в то же время резко отличаясь от всех металлов своим жидким состоянием и летучестью, чрезвычайно занимала тогдашних ученых, и некоторые выделяли её в особую группу; внимание, привлекавшееся ей, было так велико, что ртуть стали считать в числе элементов, из которых образованы собственно металлы, и в ней именно видели носителя металлических свойств. Принимая существование в природе перехода одних металлов в другие, несовершенных в совершенные, алхимики предполагали, что в обычных условиях это превращение идет чрезвычайно медленно, целыми веками, и, может быть, не без таинственного участия небесных светил, которым в тогдашнее время приписывали такую большую роль и в судьбе человека. По совпадению, известных тогда металлов было семь, как и известных тогда планет, а это ещё более указывало на таинственную связь между ними. У алхимиков металлы часто носят название планет; золото называется Солнцем, серебро — Луной, медь — Венерой, олово — Юпитером, свинец — Сатурном, железо — Марсом и ртуть — Меркурием. Когда были открыты цинк, висмут, сурьма и мышьяк, тела, во всех отношениях схожие с металлами, но у которых одно из характернейших свойств металла, ковкость, развито в слабой степени, то они были выделены в особую группу — полуметаллов. Деление металлов на собственно металлы и полуметаллы существовало ещё в середине XVIII столетия.
Определение состава металла первоначально было чисто умозрительным. В первое время алхимики принимали, что они образованы из двух элементов — ртути и серы. Происхождение этого воззрения неизвестно, оно имеется уже в VIII столетии. По Геберу доказательством присутствия ртути в металлах служит то, что она их растворяет, и в этих растворах индивидуальность их исчезает, поглощается ртутью, чего не случилось бы, если бы в них не было одного общего с ртутью начала. Кроме того, ртуть со свинцом давала нечто похожее на олово. Что касается серы, то, может быть, она взята потому, что были известны сернистые соединения, по внешнему виду схожие с металлами. В дальнейшем эти простые представления, вероятно, вследствие безуспешных попыток получения металлов искусственно, крайне усложняются, запутываются. В понятиях алхимиков, например Х—XIII столетий, ртуть и сера, из которых образованы металлы, не были теми ртутью и серой, которые имели в руках алхимики. Это было только нечто схожее с ними, обладающее особыми свойствами; нечто такое, которое в обыкновенной сере и ртути существовало реально, было выражено в них в большей степени, чем в других телах. Под ртутью, входящей в состав металлов, представляли нечто, обуславливающее неизменяемость их, металлический блеск, тягучесть, одним словом, носителя металлического вида; под серой подразумевали носителя изменяемости, разлагаемости, горючести металлов. Эти два элемента находились в металлах в различном соотношении и, как тогда говорили, различным образом фиксированные; кроме того, они могли быть различной степени чистоты. По Геберу, например, золото состояло из большого количества ртути и небольшого количества серы в высшей степени чистоты и наиболее фиксированных; в олове, напротив, предполагали много серы и мало ртути, которые были не чисты, плохо фиксированы и прочее. Всем этим, конечно, хотели выразить различное отношение металлов к единственному в тогдашнее время могущественному химическому агенту — огню. При дальнейшем развитии этих воззрений двух элементов — ртути и серы — для объяснения состава металлов алхимикам показалось недостаточно; к ним присоединили соль, а некоторые мышьяк. Этим хотели указать, что при всех превращениях металлов остается нечто не летучее, постоянное. Если в природе «превращение неблагородных металлов в благородные совершается веками», то алхимики стремились создать такие условия, в которых этот процесс совершенствования, созревания шёл бы скоро и легко. Вследствие тесной связи химии с тогдашней медициной и тогдашней биологией, идея о превращении металлов естественным образом отождествлялась с идеей о росте и развитии организованных тел: переход, например, свинца в золото, образование растения из зерна, брошенного в землю и как бы разложившегося, брожение, исцеление больного органа у человека — все это были частные явления одного общего таинственного жизненного процесса, совершенствования, и вызывались одними стимулами. Отсюда само собой понятно, что таинственное начало, дающее возможность получить золото, должно было исцелять болезни, превращать старое человеческое тело в молодое и прочее. Так сложилось понятие о чудесном философском камне.
Что касается роли философского камня в превращении неблагородных металлов в благородные, то больше всего существует указаний относительно перехода их в золото, о получении серебра говорится мало. По одним авторам, один и тот же философский камень превращает металлы в серебро и золото; по другим — существуют два рода этого вещества: одно совершенное, другое менее совершенное, и это то последнее и служит для получения серебра. Относительно количества философского камня, требующегося для превращения, указания тоже разные. По одним, 1 часть его способна превратить в золото 10000000 частей металла, по другим — 100 частей и даже только 2 части. Для получения золота плавили какой-нибудь неблагородный металл или брали ртуть и бросали туда философский камень; одни уверяли, что превращение происходит мгновенно, другие же — мало-помалу. Эти взгляды на природу металлов и на способность их к превращениям держатся в общем в течение многих веков до XVII столетия, когда начинают резко отрицать все это, тем более что эти взгляды вызвали появление многих шарлатанов, эксплуатировавших надежду легковерных получить золото. С идеями алхимиков в особенности боролся Бойль: «Я бы хотел знать, — говорит он в одном месте, — как можно разложить золото на ртуть, серу и соль; я готов уплатить издержки по этому опыту; что касается меня, то я никогда не мог этого достигнуть».
После вековых бесплодных попыток искусственного получения металлов и при том количестве фактов, которые накопились к XVII столетию, например о роли воздуха при горении, увеличении веса металла при окислении, что, впрочем, знал ещё Гебер в VIII столетии, вопрос об элементарности состава металла, казалось, был совсем близок к окончанию; но в химии появилось новое течение, результатом которого явилась флогистонная теория, и решение этого вопроса было ещё отсрочено на продолжительное время.
Тогдашних ученых сильно занимали явления горения. Исходя из основной идеи тогдашней философии, что сходство в свойствах тел должно происходить от одинаковости начал, элементов, входящих в их состав, принимали, что тела горючие заключают общий элемент. Акт горения считался актом разложения, распадения на элементы; при этом элемент горючести выделялся в виде пламени, а другие оставались. Признавая взгляд алхимиков на образование металлов из трёх элементов, ртути, серы и соли, и принимая их реальное существование в металле, горючим началом в них нужно было признать серу. Тогда другой составной частью металла нужно было, очевидно, признать остаток от прокаливания металла — «землю», как тогда говорили; следовательно, ртуть тут ни при чём. С другой стороны, сера сгорает в серную кислоту, которую многие, в силу сказанного, считали более простым телом, чем сера, и включили в число элементарных тел. Выходила путаница и противоречие. Бехер, чтобы согласовать старые понятия с новыми, принимал существование в металле земли трех сортов: собственно «землю», «землю горючую» и «землю ртутную». В этих-то условиях Шталь предложил свою теорию. По его мнению, началом горючести служит не сера и не какое-либо другое известное вещество, а нечто неизвестное, названное им флогистоном. Металлы, будто бы, образованы из флогистона и земли; прокаливание металла на воздухе сопровождается выделением флогистона; обратное получение металлов из его земли с помощью угля — вещества, богатого флогистоном — есть акт соединения флогистона с землей. Хотя металлов было несколько и каждый из них при прокаливании давал свою землю, последняя, как элемент, была одна, так что и эта составная часть металла была такого же гипотетического характера, как и флогистон; впрочем, последователи Шталя иногда принимали столько «элементарных земель», сколько было металлов. Когда Кавендиш при растворении металлов в кислотах получил водород и исследовал его свойства (неспособность поддерживать горение, его взрывчатость в смеси с воздухом и проч.), он признал в нём флогистон Шталя; металлы, по его понятиям, состоят из водорода и «земли». Этот взгляд принимался многими последователями флогистонной теории.
Несмотря на видимую стройность теории флогистона, существовали крупные факты, которые никак нельзя было связать с ней. Ещё Геберу было известно, что металлы при обжигании увеличиваются в весе; между тем, по Шталю, они должны терять флогистон: при обратном присоединении флогистона к «земле» вес полученного металла меньше веса «земли». Таким образом выходило, что флогистон должен обладать каким-то особенным свойством — отрицательным тяготением. Несмотря на все остроумные гипотезы, высказанные для объяснения этого явления, оно было непонятно и вызывало недоумение.
Когда Лавуазье выяснил роль воздуха при горении и показал, что прибыль в весе металлов при обжигании происходит от присоединения к металлам кислорода из воздуха, и таким образом установил, что акт горения металлов есть не распадение на элементы, а, напротив, акт соединения, вопрос о сложности металлов был решен отрицательно. Металлы были отнесены к простым химическим элементам, в силу основной идеи Лавуазье, что простые тела суть те, из которых не удалось выделить других тел. С созданием периодической системы химических элементов Менделеевым элементы металлов заняли в ней своё законное место.
См. также
Примечания
Ссылки
| Электрохимический ряд активности металлов | |
|---|---|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au |
dic.academic.ru
Металл — это… Что такое Металл?
Мета́лл (название происходит от лат. metallum — шахта) — один из классов элементов, которые в отличие от неметаллов (и металлоидов), обладают характерными металлическими свойствами. Металлами являются большинство химических элементов (примерно 70 %). Самым распространённым металлом в земной коре является алюминий.
Металлы (1А и 2А группа)- это химические элементы, атомы которых легко отдают валентные электроны с внешнего и предвнешнего подуровня, превращаясь в катионы, это обусловлено малым количеством валентных электронов и большим радиусом атома.
Нахождение в природе
Большая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 элементов). Исключением можно назвать около 16 элементов: т. н. благородные металлы (золото, серебро и др.), и некоторые другие (например, ртуть, медь), которые присутствуют без примесей. Золото, серебро и платина относятся также к драгоценным металлам. Кроме того, в малых количествах они присутствуют в морской воде, растениях, живых организмах (играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов. Больше всего в наших клетках кальция и натрия, сконцентрированного в лимфатических системах. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови.
Свойства металлов
Характерные свойства металлов
Физические свойства металлов
Все металлы (кроме ртути) тверды при нормальных условиях. Однако твёрдость их различна. Так, щелочные металлы легко режутся кухонным ножом. Сталь же по твёрдости схожа с оконным стеклом. Такие металлы, как ванадий, вольфрам и хром легко царапают самую твёрдую сталь и стекло.
Твёрдость некоторых металлов по шкале Мооса:
| Твёрдость | Металл | Обрабатываемость |
|---|---|---|
| 0.2 | Цезий | очень легко царапался бы ногтём (прикосновение опасно.) |
| 0.3 | Рубидий | очень легко царапался бы ногтём (прикосновение опасно.) |
| 0.4 | Калий | очень легко царапался бы ногтём (прикосновение опасно.) |
| 0.5 | Натрий | очень легко царапался бы ногтём (прикосновение опасно.) |
| 0.6 | Литий | очень легко царапался бы ногтём (прикосновение опасно.) |
| 1.2 | Индий | легко царапается ногтём |
| 1.2 | Таллий | легко царапается ногтём |
| 1.25 | Барий | легко царапается ногтём |
| 1.5 | Стронций | царапается ногтём |
| 1.5 | Галлий | царапается ногтём |
| 1.5 | Олово | царапается ногтём |
| 1.5 | Свинец | царапается ногтём |
| 1.5 | Ртуть | царапается ногтём (в твёрдом состоянии) |
| 1.75 | Кальций | царапается ногтём |
| 2.0 | Кадмий | царапается алюминиевой ложкой |
| 2.25 | Висмут | царапается алюминиевой ложкой |
| 2.5 | Магний | царапается медной проволокой |
| 2.5 | Цинк | царапается медной проволокой |
| 2.5 | Серебро | царапается медной монетой |
| 2.5 | Золото | царапается медной монетой |
| 3.0 | Медь | царапается кухонным ножом |
| 3.0 | Сурьма | царапается кухонным ножом |
| 3.5 | Платина | царапается кухонным ножом |
| 4.0 | Железо | царапается кухонным ножом (из нержавеющей стали) |
| 4.0 | Никель | царапается кухонным ножом (из нержавеющей стали) |
| 4.75 | Палладий | царапается кухонным ножом (из нержавеющей стали) |
| 5.0 | Кобальт | царапается стеклом и стальным гвоздём |
| 5.0 | Цирконий | царапается стеклом и стальным гвоздём |
| 5.0 | Бериллий | царапается напильником из и полевым шпатом |
| 5.5 | Молибден | царапается напильником из и полевым шпатом |
| 5.5 | Гафний | царапается напильником из и полевым шпатом |
| 6.0 | Титан | царапает стекло; царапается стеклом и напильником |
| 6.0 | Марганец | царапает стекло; царапается стеклом и напильником |
| 6.0 | Германий | царапает стекло; царапается стеклом и напильником |
| 6.0 | Ниобий | царапает стекло; царапается стеклом и напильником |
| 6.0 | Родий | царапает стекло; царапается стеклом и напильником |
| 6.5 | Рутений | царапает стекло; царапается кварцом |
| 6.5 | Тантал | царапает стекло; царапается кварцом |
| 6.5 | Иридий | царапает стекло; царапается кварцом |
| 7.0 | Ванадий | царапает все виды сталей; царапается топазом |
| 7.0 | Рений | царапает все виды сталей; царапается топазом |
| 7.0 | Осмий | царапает все виды сталей; царапается топазом |
| 7.5 | Вольфрам | царапает все виды сталей; царапается топазом |
| 8.5 | Хром | легко царапает стекло и все металлы; царапается рубином |
Температуры плавления лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые «нормальные» металлы, например олово и свинец, можно расплавить на обычной электрической или газовой плите.
В зависимости от плотности металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0.53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22.6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0.003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым.
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Гладкая поверхность металлов отражает большой процент света — это явление называется металлическим блеском. Однако в порошкообразном состоянии большинство металлов теряют свой блеск; алюминий и магний, тем не менее, сохраняют свой блеск и в порошке. Наиболее хорошо отражают свет алюминий, серебро и палладий — из этих металлов изготовляют зеркала. Для изготовления зеркал иногда применяется и родий, несмотря на его исключительно высокую цену: благодаря значительно большей, чем у серебра или даже палладия, твёрдости и химической стойкости, родиевый слой может быть значительно тоньше, чем серебряный.
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Химические свойства металлов
На внешнем электронном слое у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны)
1. Реакции с простыми веществами
- С кислородом реагируют все металлы, кроме золота, платины. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
4Li + O2 = 2Li2O оксид лития
2Na + O2 = Na2O2 пероксид натрия
K + O2 = KO2 надпероксид калия
Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
Na2O2 + 2Na = 2Na2O
Со среднмими и малоактивными металлами реакция происходит при нагревании:
3Fe + 2O2 = Fe3O4
2Hg + O2 = 2HgO
2Cu + O2 = 2CuO
- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
6Li + N2 = 2Li3N
При нагревании:
2AL + N2 = 2AlN
3Ca + N2 = 2Ca3N2
- С серой реагируют все металлы, кроме золота и платины:
Железо взаимодействует с серой при нагревании, образуя сульфид:
Fe + S = FeS
- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
2Na + H2 = 2NaH
Mg + H2 = MgH2
- С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодествии с водой дают ацетилен, метаниды — метан.
2Na + 2C = Na2C2
Na2C2 + 2H2O = 2NaOH + C2H2
2Na + H2 = 2NaH
Легирование
Это введение в расплав дополнительных элементов, улучшающих механические, физические и химические свойства основного материала.
Микроскопическое строение
Характерные свойства металлов можно понять, исходя из их внутреннего строения. Все они имеют слабую связь электронов внешнего энергетического уровня (другими словами, валентных электронов) с ядром. Благодаря этому созданная разность потенциалов в проводнике приводит к лавинообразному движению электронов (называемых электронами проводимости) в кристаллической решётке. Совокупность таких электронов часто называют электронным газом. Вклад в теплопроводность, помимо электронов, дают фононы (колебания решётки). Пластичность обусловлена малым энергетическим барьером для движения дислокаций и сдвига кристаллографических плоскостей. Твёрдость можно объяснить большим числом структурных дефектов (междоузельные атомы, вакансии и др.).
Из-за лёгкой отдачи электронов возможно окисление металлов, что может приводить к коррозии и дальнейшей деградации свойств. Способность к окислению можно узнать по стандартному ряду активности металлов. Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий.
Для более корректного описания электронных свойств металлов необходимо использовать квантовую механику. Во всех твёрдых телах с достаточной симметрией уровни энергии электронов отдельных атомов перекрываются и образуют разрешённые зоны, причём зона, образованная валентными электронами, называется валентной зоной. Слабая связь валентных электронов в металлах приводит к тому, что валентная зона в металлах получается очень широкой, и всех валентных электронов не хватает для её полного заполнения.
Принципиальная особенность такой частично заполненной зоны состоит в том, что даже при минимальном приложенном напряжении в образце начинается перестройка валентных электронов, т. е. течёт электрический ток.
Та же высокая подвижность электронов приводит и к высокой теплопроводности, а также к способности зеркально отражать электромагнитное излучение (что и придаёт металлам характерный блеск).
Некоторые металлы
- Щелочные:
- Щёлочноземельные:
- Переходные
- Другие:
Применение металлов
Конструкционные материалы
Металлы и их сплавы — одни из главных конструкционных материалов современной цивилизации. Это определяется прежде всего их высокой прочностью, однородностью и непроницаемостью для жидкостей и газов. Кроме того, меняя рецептуру сплавов, можно менять их свойства в очень широких пределах.
Электротехнические материалы
Металлы используются как в качестве хороших проводников электричества (медь, алюминий), так и в качестве материалов с повышенным сопротивлением для резисторов и электронагревательных элементов (нихром и т. п.).
Инструментальные материалы
Металлы и их сплавы широко применяются для изготовления инструментов (их рабочей части). В основном это инструментальные стали и твёрдые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика.
Wikimedia Foundation. 2010.
dic.academic.ru
Тема 51. Металлы, применяемые в строительстве.
Основы производства: основной сырьевой компонент для получения ме. – рудные горные породы. Наиболее часто для производства ме. используют красный, магнитный бурый и шпатовый железняк. Основные технологические операции при изготовлении ме-их материалов: обработка сырья (дробление, промывка, обогащение железных руд) – дозировка – плавка (получение металлов) – формование (получение ме. материалов). При необходимости применяют механические и хим. способы отделки, лаки, краски, наносят тонкие ме-кие или полимерные пленки.
Ме., применяемые для производства строительных ма., разделяют на 2 группы:
Черные – сплав железа с углеродом — чугун и сталь На долю черных ме приходится около 95 % производимой в мире металлопродукции.
Цв.ме. – Al, медь, цинк, олово, никель, титан, магний и др.
Чугун (строительные материалы: опорные части колонн, трубы, радиаторы, санитарно-технические, посуда, ограды, лестницы) это сплав железа с углеродом при содержании углерода более 2,14%. обладает хорошими литейными св-ствами и малой способностью к пластической деформации. В его структуре содержатся графитовые включения — размер и форма, которые определяют тип чугуна и его применение для изготовления различных изделий. Серый чугун — это чугун, в котором углерод находится в свободном состоянии в форме пластинчатого графита. Высокопрочный чугун, в котором углерод находится в свободном состоянии в форме шаровидного графита, применяется для изготовления деталей, подвергающихся значительным механическим нагрузкам. Ковкий чугун имеет более высокие характеристики пластичности по сравнению с вышеуказанным чугуном и применяется при изготовлении деталей, где требуются более высокие показатели механических свойств.
Сталь (профили и листы, оболочки, мембраны, канаты, тросы, черепица, декоративно-художественные изделия) это сплав железа, чугуна и углерода. Углерод в этом сплаве является незаменимым компонентом, его содержание около 2%. В зависимости от состава стали, она может быть прочным материалом или твердым. Прочный материал используется для изготовления морских судов, мостов. Что же касается твердой стали, она используется для изготовления различных металлорежущих инструментов. Существует также нержавеющая сталь, которая является очень прочным и антикоррозионным материалом. Нержавеющая сталь состоит из хрома и никеля. Сталь — это материал, которому можно придавать любую форму с помощью прокатки, прессования или литья. С помощью термообработки, возможно, получить сталь, которая будет обладать различными как химическими, так и физическими свойствами. Некоторые мягкие стали обрабатываются ручным инструментом. Твердой сталью можно даже резать стекло. Сталь легко подвергается методу полировки.
Цв. ме. (защитные покрытия, черепица, герметизация стыков, профильные и декоративно-худ изделия) добыча цветного ме. ограниченна природными источниками и явл. трудоемким и длительным процессом. . В чистом их виде весьма редко используют в строительстве. Значительно чаще находят применение сплавы цв. ме., которые по плотности разделяют на легкие и тяжелые.
Легкие сплавы высокой прочности, обладающих хорошими высокотемпературными механическими св-твами. Основными ме. легких сплавов алюминий, магний, титан и бериллий. Однако сплавы на основе алюминия и магния не могут применяться в условиях высокой температуры и в агрессивных средах.
Тяжелые сплавы получают на основе меди, олова, цинка, свинца. Среди тяжелых сплавов в строительстве применяют бронзу (сплав меди с оловом или сплав меди с al, железом и марганцем) и латунь (сплав меди с цинком). Из этих сплавов изготовляют архитектурные детали и санитарно-техническую арматуру.
Ме. прокат – обжатие ме. между вращающимися валиками. Ме. прокат. По конструкции лист стальной представляет собой металлический лист. Листовой металлопрокат используется как материал для производства металлической продукции, например такой, как гнутые профили, профнастил. Кроме того, листовой металлопрокат (стальной лист) имеет широкое применение в области строительства теплообменной и химической аппаратуры. Из стального листа производятся кузова автомобилей и летательных аппаратов.
Основные виды проката:
Штамповка и прессование (получение рельефных облицовочных материалов, элементов оборудования)
Сортамент: трубы, листы (для обшивок панелей, ограждений балконов, наружной облицовки, подвесных потолков),сортовой прокат (профили) (несущие и ограждающие конструкции, окна, витрины, для подвесных потолков, плинтусов, раскладок и т.д.)
Свойства металлов:
Эксплуатационно-технические – средняя плотность, прочность, пластичность, коррозионная стойкость, антимагнитность, высокая стойкость при низких отрицательных температурах.
Область применения строительных материалов из металла:
Подвесные системы, каркасы зданий, мосты и путепроводы, радио и телевизионные башни, фермы, пространственные ячейки, ванты, В строительстве сталь используют для изготовления конструкций, армирования железобетонных конструкций, устройства кровли, подмостей, ограждений, форм железобетонных изделий .
Ме — кристаллические в-ва, характерными св-вами которых явл. высокая прочность, пластичность, тепло- и электропроводность, особый блеск, металлическим. Из ме в строительстве наиболее широко применяют стали и чугуны. Из стального проката возводят каркасы пром. и гражданских зданий, мосты, изготовляют арматуру для железобетона, кровельную сталь, трубы, а также различные ме. изделия, заклепки, болты, гвозди. Широкому использованию ме. в строительстве способствует ряд ценных тех. св-ств: высокая прочность, пластичность, повышенная теплопроводность, электропроводность и свариваемость.
Первичным элементом стальных конструкций явл. прокатная сталь, листовая или профильная, которая вырабатывается на металлургических заводах. Из этих элементов на заводах — изготовителях стальных конструкций собираются конструктивные элементы (балки, колонны и т. п.), целые конструкции или их отдельные части. Наличие готовых прокатных профилей, наряду с машинной обработкой их на заводах, обеспечивает индустриальное и быстрое изготовление стальных конструкций.
Сталь листовая 1) Сталь толстолистовая 2) Сталь тонколистовая. 3) Сталь широкополосная
Уголковые профили- Швеллеры –Двутавры Балки двутавровые обыкновенные, Облегченные балки Тавры,Гнутые фасонные профили
Коррозия — самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой.
Виды коррозии: газовая, атмосферная, биокоррозия, коррозия, химическую и электрохимическую.
Хим. коррозия— это коррозийный процесс, протекающий в средах, не проводящий электрический ток. Химическая коррозия имеет место, например при высокотемпературном нагреве стали для горячей обработки давлением или термической обработки. При этом на поверхности металла образуются различные химические соединения- оксиды, сульфиды и другие- в виде пленки.В отдельных случаях образовавшиеся при хим. коррозии пленки, особенно сплошные, предохраняют металл от дальнейшей коррозии. Пр алюминий, олово, свинец, никель и хром способны к образованию на поверхности металлов плотных защитных пленок. пленки же на поверхности стальных и чугунных изделий непрочны, способны к растрескиванию и проникновению коррозии в глубь металла.
Электрохимическая коррозия обычно сопровождается протеканием электрического тока. Примерами могут служить ржавление металлических конструкций и изделий в атмосфере, корпусов судов и стальной арматуры гидросооружений в речной и морской воде и т. п.
Методы защиты: применяют защитные покрытия (лакокрасочные), электрохимическую защиту и замедлители коррозии (ингибиторы), изменяющие состав коррозионной среды.
ИЛИ- легирование сталей, нанесение металлических покрытий, электрохимическая защита.
Легирование наиболее надежно защищает металл от коррозии, причем наиболее эффективно в условиях воздействия механических напряжений и коррозийной среды. Легирование позволяет предотвратить и коррозийное растрескивание изделий. стали повышает ее антикоррозионные свойства. (добавление в состав материалов примесей для изменения физ. и хим. св-в основного материала.) Например медь,хром
Ме. покрытия наносят на поверхность изделия тонким слоем металла, обладающего достаточной стойкостью в данной среде. Металлические покрытия придают также поверхностным слоям металлоизделий требуемую твердость, износостойкость Широкое применение получили цинковые покрытия для защиты арматуры, труб и резервуаров от действия воды и горячих жидкостей.
Неме. покрытия выполняются из лаков, красок, эмалей и др. веществ и изолируют изделие от воздействия внешней среды. Они легко наносятся на изделие, хорошо закрывают поры, не изменяют свойств металла и являются относительно дешевыми. При хранении и перевозке изделий металлические изделия покрывают специальными смазочными материалами, минеральными маслами и жирами. Для защиты изделий, работающих в высокоагрессивных средах, применяют пластмассовые покрытия из винипласта, поливинилхлорида.
Хим. покрытия- защитные оксидные иные пленки- создаются при воздействии на металл сильных химических реагентов. Широко применяются также оксидирование и фосфатирование металлоизделий.
Оксидирование заключается в создании на поверхности изделия оксидной пленки, обладающей большой коррозийной стойкостью. Наиболее широко применяют оксидирование для защиты от коррозии изделий из алюминия и его сплавов.
Фосфатирование состоит в получении на изделии поверхностной пленки из нерастворимых солей железа или марганца в результате погружения металла в горячие растворы кислых фосфатов железа или марганца.
Лакокрасочные покрытия основаны на механической защите металла пленкой из различных красок и лаков. Ванны, раковины, декоративные изделия для защиты от коррозии покрывают эмалью, т. е. наплавляют на металл при температуре 750…800°С различные комбинации силикатов.
studfile.net
Металлы — Википедия
О соответствующем направлении рок-музыки см. Метал.Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
Классификация
Из 118 химических элементов, открытых на данный момент, к металлам относят:
6 элементов в группе щелочных металлов: Li, Na, K, Rb, Cs, Fr;
4 в группе щёлочноземельных металлов: Ca, Sr, Ba, Ra;
а также вне определённых групп бериллий и магний;
40 в группе переходных металлов:
— Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn;
— Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd;
— La, Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg;
— Ac, Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn;
7 в группе лёгких металлов: Al, Ga, In, Sn, Tl, Pb, Bi;
7 в группе полуметаллов[1]: B, Si, Ge, As, Sb, Te, Po;
14 в группе лантаноиды + лантан (La):
Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu;
14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний (Ac):
Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr.
Также металлическими свойствами может обладать водород[2][3].
Таким образом, к металлам, возможно, относится 94 элемента из всех открытых; все остальные являются неметаллами.
В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия (см. Металличность).
Кроме того, в физике металлам, как проводникам, противопоставляется полупроводники и диэлектрики (см. также Полуметалл (спинтроника))[4].
Некоторые группы/семейства металлов
- Щелочные:
- Щёлочноземельные:
- Другие (которые зачастую не совсем правильно относят к щёлочноземельным):
- Переходные:
- Постпереходные:
- Тугоплавкие
- Металлы платиновой группы
- Цветные
- Благородные
- Монетные
Аморфные металлы
Происхождение слова «металл»
Слово «металл» заимствовано из немецкого языка. Отмечается в «Травнике» Николая Любчанина, написанном в 1534 году: «…злато и серебро всех металей одолеваетъ». Окончательно усвоено в Петровскую эпоху. Первоначально имело общее значение «минерал, руда, металл»; разграничение этих понятий произошло в эпоху М. В. Ломоносова[5].
| Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец. Разделяются на высокие и простые металлы; которое разнство в том состоит, что высоких одним огнём без помощи других материй в пепел сожечь не можно, а напротив того простые через едину онаго силу в пепел обращаются. … За полуметаллы почитаются мышьяк, сурьма, висмут, цинк и ртуть. М. В. Ломоносов |
Немецкое слово «metall» заимствовано из латинского языка, где «metallum» — «рудник, металл». Латинское, в свою очередь, заимствовано из греческого языка (μεταλλον — «рудник, копь»).[6]
Нахождение в природе
Бо́льшая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 химических элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам. Кроме того, в малых количествах они присутствуют в морской воде и в живых организмах (играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов[7]. Больше всего в организме кальция (в костях) и натрия, выступающего в роли электролита в межклеточной жидкости и цитоплазме. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови.
Производство металлов
Подготовка руды
Металлы извлекают из земли в процессе добычи полезных ископаемых. Добытые руды служат относительно богатым источником необходимых элементов. Для выяснения нахождения руд в земной коре используются специальные поисковые методы, включающие разведку и исследование рудных месторождений. Месторождения руд разрабатываются открытым или карьерным способом и подземным или шахтным способом. Иногда применяется комбинированный (открыто-подземный) способ разработки рудных месторождений.
После извлечения руд они, как правило, подвергаются обогащению. При этом из исходного минерального сырья выделяют один или несколько полезных компонентов — рудный концентрат(ы), промпродукты и отвальные хвосты. В процессах обогащения используют отличия минералов полезного компонента и пустой породы в плотности, магнитной восприимчивости, смачиваемости, электропроводности, крупности, форме зёрен, химических свойствах и др.
Работа с рудой
Из добытой и обогащённой руды металлы извлекаются, как правило, с помощью химического или электролитического восстановления. В пирометаллургии для преобразования руды в металлическое сырьё используются высокие температуры, в гидрометаллургии применяют для тех же целей водную химию. Используемые методы зависят от вида металла и типа загрязнения.
Когда металлическая руда является ионным соединением металла и неметалла, для извлечения чистого металла она обычно подвергается выплавлению — нагреву с восстановителем. Многие распространённые металлы, такие как железо, медь, олово, плавят с использованием углерода в качестве восстановителя. Некоторые металлы, такие как алюминий и натрий, не имеют ни одного экономически оправданного восстановителя и извлекаются с применением электролиза.[8][9]
Сульфидные руды не улучшаются непосредственно до получения чистого металла, но обжигаются на воздухе, с целью преобразования их в окислы.
Физические свойства металлов
Твёрдость
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже в таблице приводится твёрдость некоторых металлов по шкале Мооса.
Температура плавления
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые металлы, например, олово и свинец, могут расплавиться на обычной электрической или газовой плите.
Плотность
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0,53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22,6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Пластичность
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0,003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Электропроводность
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Теплопроводность
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Наименьшая теплопроводность — у висмута и ртути.
Цвет
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Взаимодействие с простыми веществами
На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны).
Реакции с простыми веществами
- С кислородом реагируют все металлы, кроме золота и платиновых металлов. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
- 4Li+O2=2Li2O{\displaystyle {\mathsf {4Li+O_{2}=2Li_{2}O}}} оксид лития
- 2Na+O2=Na2O2{\displaystyle {\mathsf {2Na+O_{2}=Na_{2}O_{2}}}} пероксид натрия
- K+O2=KO2{\displaystyle {\mathsf {K+O_{2}=KO_{2}}}} надпероксид калия
Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
- Na2O2+2Na=2Na2O{\displaystyle {\mathsf {Na_{2}O_{2}+2Na=2Na_{2}O}}}
Со средними и малоактивными металлами реакция происходит при нагревании:
- 3Fe+2O2=Fe3O4{\displaystyle {\mathsf {3Fe+2O_{2}=Fe_{3}O_{4}}}}
- 2Hg+O2=2HgO{\displaystyle {\mathsf {2Hg+O_{2}=2HgO}}}
- 2Cu+O2=2CuO{\displaystyle {\mathsf {2Cu+O_{2}=2CuO}}}
- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
- 6Li+N2=2Li3N{\displaystyle {\mathsf {6Li+N_{2}=2Li_{3}N}}}
При нагревании:
- 2Al+N2=2AlN{\displaystyle {\mathsf {2Al+N_{2}=2AlN}}}
- 3Ca+N2=Ca3N2{\displaystyle {\mathsf {3Ca+N_{2}=Ca_{3}N_{2}}}}
- С серой реагируют все металлы, кроме золота и платины.
Железо взаимодействует с серой при нагревании, образуя сульфид:
- Fe+S=FeS{\displaystyle {\mathsf {Fe+S=FeS}}}
- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп, кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
- 2Na+h3=2NaH{\displaystyle {\mathsf {2Na+H_{2}=2NaH}}}
- Mg+h3=Mgh3{\displaystyle {\mathsf {Mg+H_{2}=MgH_{2}}}}
- С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
- 2Na+2C=Na2C2{\displaystyle {\mathsf {2Na+2C=Na_{2}C_{2}}}}
- Na2C2+2h3O=2NaOH+C2h3{\displaystyle {\mathsf {Na_{2}C_{2}+2H_{2}O=2NaOH+C_{2}H_{2}}}}
Взаимодействие кислот с металлами
С кислотами металлы реагируют по-разному. Металлы, стоящие в электрохимическом ряду активности металлов (ЭРАМ) до водорода, взаимодействуют практически со всеми кислотами.
Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода
Происходит реакция замещения, которая также является окислительно-восстановительной:
- Mg+2HCl=MgCl2+h3↑{\displaystyle {\mathsf {Mg+2HCl=MgCl_{2}+H_{2}\uparrow }}}
- 2Al+2h4PO4=2AlPO4+3h3↑{\displaystyle {\mathsf {2Al+2H_{3}PO_{4}=2AlPO_{4}+3H_{2}\uparrow }}}
Взаимодействие концентрированной серной кислоты H2SO4 с металлами
Окисляющие кислоты могут взаимодействовать и с металлами, стоящими в ЭРАМ после водорода:
- Cu+2h3SO4=CuSO4+SO2↑+2h3O{\displaystyle {\mathsf {Cu+2H_{2}SO_{4}=CuSO_{4}+SO_{2}\uparrow +2H_{2}O}}}
Сильно разбавленная кислота реагирует с металлом по классической схеме:
- Mg+h3SO4=MgSO4+h3↑{\displaystyle {\mathsf {Mg+H_{2}SO_{4}=MgSO_{4}+H_{2}\uparrow }}}
При увеличении концентрации кислоты образуются различные продукты:
- Mg+2h3SO4=MgSO4+SO2↑+2h3O{\displaystyle {\mathsf {Mg+2H_{2}SO_{4}=MgSO_{4}+SO_{2}\uparrow +2H_{2}O}}}
- 3Mg+4h3SO4=3MgSO4+S↓+4h3O{\displaystyle {\mathsf {3Mg+4H_{2}SO_{4}=3MgSO_{4}+S\downarrow +4H_{2}O}}}
- 4Mg+5h3SO4=4MgSO4+h3S↑+4h3O{\displaystyle {\mathsf {4Mg+5H_{2}SO_{4}=4MgSO_{4}+H_{2}S\uparrow +4H_{2}O}}}
Реакции для азотной кислоты (HNO3)
 Продукты взаимодействия железа с HNO3 разной концентрации
Продукты взаимодействия железа с HNO3 разной концентрации- Cu+4HNO3(60%)=Cu(NO3)2+2NO2↑+2h3O{\displaystyle {\mathsf {Cu+4HNO_{3}(60\%)=Cu(NO_{3})_{2}+2NO_{2}\uparrow +2H_{2}O}}}
- 3Cu+8HNO3(30%)=3Cu(NO3)2+2NO↑+4h3O{\displaystyle {\mathsf {3Cu+8HNO_{3}(30\%)=3Cu(NO_{3})_{2}+2NO\uparrow +4H_{2}O}}}
При взаимодействии с активными металлами вариантов реакций ещё больше:
- Zn+4HNO3(60%)=Zn(NO3)2+2NO2↑+2h3O{\displaystyle {\mathsf {Zn+4HNO_{3}(60\%)=Zn(NO_{3})_{2}+2NO_{2}\uparrow +2H_{2}O}}}
- 3Zn+8HNO3(30%)=3Zn(NO3)2+2NO↑+4h3O{\displaystyle {\mathsf {3Zn+8HNO_{3}(30\%)=3Zn(NO_{3})_{2}+2NO\uparrow +4H_{2}O}}}
- 4Zn+10HNO3(20%)=4Zn(NO3)2+N2O↑+5h3O{\displaystyle {\mathsf {4Zn+10HNO_{3}(20\%)=4Zn(NO_{3})_{2}+N_{2}O\uparrow +5H_{2}O}}}
- 5Zn+12HNO3(10%)=5Zn(NO3)2+N2↑+6h3O{\displaystyle {\mathsf {5Zn+12HNO_{3}(10\%)=5Zn(NO_{3})_{2}+N_{2}\uparrow +6H_{2}O}}}
- 4Zn+10HNO3(3%)=4Zn(NO3)2+Nh5NO3+3h3O{\displaystyle {\mathsf {4Zn+10HNO_{3}(3\%)=4Zn(NO_{3})_{2}+NH_{4}NO_{3}+3H_{2}O}}}
Легирование
Легирование — это введение в расплав дополнительных элементов, модифицирующих механические, физические и химические свойства основного материала.
Электронное строение
Все металлы имеют слабую связь валентных электронов (электронов внешнего энергетического уровня) с ядром. Благодаря этому созданная разность потенциалов в проводнике приводит к лавинообразному движению электронов (называемых электронами проводимости) в кристаллической решётке. Совокупность таких электронов часто называют электронным газом. Вклад в теплопроводность, помимо электронов, дают фононы (колебания решётки). Пластичность обусловлена малым энергетическим барьером для движения дислокаций и сдвига кристаллографических плоскостей. Твёрдость можно объяснить большим числом структурных дефектов (междоузельные атомы, вакансии и др.).
Из-за лёгкой отдачи электронов возможно окисление металлов, что может приводить к коррозии и дальнейшей деградации свойств. Способность к окислению можно узнать по ряду активности металлов. Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий.
Для более корректного описания электронных свойств металлов необходимо использовать квантовую механику. Во всех твёрдых телах с достаточной симметрией уровни энергии электронов отдельных атомов перекрываются и образуют разрешённые зоны, причём зона, образованная валентными электронами, называется валентной зоной. Слабая связь валентных электронов в металлах приводит к тому, что валентная зона в металлах получается очень широкой, и всех валентных электронов не хватает для её полного заполнения.
Принципиальная особенность такой частично заполненной зоны состоит в том, что даже при минимальном приложенном напряжении в образце начинается перестройка валентных электронов, то есть течёт электрический ток.
Та же высокая подвижность электронов приводит и к высокой теплопроводности, а также к способности зеркально отражать электромагнитное излучение (что и придаёт металлам характерный блеск).
Структура металлов
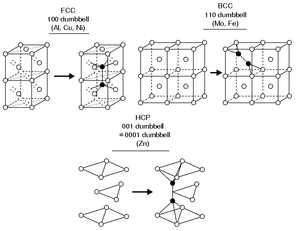 Кристаллическая структура сплавов
Вакансия в кристаллической решётке
Образование дендритов
Кристаллическая структура сплавов
Вакансия в кристаллической решётке
Образование дендритовНи один металл невозможно приготовить в абсолютно чистом состоянии. Технически «чистые» металлы могут содержать до нескольких процентов примесей, и если эти примеси являются элементами с низким атомным весом (например, углерод, азот или кислород), то в пересчёте на атомные проценты содержание этих примесей может быть очень большим. Первые небольшие количества примесей в металле обычно входят в кристалл в виде твёрдого раствора. Можно выделить два главных типа твёрдых растворов:
- первый, когда атомы примеси намного меньше атомов металла-растворителя, растворённые атомы располагаются в решётке растворителя по междоузлиям, или «пустотам». Образование таких твёрдых растворов — твёрдых растворов внедрения — почти всегда сопровождается расширением решётки растворителя, и в окрестности каждого растворённого атома имеется локальное искажение решётки;
- второй, когда атомы примеси и растворителя имеют приблизительно одинаковые размеры, образуется твёрдый раствор замещения, в котором атомы растворённого элемента замещают атомы растворителя, так что атомы обоих сортов занимают места в узлах общей решётки. В таких случаях тоже вокруг каждого растворённого атома имеется искажённая область, а будет ли при этом решётка расширяться или сжиматься, зависит от относительных размеров атомов растворителя и растворённого вещества[11].
Для большей части металлов наиболее важными элементами, образующими твёрдые растворы внедрения, являются водород, бор, углерод, азот и кислород. Присутствие дислокаций всегда приводит к появлению аномально больших или малых межатомных расстояний. В присутствии примесей каждая дислокация окружена «атмосферой» примесных атомов. Примесные атмосферы «закрепляют» дислокации, потому что в результате перемещения дислокаций будет образовываться новая конфигурация с повышенной энергией. Границы между кристаллами также являются областями с аномальными межатомными расстояниями и, следовательно, тоже растворяют примесные атомы легче, чем неискажённые области кристаллов.
При увеличении содержания примесей растворённые атомы входят и в основную массу кристалла, однако всё ещё имеется избыток примеси по границам зёрен и вокруг дислокаций. Когда содержание примеси превышает предел растворимости, появляется новая фаза, которая может представлять собой или растворённое вещество, или промежуточную фазу, или соединение. В таких случаях границы между фазами могут быть двух родов. В общем случае кристаллическая структура частичек примеси слишком отлична от структуры металла-растворителя, поэтому решётки двух фаз не могут переходить одна в другую, образуя непрерывную структуру. В таких случаях на границах раздела фаз образуются слои с нерегулярной (искажённой) структурой. С образованием границ связано появление свободной поверхностной энергии, однако энергия деформации решётки растворителя относительно невелика. В таких случаях говорят, что эти частицы выделяются некогерентно.
B ряде случаев межатомные расстояния и кристаллическая структура металла-растворителя и частичек примеси таковы, что некоторые плоскости могут соединяться между собой, образуя непрерывную структуру. Тогда говорят, что частицы второй фазы выделяются когерентно и, поскольку сопряжение решёток никогда не бывает абсолютно точным, вокруг границы образуется сильно напряжённая область. В тех случаях, когда энергия деформации слишком велика для этого, соседние кристаллы могут контактировать таким образом, что при этом в пограничных слоях возникают области упругой деформации, а на самой границе раздела — дислокации. В таких случаях говорят, что частицы выделяются полукогерентно[12].
При повышении температуры вследствие увеличения амплитуды колебаний атомов может образоваться дефект кристаллической решётки, который называют вакансия или «дырка». Диффузия вакансий является одним из механизмов образования дислокаций[13].
Как правило, кристаллизация металла происходит путём переохлаждения с образованием дендритной структуры. По мере разрастания дендритные кристаллы соприкасаются, при этом образуются различные дефекты структуры. В большинстве случаев металл затвердевает так, что первая порция кристаллов содержит меньше примесей, чем последующие. Поэтому, как правило, примеси концентрируются на границах зёрен, образуя стабильные структуры[14].
Применение металлов
Конструкционные материалы
Металлы и их сплавы — одни из главных конструкционных материалов современной цивилизации. Это определяется, прежде всего, их высокой прочностью, однородностью и непроницаемостью для жидкостей и газов. Кроме того, меняя рецептуру сплавов, можно менять их свойства в очень широких пределах.
Электротехнические материалы
Металлы используются в качестве хороших проводников электричества (медь, алюминий), так и в качестве материалов с повышенным сопротивлением для резисторов и электронагревательных элементов (нихром и т. п.).
Инструментальные материалы
Металлы и их сплавы широко применяются для изготовления инструментов (их рабочей части). В основном, это инструментальные стали и твёрдые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика.
История развития представлений о металлах
Знакомство человека с металлами началось с золота, серебра и меди, то есть с металлов, встречающихся в свободном состоянии на земной поверхности; впоследствии к ним присоединились металлы, значительно распространенные в природе и легко выделяемые из их соединений: олово, свинец, железо и ртуть. Эти семь металлов были знакомы человечеству в глубокой древности. Среди древнеегипетских артефактов встречаются золотые и медные изделия, которые, по некоторым данным, относятся к эпохе, удаленной на 3000—4000 лет от н. э.
К семи известным металлам уже только в средние века прибавились цинк, висмут, сурьма и в начале XVIII столетия мышьяк. С середины XVIII века число открытых металлов быстро возрастает и к началу XX столетия доходит до 65, а к началу XXI века — до 96.
Ни одно из химических производств не способствовало столько развитию химических знаний, как процессы, связанные с получением и обработкой металлов; с историей их связаны важнейшие моменты истории химии. Свойства металлов так характерны, что уже в самую раннюю эпоху золото, серебро, медь, свинец, олово, железо и ртуть составляли одну естественную группу однородных веществ, и понятие о «металле» относится к древнейшим химическим понятиям. Однако воззрения на их натуру в более или менее определенной форме появляются только в средние века у алхимиков. Правда, идеи Аристотеля о природе: образования всего существующего из четырёх элементов (огня, земли, воды и воздуха) уже тем самым указывали на сложность металлов; но эти идеи были слишком туманны и абстрактны. У алхимиков понятие о сложности металлов и, как результат этого, вера в возможность превращать одни металлы в другие, создавать их искусственно, является основным понятием их миросозерцания.
Лишь Лавуазье выяснил роль воздуха при горении и показал, что прибыль в весе металлов при обжигании происходит от присоединения к металлам кислорода из воздуха, и таким образом установил, что акт горения металлов есть не распадение на элементы, а, напротив, акт соединения, вопрос о сложности металлов был решен отрицательно. Металлы были отнесены к простым химическим элементам, в силу основной идеи Лавуазье, что простые тела суть те, из которых не удалось выделить других тел. С созданием периодической системы химических элементов Менделеевым элементы металлов заняли в ней своё законное место.
См. также
Примечания
- ↑ Строго говоря из-за амфотерности химических свойств полуметаллы (металлоиды) представляют собой обособленную группу, не относясь ни к металлам, ни к неметаллам; К группе металлов их можно отнести лишь условно.
- ↑ Ranga P. Dias, Isaac F. Silvera. Observation of the Wigner-Huntington transition to metallic hydrogen (англ.) // Science. — 2017-01-26. — P. eaal1579. — ISSN 1095-9203 0036-8075, 1095-9203. — DOI:10.1126/science.aal1579.
- ↑ In, Geology. Scientists Have Finally Created Metallic Hydrogen, Geology IN. Проверено 28 января 2017.
- ↑ Металлы // Энциклопедический словарь юного физика. / Сост. В. А. Чуянов. — М.: Педагогика, 1984. — с. 165—167. — 352 с.
- ↑ Ломоносов М. В. Основы металлургии и горного дела. — Санкт-Петербург: Императорская Академия Наук, 1763. — 416 с.
- ↑ Этимологический словарь русского языка. Вып. 10: М / Под общей редакцией А. Ф. Журавлёва и Н. М. Шанского. — М.: Изд-во МГУ, 2007. — 400 с. ISBN 978-5-211-05375-5
- ↑ Юрий Кукшкин. Химия вокруг нас
- ↑ (англ.) Los Alamos National Laboratory – Sodium. Проверено 8 июня 2007. Архивировано 4 августа 2012 года.
- ↑ (англ.) Los Alamos National Laboratory – Aluminum. Проверено 8 июня 2007. Архивировано 4 августа 2012 года.
- ↑ Поваренных А. С. Твердость минералов. — АН УССР, 1963. — С. 197-208. — 304 с.
- ↑ Юм-Розери, 1965, с. 92.
- ↑ Юм-Розери, 1965, с. 93-94.
- ↑ Юм-Розери, 1965, с. 97.
- ↑ Юм-Розери, 1965, с. 103.
Литература
Ссылки
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, | |
wikipedia.green
