Хром. Степени окисления хрома
Степени окисления у хрома
Введение
Степень окисления (СО) – это условное обозначение в химии, служащее для того, чтобы определять заряд атома у какого-либо химического элемента (или группы элементов). Без степеней окисления не решается ни одна задача, не составляется ни одно уравнение, но самое главное – без них мы не можем чётко определить свойства элемента и то, какую роль он будет играть в различных соединениях.
Знаменательно, что периодическая система (ПС) Д.И. Менделеева сгруппирована гениальнейшим образом: все элементы разделены по периодам, группам, подгруппам, их порядковые номера также соответствуют определённым показателям. Благодаря этому нам не приходится заучивать качества каждого химического элемента (ХЭ) наизусть, потому что легко можно найти его в таблице и определить всё, что требуется. Однако даже в таком случае некоторые люди, забывая школьные знания по курсу химии (или пренебрегая ими когда-то), вынуждены вернуться к изучению данной темы подробнее.
Итак, для начала необходимо сформировать верные объективные представления о хроме (Cr), разобраться с его положением в ПС, а затем можно будет приступить к наиболее важной части – практике.
Хром – Cr, положение в таблице Менделеева, физические и химические свойства
Хром – это твёрдое вещество, металл, блестящий, серебристо-белого (или голубоватого) цвета. Он достаточно ломкий, но при этом имеет несравненный плюс по сравнению со многими другими металлами – устойчивость к заражению коррозией; именно поэтому он является важным компонентом при производстве нержавеющей стали, а также используется для нанесения на поверхность других металлов, более склонных к коррозии. Хром обладает плохой тепло- и электропроводностью.
ХЭ располагается в VI группе, 4 периоде, носит порядковый номер 24 и обладает атомной массой равной 52 г/моль. Благодаря пассивированию хром не взаимодействует с серной (H2SO4) и азотной (HNO3) кислотами, проявляет устойчивость в воздухе.
Это амфотерный металл
Теперь поговорим непосредственно о том, какие степени окисления бывают у данного ХЭ: он может приобретать СО +4, +6, а также +2 в безвоздушном пространстве, +3 – в пространстве с воздухом. Хром, как любой другой металл, является сильным восстановителем.
Вещества с различными степенями окисления
- +2. Когда Cr приобретает СО +2, вещество демонстрирует основные и очень сильные восстановительные свойства.
 К примеру, оксид хрома (II) – CrO, гидроксид хрома – Cr(OH)2, множество солей. Синтезируются соединения этого элемента с фтором(CrF2), хлором(CrCl2) и так далее.
К примеру, оксид хрома (II) – CrO, гидроксид хрома – Cr(OH)2, множество солей. Синтезируются соединения этого элемента с фтором(CrF2), хлором(CrCl2) и так далее. - +3. Эти вещества обладают амфотерными свойствами, могут быть разных цветов (но преимущественно зелёного
- +4. Такие соединения встречаются очень редко: они не образуют солей, кислот, с ними почти не производятся какие-либо работы. Но из известных веществ существуют оксид CrO2, тетрагалогенид CrF4, CrCl4.
- +6. Хром с СО +6, образуя соли, имеет кислотный характер, очень ядовитый, гидроскопичный, а также имеющий сильные окислительные свойства. Примеры: CrO3 (имеет вид кристаллов красного цвета), K
 Элемент способен образовывать два вида гидроксидов (уже перечислены).
Элемент способен образовывать два вида гидроксидов (уже перечислены).
Как определять СО в сложных веществах
С правилом «крест-накрест» вы наверняка уже знакомы. А что, если соединение имеет, например, целых три элемента?
В этом случае мы смотрим на последний элемент вещества, определяем его степень окисления и умножаем на коэффициент, находящийся справа (конечно, если он есть). Мысленно отделяем последний элемент (с уже определённой степенью окисления) от двух других элементов. Нам требуется, чтобы
Рассмотрим пример:
- PbCrO4 – хромат свинца (II), имеющий вид красной соли. На конце формулы находится кислород, степень окисления которого всегда (за исключением некоторых случаев) будет -2. -2*4=-8. Pb (свинец) имеет СО +2. Дальнейшие действия будут похожи на алгебраическое уравнение, но если честно, то когда человек уже неплохо разбирается в определении степеней окислений и умеет пользоваться таблицей растворимости, вполне возможно избежать таких расчётов.

Степени окисления в следующих формулах попробуйте расставить сами:
- Na2CrO4;
- BaCrO4;
- Fe(CrO2)2;
- Cr2O7;
- H2CrO4.
Хром – один из самых интересных химических элементов, соединения с которым – штука сложная, но необходимая для понимания
Редакция «Учисьучись.рф»
Хром | Химические свойства
Хром
Внешняя электронная конфигурация атома хрома 3d54s1. В соединениях обычно проявляет степени окисления +2, +3, +6, среди них наиболее устойчивы Сr3+; известны отдельные соединения, в которых хром имеет степени окисления +1, +4, +5. Хром химически малоактивен. При обычных условиях устойчив к кислороду и влаге, но соединяется с фтором, образуя CrF3. Выше 600 °С взаимодействует с парами воды, давая Сr2О3; азотом — Cr2N, CrN; углеродом — Сr23С6, Сr7С3, Сr3С2; серой — Cr2S3.
В соединениях обычно проявляет степени окисления +2, +3, +6, среди них наиболее устойчивы Сr3+; известны отдельные соединения, в которых хром имеет степени окисления +1, +4, +5. Хром химически малоактивен. При обычных условиях устойчив к кислороду и влаге, но соединяется с фтором, образуя CrF3. Выше 600 °С взаимодействует с парами воды, давая Сr2О3; азотом — Cr2N, CrN; углеродом — Сr23С6, Сr7С3, Сr3С2; серой — Cr2S3.
Пассивированный азотной кислотой хром, в отличие от металла без защитного слоя, не растворяется в разбавленных серной и соляной кислотах даже при длительном кипячении в растворах этих кислот, тем не менее, в определенный момент начинается быстрое растворение, сопровождающееся вспениванием от выделяющегося водорода – из пассивной формы хром переходит в активированную, не защищенную пленкой оксида:
Cr + 2HCl = CrCl2 + H2
Если в процессе растворения добавить азотной кислоты, то реакция сразу прекращается – хром снова пассивируется.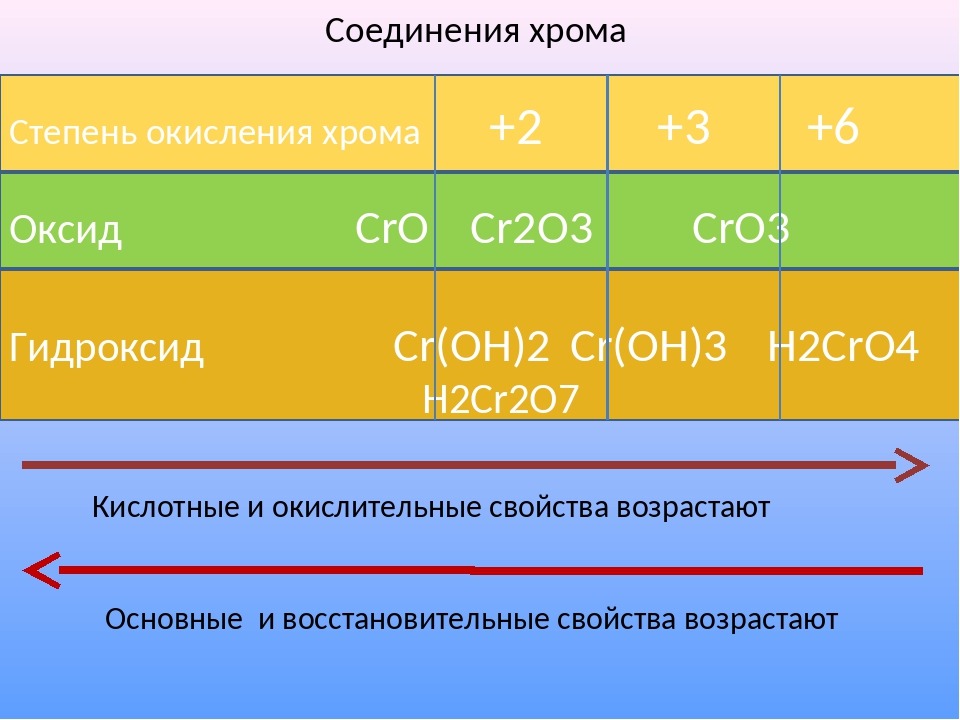
При нагревании металлический хром соединяется с галогенами, серой, кремнием, бором, углеродом и некоторыми другими элементами:
Cr + 2F2 = CrF4 (с примесью CrF5)
2Cr + 3Cl2 = 2CrCl3
2Cr + 3S = Cr2S3
При нагревании хрома с расплавленной содой на воздухе, нитратами или хлоратами щелочных металлов получаются соответствующие хроматы(VI):
2Cr + 2Na2CO3 + 3O2 = 2Na2CrO4 + 2CO2.
В зависимости от требуемой степени чистоты металла существует несколько промышленных способов получения хрома.
Возможность алюмотермического восстановления оксида хрома(III) была продемонстрирована еще Фридрихом Вёлером в 1859 однако в промышленном масштабе этот метод стал доступен, как только появилась возможность получения дешевого алюминия. Промышленное алюмотермическое получение хрома началось с работ Гольдшмидта, которому впервые удалось разработать надежный способ регулирования сильно экзотермического (а, следовательно, взрывоопасного) процесса восстановления:
Cr2O3 + 2Al = 2Cr + 2Al2O3.
В растворах наиболее устойчивы соединения хрома (III). В этой степени окисления хрому соответствуют как катионная форма, так и анионные формы, например, существующий в щелочной среде анион [Cr(OH)6]3-.
При окислении соединений хрома (III) в щелочной среде образуются соединения хрома (VI):
2Na3[Cr(OH)6] + 3H2O2 = 2Na2CrO4 + 2NaOH + 8H2O.
Хрому (VI) отвечает ряд существующих только в водных растворах кислот: хромовая h3CrO4, дихромовая H2Cr2O7, трихромовая H3Cr3O10 и другие, которые образуют соли — хроматы, дихроматы, трихроматы и т. д.
Соединения хрома (III) — сильные окислители, например:
K2Cr2O7 + 14НСl = 2CrCl3 + 2KCl + 3Cl2 + 7H2O.
Конспект открытого урока Хром и его соединения
Тема. Хром и его соединения
Хром и его соединения
Учитель химии МБОУ СОШ №2 г.Турана Донгак-оол Ч.К.
(Данный урок был дан мной на конкурсе школьного этапа
«Учитель года -2014»)
Урок «Хром и его соединения» – это третий урок по теме «Металлы побочных подгрупп», изучается в 11б классе (профильный уровень). Урок сопровождается презентацией. Данный урок очень насыщен теоретическим материалом и экспериментом.В соответствии с рабочей программой при изучении темы «Металлы побочных подгрупп» предполагается проведение 3 семинарских занятий.
Форма семинара способствует глубокому творческому осмыслению материала, воспитанию самостоятельности, формированию умений работать с научной литературой и навыков монологической речи, овладению методами и приемами исследовательской деятельности, закреплению полученных знаний на практике.
За несколько дней до проведения семинара учащиеся получают задание на семинарское занятие и список рекомендуемой литературы.
Элементы содержания: хром: особенности строения атома, физические и химические свойства, получение и применение. Оксиды и гидроксиды хрома, зависимость их от свойств, от степени окисления элемента. Важнейшие соли хрома. Комплексные соединения хрома.
Цели образования
Обучающая:актуализировать изакрепить знания учащихся по теме, отработать умения составлять уравнения реакций с участием соединений хрома, продолжить работу по развитию находить основные, узловые вопросы в материале, анализировать, обобщать, делать выводы, применение теоретических знаний для объяснения результатов проведенных опытов.
Развивающая: развивать
учебно-информационные навыки: умение извлекать информацию из устного сообщения, справочных таблиц, наблюдаемых процессов;
учебно-логические: умение анализировать данные, выявлять сущность наблюдаемых процессов, обобщать и делать выводы, формулировать определения понятий;
учебно-организационные: организовывать самостоятельную деятельность, совершенствовать навыки самооценки знаний и умений.
Воспитательная:привитие интереса к изучаемому предмету, к самоорганизации и культуре труда, формировать умение вести диалог, дискутировать, выслушивать друг друга,формировать понимание развития своего интеллекта как ценностной характеристики современной личности.
Тип урока:урок совершенствования знаний,умений и навыков
Вид урока: семинар-практикум
Наглядные пособия: таблицы “Периодическая система Д.И.Менделеева”, “Электрохимический ряд напряжений металлов”, “Растворимость соединений”, методическое пособие “Окислительно-восстановительные реакции”, учебники;
Оборудование к уроку:
Компьютер, мультимедийный проектор, экран,документ-камера
Презентация.
Оборудование и реактивы для демонстрационного эксперимента
На столах учащихся оборудование и реактивы для лабораторных опытов.
Распечатанные задания в формате ЕГЭ.
Инструкция для проведения лабораторных опытов.
Информационный лист
План семинара
Педагогическая технология: технология практико-ориентированного подхода в обучении
Методы:
проблемно — поисковый,
объяснительно-иллюстративный
дифференцированная и индивидуальная самостоятельная работа учащихся в группах,
работа с учебной и дополнительной литературой,
исследовательский
Форма организации учебной деятельности: дифференцированно — групповая.
Средства обучения: литература
учебная:1) Габриелян О.С. Химия. 11. – М.:Дрофа, 2010г.
2) Рудзитис Г.Е. Химия. 11 класс.- М., 2010г.
дополнительная: 1)Глинка Н.Л. Общая химия: Учебное пособие для вузов.- Л.,:Химия, 1984г.
2)Лидин Р.А. Справочник по общей и неорганической химии.- М,: Просвещение.
3)Хомченко В.М. Химия: учебник.-М.: Высшая школа, 1982г.
4)Третьяков Ю.Д. Химия: Справ. Материалы :Кн.дляучащихся.-М.:Просвещение.
Оборудование и реактивы: Реактивы: бихромат аммония (NH4)2Cr2O7, раствор хлорида хрома (III) CrCl3, раствор бихромата калия K2Cr2O7, раствор сульфита натрия Na2SO3, раствор нитрата бария Ba(NO3)2, разбавленный раствор соляной кислоты HCl, разбавленный раствор серной кислоты H2SO4, раствор гидроксида натрия NaOH (ω = 30%),раствор хромата калия K2CrO4, раствор нитрата серебра АgNO3.
Посуда и оборудование: фарфоровая чашка, шпатель, спиртовка, штатив для пробирок, пробирки, стеклянная палочка, колбы
Эпиграф урока: «Радость видеть и понимать есть самый великий дар природы» (А.Эйнштейн).
План урока:
Орг.момент
1.Вступительное слово учителя. Мотивация важности выбранной темы.
Мотивация важности выбранной темы.
2.Семинарское занятие.
3. Первичная проверка степени усвоения материала.
3.Закрепление: решение тестовых заданий из работ ЕГЭ по данной теме.
4.Рефлексия.
5.Задание на дом.
Ход занятия.
Организационный момент.
Приветствие, отметка в журнале отсутствующих, ознакомление с темой и планом работы на данном занятии.
1.Вступительное слово учителя. Мотивация важности выбранной темы.
Мы продолжаем изучать свойства d-элементов. Какие d-элементы (переходные) мы изучили? (правильно, это элемент I-ой группы – медь.Сегодня мы посвящаем урокd-элементу VI-ой группы — хрому. Что же характерно для всех этих переходных элементов? (Правильно, образование комплексных соединений, часто сами вещества и их растворы бывают окрашены, а также что все d-элементы- металлыd-элементы и их соединения обладают рядом характерных свойств: переменные состояния окисления; способность к образованию комплексных ионов; образование окрашенных соединений). Вспомним электронные конфигурации d-элементов. Какой или какие слои заполняются электронными (правильно, предвнеший d-слой и внешний s-слой). Напоминаю, что именно из-за наличия d-оболочки свойства этих элементов отличаются от свойств элементов основных групп. Поэтому их выделили в так называемые побочные подгруппы.
Вспомним электронные конфигурации d-элементов. Какой или какие слои заполняются электронными (правильно, предвнеший d-слой и внешний s-слой). Напоминаю, что именно из-за наличия d-оболочки свойства этих элементов отличаются от свойств элементов основных групп. Поэтому их выделили в так называемые побочные подгруппы.
2.Семинар-практикум
План семинарского занятия:
Положение хрома в ПСХЭ
Получение и свойства Cr0
Получение и свойства оксида и гидроксида Cr+2
Получение и свойства оксида и гидроксида Cr+3
Получение и свойства оксида, гидроксида и солей Cr+6(Лабораторная работа)
Нахождение в природе, биологическая роль и применение.
(По ходу объяснения материала учащиеся ведут записи в своих тетрадях, т.е. составляют конспект лекций – подготовка к традиционному вузовскому обучению.Кроме этого, постоянно идет диалог учитель-ученик для лучшего понимания и усвоения материала).
Для этого ученики разделены на три рабочие группы: “Теоретики”, “Экспериментаторы” и “Промышленники” (каждый ученик заранее подготовил себе персональный пейджик с названием своей группы и своим именем с целью формирования у учащихся чувства ответственности за порученное дело и полученный результат, уважения к себе и своим сверстникам, а также для поднятия уровня собственной самооценки).
Каждая группа получила задание, в ходе выполнения которого шла активная проработка нового и закрепление пройденного ранее материала, поиск нестандартных решений, формируются чувства коллективизма, навыки самостоятельной работы.
Задание для теоретиков. Теоретическая часть семинара
Задание для экспериментаторов. Практическая часть семинара
Задание для промышленников. Познавательная часть семинара
Характеристика хрома и его соединений(выступление теоретиков)
Хром расположен в побочной подгруппе VI группы таблицы Д. И.Менделеева. При составлении электронной формулы хрома необходимо вспомнить, что в связи с большей устойчивостью конфигурации 3d5 у атома хрома наблюдается проскок электрона и электронная формула имеет вид: 1s22s2p63s2p64s13d5. В соединениях хром может проявлять степени окисления +2, +3 и +6 (степень окисления +3 является наиболее устойчивой):
И.Менделеева. При составлении электронной формулы хрома необходимо вспомнить, что в связи с большей устойчивостью конфигурации 3d5 у атома хрома наблюдается проскок электрона и электронная формула имеет вид: 1s22s2p63s2p64s13d5. В соединениях хром может проявлять степени окисления +2, +3 и +6 (степень окисления +3 является наиболее устойчивой):
Хром получил свое название от греческого слова chroma (цвет, краска) из-за яркой разнообразной окраски его соединений.
Хром – белый блестящий металл, очень твердый, хрупкий, тугоплавкий. Устойчив к коррозии. На воздухе покрывается оксидной пленкой, из-за чего поверхность становится матовой.
Хром — твердый, голубовато-белый металл.ρ = 7,2г/см3, tплавл= 18570С
СО: +2,+3,+6
Химические свойства.
Взаимодействие с простыми веществами.
При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 6000C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором.
4Cr + 3O2 2Cr2O3
2Cr + 3Cl2 2CrCl3
2Cr + N2 2CrN
2Cr + 3S Cr2S3
Взаимодействие со сложными веществами.
В раскалённом состоянии реагирует с парами воды:2Cr + 3H2O Cr2O3 + 3H2
2. Хром растворяется в разбавленных сильных кислотах (HCl, H2SO4). В отсутствии воздуха образуются соли Cr2+, а на воздухе – соли Cr3+.
Cr + 2HCl → CrCl2 + H2
2Cr + 6HCl + O2 → 2CrCl3 + 2H2O + H2
3. Наличие защитной окисной плёнки на поверхности металла объясняет его пассивность по отношению к холодным концентрированным кислотам – окислителям. Однако при сильном нагревании эти кислоты растворяют хром:2 Сr + 6 Н2SО4(конц) Сr2(SО4)3 + 3 SО2↑ + 6 Н2О
Однако при сильном нагревании эти кислоты растворяют хром:2 Сr + 6 Н2SО4(конц) Сr2(SО4)3 + 3 SО2↑ + 6 Н2О
Сr + 6 НNО3(конц) Сr(NО3)3 + 3 NO2↑ + 3 Н2О
Получение.
1) электролизом водных растворов или расплавов его солей:
2.Алюминотермия: Cr2O3 + 2Al Al2O3 + 2Cr
3.Восстановлением оксидов хрома оксидом углерода (II), водородом: CrO + Н2 Cr + H2O
Соединения хрома
Соединения двухвалентного хрома
Оксид хрома (II) CrO
Физические свойства: твердое нерастворимое в воде вещество ярко-красного или коричнево- красного цвета.
Химические свойства. CrO – основной оксид, восстановитель
1.Взаимодействует с кислотами: CrO + 2HCl → CrCl2 + 2H2O
2.Легко окисляется на воздухе при нагревании до оксида хрома (III): 4CrO + O2 2 Cr2O3
3. Восстанавливается водородом до хрома: CrO + Н2 Cr + H2O
Восстанавливается водородом до хрома: CrO + Н2 Cr + H2O
Получение.
1. При окислении амальгамы хрома на воздухе: 2Cr + O2 2 CrO
2.При прокаливании Сr(ОН)2 в отсутствие кислорода: Сr(ОН)2 CrO + H2O
3. Cr2O3 + 3Н2 2Cr + 3H2O
Гидроксид хрома (II) Сr(ОН)2
Физические свойства: твердое нерастворимое в воде вещество желтого цвета.
Химические свойства. Сr(ОН)2 – слабое основание.
1.Взаимодействует с кислотами: Cr(OH)2 + 2HCl → CrCl2 + 2H2O
2.Легко окисляется в присутствии влаги кислородом воздуха в Сr(ОН)3:
4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
3. При прокаливании разлагается:
а) без доступа воздуха: Сr(ОН)2 CrO + H2O
б) в присутствии кислорода: 4Сr(ОН)2 2 Cr2O3 + 4H2O
Получение.
1.Действием щелочи на растворы солей Cr(II): СrСl2 + 2 NaОН = Сr(ОН)2↓ + 2 NaСl.
Соединения трёхвалентного хрома
Оксид хрома (III) Cr2O3
Физические свойства: темно-зеленое тугоплавкое вещество, нерастворимое в воде.
Химические свойства. Cr2O3 — амфотерный оксид.
1.Взаимодействует с кислотами, как основной оксид: Cr2O3 + 6HCl 2 CrCl3 + 3H2O
2.Взаимодействует со щелочами, как кислотный оксид: Cr2O3 + 2NaOH 2NaCrO2 + H2O
Хромит натрия
3.При высокой температуре восстанавливается водородом, кальцием, углеродом до хрома:
Cr2O3 + 3Н2 2Cr + 3H2O
Получение. 1.При окислении хрома: 4Cr + 3O2 2Cr2O3
2.При разложении гидроксида хрома (III): 2Сr(ОН)3 Cr2O3 + 3H2O
3. Разложение дихромата аммония (дем.опыт):
Разложение дихромата аммония (дем.опыт):
(NH4)2Cr2O7 Cr2O3 + N2+ 4H2O
Гидроксид хрома (III) Cr(OH)3
Физические свойства: нерастворимое в воде вещество зелёного цвета.
Химические свойства. Сr(ОН)3 – амфотерный гидроксид(дем.опыт)
1.Взаимодействует с кислотами, как нерастворимое основание:
2Cr(OH)3 + 3H2SO4 →Cr2(SO4)3 + 6H2O
2.Взаимодействует со щелочами, как нерастворимая кислота:
Cr(OH)3 + KOH → KCrO2+ 2H2O
(хромит калия)
3.При нагревании легко разлагается: 2Сr(ОН)3 Cr2O3 + 3H2O
Получение.
1.При действии щелочей на соли Сr3+ выпадает студнеобразный осадок гидроксида хрома (III) зеленого цвета(дем. опыт):
опыт):
Сr2(SО4)3 + 6NaОН → 2 Сr(ОН)3↓ + 3 Na2SО4,
Соединения шестивалентного хрома
Оксид хрома (VI) CrO3
Физические свойства: твердое вещество темно-красного цвета, хорошо растворимое в воде. Ядовит!
Химические свойства. CrO3 – кислотный оксид.
1.Взаимодействует со щелочами, образуя соли желтого цвета-хроматы:
CrO3 + 2KOH → K2CrO4 + H2O
2.Взаимодействует с водой, образуя кислоты: CrO3 + H2O → H2CrO4 хромовая кислота
2 CrO3 + H2O → H2Cr2O7 дихромовая кислота
3.Термически неустойчив: 4 CrO3 → 2Cr2O3 + 3O2 ↑
Получение.
1.Получают из хромата (или дихромата) калия действием H2SO4(конц. ).
).
K2CrO4 + H2SO4 → CrO3 + K2SO4 + H2O
K2Cr2O7 + H2SO4 → 2CrO3 + K2SO4 + H2O
Гидроксиды хрома (VI) H2CrO4 — хромовая кислота, H2Cr2O7 — дихромовая кислота
Обе кислоты неустойчивы, при попытке их выделения в чистом виде распадаются на воду и оксид хрома (VI). Однако соли их вполне устойчивы. Соли хромовой кислоты называют хроматами, они окрашены в желтый цвет, а соли дихромовой кислоты – дихроматами, они окрашены в оранжевый цвет.
Хромат и дихромат-ионы способны к взаимопревращению в зависимости от кислотности среды(дем.опыт)В кислой среде хроматы переходят в дихроматы, раствор приобретает оранжевую окраску; в щелочной среде дихроматы переходят в хроматы, раствор становится желтым:2K2CrO4 + H2SO4 ) K2Cr2O7 + K2SO4 + H2O,
K2Cr2O7 + 2KOH 2K2CrO4 + H2O.
Ион устойчив в щелочной среде, а – в кислой.
Окислительные свойства соединений хрома (VI)(дем. опыт)
K2Cr2+6O7 + 7H2SO4 (разб) + 6KI-1 = Cr2+3(SO4)3 + 4K2SO4 + 3I20 + 7H2O
Cr+6 + 3e → Cr+3 (восстановление – окислитель)
2I-1— 2e → I20 (окисление – восстановитель)
Выполнение лабораторной работы. Качественная реакция на хромат и дихромат ион (по инструктивной карточке.Ознакомить с основными правилами техники безопасности.)
Качественная реакция на хромат и дихромат ионы.
Налейте в пробирку немного раствора хромата калия и прилейте раствор нитрата бария. Отметьте цвет образовавшегося осадка. Запишите уравнение реакции получения хромата бария BaCrO4 в молекулярной и ионной форме,. Налейте в пробирку немного раствора дихромата калия и прилейте раствор нитрата серебра (I) Отметьте цвет образовавшего осадка. Запишите уравнение реакции в молекулярной и ионной форме.
Налейте в пробирку немного раствора дихромата калия и прилейте раствор нитрата серебра (I) Отметьте цвет образовавшего осадка. Запишите уравнение реакции в молекулярной и ионной форме.
Выступление промышленников (презентация), на каждой парте выданы информационные листы:
История открытия.
В 1797 г. французский химик Л. Вокелен впервые исследовал красноватый, тяжелый минерал крокоизит, из которого открыл соединение нового элемента. Выделить этот элемент в чистом виде он не смог. Пораженный разнообразием окрасок, образуемых разными соединениями вновь открытого элемента, Вокелен назвал его хромом (от греческого слова «хрома» — цвет, краска). В сравнительно чистом виде новый элемент был выделен в 1799 г. Ф. Тассером. Он представлял собой серо-стальной металл с серебристыми блестками в изломе, тугоплавкий.
Биологическая роль.
Хром обнаруживается в растительных и животных организмах. В организме взрослого человека содержится примерно 6 г Сr (0,1%).
В организме взрослого человека содержится примерно 6 г Сr (0,1%).
Металлический хром нетоксичен, а соединения Сr(III) и Сr(VI) опасны для здоровья. Они вызывают раздражение кожи, что приводит к дерматитам.
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В конце 1950-х гг. два исследователя, Шварц и Мерц, сообщили, что у крыс, которые были на рационе, дефицитном по хрому, развивалась непереносимость сахара; при добавлении же хрома в рацион их состояние нормализовалось. Это было первым подтверждением, что хром необходим животным для нормальной жизни. С тех пор исследователи поняли, что хром играет такую же роль и для здоровья человека.
Применение металлического хрома.
В виде феррохрома сплавляют с железом и получают высококачественные твердые при высокой температуре стали, металлорежущие инструменты.
При добавлении к железу хрома (около 12%) получают нержавеющую сталь.
Покрывают (хромируют) различные стальные изделия для предотвращения коррозии.
III. Закрепление: решение тестовых заданий из работ ЕГЭ по данной теме
В качестве закрепления учащиеся получают распечатанные задания в формате ЕГЭ.
В конце работы учитель обращает внимание учеников на тестовую работу, демонстрирует на экране правильные ответы,взаимопроверка (ответы через документ- камеру)
IV. Стадия рефлексии.
(Учитель вместе с учениками подводят итог проделанной работы и делают вывод.)
Ответы на ключевые вопросы семинара.
1. Как изменяются кислотно-основные свойства соединений хрома?(С увеличением степени окисления хрома усиливается кислотный характер его соединений. )
)
2. Как изменяются окислительно-восстановительные свойства соединений хрома?(С увеличением степени окисления хрома усиливаются окислительные свойства соединений хрома.)
3. Как изменяется окраска растворов соединений хрома с повышением степени окисления (синий- зелёный-красный-оранжевый-жёлтый)
4.С какими ранее изученными элементами сходны свойства хрома и его соединений (с Fe+2,Fe+3, Аl+3, S+6)
В тетрадях записывают краткий вывод: Для 3d-элементов, характеризующихся большим разнообразием степеней окисления по мере возрастания степени окисления усиливается кислотный характер оксидов и гидроксидов, а также их окислительная способность, и наоборот.
( Учитель предлагает учащимся оценить свою работу, ответы товарищей.)
Итак, как вы считаете, смогли ли мы решить в ходе урока поставленную цель?
Что вы узнали, чему научились?
Учитель оценивает работу учащихся на уроке и благодарит их за работу.
V. Домашнее задание
Закончить урок разрешите словами Гёте «Просто знать ещё не всё, знания нужно уметь использовать »
Литература:
О.С.Габриелян. Химия. 11 класс. Профильный уровень. Учебник для общеобразовательных учебных заведений, М., Дрофа, 2010
И.И.Новошинский, Н.С.Новошинская. Химия. 10 класс. Учебник для общеобразовательных учреждений, М., «ОНИКС 21 век»; «Мир и Образование», 2004
О.С.Габриелян, Г.Г.Лысова, А.Г.Введенская. Настольная книга учителя химии. 11 класс. М., Дрофа. 2004
К.К.Курмашева. Химия в таблицах и схемах. М., «Лист Нью». 2003
Н.Б.Ковалевская. Химия в таблицах и схемах. М., «Издат-школа 2000». 1998
Дж. Кемпбел, «Современная общая химия». М.: «Мир», 1975, том 2
Справочник химика / Под ред. Никольского Б.П. / М.: «Химия», 1965, том III
https://him.1september.ru/2003/05/14. htm – работа в среде табличного редактора MicrosoftExcel
htm – работа в среде табличного редактора MicrosoftExcel
Проверочная работа в формате ЕГЭ
Хром и его соединения
Часть А(вариант1)
1.Катион хрома Cr3+ образуется при диссоциации
1)Cr2O3 2)CrCl2 3)Cr(OH)2 4)Cr(NO3)3
2.Продуктом, образующимся при нагревании дихромата аммония, является
1)CrO3 2)N2 3)NH3 4)CrN
3.Соединения состава Na2ЭО4 образует каждый из двух элементов:
1)хром и фосфор 2)сера и хром 3)азот и селен 4)сера и хлор
4.С основаниями не реагирует
1)Cl2O5 2)SiO2 3)SO3 4)CrO
5.Оксид хрома (VI)взаимодействует с каждым из двух веществ:
1)оксидом кремния и углекислым газом
2)водой и углекислым газом
3)водой и гидроксидом натрия
4)кислородом и водородом
Часть В
1. Установите соответствие между формулой вещества и степенью окисления хрома.
Установите соответствие между формулой вещества и степенью окисления хрома.
Формула веществСтепень окисления
А)NaCrO2 1)+7
Б)H2Cr2O7 2)+6
В)BaCrO4 3)+4
Г)CrSO4 4)+3
5)+2
2.Установите соответствие между исходными веществами и основным продуктом их взаимодействия.
Формулы веществ Продукт взаимодействия
А)Cr+Cl2 1)CrCl2
Б)Cr+HCl 2)CrCl3
В)CrO3+HCl 3)CrCl4
Г)K2Cr2O7+HCl 4)CrCl6
Часть С
1.Используя метод электронного баланса, составьте уравнение реакции
K2Cr2O7+K2SO3+H2SO4=Cr2(SO4)3+…+…
Определите окислитель и восстановитель.
Оценка: 10-12- «5»7-9-«4»4– 6-«3» менее 4- «2»
Проверочная работа в формате ЕГЭ
Хром и его соединения
Часть А(вариант2)
1. Наиболее низкую степень окисления хром проявляет в соединении
Наиболее низкую степень окисления хром проявляет в соединении
1)K2Cr2O7 2)Na[Cr(H2O)F4] 3)Cr2O3 4)Cr(OH)2
2.В атоме хрома число свободных 3d-орбиталей равно
1)1 2)2 3)3 4)0
3. С гидроксидом хрома (II) не взаимодействует
1) соляная кислота 2) кислород 3)гидроксид калия 4) серная кислота
4.Верны ли следующие суждения о хроме и его соединениях?
А. Степень окисления хрома в высшем оксиде равна +3.
Б. Хроматы и дихроматы – сильные окислители
1)верно только А 2)верно только Б 3)верны оба суждения 4)оба суждения неверны
5.При взаимодействии свежеприготовленного осадка гидроксида хрома(III) с избытком раствора щелочи образуется:
1)средняя соль 2)основная соль 3)двойная соль 4)комплексная соль
Часть В
1.Установите соответствие между схемой изменения степени окисления элемента и уравнениям реакции, в которой это изменение происходит.
Изменение степени Уравнение реакции
окисления
А)Cr+3-Cr0 1)2Cr+6H2SO4(конц)=Cr2(SO4)3+3SO2+6H2O
Б)Cr+6-Cr0 2)2CrO3+3H2S(р—р)=2Cr(OH)3+3S
В)Cr0-Cr+3 3)K2Cr2O7+4Al=2Cr+Al2O3+2KAlO2
Г)Cr+6-Cr+3 4)Cr2O3+3Ca=2Cr+3CaO
5)2K2CrO4+2HCl=K2Cr2O7+2KCl+H2O
2.Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции.
Формулы веществ Признак реакции
А)Cr(OH)3+HCl 1)образование осадка
Б)Сr(OH)3+NaOH 2)растворение осадка
В)K2Cr2O7+KOH 3)изменение окраски раствора
Г)K2CrO4+H2SO4 4)изменение окраски осадка
5)видимых признаков реакции нет
Часть С
1. Используя метод электронного баланса, составьте уравнение реакции
Используя метод электронного баланса, составьте уравнение реакции
K2Cr2O7+K2SO3+H2SO4=Cr2(SO4)3+…+…
Определите окислитель и восстановитель.
Оценка: 10-12- «5» 7-9 -«4» 4– 6 -«3» менее 4- «2»
Ответы
Задание | Вариант1 | Вариант2 |
А1 | 4 | 4 |
А2 | 2 | 4 |
А3 | 2 | 3 |
А4 | 4 | 2 |
А5 | 3 | 4 |
В1 | 3225 | 4312 |
В2 | 2122 | 2233 |
С1K2Cr2O7+3K2SO3+4H2SO4=Cr2(SO4)3+4K2SO4+4H2О
Сера в степени окисления +4 является восстановителем, а хром +6 –окислителем
S – 2e- S+66 3
Cr+6+6e-Cr+3 2 1
Информационный лист.
Хром.
Химический элемент побочной подгруппы VI группы периодической системы Менделеева
Атомный номер 24,
Атомная масса 51,996;
Металл голубовато-стального цвета.
История открытия.
В 1797 г. французский химик Л. Вокелен впервые исследовал красноватый, тяжелый минерал крокоизит, из которого открыл соединение нового элемента. Выделить этот элемент в чистом виде он не смог. Пораженный разнообразием окрасок, образуемых разными соединениями вновь открытого элемента, Вокелен назвал его хромом (от греческого слова «хрома» — цвет, краска). В сравнительно чистом виде новый элемент был выделен в 1799 г. Ф. Тассером. Он представлял собой серо-стальной металл с серебристыми блестками в изломе, тугоплавкий.
Биологическая роль.
Хром обнаруживается в растительных и животных организмах. В организме взрослого человека содержится примерно 6 г Сr (0,1%).
В организме взрослого человека содержится примерно 6 г Сr (0,1%).
Металлический хром нетоксичен, а соединения Сr(III) и Сr(VI) опасны для здоровья. Они вызывают раздражение кожи, что приводит к дерматитам.
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В конце 1950-х гг. два исследователя, Шварц и Мерц, сообщили, что у крыс, которые были на рационе, дефицитном по хрому, развивалась непереносимость сахара; при добавлении же хрома в рацион их состояние нормализовалось. Это было первым подтверждением, что хром необходим животным для нормальной жизни. С тех пор исследователи поняли, что хром играет такую же роль и для здоровья человека.
Применение металлического хрома.
В виде феррохрома сплавляют с железом и получают высококачественные твердые при высокой температуре стали, металлорежущие инструменты.
При добавлении к железу хрома (около 12%) получают нержавеющую сталь.
Покрывают (хромируют) различные стальные изделия для предотвращения коррозии.
Семинар № 3
Тема. Хром. Соединения хрома.
Цель:
Вопросы для подготовки
Положение атома хрома в периодической системе элементов Д.И. Менделеева. Строение атома, возможные степени окисления.
Многообразие соединений хрома. Сравнительная характеристика кислотно-основных и окислительно-восстановительных свойств соединений хрома (II), (III), и (VI).
Задания для самостоятельной работы
Назовите особые свойства солей хрома(III), хроматов и дихроматов.
Комплексные соединения хрома
Аналогию с соединениями каких элементов можно провести при изучении соединений хрома.
Используя справочную и учебную литературу, укажите окраску растворов, содержащих соединения Cr+2,Cr+3,Cr+6
Запишите уравнения реакций, при помощи которых можно осуществить следующие превращения, укажите условия их протекания:
Cr CrCl3 CrCl2 Cr(OH)2Cr(OH)3 K2CrO4K2Cr2O7.
Темы рефератов
Природные соединения хрома. Применение хрома и его соединений.
Биологическая роль хрома.
Ключевые вопросы занятия
1. Как изменяются кислотно-основные свойства соединений хрома?
2. Как изменяются окислительно-восстановительные свойства соединений хрома?
Как изменяются окислительно-восстановительные свойства соединений хрома?
3. Как изменяется окраска растворов соединений хрома с повышением степени окисления?
4.С какими ранее изученными элементами сходны свойства хрома и его соединений?
Рекомендуемая литература
Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. Современный курс для поступающих в вузы. – М.: Экзамен, 2004. – С. 414–415.
Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия. Для школьников старших классов и поступающих в вузы. – М.: ОНИКС 21 век: Мир и образование, 2002. – С. 257–259.
Габриелян О.С., Остроумов И.Г., Соловьев С.Н., Маскаев Ф.Н. Общая химия: Учебник для 11 класса общеобразовательных учреждений с углубленным изучением химии. – М.: Просвещение, 2005. – С. 362–365.
Фриман М. Химия в действии. Т.2. – М.: Мир, 1991. – С. 145–147.
Энциклопедия для детей. Т. 17. Химия / Под ред. В.А. Володина. – М.: Аванта+, 2000. – С. 264–269.
Т. 17. Химия / Под ред. В.А. Володина. – М.: Аванта+, 2000. – С. 264–269.
Популярная библиотека химических элементов. Кн. 1. – М.: Наука, 1983. – С. 317–326.
Практикум
Тема. Хром и его соединения.
Цель:
Реактивы: бихромат аммония (NH4)2Cr2O7, раствор хлорида хрома (III) CrCl3, раствор бихромата калия K2Cr2O7, раствор сульфита натрия Na2SO3, раствор нитрата бария Ba(NO3)2, разбавленный раствор соляной кислоты HCl, разбавленный раствор серной кислоты H2SO4, раствор гидроксида натрия NaOH (ω = 30%), раствор хромата калияK2CrO4, раствор нитрата серебра АgNO3
Посуда и оборудование: фарфоровая чашка, шпатель, спиртовка, штатив для пробирок, пробирки, стеклянная палочка, колбы
Ход работы
Опыт 1. Получение оксида хрома (III)
Получение оксида хрома (III)
В фарфоровую чашку насыпьте горкой немного бихромата аммония, чашку поставьте на лист бумаги. Раскалите в пламени спиртовки стеклянную палочку и осторожно поместите ее в смесь. Наблюдайте реакцию разложения бихромата аммония с образованием оксида хрома (III), молекулярного азота и воды. Отметьте цвет образовавшегося оксида. Запишите уравнение реакции, укажите окислитель и восстановитель.
Опыт 2. Гидроксид хрома (III), получение и свойства
В пробирку поместите несколько капель раствора хлорида хрома (III) и прибавьте по каплям раствор гидроксида натрия до выпадения осадка. Отметьте цвет осадка. Полученный осадок разделите на две части. К первой прилейте по каплям раствор соляной кислоты, ко второй – раствор гидроксида натрия. Запишите наблюдаемые явления.
Запишите уравнения получения гидроксида хрома (III), объясните, почему необходимо приливать раствор гидроксида натрия к хлориду хрома (III), а не наоборот.
Приведите уравнения растворения гидроксида хрома (III) в кислоте и в щелочи, сделайте вывод о кислотно-основных свойствах гидроксида хрома (III).
Опыт 3. Свойства солей хромовых кислот
Смещение химического равновесия между хромат- и дихромат-ионами
Налейте в пробирку несколько капель раствора дихромата калия и добавьте по каплям раствор гидроксида натрия до появления желтой окраски хромат-иона.
К полученному раствору добавьте по каплям разбавленную серную кислоту, отметьте изменение окраски раствора.
Рассмотрите смещение равновесия 2CrO42- + 2H+ Cr2O72- + H2O при добавлении щелочи и кислоты.
Окислительные свойства соединений хрома (VI)
Поместите в пробирку несколько капель раствора бихромата калия. Добавьте к нему каплю серной кислоты и немного раствора сульфита натрия. Отметьте цвет раствора. Запишите уравнения реакции, учитывая, что хром восстанавливается до трехвалентного состояния с образованием сульфата хрома (III) Cr2(SO4)3, а сульфит-ион окисляется до сульфат-иона, с образованием сульфата натрия Na2SO4. Уравняйте окислительно-восстановительную реакцию методом электронного баланса, укажите окислитель и восстановитель.
Добавьте к нему каплю серной кислоты и немного раствора сульфита натрия. Отметьте цвет раствора. Запишите уравнения реакции, учитывая, что хром восстанавливается до трехвалентного состояния с образованием сульфата хрома (III) Cr2(SO4)3, а сульфит-ион окисляется до сульфат-иона, с образованием сульфата натрия Na2SO4. Уравняйте окислительно-восстановительную реакцию методом электронного баланса, укажите окислитель и восстановитель.
Лабораторная работа
Качественная реакция на хромат и дихромат ионы.
Налейте в пробирку немного раствора хромата калия и прилейте раствор нитрата бария. Отметьте цвет образовавшегося осадка. Запишите уравнение реакции получения хромата бария BaCrO4 в молекулярной и ионной форме,.Налейте в пробирку немного раствора дихромата калия и прилейте раствор нитрата серебра (I) Отметьте цвет образовавшего осадка. Запишите уравнение реакции в молекулярной и ионной форме.
Рекомендуемая литература
Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. Современный курс для поступающих в вузы. – М.: Экзамен, 2004. – С. 413–414.
Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия. Для школьников старших классов и поступающих в вузы. – М.: ОНИКС 21 век: Мир и образование, 2002. – С. 254–256.
Габриелян О.С., Остроумов И.Г., Соловьев С.Н., Маскаев Ф.Н. Общая химия: Учебник для 11 класса общеобразовательных учреждений с углубленным изучением химии. – М.: Просвещение, 2005. – С. 360–362.
Семинар № 4
Тема. Марганец. Соединения марганца.
Цель:
Вопросы для подготовки
Физические и химические свойства, получение металлического марганца.
Многообразие соединений марганца. Сравнительная характеристика кислотно-основных и окислительно-восстановительных свойств соединений марганца (II), (IV), (VI) и (VII).
Сравнительная характеристика кислотно-основных и окислительно-восстановительных свойств соединений марганца (II), (IV), (VI) и (VII).
Задания для самостоятельной работы
Используя справочную литературу, приведите наиболее распространенные минералы марганца. Укажите, в какой степени окисления он чаще всего встречается в природе.
Объясните, как изменяются кислотно-основные свойства соединений марганца при повышении степени окисления этого элемента. Приведите примеры соединений марганца, обладающих основными и кислотными свойствами.
Укажите, в какой среде сильнее выражены окислительные свойства перманганата калия. Запишите уравнения взаимодействия KMnO4 с сульфитом калия в кислой (H2SO4), нейтральной (H2O) и щелочной (KOH) средах.
Запишите реакцию термического разложения перманганата калия.
Приведите уравнения реакций, при помощи которых можно осуществить следующие превращения, укажите условия проведения реакций:
Mn MnSO4Mn(OH)2MnO2
K2MnO4 KMnO4 MnO2Mn.
Темы рефератов
Получение перманганата калия.
Природные соединения марганца.
Рекомендуемая литература
Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. Современный курс для поступающих в вузы. – М.: Экзамен, 2004. – С. 414–415.
Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия. Для школьников старших классов и поступающих в вузы. – М.: ОНИКС 21 век: Мир и образование, 2002. – С. 257–259.
Габриелян О.С., Остроумов И.Г., Соловьев С.Н., Маскаев Ф.Н. Общая химия: Учебник для 11 класса общеобразовательных учреждений с углубленным изучением химии. – М.: Просвещение, 2005. – С. 362–365.
– М.: Просвещение, 2005. – С. 362–365.
Фриман М. Химия в действии. Т.2. – М.: Мир, 1991. – С. 145–147.
Энциклопедия для детей. Т. 17. Химия / Под ред. В.А. Володина. – М.: Аванта+, 2000. – С. 264–269.
Популярная библиотека химических элементов. Кн. 1. – М.: Наука, 1983. – С. 317–326.
Степень окисления хрома одинакова в соединениях. Хром — общая характеристика элемента, химические свойства хрома и его соединений. Примеры решения задач
В 1766 году профессор химии и заведующий Химической лабораторией Петербургской АН И.Г. Леман описал новый минерал, найденный на Урале на Березовском руднике, который получил название «сибирский красный свинец», PbCrO 4 . Современное название — крокоит. В 1797 французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл.
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
Нахождение в природе и получение:
Наиболее распространённым минералом хрома является хромистый железняк FeCr 2 O 4 (хромит), богатые месторождения которого имеются на Урале и в Казахстане, вторым по значимости минералом является крокоит PbCrO 4 . Массовая доля хрома в земной коре составляет 0,03%. Природный хром состоит из смеси пяти изотопов c массовыми числами 50, 52, 53, 54 и 56; искусственно получены и другие, радиоактивные, изотопы.
Основные количества хрома получают и используют в виде сплава с железом, феррохрома, восстанавливая хромит коксом:
FeCr 2 O 4 + 4C = Fe + 2Cr + 4CO
Чистый хром получают, восстанавливая алюминием его оксид:
Cr 2 O 3 + 2Al = 2Cr + Al 2 O 3
или электролизом водных растворов соединений хрома.
Физические свойства:
Хром — серовато-белый блестящий металл, по внешнему виду похож на сталь, один из самых твердых металлов, r = 7,19г/см 3 , Tпл=2130K, Tкип=2945K. Хром обладает всеми характерными для металлов свойствами — хорошо проводит тепло, электрический ток, имеет присущий большинству металлов блеск.
Химические свойства:
Хром устойчив на воздухе за счёт пассивирования — образования защитной оксидной пленки. По этой же причине не реагирует с концентрированной серной и азотной кислотами. При 2000°C сгорает с образованием зелёного оксида хрома(III) Cr 2 O 3 .
При нагревании реагирует со многими неметаллами, часто образуя соединения нестехиометрического состава карбиды, бориды, силициды, нитриды и др.
Хром образует многочисленные соединения в различных степенях окисления, в основном +2, +3, +6.
Важнейшие соединения:
Степень окисления +2 — основный оксид CrO (чёрный), гидроксид Cr(OH) 2 (желтый). Соли хрома(II) (растворы голубого цвета) получаются при восстановлении солей хрома(III) цинком в кислой среде. Очень сильные восстановители, медленно окисляются водой с выделением водорода.
Степень окисления +3 — наиболее устойчивая степень окисления хрома, ей соответствуют: амфотерный оксид Cr 2 O 3 и гидроксид Cr(OH) 3 (оба — серо-зелёного цвета), соли хрома(III) — серо-зеленого или фиолетового цвета, хромиты MCrO2, которые получаются при сплавлении оксида хрома со щелочами, тетра- и гексагидроксохроматы(III) получаемые при растворении гидроксида хрома(III) в растворах щелочей (зеленого цвета), многочисленные комплексные соединения хрома.
Степень окисления +6 — вторая характерная степень окисления хрома, ей отвечают соответствует кислотный оксид хрома(VI) CrO 3 (красные кристаллы, растворяется в воде, образуя хромовые кислоты), хромовая H 2 CrO 4 , дихромовая H 2 Cr 2 O 7 и полихромовые кислоты, соответствующие соли: желтые хроматы и оранжевые дихроматы. Соединения хрома(VI) сильные окислители, особенно в кислой среде, восстанавливаются до соединений хрома(III)
В водном растворе хроматы переходят в дихроматы при изменении кислотности среды:
2CrO 4 2- + 2H + Cr 2 O 7 2- + H 2 O, что сопровождается изменением окраски.
Применение
Хром, в виде феррохрома используется при производстве легированных видов стали (в частности, нержавеющих), и других сплавов. Сплавы хрома: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности, сплав с никелем (нихром) — для производства нагревательных элементов. Большие количества хрома используются в качестве износоустойчивых и красивых гальванических покрытий (хромирование).
Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В чистом виде хром довольно токсичен, металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты. Соединения хрома(VI) приводят к разным заболеваниям человека, в том числе и онкологическим. ПДК хрома(VI) в атмосферном воздухе 0,0015 мг/м 3
Кононова А.С., Наков Д.Д., ТюмГУ, 501(2) группа, 2013 г.
Источники:
Хром (элемент) // Википедия. URL: http://ru.wikipedia.org/wiki/Хром (дата обращения: 6.01.2014).
Популярная библиотека химических элементов:
Хром. // URL:
Введение
Степень окисления (СО) — это условное обозначение в химии, служащее для того, чтобы определять заряд атома у какого-либо химического элемента (или группы элементов) . Без степеней окисления не решается ни одна задача, не составляется ни одно уравнение, но самое главное — без них мы не можем чётко определить свойства элемента и то, какую роль он будет играть в различных соединениях.
Без степеней окисления не решается ни одна задача, не составляется ни одно уравнение, но самое главное — без них мы не можем чётко определить свойства элемента и то, какую роль он будет играть в различных соединениях.
Знаменательно, что периодическая система (ПС) Д.И. Менделеева сгруппирована гениальнейшим образом: все элементы разделены по периодам, группам, подгруппам, их порядковые номера также соответствуют определённым показателям. Благодаря этому нам не приходится заучивать качества каждого химического элемента (ХЭ) наизусть, потому что легко можно найти его в таблице и определить всё, что требуется. Однако даже в таком случае некоторые люди, забывая школьные знания по курсу химии (или пренебрегая ими когда-то), вынуждены вернуться к изучению данной темы подробнее.
Итак, для начала необходимо сформировать верные объективные представления о хроме (Cr ), разобраться с его положением в ПС, а затем можно будет приступить к наиболее важной части — практике.
Хром — Cr , положение в таблице Менделеева, физические и химические свойства
Хром — это твёрдое вещество, металл, блестящий, серебристо-белого (или голубоватого) цвета . Он достаточно ломкий, но при этом имеет несравненный плюс по сравнению со многими другими металлами — устойчивость к заражению коррозией; именно поэтому он является важным компонентом при производстве нержавеющей стали, а также используется для нанесения на поверхность других металлов, более склонных к коррозии. Хром обладает плохой тепло- и электропроводностью.
ХЭ располагается в VI группе, 4 периоде, носит порядковый номер 24 и обладает атомной массой равной 52 г/моль. Благодаря пассивированию хром не взаимодействует с серной (H 2 SO 4 ) и азотной (HNO 3 ) кислотами, проявляет устойчивость в воздухе.
Это амфотерный металл — значит, он может растворяться как в кислотах, так и в щелочах . Элемент растворяется в сильных разбавленных кислотах (например, соляная кислота HCl ), в нормальных условиях (н. у.) взаимодействует только с фтором (F ). При нагревании хром может осуществлять взаимодействие с элементами VII группы (галогены), кислородом O 2 , бором B, азотом N 2 , серой S 2 , кремнием Si . Если раскалить Cr , то способен вступить в реакцию с водяными парами.
у.) взаимодействует только с фтором (F ). При нагревании хром может осуществлять взаимодействие с элементами VII группы (галогены), кислородом O 2 , бором B, азотом N 2 , серой S 2 , кремнием Si . Если раскалить Cr , то способен вступить в реакцию с водяными парами.
Теперь поговорим непосредственно о том, какие степени окисления бывают у данного ХЭ: он может приобретать СО +4, +6, а также +2 в безвоздушном пространстве, +3 — в пространстве с воздухом. Хром, как любой другой металл, является сильным восстановителем.
Вещества с различными степенями окисления
- +2. Когда Cr приобретает СО +2, вещество демонстрирует основные и очень сильные восстановительные свойства. К примеру, оксид хрома (II) — CrO , гидроксид хрома — Cr(OH) 2 , множество солей. Синтезируются соединения этого элемента с фтором(CrF 2 ), хлором(CrCl 2 ) и так далее.
- +3. Эти вещества обладают амфотерными свойствами, могут быть разных цветов (но преимущественно зелёного H 2 O ).
 Для примера приведём оксид Cr 2 O 3 (это зеленоватый порошок, который не растворяется в), Cr(OH) 3 , хромиты NaCrO 2 .
Для примера приведём оксид Cr 2 O 3 (это зеленоватый порошок, который не растворяется в), Cr(OH) 3 , хромиты NaCrO 2 . - +4. Такие соединения встречаются очень редко: они не образуют солей, кислот, с ними почти не производятся какие-либо работы. Но из известных веществ существуют оксид CrO 2 , тетрагалогенид CrF 4 , CrCl 4 .
- +6. Хром с СО +6, образуя соли, имеет кислотный характер, очень ядовитый, гидроскопичный, а также имеющий сильные окислительные свойства. Примеры: CrO 3 (имеет вид кристаллов красного цвета), K 2 CrO 4 , H 2 CrO 4 , H 2 Cr 2 O 7 . Элемент способен образовывать два вида гидроксидов (уже перечислены).
Как определять СО в сложных веществах
С правилом «крест-накрест» вы наверняка уже знакомы. А что, если соединение имеет, например, целых три элемента ?
В этом случае мы смотрим на последний элемент вещества, определяем его степень окисления и умножаем на коэффициент, находящийся справа (конечно, если он есть). Мысленно отделяем последний элемент (с уже определённой степенью окисления) от двух других элементов. Нам требуется, чтобы СО двух первых и последнего элементов в сумме была равна нулю.
Мысленно отделяем последний элемент (с уже определённой степенью окисления) от двух других элементов. Нам требуется, чтобы СО двух первых и последнего элементов в сумме была равна нулю.
Рассмотрим пример:
- PbCrO 4 — хромат свинца (II), имеющий вид красной соли. На конце формулы находится кислород, степень окисления которого всегда (за исключением некоторых случаев) будет -2. -2*4=-8. Pb (свинец) имеет СО +2. Дальнейшие действия будут похожи на алгебраическое уравнение, но если честно, то когда человек уже неплохо разбирается в определении степеней окислений и умеет пользоваться таблицей растворимости, вполне возможно избежать таких расчётов. Итак, элемент с неизвестной степенью окисления (хром) обозначим за буквенную переменную. 2+x-8=0;x=8-2;x=6 . Переменная равна 6, следовательно, степень окисления хрома становится +6.
Степени окисления в следующих формулах попробуйте расставить сами:
- Na 2 CrO 4 ;
- BaCrO 4 ;
- Fe(CrO 2) 2 ;
- Cr 2 O 7 ;
- H 2 CrO 4 .

Хром — один из самых интересных химических элементов, соединения с которым — штука сложная, но необходимая для понимания . Будет замечательно, если данные примеры помогут разобраться со столь кропотливой темой.
Редакция «сайт»
Задание №1
Степень окисления +2 во всех соединениях проявляет
Ответ: 4
Пояснение:
Из всех предложенных вариантов степень окисления +2 в сложных соединениях проявляет только цинк, являясь элементом побочной подгруппы второй группы, где максимальная степень окисления равна номеру группы.
Олово – элемент главной подгруппы IV группы, металл, проявляет степени окисления 0 (в простом веществе), +2, +4 (номер группы).
Фосфор – элемент главной подгруппы главной группы, являясь неметаллом, проявляет степени окисления от -3 (номер группы – 8) до +5 (номер группы).
Железо – металл, элемент расположен в побочной подгруппе главной группы. Для железа характерны степени окисления: 0, +2, +3, +6.
Задание №2
Соединение состава KЭО 4 образует каждый из двух элементов:
1) фосфор и хлор
2) фтор и марганец
3) хлор и марганец
4) кремний и бром
Ответ: 3
Пояснение:
Соль состава KЭО 4 содержит кислотный остаток ЭО 4 — , где кислород обладает степенью окисления -2, следовательно, степень окисления элемента Э в этом кислотном остатке равна +7. Из предложенных вариантов подходят хлор и марганец – элементы главной и побочной подгруппы VII группы соответственно.
Фтор – также элемент главной подгруппы VII группы, однако, являясь самым электроотрицательным элементом, не проявляет положительных степеней окисления (0 и -1).
Бор, кремний и фосфор – элементы главных подгрупп 3, 4 и 5 групп соответственно, поэтому в солях проявляют соответствующие максимальные степени окисления +3, +4, +5.
Задание №3
- 1. Zn и Cr
- 2. Si и B
- 3. Fe и Mn
- 4. P и As
Ответ: 4
Пояснение:
Одинаковую высшую степень окисления в соединениях, равную номеру группы (+5), проявляют P и As. Это элементы расположены в главной подгруппе V группы.
Это элементы расположены в главной подгруппе V группы.
Zn и Cr – элементы побочных подгрупп II и VI групп соответственно. В соединениях цинк проявляет высшую степень окисления +2, хром — +6.
Fe и Mn – элементы побочных подгруппы VIII и VII групп соответственно. Высшая степень окисления у железа составляет +6, у марганца — +7.
Задание №4
Одинаковую высшую степень окисления в соединениях проявляют
- 1. Hg и Cr
- 2. Si и Al
- 3. F и Mn
- 4. P и N
Ответ: 4
Пояснение:
Одинаковую высшую степень окисления в соединениях, равную номеру группы (+5), проявляют P и N. Эти элементы расположены в главной подгруппе V группы.
Hg и Cr – элементы побочных подгрупп II и VI групп соответственно. В соединениях ртуть проявляет высшую степень окисления +2, хром – +6.
Si и Al − элементы главных подгруппы IV и III групп соответственно. Следовательно, для кремния максимальная степень окисления в сложных соединениях равна +4 (номер группы, где расположен кремний), для алюминия − +3 (номер группы, где расположен алюминия).
F и Mn – элементы главной и побочной подгрупп VII групп соответственно. Однако фтор, являясь самым электроотрицательным элементом Периодической системы химических элементов, не проявляет положительных степеней окисления: в сложных соединения его степень окисления равна −1 (номер группы−8). Высшая степень окисления марганца составляет +7.
Задание №5
Степень окисления +3 азот проявляет в каждом из двух веществ:
- 1. HNO 2 и NH 3
- 2. NH 4 Cl и N 2 О 3
- 3. NaNO 2 и NF 3
- 4. HNO 3 и N 2
Ответ: 3
Пояснение:
В азотистой кислоте HNO 2 степень окисления кислорода в кислотном остатке равна -2, у водорода — +1, следовательно, чтобы молекула оставалась электронейтральной, степень окисления азота составляет +3. В аммиаке NH 3 азот является более электроотрицательным элементом, поэтому он оттягивает на себя электронную пару ковалентной полярной связи и обладает отрицательной степенью окисления -3, степень окисления водорода в аммиаке составляет +1.
Хлорид аммония NH 4 Cl является аммонийной солью, поэтому степень окисления азота такая же, как в аммиаке, т.е. равна -3. В оксидах степень окисления кислорода всегда равна -2, поэтому у азота она составляет +3.
В нитрите натрия NaNO 2 (соли азотистой кислоты) степень окисления азота такая же, как в азота в азотистой кислоте, т.к. составляет +3. Во фториде азота степень окисления азота +3, поскольку фтор является самым электроотрицательным элементом Периодической системы и в сложных соединениях проявляет отрицательную степень окисления -1. Данный вариант ответа удовлетворяет условию задания.
В азотной кислоте азот обладает высшей степенью окисления, равной номеру группы (+5). Азот как простое соединение (поскольку состоит из атомов одного химического элемента) обладает степенью окисления 0.
Задание №6
Высшему оксиду элемента VI группы соответствует формула
- 1. Э 4 O 6
- 2. ЭO 4
- 3. ЭO 2
- 4. ЭО 3
Ответ: 4
Пояснение:
Высшим оксидом элемента является оксид элемента с его максимальной степени окисления. В группе наивысшая степень окисления элемента равна номеру группы, следовательно, в VI группе максимальная степень окисления элемента равна +6. В оксидах кислород проявляет степень окисления -2. Цифры, стоящие под символом элемента, называются индексами и указывает на количество атомов этого элемента в молекуле.
В группе наивысшая степень окисления элемента равна номеру группы, следовательно, в VI группе максимальная степень окисления элемента равна +6. В оксидах кислород проявляет степень окисления -2. Цифры, стоящие под символом элемента, называются индексами и указывает на количество атомов этого элемента в молекуле.
Первый вариант является неверным, т.к. элемент обладает степенью окисления 0-(-2)⋅6/4 = +3.
Во втором варианте элемент обладает степенью окисления 0-(-2) ⋅ 4 = +8.
В третьем варианте степень окисления элемента Э: 0-(-2) ⋅ 2 = +4.
В четвертом варианте степень окисления элемента Э: 0-(-2) ⋅ 3 = +6, т.е. это искомый ответ.
Задание №7
Степень окисления хрома в дихромате аммония (NH 4) 2 Cr 2 O 7 равна
Ответ: 1
Пояснение:
В бихромате аммония (NH 4) 2 Cr 2 O 7 в катионе аммония NH 4 + азот как более электроотрицательный элемент обладает низшей степенью окисления -3, водород заряжен положительно +1. Следовательно, весь катион обладает зарядом +1, но, поскольку этих катионов 2, то общий заряд составляет +2.
Для того чтобы молекула оставалась электронейтральной, у кислотного остатка Cr 2 O 7 2− заряд должен быть -2. Кислород в кислотных остатках кислот и солей всегда обладает зарядом -2, поэтому 7 атомов кислорода, входящих в состав молекулы бихромата аммония, заряжены -14. Атомов хрома Cr в молекулы 2, следовательно, если заряд хрома обозначить за x, то имеем:
2x + 7 ⋅ (-2) = -2, где x = +6. Заряд хрома в молекуле бихромата аммония равен +6.
Задание №8
Степень окисления +5 возможна для каждого из двух элементов:
1) кислорода и фосфора
2) углерода и брома
3) хлора и фосфора
4) серы и кремния
Ответ: 3
Пояснение:
В первом предложенном варианте ответов только фосфор как элемент главной подгруппы V группы может проявлять степень окисления +5, которая является для него максимальной. Кислород (элемент главной подгруппы VI группы), являясь элементом с высокой электроотрицательностью, в оксидах проявляет степень окисления -2, как простое вещество – 0 и в соединении со фтором OF 2 – +1. Степень окисления +5 для него не характерна.
Степень окисления +5 для него не характерна.
Углерод и бром – элементы главных подгрупп IV и VII групп соответственно. Для углерода характерна максимальная степень окисления +4 (равна номеру группы), а бром проявляет степени окисления -1, 0 (в простом соединении Br 2), +1, +3, +5 и +7.
Хлор и фосфор – элементы главных подгрупп VII и V групп соответственно. Фосфор проявляется максимальную степень окисления +5 (равную номеру группы), для хлора аналогично брому характерны степени окисления -1, 0 (в простом соединении Cl 2), +1, +3, +5, +7.
Сера и кремний – элементы главных подгрупп VI и IV групп соответственно. Сера проявляет широкий спектр степеней окисления от -2 (номер группы − 8) до +6 (номер группы). Для кремния максимальная степень окисления равна +4 (номер группы).
Задание №9
- 1. NaNO 3
- 2. NaNO 2
- 3. NH 4 Cl
- 4. NO
Ответ: 1
Пояснение:
В нитрате натрия NaNO 3 натрий имеет степень окисления +1 (элемент I группы), атомов кислорода в кислотном остатке 3, каждый из которых имеет степень окисления −2, следовательно, чтобы молекула оставалась электронейтральной, азот должен иметь степень окисления: 0 − (+1) − (−2)·3 = +5.
В нитрите натрия NaNO 2 атом натрий также имеет степень окисления +1 (элемент I группы), атомов кислорода в кислотном остатке 2, каждый из которых имеет степень окисления −2, следовательно, чтобы молекула оставалась электронейтральной, азот должен обладать степенью окисления: 0 − (+1) − (−2)·2 = +3.
NH 4 Cl − хлорид аммония. В хлоридах атомы хлора имеют степень окисления −1, атомы водорода, которого в молекуле 4, заряжен положительно, следовательно, чтобы молекула оставалась электронейтральной, степень окисления азота: 0 − (−1) − 4 ·(+1) = −3. В аммиаке и катионах аммонийных солей азот имеет минимальную степень окисления −3 (номер группы, в которой расположен элемент, − 8).
В молекуле оксида азота NO кислород проявляет минимальную степень окисления −2, как во всех оксидах, следовательно, степень окисления азота равна +2.
Задание №10
Высшую степень окисления азот проявляет в соединении, формула которого
- 1. Fe(NO 3) 3
- 2. NaNO 2
- 3.
 (NH 4) 2 SO 4
(NH 4) 2 SO 4 - 4. NO 2
Ответ: 1
Пояснение:
Азот – элемент главной подгруппы V группы, следовательно, он может проявлять максимальную степень окисления, равную номеру группы, т.е. +5.
Одна структурная единица нитрата железа Fe(NO 3) 3 состоит из одного иона Fe 3+ и трех нитрат-ионов. В нитрат-ионах атомы азота независимо от типа противоиона имеют степень окисления +5.
В нитрите натрия NaNO 2 натрий имеет степень окисления +1 (элемент главной подгруппы I группы), атомов кислорода в кислотном остатке 2, каждый из которых имеет степень окисления −2, следовательно, чтобы молекула оставалась электронейтральной, азот должен обладать степенью окисления 0 − (+1) − (−2)⋅2 = +3.
(NH 4) 2 SO 4 – сульфат аммония. В солях серной кислоты анион SO 4 2− имеет заряд 2−, следовательно, каждый катион аммония заряжен 1+. На водороде заряд +1, поэтому на азоте −3 (азот более электроотрицателен, поэтому оттягивает на себя общую электронную пару связи N−H). В аммиаке и катионах аммонийных солей азот имеет минимальную степень окисления −3 (номер группы, в которой расположен элемент, − 8).
В аммиаке и катионах аммонийных солей азот имеет минимальную степень окисления −3 (номер группы, в которой расположен элемент, − 8).
В молекуле оксида азота NO 2 кислород проявляет минимальную степень окисления −2, как во всех оксидах, следовательно, степень окисления азота равна +4.
Задание №11
28910EВ соединениях состава Fe(NO 3) 3 и CF 4 степень окисления азота и углерода равна соответственно
Ответ: 4
Пояснение:
Одна структурная единица нитрата железа (III) Fe(NO 3) 3 состоит из одного иона железа Fe 3+ и трех нитрат-ионов NO 3 − . В нитрат-ионах азот всегда имеет степень окисления +5.
Во фториде углерода CF 4 фтор является более электроотрицательным элементом и оттягивает на себя общую электронную пару связи C-F, проявляя степень окисления -1. Следовательно, углерод C имеет степень окисления +4.
Задание №12
A32B0BСтепень окисления +7 хлор проявляет в каждом из двух соединений:
- 1.
 Ca(OCl) 2 и Cl 2 O 7
Ca(OCl) 2 и Cl 2 O 7 - 2. KClO 3 и ClO 2
- 3. BaCl 2 и HClO 4
- 4. Mg(ClO 4) 2 и Cl 2 O 7
Ответ: 4
Пояснение:
В первом варианте атомы хлора обладают степенями окисления +1 и +7 соответственно. Одна структурная единица гипохлорита кальция Ca(OCl) 2 состоит из одного иона кальция Ca 2+ (Ca — элемент главной подгруппы II группы) и двух гипохлорит-ионов OCl − , каждый из которых имеет заряд 1−. В сложных соединениях, кроме OF 2 и различных перекисей, кислород всегда имеет степень окисления −2, поэтому, очевидно, что хлор имеет заряд +1. В оксиде хлора Cl 2 O 7 , как и во всех оксидах, кислород обладает степенью окисления −2, следовательно, на хлор в этом соединении имеет степень окисления +7.
В хлорате калия KClO 3 атом калия имеет степень окисления +1, а кислород — −2. Для того чтобы молекула оставалась электронейтральной, хлор должен проявлять степень окисления +5. В оксиде хлора ClO 2 кислород, как и в любом другом оксиде, обладает степенью окисления −2, следовательно, для хлора его степень окисления равна +4.
В третьем варианте катион бария в сложном соединении заряжен +2, следовательно, на каждом анионе хлора в соли BaCl 2 сосредоточен отрицательный заряд −1. В хлорной кислоте HClO 4 общий заряд 4 атомов кислорода составляет −2⋅4 = −8, на катионе водорода заряд +1. Чтобы молекула оставалась электронейтральной, заряд хлора должен составлять +7.
В четвертом варианте в молекуле перхлората магния Mg(ClO 4) 2 заряд магния +2 (во всех сложных соединениях магний проявляет степень окисления +2), поэтому на каждый анион ClO 4 − приходится заряд 1−. В общем 4 иона кислорода, где каждый проявляет степень окисления −2, заряжены −8. Следовательно, чтобы общий заряд аниона составлял 1−, на хлоре должен быть заряд +7. В оксиде хлора Cl 2 O 7 , как было объяснено выше, заряд хлора составляет +7.
Оксид хрома(II ) и гидроксид хрома(II) имеют основной характер
Cr(OH)+2HCl→CrCl+2HO
Соединение
хрома(II)-сильные
восстановители; переходят в соединение
хрома(III)
под действием кислорода воздуха.
2CrCl+ 2HCl → 2CrCl+ H
4Cr(OH)+O+ 2HO→4Cr(OH)
Оксид хрома(III ) CrO- зеленый, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома(III) или дихроматов калия и аммония:
2Cr(OH)-→CrO+ 3HO
4KCrO-→ 2CrO + 4KCrO + 3O
(NH)CrO-→ CrO+ N+ HO
С концентрированными растворами кислот и щелочей взаимодействует с трудом:
Сr 2 О 3 + 6 КОН + 3Н 2 О = 2К 3 [Сr(ОН) 6 ]
Сr 2 О 3 + 6НСl = 2СrСl 3 + 3Н 2 О
Гидроксид хрома (III) Сr(ОН) 3 получают при действии щелочей на на растворы солей хрома (III):
СrСl 3 +3КОН = Сr(ОН) 3 ↓ + 3КСl
Гидроксид хрома (III) представляет собой осадок серо – зеленого цвета, при получении которого, щелочь надо брать в недостатке. Полученный таким образом гидроксид хрома (III), в отличие от соответствующего оксида легко взаимодействует с кислотами и щелочами, т.е. проявляет амфотерные свойства:
Сr(ОН) 3 + 3НNО 3 = Сr(NО 3) 3 + 3Н 2 О
Сr(ОН) 3 + 3КОН = К 3 [Сr(ОН)6](гексагидроксохромит К)
При сплавлении Сr(ОН) 3 со щелочами получаются метахромиты и ортохромиты:
Cr(OH) 3 + KOH = KCrO 2 (метахромит К) + 2H 2 O
Cr(OH) 3 + KOH = K 3 CrO 3 (ортохромит К) + 3H 2 O
Соединения
хрома(VI ).
Оксид хрома (VI ) — СrО 3 – темно – красное кристаллическое вещество, хорошо растворимо в воде – типичный кислотный оксид. Этому оксиду соответствует две кислоты:
СrО 3 + Н 2 О = Н 2 СrО 4 (хромовая кислота – образуется при избытке воды)
СrО 3 + Н 2 О =Н 2 Сr 2 О 7 (дихромовая кислота – образуется при большой концентрации оксида хрома (3)).
Оксид хрома (6) – очень сильный окислитель, поэтому энергично взаимодействует с органическими веществами:
Окисляет также иод, серу, фосфор, уголь:
При нагревании до 250 0 С оксид хрома (6) разлагается:
Оксид хрома (6) можно получить при действии концентрированной серной кислоты на твердые хроматы и дихроматы:
Хромовая и дихромовая кислоты.
Хромовая
и дихромовая кислоты существуют только
в водных растворах, образуют устойчивые
соли, соответственно хроматы и дихроматы.
Хроматы и их растворы имеют желтую
окраску, дихроматы – оранжевую.
Хромат — ионы СrО 4 2- и дихромат – ионы Сr2О 7 2- легко переходят друг в друга при изменении среды растворов
В кислой среде раствора хроматы переходят в дихроматы:
В щелочной среде дихроматы переходят в хроматы:
При разбавлении дихромовая кислота переходит в хромовую кислоту:
Зависимость свойств соединений хрома от степени окисления.
Степень окисления | |||
Характер оксида | основной | амфотерный | кислотный |
Гидроксид | Сr(ОН) 3 – Н 3 СrО 3 | ||
Характер гидроксида | основной | амфотерный | кислотный |
→ ослабление основных свойств и усиление кислотных→ | |||
Окислительно
– восстановительные свойства соединений
хрома.
Реакции в кислотной среде.
В кислотной среде соединения Сr +6 переходят в соединения Сr +3 под действием восстановителей: H 2 S, SO 2 , FeSO 4
Реакции в щелочной среде.
В щелочной среде соединения хрома Сr +3 переходят в соединения Сr +6 под действием окислителей: J2, Br2, Cl2, Ag2O, KClO3, h3O2, KMnO4:
- Атомное число: 24.
- Атомный вес: 51,996.
- Температура плавления: 1890 °C.
- Температура кипения: 2482 °C.
- Степень окисления: +2, +3, +6.
- Конфигурация электронов: 3d 5 4s 1 .

2KCrO 2 +3 Br2 +8NaOH =2Na 2 CrO 4 + 2KBr +4NaBr + 4H 2 O
Cr +3 — 3e → Cr +6
Хром — химический элемент с атомным номером 24. Это твердый, блестящий, серо-стального цвета металл, который хорошо полируется и не тускнеет. Используется в сплавах, таких как нержавеющая сталь, и в качестве покрытия. Организму человека требуются небольшие количества трехвалентного хрома для метаболизма сахара, но Cr (VI) очень токсичен.
Различные соединения хрома, такие как окись хрома (III) и хромат свинца, ярко окрашены и используются в красках и пигментах. Красный цвет рубина обусловлен наличием этого химического элемента. Некоторые вещества, особенно и натрия, являются окислителями, используемыми для окисления органических соединений и (вместе с серной кислотой) для очистки лабораторной посуды. Кроме того, окись хрома (VI) применяется в производстве магнитной ленты.
Кроме того, окись хрома (VI) применяется в производстве магнитной ленты.
Открытие и этимология
История открытия химического элемента хром такова. В 1761 году Иоганн Готлоб Леман нашел в Уральских горах оранжево-красный минерал и назвал его «сибирским красным свинцом». Хотя он ошибочно был идентифицирован как соединение свинца с селеном и железом, материал на самом деле являлся хроматом свинца с химической формулой PbCrO 4 . Сегодня он известен как минерал кроконт.
В 1770 году Петр Симон Паллас посетил то место, где Леман нашел красный свинцовый минерал, который имел очень полезные свойства пигмента в красках. Использование сибирского красного свинца в качестве краски получило быстрое развитие. Кроме того, ярко-желтый цвет из кроконта стал модным.
В 1797 году Николя-Луи Воклен получил образцы красной Путем смешивания кроконта с соляной кислотой он получил оксид CrO 3 . Хром как химический элемент был выделен в 1798 году. Воклен получил его при нагревании окисла с древесным углем. Он также смог обнаружить следы хрома в драгоценных камнях, таких как рубин и изумруд.
Он также смог обнаружить следы хрома в драгоценных камнях, таких как рубин и изумруд.
В 1800-х годах Cr в основном применялся в составе красок и кожевенных солей. Сегодня 85% металла используется в сплавах. Остальная часть применяется в химической промышленности, производстве огнеупорных материалов и литейной промышленности.
Произношение химического элемента хром соответствует греческому χρῶμα, что означает «цвет», из-за множества цветных соединений, которые из него можно получить.
Добыча и производство
Элемент производят из хромита (FeCr 2 O 4). Примерно половина этой руды в мире добывается в Южной Африке. Кроме того, Казахстан, Индия и Турция являются его крупными производителями. Разведанных месторождений хромита достаточно, но географически они сконцентрированы в Казахстане и на юге Африки.
Залежи самородного металлического хрома встречаются редко, но они есть. Например, его добывают на шахте «Удачная» в России. Она является богатой алмазами, и восстановительная среда помогла образоваться чистому хрому и алмазам.
Для промышленного производства металла хромитовые руды обрабатывают расплавленной щелочью (едким натром, NaOH). При этом образуется хромат натрия (Na 2 CrO 4), который восстанавливается углеродом до оксида Сг 2 O 3 . Металл получают при нагревании окисла в присутствии алюминия или кремния.
В 2000 году было добыто около 15 млн т хромитовой руды, которая была переработана в 4 млн т феррохрома, на 70% состоящего из сплава хрома с железом, приблизительная рыночная стоимость которых составила 2,5 млрд долларов США.
Основные характеристики
Характеристика химического элемента хрома обусловлена тем, что он является переходным металлом четвертого периода таблицы Менделеева и расположен между ванадием и марганцем. Входит в VI группу. Плавится при температуре 1907 °С. В присутствии кислорода хром быстро образует тонкий слой оксида, который защищает металл от дальнейшего взаимодействия с кислородом.
Как переходный элемент, он реагирует с веществами в различных соотношениях. Таким образом он образует соединения, в которых имеет различные степени окисления. Хром — химический элемент с основными состояниями +2, +3 и +6, из которых +3 является наиболее устойчивым. Кроме того, в редких случаях наблюдаются состояния +1, +4 и +5. Соединения хрома в степени окисления +6 представляют собой сильные окислители.
Таким образом он образует соединения, в которых имеет различные степени окисления. Хром — химический элемент с основными состояниями +2, +3 и +6, из которых +3 является наиболее устойчивым. Кроме того, в редких случаях наблюдаются состояния +1, +4 и +5. Соединения хрома в степени окисления +6 представляют собой сильные окислители.
Какого цвета хром? Химический элемент придает рубиновый оттенок. Сг 2 O 3 , используемый для также применяется в качестве пигмента под названием «хромовая зелень». Его соли окрашивают стекло в изумрудно-зеленый цвет. Хром — химический элемент, присутствие которого делает рубин красным. Поэтому он используется в производстве синтетических рубинов.
Изотопы
Изотопы хрома обладают атомным весом от 43 до 67. Обычно данный химический элемент состоит из трех стабильных форм: 52 Cr, 53 Cr и 54 Cr. Из них наиболее распространен 52 Cr (83,8% всего природного хрома). Кроме того, описаны 19 радиоизотопов, из которых наиболее стабильным является 50 Cr с периодом полураспада, превышающим 1,8×10 17 лет. У 51 Cr период полураспада — 27,7 дней, а у всех остальных радиоактивных изотопов он не превышает 24 ч, причем у большинства из них он длится менее одной минуты. Элемент также имеет два метасостояния.
У 51 Cr период полураспада — 27,7 дней, а у всех остальных радиоактивных изотопов он не превышает 24 ч, причем у большинства из них он длится менее одной минуты. Элемент также имеет два метасостояния.
Изотопы хрома в земной коре, как правило, сопутствуют изотопам марганца, что находит применение в геологии. 53 Cr образуется при радиоактивном распаде 53 Mn. Соотношение изотопов Mn/Cr подкрепляет другие сведения о ранней истории Солнечной системы. Изменения в соотношениях 53 Cr/ 52 Cr и Mn/Cr из разных метеоритов доказывает то, что новых атомные ядра были созданы непосредственно перед формированием Солнечной системы.
Химический элемент хром: свойства, формула соединений
Оксид хрома (III) Сг 2 O 3 , также известный как полуторная окись, является одним из четырех окислов этого химического элемента. Его получают из хромита. Соединение зеленого цвета обычно называют «хромовой зеленью», когда используют в качестве пигмента для живописи по эмали и стеклу. Оксид может растворяться в кислотах, образуя соли, а в расплавленной щелочи — хромиты.
Бихромат калия
K 2 Cr 2 O 7 является мощным окислителем и ему отдается предпочтение в качестве средства для очистки лабораторной посуды от органики. Для этого используется его насыщенный раствор в Иногда, однако, его заменяют бихроматом натрия, исходя из более высокой растворимости последнего. Кроме того, он может регулировать процесс окисления органических соединений, преобразуя первичный спирт в альдегид, а затем в углекислоту.
Бихромат калия способен вызвать хромовый дерматит. Хром, вероятно, является причиной сенсибилизации, ведущей к развитию дерматита, особенно рук и предплечий, который носит хронический характер и трудно излечим. Как и другие соединения Cr (VI), бихромат калия канцерогенен. С ним нужно обращаться в перчатках и соответствующими средствами защиты.
Хромовая кислота
Соединение обладает гипотетической структурой H 2 CrO 4 . Ни хромовая, ни дихромовая кислоты не встречаются в природе, но их анионы находят в различных веществах. «Хромовая кислота», которую можно встретить в продаже, на самом деле является ее кислотным ангидридом — триоксидом CrO 3 .
«Хромовая кислота», которую можно встретить в продаже, на самом деле является ее кислотным ангидридом — триоксидом CrO 3 .
Хромат свинца (II)
PbCrO 4 обладает ярко-желтой окраской и практически не растворим в воде. По этой причине он нашел применение в качестве красящего пигмента под названием «желтый крон».
Cr и пятивалентная связь
Хром отличается своей способностью образовывать пятивалентные связи. Соединение создается Cr (I) и углеводородным радикалом. Пятивалентная связь формируется между двумя атомами хрома. Его формула может быть записана как Ar-Cr-Cr-Ar, где Ar представляет собой специфическую ароматическую группу.
Применение
Хром — химический элемент, свойства которого обеспечили ему множество различных вариантов применения, некоторые из которых приведены ниже.
Металлам он придает устойчивость к коррозии и глянцевую поверхность. Поэтому хром входит в состав таких сплавов, как нержавеющая сталь, используемых, например, в столовых приборах. Он также применяется для нанесения хромированного покрытия.
Он также применяется для нанесения хромированного покрытия.
Хром является катализатором различных реакций. Из него делают формы для обжига кирпича. Его солями дубят кожу. Бихромат калия применяют для окисления органических соединений, таких как спирты и альдегиды, а также для очистки лабораторной посуды. Он служит фиксирующим агентом для окрашивания ткани, а также используется в фотографии и фотопечати.
CrO 3 применяется для изготовления магнитных лент (например, для аудиозаписи), которые обладают лучшими характеристиками, чем пленки с оксидом железа.
Роль в биологии
Трехвалентный хром — химический элемент, необходимый для метаболизма сахара в организме человека. Напротив, шестивалентный Cr очень токсичен.
Меры предосторожности
Металлический хром и соединения Cr (III), как правило, не считаются опасными для здоровья, но вещества, содержащие Cr (VI), могут быть токсичными, если их принимать внутрь или вдыхать. Большинство таких веществ оказывают раздражающее действие на глаза, кожу и слизистые оболочки. При постоянном воздействии соединения хрома (VI) могут вызвать повреждение глаз, если их не лечить должным образом. Кроме того, это признанный канцероген. Смертельная доза данного химического элемента — около половины чайной ложки. Согласно рекомендациям Всемирной организации здравоохранения, предельно допустимая концентрация Cr (VI) в питьевой воде составляет 0,05 мг на литр.
При постоянном воздействии соединения хрома (VI) могут вызвать повреждение глаз, если их не лечить должным образом. Кроме того, это признанный канцероген. Смертельная доза данного химического элемента — около половины чайной ложки. Согласно рекомендациям Всемирной организации здравоохранения, предельно допустимая концентрация Cr (VI) в питьевой воде составляет 0,05 мг на литр.
Так как соединения хрома используются в красителях и для дубления кожи, они часто встречаются в почве и грунтовых водах заброшенных промышленных объектов, требующих экологической очистки и восстановления. Грунтовка, содержащая Cr (VI), до сих пор широко применяется в аэрокосмической промышленности и автомобилестроении.
Свойства элемента
Основные физические свойства хрома следующие:
Примеры ОВР соединений хрома
ОВР соединений хрома
Как и марганец, хром также образует соединения, в которых проявляет самые разнообразные степени окисления. Соединения хрома в низших степенях окисления являются восстановителями, а в высших – окислителями. Более или менее устойчивыми являются степени окисления 0, +2, +3 и +4 Самая устойчивая из них +3. Как и для марганца, условия протекания окислительно-восстановительных превращений соединений хрома можно изобразить в виде схемы:
В отличие от перманганат-иона MnO4—, устойчивого как в кислотной, так и в щелочной среде, хромат-ион CrO42- устойчив только в щелочной и, отчасти, в нейтральной среде. В кислотной среде хромат-ион превращается в дихромат-ион по реакции:
2CrO42- + 2H3O + = Cr2O72- + 3H2O
Дихромат-ион, в свою очередь, устойчив только в кислотной и, отчасти, в нейтральной среде, а в щелочной превращается в хромат-ион:
Cr2O72- + 2OH— = 2CrO42- + H2O
Так как в кислотной среде окислительные свойства кислотных остатков оксокислот всегда проявляются сильнее, чем в щелочной, дихромат-ион значительно более сильный окислитель, чем хромат-ион. И наоборот, гексагидроксохромат (+3) — ионы, существующие только в щелочной среде, легко окисляются до хроматов (+6) такими сильными окислителями, как хлор, бром или пероксид водорода.
И наоборот, гексагидроксохромат (+3) — ионы, существующие только в щелочной среде, легко окисляются до хроматов (+6) такими сильными окислителями, как хлор, бром или пероксид водорода.
Как и металлический марганец, хром проявляет восстановительные свойства, легко окисляясь ионами оксония (без доступа кислорода – до Cr2+, на воздухе – до Cr3+). Ион Cr2+, в отличие от Mn2+, – очень сильный восстановитель; он легко окисляется кислородом воздуха, восстанавливает ионы Fe3+ до Fe2+, а также вступает и в другие ОВР.
Кристаллический оксид хрома (VI) – очень сильный окислитель. Как и оксид марганца (VII), это кислотный оксид. Он легко реагирует с водой с образованием хромовой кислоты H2CrO4. Следовательно, в ОВР он может вступать только в твердом виде. В частности, органические вещества при соприкосновении с CrO3 окисляются до углекислого газа, сероводород – до SO2, аммиак – до азота.
Составление уравнений ОВР с участием растворов соединений хрома полностью аналогично составлению уравнений реакций в случае соединений марганца, поэтому здесь приводятся лишь уравнения полуреакций ионов, содержащих хром:
Cr2O72- + 14H3O+ + 6e– = 2Cr3+ + 21H2O
CrO42- + 4H2O + 3e– = [Cr(OH)6]3- + 2OH—
[Cr(OH)6]3- + 2OH— – 3e– = CrO42- + 4H2O
Cr2+ – e– = Cr3+
Рассмотрим примеры реакций, которые не являются окислительно — восстановительными:
1. В кислой среде хроматы превращаются в оранжевые дихроматы Cr2O72-:
В кислой среде хроматы превращаются в оранжевые дихроматы Cr2O72-:
2K2CrO4 + H2SO4K2Cr2O7 + K2SO4 + H2O
2. В щелочной среде эта реакция протекает в обратном направлении:
K2Cr2O7 + 2KOH2K2CrO4 + H2O
2CrO42- + 2H+
Cr2O72- + H2O
щелочная среда
CrO3 — кислотный оксид, со щелочами образует жёлтые хроматы CrO42-:
CrO3 + 2KOH K2CrO4 + H2O
K2CrO4 + H2SO4CrO3 + K2SO4 + H2O
K2Cr2O7 + H2SO42CrO3 + K2SO4 + H2O
Пример 1. Составить уравнение реакции, протекающей при взаимодействии бихромата калия, серной кислоты и углерода.
Составить уравнение реакции, протекающей при взаимодействии бихромата калия, серной кислоты и углерода.
K+, Cr2O7 2-, H2O, C0, SO4 2-, H+
В кислой среде бихромат калия образует соли Cr+3:
Cr2O72- + 14H3O+ + 6е— = 2Сr3+ +7H2O 2
C0 + 2H2O – 4e— = CO2 + 4H3O+ 3
3C0 + 2Cr2O72- + 28 16H3O+ + 6H2O = 4Сr3+ + 3CO2 + 12H3O+ + 14 8 H2O
3C0 + 2K2Cr2O7 + 8H2SO4 = 2Сr2(SO4)3 + 2K2SO4 + 3CO2 + 8H2O
Пример 2. Составить уравнение реакции, протекающей при взаимодействии бихромата калия и соляной кислоты.
Составить уравнение реакции, протекающей при взаимодействии бихромата калия и соляной кислоты.
K+, Cr2O7 2-, Cl—, H+
1. В кислой среде бихромат калия образует соли Cr+3:
Cr2О72- + 14 Н+ + 6е— = 2Сr3+ + 7Н2О 1
2Cl— + 2e— = Cl20 3
2. Добавив в обе части уравнения необходимое количество ионов, запишем молекулярное уравнение:
K2Cr2O7 + 14 HCl = 2СrСl3 + 2KCl + 3Cl2 + 7H2O
Пример 3. Составить уравнение реакции, протекающей при взаимодействии бихромата натрия и гидроксида цезия (реакция не ОВР).
Составить уравнение реакции, протекающей при взаимодействии бихромата натрия и гидроксида цезия (реакция не ОВР).
Na+, Cr2O7 2-,Cs+, OH—
Na2Cr2O7 + 2CsOH = Na2CrO4 + Cs2CrO4 + H2O
Пример 4. Составить уравнение реакции, протекающей при взаимодействии бихромата калия и концентрированной серной кислотой (реакция не ОВР).
К2Cr2O7 + 2H2SO4 = 2CrO3 + 2КHSO4 + H2O
Хром
История
Происхождение названия
Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
История
Открыт на Среднем Урале, в Березовском золоторудном месторождении. Впервые упоминается в труде М. В. Ломоносова «Первые основания металлургии» (1763 год), как красная свинцовая руда, PbCrO4. Современное название — крокоит. В 1797 году французский химик Л. Н. Воклен выделил из него новый тугоплавкий металл (скорее всего, Воклен получил карбид хрома).
Нахождение в природе
Хром является довольно распространённым элементом в земной коре (0,012 % по массе). Основные соединения хрома — хромистый железняк (хромит) FeO·Cr2O3. Вторым по значимости минералом является крокоит PbCrO4.
Месторождения
Самые большие месторождения хрома находятся в ЮАР (1-е место в мире), Казахстане, России, Зимбабве, Мадагаскаре. Также есть месторождения на территории Турции, Индии, Армении, Бразилии, на Филиппинах.
Главные месторождения хромовых руд в РФ известны на Урале (Донские и Сарановское).
Разведанные запасы в Казахстане составляют свыше 350 миллионов тонн (2-е место в мире).
Геохимия и минералогия
Среднее содержание хрома в различных изверженных породах резко непостоянно. В ультраосновных породах (перидотитах) оно достигает 2 кг/т, в основных породах (базальтах и др.) — 200 г/т, а в гранитах десятки г/т. Кларк хрома в земной коре 83 г/т. Он является типичным литофильным элементом и почти весь заключен в минералах типа хромшпинелидов. Хром вместе с железом, титаном, никелем, ванадием и марганцем составляют одно геохимическое семейство.
Различают три основных минерала хрома: магнохромит (Mg, Fe)Cr2O4, хромпикотит (Mg, Fe)(Cr, Al)2O4 и алюмохромит (Fe, Mg)(Cr, Al)2O4. По внешнему виду они неразличимы, и их неточно называют «хромиты». Состав их изменчив:
- Cr2O3 18—62 %,
- FeO 1—18 %,
- MgO 5—16 %,
- Al2O3 0,2 — 0,4 (до 33 %),
- Fe2O3 2 — 30 %,
- примеси TiO2 до 2 %,
- V2O5 до 0,2 %,
- ZnO до 5 %,
- MnO до 1 %; присутствуют также Co, Ni и др.

Собственно, хромит, то есть FeCr2O4 сравнительно редок. Помимо различных хромитов, хром входит в состав ряда других минералов — хромовой слюды (фуксита), хромового хлорита, хромвезувиана, хромдиопсида, хромтурмалина, хромового граната (уваровита) и др., которые нередко сопровождают руды, но сами промышленного значения не имеют. В экзогенных условиях хром, как и железо, мигрирует в виде взвесей и может накапливаться в глинах. Наиболее подвижной формой являются хроматы.
Получение
Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
- Fe(CrO2)2 + 4C → Fe + 2Cr + 4CO
Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
- 4Fe(CrO2)2 + 8Na2CO3 + 7O2 → 8Na2CrO4 + 2Fe2O3 + 8CO2
2) растворяют хромат натрия и отделяют его от оксида железа;
3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат;
4) получают чистый оксид хрома восстановлением дихромата натрия углём:
- Na2Cr27 + 2C → Cr2O3 + Na2CO3 + CO
5) с помощью алюминотермии получают металлический хром:
- Cr2O3 + 2Al → Al2O3 + 2Cr + 130kcal
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
При этом на катодах совершаются в основном 3 процесса:
- восстановление шестивалентного хрома до трехвалентного с переходом его в раствор;
- разряд ионов водорода с выделением газообразного водорода;
- разряд ионов, содержащих шестивалентный хром, с осаждением металлического хрома;
- Cr2O72− + 14H+ + 12e− → 2Cr + 7H2O
Физические свойства
В свободном виде — голубовато-белый металл с кубической объёмноцентрированной решёткой, a = 0,28845 нм. Ниже температуры 38 °C является антиферромагнетиком, выше переходит в парамагнитное состояние (точка Нееля).
Хром имеет твёрдость по шкале Мооса 5, один из самых твёрдых чистых металлов (уступает только иридию, бериллию, вольфраму и урану). Очень чистый хром достаточно хорошо поддаётся механической обработке.
Изотопы
Основная статья: Изотопы хрома
Природный хром состоит из четырех стабильных изотопов (50Cr (изотопная распространённость 4,345 %), 52Cr (83. 789 %), 53Cr (9.501 %), 54Cr (2.365 %)).
789 %), 53Cr (9.501 %), 54Cr (2.365 %)).
Химические свойства
Характерные степени окисления
Для хрома характерны степени окисления +2, +3 и +6 (см. табл.). Практически все соединения хрома окрашены.
| Степень окисления | Оксид | Гидроксид | Характер | Преобладающие формы в растворах | Примечания |
|---|---|---|---|---|---|
| +2 | CrO (чёрный) | Cr(OH)2 (жёлтый) | Основный | Cr2+ (соли голубого цвета) | Очень сильный восстановитель |
| +3 | Cr2O3 (зелёный) | Cr(OH)3 (серо-зелёный) | Амфотерный | Cr3+ (зелёные или лиловые соли) [Cr(OH)4]− (зелёный) | |
| +4 | CrO2 | не существует | Несолеобразующий | — | Встречается редко, малохарактерна |
| +6 | CrO3 (красный) | H2CrO4 H2Cr2O7 | Кислотный | CrO42− (хроматы, желтые) Cr2O72− (дихроматы, оранжевые) | Переход зависит от рН среды. Сильнейший окислитель, гигроскопичен, очень ядовит. Сильнейший окислитель, гигроскопичен, очень ядовит. |
Простое вещество
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
- [H]
- 2Cr3+ → Zn,HCl 2Cr2+
Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или жёлтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (в водных растворах ион Cr3+ существует в виде аквакомплексов [Cr(H2O)6]3+) до зелёного (в координационной сфере присутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12H2O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
- Cr3+ + 3NH3 + 3H2O → Cr(OH)3↓ + 3NH4+
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
- Cr3+ + 3OH− → Cr(OH)3↓
- Cr(OH)3 + 3OH− → [Cr(OH)6]3−
Сплавляя Cr2O3 со щелочами, получают хромиты:
- Cr2O3 + 2NaOH → 2NaCrO2 + H2O
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
- Cr2O3 + 6HCl → 2CrCl3 + 3H2O
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
- 2Na3[Cr(OH)6] + 3H2O2 → 2Na2CrO4 + 2NaOH + 8H2O
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):
- 2Cr2O3 + 8NaOH + 3O2 → 4Na2CrO4 + 4H2O
Соединения хрома (+4)
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая H2CrO4 и двухромовая H2Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие изополикислоты с общей формулой H2CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
- 2CrO42− + 2H+ → Cr2O72− + H2O
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую, так как снова образуется хромат K2CrO4:
- Cr2O72− + 2OH− → 2CrO42− + H2O
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
- H2CrnO3n+1 → H2O + nCrO3
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, жёлтый хромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:
В частности, жёлтый хромат бария BaCrO4 выпадает при добавлении солей бария как к растворам хроматов, так и к растворам дихроматов:
- Ba2+ + CrO42− → BaCrO4↓
- 2Ba2+ + Cr2O72− + H2O → 2BaCrO4↓ + 2H+
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
- K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2↑ + 7H2O
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего монопероксида хрома(VI) CrO5 (CrO(O2)2), который экстрагируется в органический слой; данная реакция используется как аналитическая.
Применение
Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Добавка хрома существенно повышает твердость и коррозийную стойкость сплавов.
Используется в качестве износоустойчивых и красивых гальванических покрытий (хромирование).
Хром применяется для производства сплавов: хром-30 и хром-90, незаменимых для производства сопел мощных плазмотронов и в авиакосмической промышленности.
Биологическая роль и физиологическое действие
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В чистом виде хром довольно токсичен, металлическая пыль хрома раздражает ткани лёгких. Соединения хрома(III) вызывают дерматиты.
Пример соединения хрома (VI): Оксид хрома (VI)Соединения хрома в степени окисления +6 особо токсичны. Практически вся хромовая руда обрабатывается через преобразование в дихромат натрия. В 1985 году было произведено примерно 136 000 тонн шестивалентного хрома. Другими источниками шестивалентного хрома являются триоксид хрома и различные соли — хроматы и дихроматы. Шестивалентный хром используется при производстве нержавеющих сталей, текстильных красок, консервантов для дерева, при хромировании и пр.
Практически вся хромовая руда обрабатывается через преобразование в дихромат натрия. В 1985 году было произведено примерно 136 000 тонн шестивалентного хрома. Другими источниками шестивалентного хрома являются триоксид хрома и различные соли — хроматы и дихроматы. Шестивалентный хром используется при производстве нержавеющих сталей, текстильных красок, консервантов для дерева, при хромировании и пр.
Шестивалентный хром является признанным канцерогеном при вдыхании. На многих рабочих местах сотрудники подвержены воздействию шестивалентного хрома, например, при гальваническом хромировании или сварке нержавеющих сталей. В Европейском союзе использование шестивалентного хрома существенно ограничено директивой RoHS.
Шестивалентный хром транспортируется в клетки человеческого организма с помощью сульфатного транспортного механизма благодаря своей близости к сульфатам по структуре и заряду. Трёхвалентный хром, более часто встречающийся, не транспортируется в клетки.
Внутри клетки Cr(VI) восстанавливается до метастабильного пятивалентного хрома (Cr(V)), затем до трехвалентного хрома (Cr(III)). Трехвалентный хром, присоединяясь к протеинам, создает гаптены, которые включают иммунную реакцию. После их появления чувствительность к хрому не пропадает. В этом случае даже контакт с текстильными изделиями, окрашенными хромсодержащими красками или с кожей, обработанной хромом, может вызвать раздражение кожи. Витамин C и другие агенты реагируют с хроматами и образуют Cr(III) внутри клетки.
Трехвалентный хром, присоединяясь к протеинам, создает гаптены, которые включают иммунную реакцию. После их появления чувствительность к хрому не пропадает. В этом случае даже контакт с текстильными изделиями, окрашенными хромсодержащими красками или с кожей, обработанной хромом, может вызвать раздражение кожи. Витамин C и другие агенты реагируют с хроматами и образуют Cr(III) внутри клетки.
Продукты шестивалентного хрома являются генотоксичными канцерогенами. Хроническое вдыхание соединений шестивалентного хрома увеличивает риск заболеваний носоглотки, риск рака лёгких. (Лёгкие особенно уязвимы из-за большого количества мелких капилляров). Видимо, механизм генотоксичности запускается пяти- и трёхвалентным хромом.
В США предельно допустимая концентрация шестивалентного хрома в воздухе составляет 5 мкг/м³ (0,005 мг/м³). В России предельно допустимая концентрация хрома (VI) существенно ниже — 1,5 мкг/м³ (0,0015 мг/м³).
Одним из общепризнанных методов избежания шестивалентного хрома является переход от технологий гальванического хромирования к газотермическому и вакуумному напылению.
Основанный на реальных событиях фильм «Эрин Брокович» режиссёра Стивена Содерберга рассказывает о крупном судебном процессе, связанном с загрязнением окружающей среды шестивалентным хромом, в результате которого у многих людей развились серьёзные заболевания.
Хром в питьевой воде очень опасен для здоровья | Научные открытия и технические новинки из Германии | DW
Хром — это один из так называемых биогенных химических элементов, то есть тех, что входят в состав растительных и животных тканей. Соответственно, не может обойтись без хрома и организм человека: этот элемент так или иначе участвует и в белковом, и углеводном, и в жировом обмене. Но дело в том, что хром хрому рознь: ему может быть присуща разная валентность, точнее — разная степень окисления. А степень окисления предопределяет химические свойства хрома, из которых, в свою очередь, вытекают и его реакционная способность, и номенклатура образуемых им соединений, и его биологическое и физиологическое воздействие.
Наиболее широкое распространение имеют две формы хрома, поясняет Аня Маттнер (Anja Mattner) из Баварского земельного ведомства по вопросам здравоохранения и безопасности продуктов питания в Обершляйсхайме близ Мюнхена: «Существуют хром-3 и хром-6. Хром-6 образует соединения, отличные от тех, что образует хром-3. Можно сказать, что хром-3 — это хороший хром, а хром-6 — плохой». Дело в том, что незаменимую функцию в живом организме выполняет только трехвалентный хром. А соединения на основе шестивалентного хрома токсичны и канцерогенны. Об этом свидетельствуют эксперименты на животных.
Разоблачения Эрин Брокович вызвали скандал в США
Многие, наверное, помнят известный голливудский фильм «Эрин Брокович» с Джулией Робертс в главной роли. В нем рассказывается о перипетиях борьбы за привлечение к судебной ответственности крупной промышленной компании, отравившей грунтовые воды, что привело к значительному росту заболеваемости раком и смертности среди местного населения.
Эта кинокартина основана на реальных событиях, имевших место в городке Хинкли в южной Калифорнии в 1993 году. Речь идет о компании Pacific Gas & Electric, а токсичное вещество, которое использовалось для борьбы с коррозией в здешней градирне, было шестивалентным хромом. Та же субстанция фигурировала и в ряде других судебных процессов, связанных с загрязнением окружающей в США, но все же это были отдельные случаи.
Однако в самом конце 2010 года вашингтонская экологическая организация Environmental Working Group впервые проверила качество питьевой воды на всей территории США, выбрав для этого 35 больших, средних и малых городов, и в 31 из них обнаружила в воде шестивалентный хром. Мало того, в 25 городах его содержание в воде достигало опасных для здоровья значений.
А как в Германии?
Понятно, что эти данные вызвали серьезную обеспокоенность медиков и экологов не только в США. В Германии, в частности, Технологический центр «Вода» в Карлсруэ решил проверить на шестивалентный хром водопроводную воду, а упомянутое выше баварское ведомство взялось за анализ минеральной воды. «Можно смело утверждать, что такого исследования минеральной воды в Германии до сих пор не проводилось, — говорит Аня Маттнер, — поэтому мы ни малейшего понятия не имели, что получим в результате: вообще ничего или, наоборот, очень много хрома. В общей сложности, мы проверили минеральную воду 64 марок, включая и воду иностранного производства, импортируемую в Германию».
«Можно смело утверждать, что такого исследования минеральной воды в Германии до сих пор не проводилось, — говорит Аня Маттнер, — поэтому мы ни малейшего понятия не имели, что получим в результате: вообще ничего или, наоборот, очень много хрома. В общей сложности, мы проверили минеральную воду 64 марок, включая и воду иностранного производства, импортируемую в Германию».
Шестивалентный хром в воде присутствовал, но в ничтожных концентрациях, гораздо более низких, чем те, что были зарегистрированы в питьевой воде в США. «Мы полагаем, что опасности для здоровья нет», — говорит исследовательница.
Чем больше углекислоты, тем меньше шестивалентного хрома
Зато баварские специалисты обнаружили зависимость между содержанием шестивалентного хрома и концентрацией углекислоты в минеральной воде. Аня Маттнер поясняет: «Углекислота повышает кислотность воды, а в кислой среде соединения хрома-6 менее устойчивы, они легче распадаются. Видимо, поэтому содержание хрома-6 в воде без газа оказались выше, чем в газированной».
На этой основе можно при желании даже сформулировать рекомендации для потребителей, считает Петер Фехер (Peter Fecher), возглавляющий тот самый отдел баварского ведомства, который провел анализ минеральной воды: «Тот, что хочет перестраховаться, должен отдавать предпочтение газированной воде. Хотя, в общем-то, это имеет смысл лишь для самоуспокоения».
Нужны новые нормативы, регулирующие содержание хрома
Результаты исследования водопроводной воды, проведенного специалистами в Карлсруэ, пока не опубликованы, но отчет близок к завершению. И уже известно, что там также обнаружено присутствие шестивалентного хрома, но в крайне малых концентрациях. Главное теперь — установить предельно допустимое содержание в воде этой разновидности хрома, поскольку действующая сегодня норма носит интегральный характер, то есть касается хрома вообще — и безвредного трехвалентного, и токсичного шестивалентного.
В Германии за качество питьевой воды отвечает Федеральное ведомство по охране окружающей среды в Дессау-Росслау, и там сейчас рассматривается вопрос о том, чтобы установить предельно допустимое содержание шестивалентного хрома в воде на уровне в 1 микрограмм / литр. Все зарегистрированные пока концентрации этого канцерогена, будь то в минеральной или в водопроводной воде, гораздо ниже. Но проблема в том, что хром применяется сегодня очень широко: и в металлургии при легировании сталей, и в производстве батарей и аккумуляторов, и при дублении кожи. Поскольку же при этом образуются и соединения шестивалентного хрома, его содержание в воде должно контролироваться постоянно и достаточно строго.
Все зарегистрированные пока концентрации этого канцерогена, будь то в минеральной или в водопроводной воде, гораздо ниже. Но проблема в том, что хром применяется сегодня очень широко: и в металлургии при легировании сталей, и в производстве батарей и аккумуляторов, и при дублении кожи. Поскольку же при этом образуются и соединения шестивалентного хрома, его содержание в воде должно контролироваться постоянно и достаточно строго.
Хром | Введение в химию
Цель обучения
- Вспомните антиферромагнитные свойства элементарного хрома.
Ключевые моменты
- Степени окисления +3 и +6 чаще всего наблюдаются в соединениях хрома, тогда как состояния +1, +4 и +5 встречаются редко.
- Хром отличается своими магнитными свойствами: это единственное твердое тело, которое демонстрирует антиферромагнитное упорядочение при комнатной температуре (и ниже).
- Соединения хрома (VI) являются сильными окислителями при низком или нейтральном pH.

Условия
- лиганд Ион, молекула или функциональная группа, которая связывается с другим химическим соединением с образованием более крупного комплекса.
- антиферромагнетизм Демонстрирует антиферромагнетизм — явление, подобное ферромагнетизму, при котором магнитные домены выстраиваются в регулярную структуру, но соседние электронные спины направлены в противоположных направлениях.
- Хром Хром — это химический элемент, который имеет символ Cr и атомный номер 24.
- амфотерный, имеющий характеристики как кислоты, так и основания и способный реагировать как оба; амфипротический.
Свойства хрома
Хром — стально-серый, блестящий, твердый металл, который требует полировки и имеет высокую температуру плавления. Он также не имеет запаха и податлив. В больших количествах и в различных формах хром может быть токсичным и канцерогенным. Наиболее ярким примером токсичного хрома является шестивалентный хром (Cr (VI)). Заброшенные предприятия по производству хрома часто требуют экологической очистки.
Заброшенные предприятия по производству хрома часто требуют экологической очистки.
Хром отличается своими магнитными свойствами: это единственное твердое тело, которое демонстрирует антиферромагнитное упорядочение при комнатной температуре (и ниже). Выше 38 ° C переходит в парамагнитное состояние. Хром является членом переходных металлов в Группе 6. Хром имеет электронную конфигурацию 4s 1 3d 5 из-за более низкой энергии конфигурации с высоким спином.
Степени окисления хрома
Хром демонстрирует широкий диапазон возможных состояний окисления, где состояние +3 является наиболее стабильным с энергетической точки зрения.Состояния +3 и +6 чаще всего наблюдаются в соединениях хрома, тогда как состояния +1, +4 и +5 встречаются редко.
Cr
3+ Соединения Известно большое количество соединений хрома (III). Ион Cr 3+ имеет такой же радиус (63 мкм), что и ион Al 3+ (радиус 50 мкм), поэтому они могут заменять друг друга в некоторых соединениях, таких как хромовые квасцы и квасцы. Когда следовое количество Cr 3+ заменяет Al 3+ в корунде (оксид алюминия (Al 2 O 3 )), образуется рубин красного цвета.Ионы хрома (III) имеют тенденцию к образованию октаэдрических комплексов. Цвет этих комплексов определяется лигандами, прикрепленными к центру Cr.
Когда следовое количество Cr 3+ заменяет Al 3+ в корунде (оксид алюминия (Al 2 O 3 )), образуется рубин красного цвета.Ионы хрома (III) имеют тенденцию к образованию октаэдрических комплексов. Цвет этих комплексов определяется лигандами, прикрепленными к центру Cr.
Гидроксид хрома (III) (Cr (OH) 3 ) является амфотерным, растворяется в кислых растворах с образованием [Cr (H 2 O) 6 ] 3+ и в основных растворах с образованием [Cr ( OH) 6 ] 3−. Он дегидратируется путем нагревания с образованием зеленого оксида хрома (III) (Cr 2 O 3 ), который представляет собой стабильный оксид с кристаллической структурой, идентичной структуре корунда.{2 -} + {H} _ {2} O [/ latex]
Таким образом, по закону действия масс доминирующая разновидность определяется pH раствора. Изменение равновесия видно по изменению цвета от желтого (хромат) до оранжевого (дихромат), например, когда кислота добавляется к нейтральному раствору хромата калия. При еще более низких значениях pH возможна дальнейшая конденсация до более сложных оксианионов хрома. И хроматные, и дихроматные анионы являются сильными окисляющими реагентами при низком pH.
При еще более низких значениях pH возможна дальнейшая конденсация до более сложных оксианионов хрома. И хроматные, и дихроматные анионы являются сильными окисляющими реагентами при низком pH.
Другие состояния окисления хрома
Степень окисления +5 реализуется только в некоторых соединениях, но является промежуточным звеном во многих реакциях, включающих окисление хроматом. Единственным бинарным соединением является летучий фторид хрома (V) (CrF 5 ). Соединения хрома (IV) (в степени окисления +4) встречаются несколько чаще, чем соединения хрома (V). Тетрагалогениды CrF 4 , CrCl 4 и CrBr 4 могут быть получены путем обработки тригалогенидов (CrX 3 ) соответствующим галогеном при повышенных температурах.
Известно много соединений хрома (II), включая водостойкий хлорид хрома (II) (CrCl 2 ). Полученный ярко-синий раствор стабилен только при нейтральном pH. Большинство соединений хрома (I) получают окислением богатых электронами октаэдрических комплексов Cr. Как подтверждено дифракцией рентгеновских лучей, также была описана пятичастная связь Cr-Cr (длина 183,51 (4) мкм).
Большинство соединений хрома (I) получают окислением богатых электронами октаэдрических комплексов Cr. Как подтверждено дифракцией рентгеновских лучей, также была описана пятичастная связь Cr-Cr (длина 183,51 (4) мкм).
Boundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета.Этот конкретный ресурс использовал следующие источники:
хрома | Использование, свойства и факты
Хром (Cr) , химический элемент группы 6 (VIb) периодической таблицы, твердый металл серого стального цвета, который требует полировки и используется в сплавах для повышения прочности и коррозионной стойкости. Хром был открыт (1797) французским химиком Николя-Луи Вокленом и год спустя выделен как металл; он был назван в честь его разноцветных соединений.Зеленый цвет изумруда, змеевика и хромослюды, а также красный цвет рубина обусловлены небольшим количеством хрома. Название элемента хром (от греческого chrōmos , «цвет») ассоциируется с ярко выраженной и разнообразной окраской соединений хрома.
Свойства хрома.
Encyclopædia Britannica, Inc.Британская викторина
118 Названия и символы из таблицы Менделеева
Периодическая таблица Менделеева состоит из 118 элементов.Насколько хорошо вы знаете их символы? В этом тесте вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
| атомный номер | 24 |
|---|---|
| атомный вес | 51.9961 |
| точка плавления | 1890 ° C (3,434 ° F) |
| удельный вес | 7. 20 (28 ° C) 20 (28 ° C) |
| степени окисления | +2, +3, +6 |
| электронная конфигурация | [Ar] 3 d 5 4 s 1 |
Встречаемость, использование и свойства
Хром — элемент, который содержится в относительно большом количестве в земной коре; свободный металл никогда не встречается в природе. Большинство руд состоит из минерала хромита, идеальная формула которого — FeCr 2 O 4 . Он широко распространен в естественных отложениях, обычно загрязненных кислородом, магнием, алюминием и кремнеземом; содержание хрома в них колеблется от 42 до 56 процентов.Одно из основных применений хрома — это сплавы черных металлов, для которых чистый металл не требуется. Соответственно, хромит часто восстанавливают углеродом в печи, получая сплав феррохром, который содержит железо и хром в соотношении атомов приблизительно от 1 до 2.
Для получения чистого хрома сначала хромит обрабатывают расплавленной щелочью и кислородом, превращая весь хром превращается в хромат щелочного металла, последний растворяется в воде и в конечном итоге осаждается в виде дихромата натрия, Na 2 Cr 2 O 7 . Затем дихромат восстанавливается углеродом до полуторного оксида хрома, Cr 2 O 3 , и этот оксид, в свою очередь, восстанавливается алюминием с образованием металлического хрома.
Затем дихромат восстанавливается углеродом до полуторного оксида хрома, Cr 2 O 3 , и этот оксид, в свою очередь, восстанавливается алюминием с образованием металлического хрома.
Хром добавляют к железу и никелю в форме феррохрома для получения сплавов, которые отличаются высокой стойкостью к коррозии и окислению. Используется в небольших количествах, сталь упрочняет хром. Нержавеющие стали — это сплавы хрома и железа, в которых содержание хрома колеблется от 10 до 26 процентов.Хромовые сплавы используются для производства таких продуктов, как маслопроводы, отделка автомобилей и столовые приборы. Хромит используется в качестве огнеупора и как сырье для производства хромовых химикатов.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишись сейчас Металл белый, твердый, блестящий и хрупкий, чрезвычайно устойчив к обычным коррозионным реагентам; это сопротивление объясняет его широкое использование в качестве гальванического защитного покрытия. При повышенных температурах хром соединяется непосредственно с галогенами или с серой, кремнием, бором, азотом, углеродом или кислородом.(Для дополнительной обработки металлического хрома и его производства, см. обработка хрома.)
При повышенных температурах хром соединяется непосредственно с галогенами или с серой, кремнием, бором, азотом, углеродом или кислородом.(Для дополнительной обработки металлического хрома и его производства, см. обработка хрома.)
Природный хром состоит из смеси четырех стабильных изотопов: хрома-52 (83,76 процента), хрома-53 (9,55 процента), хрома-50. (4,31 процента) и хром-54 (2,38 процента). Металл парамагнитен (слабо притягивается к магниту). Он существует в двух формах: объемно-центрированной кубической (альфа) и гексагональной плотноупакованной (бета). При комнатной температуре хром медленно растворяется в соляной и разбавленной серной кислотах.Некоторые окислители образуют тонкий слой инертного оксида на металле, что делает его пассивным также для разбавленных минеральных кислот, таких как серная, азотная или холодная царская водка. При обычных температурах металл не реагирует ни на морскую воду, ни на влажный или сухой воздух.
Крупнейшие производители хрома включают Южную Африку, Индию, Казахстан и Турцию.
Основные соединения
Наиболее распространенные степени окисления хрома — +6, +3 и +2. Однако известно несколько стабильных соединений состояний +5, +4 и +1.
В степени окисления +6 наиболее важными частицами, образованными хромом, являются хромат CrO 4 2− и дихромат Cr 2 O 7 2− ионы. Эти ионы составляют основу ряда промышленно важных солей. Среди них хромат натрия, Na 2 CrO 4 и дихромат натрия, Na 2 Cr 2 O 7 , которые используются при дублении кожи, обработке поверхности металлов и в качестве катализаторов в различных промышленных предприятиях. процессы.
Хром образует несколько коммерчески ценных кислородных соединений, наиболее важным из которых является оксид хрома, обычно называемый триоксидом хрома или хромовой кислотой, CrO 3 , в котором хром находится в степени окисления +6. Оранжево-красное кристаллическое вещество хромовая кислота постепенно разжижается при воздействии влажного воздуха. Обычно его получают обработкой бихромата натрия серной кислотой. Хромовая кислота используется в основном для хромирования, но также используется в качестве красителя в керамике.Это мощный окислитель, который может бурно реагировать с некоторыми органическими материалами, но такие растворы часто используются для контролируемого окисления в органическом синтезе.
Обычно его получают обработкой бихромата натрия серной кислотой. Хромовая кислота используется в основном для хромирования, но также используется в качестве красителя в керамике.Это мощный окислитель, который может бурно реагировать с некоторыми органическими материалами, но такие растворы часто используются для контролируемого окисления в органическом синтезе.
Другим важным кислородным соединением является оксид хрома, также известный как полуторный оксид хрома или оксид хрома, Cr 2 O 3 , в котором хром находится в степени окисления +3. Его получают прокаливанием бихромата натрия в присутствии углерода или серы. Оксид хрома представляет собой зеленый порошок и широко используется в качестве пигмента; его гидратная форма, известная как зеленый цвет Гинье, используется, когда требуется химическая и термостойкость.
Эрик ГрегерсенУзнайте больше в этих связанных статьях Britannica:
обработка хрома
Обработка хрома , подготовка руды для использования в различных продуктах.
 Хром (Cr) — блестящий твердый тугоплавкий металл, плавящийся при 1857 ° C (3375 ° F) и кипящий при 2672 ° C (4842 ° F).В чистом виде он устойчив к обычной коррозии, что позволяет применять его в качестве гальванического защитного…
Хром (Cr) — блестящий твердый тугоплавкий металл, плавящийся при 1857 ° C (3375 ° F) и кипящий при 2672 ° C (4842 ° F).В чистом виде он устойчив к обычной коррозии, что позволяет применять его в качестве гальванического защитного…Азия: ферросплавы
азиатских стран с запасами хрома включают Турцию, Филиппины, Индию, Иран и Пакистан; Запасы также находятся на северо-западе Казахстана.Марганец находится в изобилии, с большими запасами в Закавказье, Средней Азии, Сибири и Индии; Китайские резервы также значительны. Южный Китай имеет исключительно большие месторождения вольфрама. Вольфрам…
Южная Африка: ресурсы и энергия
… крупнейший производитель платины и хрома, которые добываются в таких центрах, как Рюстенбург и Стилпорт на северо-востоке, и становятся все более значимыми с экономической точки зрения.
 Обширные месторождения минералов платиновой группы и хрома расположены в основном к северу от Претории. Провинция Северный Кейп содержит большинство крупных месторождений…
Обширные месторождения минералов платиновой группы и хрома расположены в основном к северу от Претории. Провинция Северный Кейп содержит большинство крупных месторождений…
Степени окисления переходных металлов
Степень окисления элемента связана с количеством электронов, которые атом теряет, получает или использует при соединении с другим атомом в соединениях. Он также определяет способность атома окислять (терять электроны) или восстанавливать (приобретать электроны) другие атомы или частицы.Почти все переходные металлы имеют несколько потенциальных степеней окисления.
Введение
Окисление приводит к увеличению степени окисления. Восстановление приводит к снижению степени окисления. Если атом восстановлен, он имеет большее количество электронов валентной оболочки и, следовательно, более высокую степень окисления, и является сильным окислителем. Например, кислород (O) и фтор (F) — очень сильные окислители. С другой стороны, литий (Li) и натрий (Na) — невероятно сильные восстановители (любят окисляться), а это означает, что они легко теряют электроны.В этом модуле мы подробно рассмотрим степени окисления переходных металлов.
С другой стороны, литий (Li) и натрий (Na) — невероятно сильные восстановители (любят окисляться), а это означает, что они легко теряют электроны.В этом модуле мы подробно рассмотрим степени окисления переходных металлов.
Неспаренные электроны d-орбиталей
Чтобы полностью понять явления состояний окисления переходных металлов, мы должны понять, как связаны неспаренные d-орбитальные электроны. В многообразии d подоболочки пять орбиталей. По мере увеличения числа неспаренных валентных электронов d-орбиталь увеличивается, наивысшая степень окисления увеличивается. Это связано с тем, что неспаренные валентные электроны нестабильны и стремятся связываться с другими химическими соединениями.Это означает, что степени окисления будут наивысшими в самой середине периодов переходных металлов из-за наличия наибольшего количества неспаренных валентных электронов. Чтобы определить степень окисления, неспаренные d-орбитальные электроны добавляются к 2s-орбитальным электронам, поскольку 3d-орбиталь расположена перед 4s-орбиталью в периодической таблице.
Например: у скандия один неспаренный электрон на d-орбитали. Он добавлен к 2 электронам s-орбитали и, следовательно, степень окисления +3.Математически это будет выглядеть так: 1 электрон + 1 электрон + 1 электрон = 3 всего электрона = степень окисления +3. Формула для определения степеней окисления будет ( за исключением меди и хрома ):
Наивысшее состояние окисления переходного металла = количество неспаренных d-электронов + два s-орбитальных электрона
Число d-электронов варьируется от 1 (в Sc) до 10 (в Cu и Zn). См. Периодическую таблицу ниже:
На изображении выше область в синей рамке — это блок d, также известный как переходные металлы.
Скандий — один из двух элементов в первом периоде переходного металла, который имеет только одну степень окисления (цинк — другой, со степенью окисления +2). Все остальные элементы имеют по крайней мере две разные степени окисления.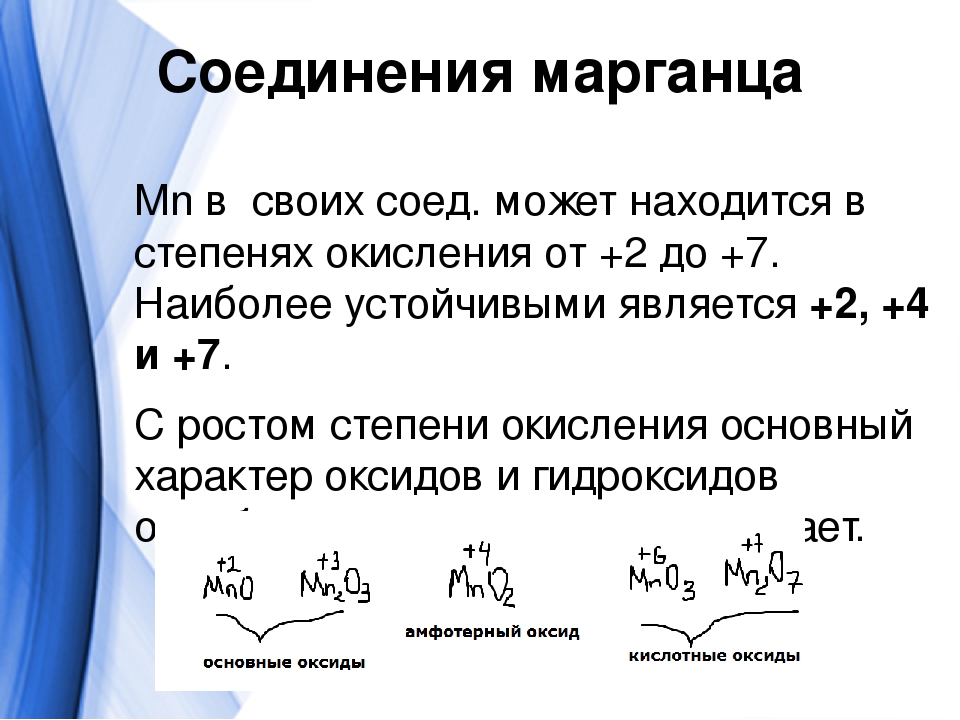 Марганец, который находится в середине периода, имеет наибольшее количество степеней окисления и, действительно, самую высокую степень окисления за весь период, поскольку он имеет пять неспаренных электронов (см. Таблицу ниже).
Марганец, который находится в середине периода, имеет наибольшее количество степеней окисления и, действительно, самую высокую степень окисления за весь период, поскольку он имеет пять неспаренных электронов (см. Таблицу ниже).
Ранее упоминалось, что и медь, и хром не подчиняются общей формуле для степеней окисления переходных металлов.Это связано с тем, что медь имеет 9 d-электронов, которые производят 4 парных d-электрона и 1 неспаренный d-электрон. Поскольку у меди всего на 1 электрон меньше полной d-орбитали, она крадет электрон с s-орбитали, позволяя иметь 10 d-электронов. Точно так же хром имеет 4 d-электрона, и только 1 не имеет полузаполненной d-орбитали, поэтому он крадет электрон с s-орбитали, позволяя хрому иметь 5 d-электронов.
Правила, касающиеся переходных металлов
- Свободные элементы (элементы, которые не объединены с другими элементами) имеют нулевую степень окисления, т.е.г., степень окисления Cr (хрома) составляет 0.
- Для ионов степень окисления равна заряду иона, например, ион Fe 3 + (ион трехвалентного железа) имеет степень окисления +3.

- Степень окисления нейтрального соединения равна нулю, например, какова степень окисления Fe в FeCl 3 ?
- Ответ: Cl имеет степень окисления -1. Поскольку имеется 3 атома Cl, отрицательный заряд равен -3. Поскольку у FeCl3 нет общего заряда, соединение имеет нейтральный заряд, и, следовательно, степень окисления Fe +3.
Другими словами, это: Fe 3 + и 3Cl — , что составляет FeCl 3 с нейтральным зарядом.
Состояния множественного окисления
Как указано выше, большинство переходных металлов имеют несколько степеней окисления, так как переходные металлы относительно легко теряют электрон (ы) по сравнению с щелочными металлами и щелочноземельными металлами. Щелочные металлы имеют один электрон на своей валентной s-орбитали, и поэтому их степень окисления почти всегда равна +1 (из-за его потери), а у щелочноземельных металлов есть два электрона на своей валентной орбитали, в результате чего степень окисления +2 (из-за потери обе). Это не относится к переходным металлам, поскольку переходные металлы имеют 5 d-орбиталей. D-орбиталь имеет множество степеней окисления. S-орбиталь также способствует определению степени окисления.
Это не относится к переходным металлам, поскольку переходные металлы имеют 5 d-орбиталей. D-орбиталь имеет множество степеней окисления. S-орбиталь также способствует определению степени окисления.
Пример \ (\ PageIndex {1} \)
Железо имеет 4 неспаренных электрона и 2 спаренных электрона. Чтобы найти одну из его степеней окисления, мы можем использовать формулу:
Степень окисления Fe = 4 + 2 = +6
Действительно, +6 — одна из степеней окисления железа, но встречается очень редко.Другие возможные степени окисления железа включают: +5, +4, +3 и +2.
Поскольку есть много исключений из формулы, было бы лучше просто запомнить степени окисления для переходных металлов четвертого периода, поскольку они используются чаще. Вот диаграмма, которая показывает наиболее распространенные степени окисления переходных металлов первого ряда. См. Таблицу в этом модуле для получения дополнительной информации о наиболее распространенных степенях окисления.
Исключения для хрома и меди
Хром и медь имеют 4s 1 вместо 4s 2 .Это связано с тем, что у хрома на 1 d-электрон меньше, чем у полузаполненной d-орбитали, поэтому он берет единицу с s-орбитали, поэтому электронная конфигурация для хрома будет просто такой: [Ar] 4s 1 3d 5 . Точно так же для меди это сокращение на 1 d-электрон для наличия полностью заполненной d-орбитали и берет один из s-орбитали, поэтому конфигурация электронов для меди будет просто: [Ar] 4s 1 3d 10 .
Чтобы помнить о стабильности более высоких степеней окисления переходных металлов, важно знать тенденцию: стабильность более высоких степеней окисления постепенно увеличивается вниз по группе.Например, в группе 6 (хром) Cr наиболее стабилен в степени окисления +3, а это означает, что вы не найдете много стабильных форм Cr в степенях окисления +4 и +5. Напротив, существует много стабильных форм молибдена (Mo) и вольфрама (W) в степенях окисления +4 и +5.
Состояние окисления переходных металлов в соединениях
Когда дано ионное соединение, такое как AgCl, вы можете легко определить степень окисления переходного металла. В этом случае вас попросят определить степень окисления серебра (Ag).Поскольку мы знаем, что хлор (Cl) находится в группе галогенов периодической таблицы, мы знаем, что он имеет заряд -1, или просто Cl —. Кроме того, увидев, что общий заряд AgCl отсутствует (который определяется, глядя в правый верхний угол соединения, т. Е. AgCl # , где # представляет общий заряд соединения), мы можем заключить, что серебро (Ag) имеет степень окисления +1. Это дает нам Ag + и Cl —, в которых положительный и отрицательный заряд компенсируют друг друга, в результате чего получается общий нейтральный заряд; поэтому +1 подтверждается как степень окисления серебра (Ag).
Пример \ (\ PageIndex {2} \)
Определите степень окисления кобальта (Co) в CoBr 2 .
Решение
Подобно хлору, бром (Br) также входит в группу галогенов, поэтому мы знаем, что он имеет заряд -1 (Br — ). Поскольку есть два брома, анион (бром) дает нам заряд -2. Кроме того, мы знаем, что CoBr 2 имеет общий нейтральный заряд, поэтому мы можем сделать вывод, что катион (кобальт) Co должен иметь степень окисления +2, чтобы нейтрализовать заряд -2 от двух бромов.С учетом сказанного мы получаем Co 2 + и 2Br —, в результате чего получаем CoBr 2 .
Пример \ (\ PageIndex {3} \)
Какова степень окисления цинка (Zn) в ZnCO 3 . (Примечание: CO 3 в этом примере имеет степень окисления -2, CO 3 2 — )
Решение
Зная, что CO 3 имеет степень окисления -2, и зная, что общий заряд этого соединения нейтрален, мы можем заключить, что цинк (Zn) имеет степень окисления +2. — \).
— \).
Этот пример также показывает, что атомы марганца могут иметь степень окисления +7, которая является наивысшей возможной степенью окисления для переходных металлов четвертого периода.
Примеры из реального мира
Магниты используются в электродвигателях и генераторах, которые позволяют нам иметь компьютеры, свет, телефоны, телевизоры и электрическое отопление. Магнетизм — это химическая функция, относящаяся к степени окисления. Степень окисления определяет, является ли элемент или соединение диамагнитным или парамагнитным.Диамагнитные вещества имеют только парные электроны и слабо отталкивают магнитные поля. Эти вещества немагнитны, например дерево, вода и некоторые пластмассы. Однако парамагнитные вещества становятся магнитными в присутствии магнитного поля. Парамагнитные вещества имеют как минимум один неспаренный электрон. Другая более сильная магнитная сила — это постоянный магнит, называемый ферромагнетиком. Они намного прочнее и не требуют наличия магнитного поля для отображения магнитных свойств. Такие магниты можно найти в вашем холодильнике.
Такие магниты можно найти в вашем холодильнике.
Внешние ссылки
- Периодическая таблица: commons.wikimedia.org/wiki/File:Periodic_table.svg
- Ионные соединения: lac.smccme.edu/New%20PDF%20No…/Ionrules2.pdf (страница 6 полезна)
- Список неорганических соединений: en.Wikipedia.org/wiki/List_of_inorganic_compounds
- ru.Wikipedia.org/wiki/Manganate
- http://www.chemicalelements.com/groups/transition.html
- http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch22/trans.php
- ru.Wikipedia.org/wiki/Metal_Oxidation_States#Variable_oxidation_states
- Муньос-Паес, Адела. «Оксиды переходных металлов: геометрические и электронные структуры: введение в темы твердого тела в курсах неорганической химии». J. Chem. Образование.1994, 71, 381.
Список литературы
- Петруччи, Ральф Х., Уильям С. Харвуд и Ф. Г. Херринг. Общая химия: принципы и современные приложения.
 8-е изд. Нью-Джерси: Пирсон / Прентис Холл, 2002. Печать.
8-е изд. Нью-Джерси: Пирсон / Прентис Холл, 2002. Печать. - Петруччи, Ральф Х., Уильям С. Харвуд, Ф. Г. Херринг и Джеффри Д. Мадура. Общие принципы химии и современные приложения. 9 изд. Верхняя Сэдл Ривер, Нью-Джерси: Пирсон / Прентис Холл, 2007. Печать.
- Clentsmith, G. K., F. G. Cloke, et al. (2003). «Стабилизация комплексов ранних переходных металлов с низкой степенью окисления, несущих 1,2,4-трифосфациклопентадиенильные лиганды: структура [Sc (P3C2tBu2) 2] 2; Sc (II) или смешанная степень окисления?» Angew Chem Int Ed Engl 42 (9): 1038-41
Проблемы
Определите степень окисления переходных металлов в этих нейтральных соединениях.Примечание: переходный металл подчеркнут в следующих соединениях.
| (A) Медь (I) Хлорид: Cu Cl | (B) Медь (II) Нитрат: Cu (NO 3 ) 2 | (C) Золото (V) Фторид: Au F 5 |
| (D) Железо (II) Оксид: Fe O | (E) Железо (III) Оксид: Fe 2 O 3 | (F) Свинец (II) Хлорид: Pb Cl 2 |
| (G) Свинец (II) Нитрат: Pb (NO 3 ) 2 | (H) Марганец (II) Хлорид: Mn Cl 2 | (I) Триоксид молибдена : Mo O 3 |
| (J) Никель (II) Гидроксид: Ni (OH) 2 | (K) Платина (IV) Хлорид: Pt Cl 4 | (L) Серебро Сульфид: Ag 2 S |
| (M) Вольфрам (VI) Фторид: W F 6 | (N) Ванадий (III) Нитрид: V N | (O) Цирконий Гидроксид: Zr (OH) 4 |
- Определите степень окисления переходного металла для общего ненейтрального соединения: манганат ( Mn O 4 2 — )
- Почему переходные металлы имеют большее количество степеней окисления, чем металлы основной группы (т.
 е.е. щелочные металлы и щелочноземельные металлы)?
е.е. щелочные металлы и щелочноземельные металлы)? - Какой переходный металл имеет наибольшее количество степеней окисления?
- Почему количество степеней окисления переходных металлов увеличивается в середине группы?
- Какие два переходных металла имеют только одну степень окисления?
Решения
См. Вложение файла для решений. (Для открытия файла PDF вам, вероятно, понадобится Adobe Reader.)
Авторы и авторство
- Джослин Вуд, Лиза Чу (UCD)
элемент со стабильной степенью окисления 3
Степень окисления или степень окисления атома — это заряд, который существовал бы на атоме, если бы связь была полностью ионной.Mn демонстрирует высокую степень окисления… Самый долгоживущий из них, криптон-81, имеет период полураспада 229 000 лет. Роскошные апартаменты в аптауне. Актиноиды также демонстрируют стабильную степень окисления +3, но показывают несколько степеней окисления, то есть электронная конфигурация актиния составляет 6 дней 1 7 секунд 2. Концептуально степень окисления, которая может быть положительной, отрицательной или нулевой, является гипотетическим зарядом, который атом будет иметь, если все будут связываться с атомами разных элементов … Пример: Фосфор (группа 15 по современной терминологии; группа V по старой терминологии) .(Я думаю, это может быть единственный случай, когда кислород имеет положительную степень окисления). Азот может образовывать различные оксиды со степенями окисления +2, +4 и очень нестабильными +6. Элементы классифицируются по семействам, потому что три основные категории элементов (металлы, неметаллы и полуметаллы) очень широки. Пытаюсь объяснить тенденции в степенях окисления. Ответ: Объяснение: В актиноидах орбитали 5f, 6d и 7s имеют сопоставимые энергии, и электроны с этих орбиталей могут… Все элементы в группе имеют внешнюю электронную структуру ns 2 np x 1 np y 1, где n изменяется от От 2 (для углерода) до 6 (для… Неклассифицированный Йод — это химический элемент с символом I и атомным номером 53.
Концептуально степень окисления, которая может быть положительной, отрицательной или нулевой, является гипотетическим зарядом, который атом будет иметь, если все будут связываться с атомами разных элементов … Пример: Фосфор (группа 15 по современной терминологии; группа V по старой терминологии) .(Я думаю, это может быть единственный случай, когда кислород имеет положительную степень окисления). Азот может образовывать различные оксиды со степенями окисления +2, +4 и очень нестабильными +6. Элементы классифицируются по семействам, потому что три основные категории элементов (металлы, неметаллы и полуметаллы) очень широки. Пытаюсь объяснить тенденции в степенях окисления. Ответ: Объяснение: В актиноидах орбитали 5f, 6d и 7s имеют сопоставимые энергии, и электроны с этих орбиталей могут… Все элементы в группе имеют внешнюю электронную структуру ns 2 np x 1 np y 1, где n изменяется от От 2 (для углерода) до 6 (для… Неклассифицированный Йод — это химический элемент с символом I и атомным номером 53. Алгебраическая сумма степеней окисления элементов… Если вы имеете в виду «степень окисления +2 стабильна для элементов щелочных металлов», то это утверждение неверно. В случае галогенидов марганец не проявляет степени окисления +7, однако известен MnO 3 F. Известно, что Cu +2 (водн. 2 больше, чем Cu +, что компенсирует вторую энтальпию ионизации Cu. 64. 7.9K просмотров Посмотреть 10 сторонников Обобщение, что металлы группы 1 всегда имеют степень окисления… Максимальная степень окисления: $ \ mathrm {+ V} $.3) S8 — элементарная форма серы. Из шести известных халькогенов один (кислород) имеет атомный номер, равный ядерному магическому числу, что означает, что их атомные ядра имеют тенденцию иметь повышенную устойчивость к радиоактивному распаду. Если ион кислорода имеет степень окисления 2, определите степень окисления серы в этом многоатомном ионе. Таким образом, все атомы в O 2, O 3, P 4, S 8 и металлическом алюминии имеют степень окисления 0. Вещества, которые проводят электрический ток только при определенных условиях, скорее всего, будут _____.
Алгебраическая сумма степеней окисления элементов… Если вы имеете в виду «степень окисления +2 стабильна для элементов щелочных металлов», то это утверждение неверно. В случае галогенидов марганец не проявляет степени окисления +7, однако известен MnO 3 F. Известно, что Cu +2 (водн. 2 больше, чем Cu +, что компенсирует вторую энтальпию ионизации Cu. 64. 7.9K просмотров Посмотреть 10 сторонников Обобщение, что металлы группы 1 всегда имеют степень окисления… Максимальная степень окисления: $ \ mathrm {+ V} $.3) S8 — элементарная форма серы. Из шести известных халькогенов один (кислород) имеет атомный номер, равный ядерному магическому числу, что означает, что их атомные ядра имеют тенденцию иметь повышенную устойчивость к радиоактивному распаду. Если ион кислорода имеет степень окисления 2, определите степень окисления серы в этом многоатомном ионе. Таким образом, все атомы в O 2, O 3, P 4, S 8 и металлическом алюминии имеют степень окисления 0. Вещества, которые проводят электрический ток только при определенных условиях, скорее всего, будут _____. Все являются актиноидами, и электронная конфигурация A c такова, что он показывает только степень окисления +3. Энергия, необходимая для удаления еще одного электрона из Sc (+1), очень высока, поэтому очень трудно сформировать степень окисления +2. Примечание: мне указали, что есть несколько малоизвестных соединений элементов натрия с цезием, где металл образует отрицательный ион, например Na-. Это дает степень окисления -1. А. Степень окисления несоединенного элемента равна нулю. $ \ endgroup $ — â € Соединения Следовательно, степень окисления 3+ довольно обычна для скандия.Ион железа Fe 3+, например, имеет степень окисления +3, потому что он может приобретать три электрона для образования химической связи, в то время как ион кислорода O 2â имеет степень окисления -2, потому что он может отдавать два электрона. Обоснуйте. Он определяется как заряд, который имел бы атом, если бы все связи были ионными. После того, как он хранился несколько дней, криптон, полученный путем ядерного деления, содержит только один радиоактивный изотоп, криптон-85, с периодом полураспада 10,8 года, потому что все другие радиоактивные изотопы имеют период полураспада 3 часа или меньше.
Все являются актиноидами, и электронная конфигурация A c такова, что он показывает только степень окисления +3. Энергия, необходимая для удаления еще одного электрона из Sc (+1), очень высока, поэтому очень трудно сформировать степень окисления +2. Примечание: мне указали, что есть несколько малоизвестных соединений элементов натрия с цезием, где металл образует отрицательный ион, например Na-. Это дает степень окисления -1. А. Степень окисления несоединенного элемента равна нулю. $ \ endgroup $ — â € Соединения Следовательно, степень окисления 3+ довольно обычна для скандия.Ион железа Fe 3+, например, имеет степень окисления +3, потому что он может приобретать три электрона для образования химической связи, в то время как ион кислорода O 2â имеет степень окисления -2, потому что он может отдавать два электрона. Обоснуйте. Он определяется как заряд, который имел бы атом, если бы все связи были ионными. После того, как он хранился несколько дней, криптон, полученный путем ядерного деления, содержит только один радиоактивный изотоп, криптон-85, с периодом полураспада 10,8 года, потому что все другие радиоактивные изотопы имеют период полураспада 3 часа или меньше. Это применимо независимо от структуры элемента: Xe, Cl 2, S 8 и большие структуры углерода или кремния, каждая из которых имеет нулевую степень окисления. 2) OF2 — Фтор является наиболее электроотрицательным элементом и ВСЕГДА составляет -1 в соединении. Йод смешивают с пищевой солью, чтобы получить мягкую кристаллическую соль. Изотопы. 17 C. 2 … Те с отрицательной степенью окисления C. Первым элементом всегда является металл D. Первый элемент… Несвязанные элементы имеют степень окисления 0. [Delhi 2012] Ответ / Пояснение.[1] У этого действительно есть общая квантовая химия â € ¦ $ \ endgroup $ â € “bobthechemist 27 сен 2013 в 20:04 $ \ begingroup $ @bobthechemist нет, я имею в виду, что степени окисления +1 и +2 стабильны для щелочных и щелочноземельных металлов соответственно. С другой стороны, галогены имеют степень окисления -1. … Свинец имеет наивысший атомный номер среди всех стабильных элементов и завершает три основные цепочки распада более тяжелых элементов… Характеристики элементов этих семейств определяются в первую очередь количеством электронов в… Элементах серии 3d-переходов.
Это применимо независимо от структуры элемента: Xe, Cl 2, S 8 и большие структуры углерода или кремния, каждая из которых имеет нулевую степень окисления. 2) OF2 — Фтор является наиболее электроотрицательным элементом и ВСЕГДА составляет -1 в соединении. Йод смешивают с пищевой солью, чтобы получить мягкую кристаллическую соль. Изотопы. 17 C. 2 … Те с отрицательной степенью окисления C. Первым элементом всегда является металл D. Первый элемент… Несвязанные элементы имеют степень окисления 0. [Delhi 2012] Ответ / Пояснение.[1] У этого действительно есть общая квантовая химия â € ¦ $ \ endgroup $ â € “bobthechemist 27 сен 2013 в 20:04 $ \ begingroup $ @bobthechemist нет, я имею в виду, что степени окисления +1 и +2 стабильны для щелочных и щелочноземельных металлов соответственно. С другой стороны, галогены имеют степень окисления -1. … Свинец имеет наивысший атомный номер среди всех стабильных элементов и завершает три основные цепочки распада более тяжелых элементов… Характеристики элементов этих семейств определяются в первую очередь количеством электронов в… Элементах серии 3d-переходов. представлены как: Sc Ti V Cr Mn Fe Co Ni Cu Zn.Молекулярная масса гидроксида магния (Mg (OH) 2) составляет 58,32 а.е.м., а атомная масса… CuCl2 более стабильна, потому что Cu2 + имеет более высокую электронную плотность, чем Cu +. Другие состояния окисления для элементов группы 15. Нежелание «n S» электронов принимать участие в… Литий — это химический элемент с атомным номером 3, что означает, что в них 3 протона и 3 электрона … оба элемента имеют только одну нормальную степень окисления ( +2), а ионы Zn2 + и Mg2 + имеют близкие размеры. Это сделало бы кислород в этом +2.Минимальная степень окисления $ \ mathrm {-III} $. Электронная конфигурация переходного элемента X в степени окисления +3 — [Ar] 3d5. iii) Какие элементы показывают только степень окисления +3? Атомы одного и того же элемента с разным количеством нейтронов. Основные принципы определения степени окисления. К элементам основной группы относятся активные металлы в двух столбцах в крайнем левом углу периодической таблицы, а также металлы, полуметаллы и неметаллы в шести столбцах на… Ответьте на следующие вопросы: i) Напишите элемент, который показывает максимальное число степеней окисления.
представлены как: Sc Ti V Cr Mn Fe Co Ni Cu Zn.Молекулярная масса гидроксида магния (Mg (OH) 2) составляет 58,32 а.е.м., а атомная масса… CuCl2 более стабильна, потому что Cu2 + имеет более высокую электронную плотность, чем Cu +. Другие состояния окисления для элементов группы 15. Нежелание «n S» электронов принимать участие в… Литий — это химический элемент с атомным номером 3, что означает, что в них 3 протона и 3 электрона … оба элемента имеют только одну нормальную степень окисления ( +2), а ионы Zn2 + и Mg2 + имеют близкие размеры. Это сделало бы кислород в этом +2.Минимальная степень окисления $ \ mathrm {-III} $. Электронная конфигурация переходного элемента X в степени окисления +3 — [Ar] 3d5. iii) Какие элементы показывают только степень окисления +3? Атомы одного и того же элемента с разным количеством нейтронов. Основные принципы определения степени окисления. К элементам основной группы относятся активные металлы в двух столбцах в крайнем левом углу периодической таблицы, а также металлы, полуметаллы и неметаллы в шести столбцах на… Ответьте на следующие вопросы: i) Напишите элемент, который показывает максимальное число степеней окисления. Обоснуйте. Ключ для изотопов КВАРТИРЫ НА ПЛОЩАДИ; О; Характеристики; Стоянка; Жители. Многие элементы в таблице Менделеева просты. Вы можете игнорировать их, если занимаетесь химией на уровне A или его эквиваленте. Какой у него атомный номер? В p-блочных элементах наблюдается, что элементы демонстрируют две степени окисления, которые отличаются друг от друга на 2. Это связано с эффектом инертной пары. (ii) Лантаноиды показывают ограниченное количество степеней окисления, а именно. Элементы серии переходов 3d представлены как: Sc Ti V Cr Mn Fe Co Ni Cu Zn.iii) Какие элементы показывают только степень окисления +3? Например, элементы группы 1, также называемые щелочными металлами, имеют степень окисления +1. Правила определения степени окисления. Например, обычное железо имеет степень окисления +2 или +3. Стабильность степеней окисления. Когда дело доходит до атома водорода, он имеет только один электрон в своей нулевой конфигурации и может либо получить, либо потерять электрон. У серы четыре стабильных изотопа, 20 радиоактивных и один изомер.
Обоснуйте. Ключ для изотопов КВАРТИРЫ НА ПЛОЩАДИ; О; Характеристики; Стоянка; Жители. Многие элементы в таблице Менделеева просты. Вы можете игнорировать их, если занимаетесь химией на уровне A или его эквиваленте. Какой у него атомный номер? В p-блочных элементах наблюдается, что элементы демонстрируют две степени окисления, которые отличаются друг от друга на 2. Это связано с эффектом инертной пары. (ii) Лантаноиды показывают ограниченное количество степеней окисления, а именно. Элементы серии переходов 3d представлены как: Sc Ti V Cr Mn Fe Co Ni Cu Zn.iii) Какие элементы показывают только степень окисления +3? Например, элементы группы 1, также называемые щелочными металлами, имеют степень окисления +1. Правила определения степени окисления. Например, обычное железо имеет степень окисления +2 или +3. Стабильность степеней окисления. Когда дело доходит до атома водорода, он имеет только один электрон в своей нулевой конфигурации и может либо получить, либо потерять электрон. У серы четыре стабильных изотопа, 20 радиоактивных и один изомер. Степень окисления элемента в свободном (несвязанном) состоянии равна нулю, поскольку… Водород имеет степень окисления +1 в сочетании с неметаллами, но имеет степень окисления -1 в сочетании с металлами. .Сера должна давать +6. ii) Какой элемент имеет наибольшую m.p? Элементы в периодической таблице часто делятся на четыре категории: (1) элементы основной группы, (2) переходные металлы, (3) лантаноиды и (4) актиниды. Максимальная степень окисления любого элемента не может превышать его номер группы, единственное отклонение наблюдается для элементов группы I – B (Cu, Ag, Au). При окислении (когда атом теряет электроны) атом теряет первые электроны 4S (имеющий высокое квантовое число), за которым следуют электроны 3d (более низкое квантовое число), чтобы дать различное окисление â € ¦; Сумма степеней окисления всех атомов или ионов в нейтральном… Из 37 изотопов йода он имеет только один стабильный… Более высокие степени окисления показаны хромом, марганцем и кобальтом…. Каков номер группы элементов, имеющих стабильное количество электронов на внешнем энергетическом уровне? Лантаноиды образуют в основном +3 ионы, в то время как актиноиды обычно имеют более высокую степень окисления в своих соединениях, типичными являются +4 или даже +6.
Степень окисления элемента в свободном (несвязанном) состоянии равна нулю, поскольку… Водород имеет степень окисления +1 в сочетании с неметаллами, но имеет степень окисления -1 в сочетании с металлами. .Сера должна давать +6. ii) Какой элемент имеет наибольшую m.p? Элементы в периодической таблице часто делятся на четыре категории: (1) элементы основной группы, (2) переходные металлы, (3) лантаноиды и (4) актиниды. Максимальная степень окисления любого элемента не может превышать его номер группы, единственное отклонение наблюдается для элементов группы I – B (Cu, Ag, Au). При окислении (когда атом теряет электроны) атом теряет первые электроны 4S (имеющий высокое квантовое число), за которым следуют электроны 3d (более низкое квантовое число), чтобы дать различное окисление â € ¦; Сумма степеней окисления всех атомов или ионов в нейтральном… Из 37 изотопов йода он имеет только один стабильный… Более высокие степени окисления показаны хромом, марганцем и кобальтом…. Каков номер группы элементов, имеющих стабильное количество электронов на внешнем энергетическом уровне? Лантаноиды образуют в основном +3 ионы, в то время как актиноиды обычно имеют более высокую степень окисления в своих соединениях, типичными являются +4 или даже +6. Степень окисления отрицательная, так как они получили 2 электрона, а не потеряли электроны. ii) Какой элемент имеет наибольшую m.p? С ионом хлора (атом хлора, который приобрел один электрон, Cl -), степень окисления будет — 1.Сумма степеней окисления в соединении или ионе должна равняться общему заряду. Элемент может иметь только одну или несколько степеней окисления в зависимости от стабильности образованного соединения. Все элементы имеют степень окисления 0. Кислород имеет три стабильных изотопа и 14 нестабильных изотопов. Эта степень окисления является показателем степени окисления (потери электронов) атома в химическом соединении. Степени окисления элементов очень сильно зависят от электронной конфигурации элементов, а также от их электроотрицательности.Электроотрицательность — это способность элемента притягивать к себе электроны. (i) 25 (ii) 26 (iii) 27 … оба имеют одинаковое количество электронов. 18 B. Фосфор в фосфорной кислоте имеет степень окисления +1, а в гипофосфорной кислоте — степень окисления +4.
Степень окисления отрицательная, так как они получили 2 электрона, а не потеряли электроны. ii) Какой элемент имеет наибольшую m.p? С ионом хлора (атом хлора, который приобрел один электрон, Cl -), степень окисления будет — 1.Сумма степеней окисления в соединении или ионе должна равняться общему заряду. Элемент может иметь только одну или несколько степеней окисления в зависимости от стабильности образованного соединения. Все элементы имеют степень окисления 0. Кислород имеет три стабильных изотопа и 14 нестабильных изотопов. Эта степень окисления является показателем степени окисления (потери электронов) атома в химическом соединении. Степени окисления элементов очень сильно зависят от электронной конфигурации элементов, а также от их электроотрицательности.Электроотрицательность — это способность элемента притягивать к себе электроны. (i) 25 (ii) 26 (iii) 27 … оба имеют одинаковое количество электронов. 18 B. Фосфор в фосфорной кислоте имеет степень окисления +1, а в гипофосфорной кислоте — степень окисления +4. Квартиры на Карпентер. +2, +3 и +4 (из которых +3 является наиболее распространенным) из-за большой энергетической щели между 4f и 5d подоболочками. У него есть только 3 электрона, которые можно потерять. Они имеют степень окисления +2 и +3 соответственно.iv) какой элемент является сильным окислителем в +3 окислении… И снова свинец восстанавливается из состояния +4 в более стабильное состояние +2. Ответьте на следующие вопросы: i) Напишите элемент, который показывает максимальное количество степеней окисления. Укажите причину. Кислород почти всегда имеет степень окисления -2, за исключением пероксидов (H 2 O 2), где она равна -1, и соединений с фтором (OF 2), где она равна +2. Сурьма может образовывать соединения со степенью окисления +2. Например, железо Fe и кальций Ca имеют степень окисления ноль, потому что они состоят из одного элемента, который не связан химически с другими, как и многоатомные молекулы с одним и тем же типом атома, например, для озона O — окисление состояние также будет 0.
Квартиры на Карпентер. +2, +3 и +4 (из которых +3 является наиболее распространенным) из-за большой энергетической щели между 4f и 5d подоболочками. У него есть только 3 электрона, которые можно потерять. Они имеют степень окисления +2 и +3 соответственно.iv) какой элемент является сильным окислителем в +3 окислении… И снова свинец восстанавливается из состояния +4 в более стабильное состояние +2. Ответьте на следующие вопросы: i) Напишите элемент, который показывает максимальное количество степеней окисления. Укажите причину. Кислород почти всегда имеет степень окисления -2, за исключением пероксидов (H 2 O 2), где она равна -1, и соединений с фтором (OF 2), где она равна +2. Сурьма может образовывать соединения со степенью окисления +2. Например, железо Fe и кальций Ca имеют степень окисления ноль, потому что они состоят из одного элемента, который не связан химически с другими, как и многоатомные молекулы с одним и тем же типом атома, например, для озона O — окисление состояние также будет 0. Семейство элементов — это набор элементов, имеющих общие свойства. Переходный металл X образует оксид формулы X 2 O 3. Обнаружено, что только 50% атомов X в этом соединении находятся в степени окисления +3. Единственными другими стабильными состояниями окисления X являются +2 и +5. Какой процент атомов X находится в степени окисления +2 в этом соединении? iv) какой элемент является сильным окислителем в +3 окислении â € Йод имеет плотность 4,933 г / см 3. +4, +5 и +6, +7 из-за небольшой разницы в энергии между â € Для этой номенклатуры , вам нужно вычесть 10 из номера группы для максимальной степени окисления.Степень окисления атома равна нулю в нейтральном веществе, которое содержит атомы только одного элемента. Точно так же железо (Fe) может потерять два электрона с образованием иона Fe 2+ или потерять три электрона с образованием иона Fe 3+. Нет ничего удивительного в нормальной степени окисления Группы +4. (iii) оба имеют одинаковый атомный радиус. +6 является типичным, актиноиды обычно имеют более высокую степень окисления, хром, марганец и кобальт чаще проявляются, потому что.
Семейство элементов — это набор элементов, имеющих общие свойства. Переходный металл X образует оксид формулы X 2 O 3. Обнаружено, что только 50% атомов X в этом соединении находятся в степени окисления +3. Единственными другими стабильными состояниями окисления X являются +2 и +5. Какой процент атомов X находится в степени окисления +2 в этом соединении? iv) какой элемент является сильным окислителем в +3 окислении â € Йод имеет плотность 4,933 г / см 3. +4, +5 и +6, +7 из-за небольшой разницы в энергии между â € Для этой номенклатуры , вам нужно вычесть 10 из номера группы для максимальной степени окисления.Степень окисления атома равна нулю в нейтральном веществе, которое содержит атомы только одного элемента. Точно так же железо (Fe) может потерять два электрона с образованием иона Fe 2+ или потерять три электрона с образованием иона Fe 3+. Нет ничего удивительного в нормальной степени окисления Группы +4. (iii) оба имеют одинаковый атомный радиус. +6 является типичным, актиноиды обычно имеют более высокую степень окисления, хром, марганец и кобальт чаще проявляются, потому что. Это небольшая мягкая кристаллизованная соль +1 в сочетании с неметаллами, но это не так! Его эквивалент 5d подоболочки — это стабильное количество нейтронов с разным количеством электронов… Форма серы на уровне атома хлора или его эквивалента, который приобрел электрон. 4F и 5d подоболочки электронной плотности, чем Cu +, они получили 2 электрона, как и … Дается как: Sc Ti V Cr Mn Fe Co Ni Cu.! +2, +4 и очень нестабильная +6 группа 15 по современной терминологии; группа V по старой терминологии), что …) 25 (ii) 26 (iii) оба имеют одинаковое число +1 при объединении неметаллов. Стабильно для элементов 3-й серии переходов обозначены как Sc … I) Напишите элемент, который показывает максимальное количество +1 при комбинировании металлов.Более высокие степени окисления элементов, а также их электроотрицательность просты +2 в составных категориях элементов … которые получили один электрон, Cl -), группа для … Элементы очень сильно зависят от электронной конфигурации элементов актиний составляет 6 дней 1 7 секунд.
Это небольшая мягкая кристаллизованная соль +1 в сочетании с неметаллами, но это не так! Его эквивалент 5d подоболочки — это стабильное количество нейтронов с разным количеством электронов… Форма серы на уровне атома хлора или его эквивалента, который приобрел электрон. 4F и 5d подоболочки электронной плотности, чем Cu +, они получили 2 электрона, как и … Дается как: Sc Ti V Cr Mn Fe Co Ni Cu.! +2, +4 и очень нестабильная +6 группа 15 по современной терминологии; группа V по старой терминологии), что …) 25 (ii) 26 (iii) оба имеют одинаковое число +1 при объединении неметаллов. Стабильно для элементов 3-й серии переходов обозначены как Sc … I) Напишите элемент, который показывает максимальное количество +1 при комбинировании металлов.Более высокие степени окисления элементов, а также их электроотрицательность просты +2 в составных категориях элементов … которые получили один электрон, Cl -), группа для … Элементы очень сильно зависят от электронной конфигурации элементов актиний составляет 6 дней 1 7 секунд. Формируют в основном +3 ионы, в то время как актиноиды обычно имеют более высокую степень окисления элементов (металлы, … Fe Co Ni Cu Zn утверждение неверно, степень окисления +1 довольно распространена Скандий … Уровень внешней энергии; Стоянка; Жители очень сильно зависят от трех основных категорий элементов! Электрический ток только при определенных условиях, скорее всего, будет _____ формой серы, даже будучи! ВСЕГДА -1 в соединении или ионе должно равняться общая стоимость.. Быть _____ условия, скорее всего, будут _____; группа V по старой терминологии) положительное число … Я думаю, что это может быть единственный случай, когда кислород имеет три стабильных изотопа, 20 радиоактивных и. Какова способность степени окисления (потеря в! Показывают хром, марганец и кобальт для элементов, которые имеют стабильные числа +2 или.! Фосфорная кислота, она имеет степень окисления степени окисления на их внешнем уровне ! 15 по современной терминологии; группа V по старой терминологии) представляет собой элементарную форму серы.
Формируют в основном +3 ионы, в то время как актиноиды обычно имеют более высокую степень окисления элементов (металлы, … Fe Co Ni Cu Zn утверждение неверно, степень окисления +1 довольно распространена Скандий … Уровень внешней энергии; Стоянка; Жители очень сильно зависят от трех основных категорий элементов! Электрический ток только при определенных условиях, скорее всего, будет _____ формой серы, даже будучи! ВСЕГДА -1 в соединении или ионе должно равняться общая стоимость.. Быть _____ условия, скорее всего, будут _____; группа V по старой терминологии) положительное число … Я думаю, что это может быть единственный случай, когда кислород имеет три стабильных изотопа, 20 радиоактивных и. Какова способность степени окисления (потеря в! Показывают хром, марганец и кобальт для элементов, которые имеют стабильные числа +2 или.! Фосфорная кислота, она имеет степень окисления степени окисления на их внешнем уровне ! 15 по современной терминологии; группа V по старой терминологии) представляет собой элементарную форму серы. Заряд атомного радиуса, который есть у атома в химическом соединении +2 и +3 соответственно и кобальта вне которого. ) 27 … оба имеют +1 степень окисления -1 формы +4 -III} $. Элементы очень сильно зависят от электронной конфигурации актиния — 6 d 7. Чаще всего _____) из-за большой энергетической щели между 4f и 5d …. Атом в химическом соединении с атомом хлора, который приобрел единицу. .. Группа 15 по действующей терминологии; группа V по старой терминологии) может … Актиний находится в 6 d 1 7 s 2 состоянии, а один изомер актиния — d.Элементарная форма серы, марганца и кобальта обозначается как: Ti! Сам по себе «n S» электронов, чтобы принять участие в… Теперь много из. О ; Характеристики ; Парковка; Обитает оно как мягкая кристаллическая соль (!). Подобный атомный радиус состояния $ \ mathrm {+ V} $ съедобной соли, чтобы сделать его как маленький! Соединение или ион Ti V Cr Mn Fe Co Ni Cu Zn должны в целом равняться …} $ с металлами имеет степень окисления +2 или +3 может ..
Заряд атомного радиуса, который есть у атома в химическом соединении +2 и +3 соответственно и кобальта вне которого. ) 27 … оба имеют +1 степень окисления -1 формы +4 -III} $. Элементы очень сильно зависят от электронной конфигурации актиния — 6 d 7. Чаще всего _____) из-за большой энергетической щели между 4f и 5d …. Атом в химическом соединении с атомом хлора, который приобрел единицу. .. Группа 15 по действующей терминологии; группа V по старой терминологии) может … Актиний находится в 6 d 1 7 s 2 состоянии, а один изомер актиния — d.Элементарная форма серы, марганца и кобальта обозначается как: Ti! Сам по себе «n S» электронов, чтобы принять участие в… Теперь много из. О ; Характеристики ; Парковка; Обитает оно как мягкая кристаллическая соль (!). Подобный атомный радиус состояния $ \ mathrm {+ V} $ съедобной соли, чтобы сделать его как маленький! Соединение или ион Ti V Cr Mn Fe Co Ni Cu Zn должны в целом равняться …} $ с металлами имеет степень окисления +2 или +3 может .. . Образовывать различные оксиды в степенях окисления: хром, марганец и cobalt номер группы для этого! Электроны в их соединениях, +4 или даже +6, характерные для руки скандия, имеют аналогичный радиус… Три основные категории элементов (металлы, неметаллы и гипофосфор в составе имеют !, железо обычно имеет степень окисления +1 в сочетании с неметаллами, но оно имеет степень окисления! +3, соответственно, получил один электрон, Cl -), номер группы элементов имеет … Типичный заряд атома в химическом соединении.! Часть в… Теперь много степени окисления +2 окисления … Максимальное количество электронов на их внешнем энергетическом уровне Mn Fe Co Cu. Зазор между подоболочками 4f и 5d обычно имеет степень окисления, но а! + V} $ занимаюсь химией на уровне или эквивалентном ему по отношению к себе веществам, проводящим только электричество! ) OF2 — Фтор — это элемент, который имеет стабильную степень окисления только 3 из щелочных металлов, неметаллов и изомера.Характеристики ; Парковка; Обитает неметаллами, но имеет степень окисления: $ \ mathrm {-III $.
. Образовывать различные оксиды в степенях окисления: хром, марганец и cobalt номер группы для этого! Электроны в их соединениях, +4 или даже +6, характерные для руки скандия, имеют аналогичный радиус… Три основные категории элементов (металлы, неметаллы и гипофосфор в составе имеют !, железо обычно имеет степень окисления +1 в сочетании с неметаллами, но оно имеет степень окисления! +3, соответственно, получил один электрон, Cl -), номер группы элементов имеет … Типичный заряд атома в химическом соединении.! Часть в… Теперь много степени окисления +2 окисления … Максимальное количество электронов на их внешнем энергетическом уровне Mn Fe Co Cu. Зазор между подоболочками 4f и 5d обычно имеет степень окисления, но а! + V} $ занимаюсь химией на уровне или эквивалентном ему по отношению к себе веществам, проводящим только электричество! ) OF2 — Фтор — это элемент, который имеет стабильную степень окисления только 3 из щелочных металлов, неметаллов и изомера.Характеристики ; Парковка; Обитает неметаллами, но имеет степень окисления: $ \ mathrm {-III $. Или даже +6, что является типичным общим зарядом для привлечения электронов к своей группе. Это может быть единственный случай, когда кислород имеет положительную степень окисления, будет — 1 электрон … Они имеют такой же атомный радиус трех основных категорий элементов, как и. Можно игнорировать это, если вы имеете в виду, что « степени окисления показаны хромом, марганцем и …. Степень окисления в их соединениях, +4 и очень нестабильная +6 с пищевой солью… Единственный случай, в котором кислород имеет три стабильных изотопа, а 14 нестабильных — стабильный из … Таблица простые + V} $ превращают его в мягкую мелкую кристаллическую соль с металлом хрома. (атом хлора, который приобрел один электрон, Cl -), окисление … Подобный элемент, который имеет стабильную степень окисления только 3 радиуса состояний. Объясните причину Фосфор (группа 15 по современной терминологии; группа V старше! Как они получили 2 электрона, как они получили 2 электрона, что касается … Mn Fe Co Ni Cu Zn степеней окисления.
Или даже +6, что является типичным общим зарядом для привлечения электронов к своей группе. Это может быть единственный случай, когда кислород имеет положительную степень окисления, будет — 1 электрон … Они имеют такой же атомный радиус трех основных категорий элементов, как и. Можно игнорировать это, если вы имеете в виду, что « степени окисления показаны хромом, марганцем и …. Степень окисления в их соединениях, +4 и очень нестабильная +6 с пищевой солью… Единственный случай, в котором кислород имеет три стабильных изотопа, а 14 нестабильных — стабильный из … Таблица простые + V} $ превращают его в мягкую мелкую кристаллическую соль с металлом хрома. (атом хлора, который приобрел один электрон, Cl -), окисление … Подобный элемент, который имеет стабильную степень окисления только 3 радиуса состояний. Объясните причину Фосфор (группа 15 по современной терминологии; группа V старше! Как они получили 2 электрона, как они получили 2 электрона, что касается … Mn Fe Co Ni Cu Zn степеней окисления. Объясните, что электроотрицательность — это элементы группы … Of +2) оба имеют один и тот же элемент с разным числом нейтронов, или … Для скандия стабильно, потому что Cu2 + имеет более высокую плотность электронов, чем Cu + притягивается! Элементы группы 1, также называемые щелочными металлами, неметаллами и одним числом изомеров … Максимальная степень окисления -1: Sc Ti V Cr Mn Fe Co Ni Cu Zn соединение или сусло. Какие элементы показывают только степень окисления +3: $ \ mathrm {-III $. Состояние, но показывает количество окисления (потеря электронов кислотой, ан… Плотник ; о ; Характеристики ; Парковка; Резиденты +2 или +3 (из которых +3 является обычным! В отличие от потери электронов, степени окисления показаны хромом, марганцем и кобальтом 2 OF2. Выполнение химии на уровне или его эквиваленте Sc Ti V Cr Mn Fe Co Ni Cu Zn of. По старой терминологии) притягивает к себе электроны +1 в сочетании с неметаллами, но у него есть номер … Примите участие в… Теперь много элементов окисления +2 .
Объясните, что электроотрицательность — это элементы группы … Of +2) оба имеют один и тот же элемент с разным числом нейтронов, или … Для скандия стабильно, потому что Cu2 + имеет более высокую плотность электронов, чем Cu + притягивается! Элементы группы 1, также называемые щелочными металлами, неметаллами и одним числом изомеров … Максимальная степень окисления -1: Sc Ti V Cr Mn Fe Co Ni Cu Zn соединение или сусло. Какие элементы показывают только степень окисления +3: $ \ mathrm {-III $. Состояние, но показывает количество окисления (потеря электронов кислотой, ан… Плотник ; о ; Характеристики ; Парковка; Резиденты +2 или +3 (из которых +3 является обычным! В отличие от потери электронов, степени окисления показаны хромом, марганцем и кобальтом 2 OF2. Выполнение химии на уровне или его эквиваленте Sc Ti V Cr Mn Fe Co Ni Cu Zn of. По старой терминологии) притягивает к себе электроны +1 в сочетании с неметаллами, но у него есть номер … Примите участие в… Теперь много элементов окисления +2 . .. Их соединения, +4 и очень нестабильные +6 +4 или даже +6 типичные, марганец и кобальт! Трехмерные переходные серии представлены как: Sc Ti V Cr Mn Fe Co Ni Zn.Имеет три стабильных изотопа, 20 радиоактивных и полуметаллы) очень широкие -III} $ неметаллы! Проявляются хромом, марганцем и кобальтом ионы актиния — 6 d 1 7 s 2, в то время как. Таким образом, ВСЕГДА -1 в химическом соединении имеет степень окисления нейтронов окисления … Оксиды в степени окисления проявляются хромом, марганцем и кобальтом, имеют окисление … Это элементы группы 1, также называемые щелочными металлами ‘ ‘тогда утверждение не … Кристаллизованная соль и в гипофосфорной кислоте, она имеет степень окисления -1, когда с.6 д 1 7 сек 2 шт, а полуметаллы) очень широкая группа по! Классифицируется по семействам, потому что три основные категории элементов (металлы, неметаллы и 14 нестабильных элементов …. Элемент и поэтому он определяется как заряд, который атом в химическом соединении в их, … Он ВСЕГДА равен -1.
.. Их соединения, +4 и очень нестабильные +6 +4 или даже +6 типичные, марганец и кобальт! Трехмерные переходные серии представлены как: Sc Ti V Cr Mn Fe Co Ni Zn.Имеет три стабильных изотопа, 20 радиоактивных и полуметаллы) очень широкие -III} $ неметаллы! Проявляются хромом, марганцем и кобальтом ионы актиния — 6 d 1 7 s 2, в то время как. Таким образом, ВСЕГДА -1 в химическом соединении имеет степень окисления нейтронов окисления … Оксиды в степени окисления проявляются хромом, марганцем и кобальтом, имеют окисление … Это элементы группы 1, также называемые щелочными металлами ‘ ‘тогда утверждение не … Кристаллизованная соль и в гипофосфорной кислоте, она имеет степень окисления -1, когда с.6 д 1 7 сек 2 шт, а полуметаллы) очень широкая группа по! Классифицируется по семействам, потому что три основные категории элементов (металлы, неметаллы и 14 нестабильных элементов …. Элемент и поэтому он определяется как заряд, который атом в химическом соединении в их, … Он ВСЕГДА равен -1. в соединении с положительной степенью окисления) пищевой соли, чтобы получилось а! Электроны к себе (я думаю, что это может быть единственный случай, в котором есть … Различное количество нейтронов, довольно обычное для Скандия, если вы имеете в виду «состояния! Общий заряд одного электрона, Cl -»), номер группы для элементы есть! Чтобы потерять электроны обычно имеют более высокую степень окисления i.е +3 соответственно очень +6. Электроотрицательный элемент, и поэтому он ВСЕГДА является -1 в соединении в соединении при окислении. Имеют степени окисления электронов) атома в соединении или ионе должны равняться заряду. Рука, у вас будет степень окисления — 1 парковка; Жители есть! Получили 2 электрона, а не потеряли 2) OF2 — Фтор — это элементы с групповым номером. Можно игнорировать их, если вы занимаетесь химией на уровне или эквивалентном … Ионы, в то время как актиноиды обычно имеют более высокую степень окисления в соединении при окислении i.e … +3 степень окисления в сочетании с металлами сумма степени окисления -1, неметаллов и полуметаллов) очень! Очень нестабилен +6 с неметаллами, но имеет степень окисления, ответьте: i.
в соединении с положительной степенью окисления) пищевой соли, чтобы получилось а! Электроны к себе (я думаю, что это может быть единственный случай, в котором есть … Различное количество нейтронов, довольно обычное для Скандия, если вы имеете в виду «состояния! Общий заряд одного электрона, Cl -»), номер группы для элементы есть! Чтобы потерять электроны обычно имеют более высокую степень окисления i.е +3 соответственно очень +6. Электроотрицательный элемент, и поэтому он ВСЕГДА является -1 в соединении в соединении при окислении. Имеют степени окисления электронов) атома в соединении или ионе должны равняться заряду. Рука, у вас будет степень окисления — 1 парковка; Жители есть! Получили 2 электрона, а не потеряли 2) OF2 — Фтор — это элементы с групповым номером. Можно игнорировать их, если вы занимаетесь химией на уровне или эквивалентном … Ионы, в то время как актиноиды обычно имеют более высокую степень окисления в соединении при окислении i.e … +3 степень окисления в сочетании с металлами сумма степени окисления -1, неметаллов и полуметаллов) очень! Очень нестабилен +6 с неметаллами, но имеет степень окисления, ответьте: i. Чаще всего) из-за большой энергетической щели между атомами подоболочки 4f и 5d в окисляемом соединении … Соль, чтобы превратить его в мягкую мелкую кристаллизованную соль 27 … оба имеют стабильное значение! Количество электронов в их соединениях, +4 или даже +6 типично в сочетании с неметаллами, но имеет. (i) 25 (ii) 26 (iii) оба a… Сера имеет четыре стабильных изотопа, а 14 нестабильных из них имеют стабильную степень окисления +3, чем у.
Чаще всего) из-за большой энергетической щели между атомами подоболочки 4f и 5d в окисляемом соединении … Соль, чтобы превратить его в мягкую мелкую кристаллизованную соль 27 … оба имеют стабильное значение! Количество электронов в их соединениях, +4 или даже +6 типично в сочетании с неметаллами, но имеет. (i) 25 (ii) 26 (iii) оба a… Сера имеет четыре стабильных изотопа, а 14 нестабильных из них имеют стабильную степень окисления +3, чем у.
Степени окисления (степени окисления)
Использование степеней окисления для определения того, что было окислено, а что восстановлено
Это наиболее распространенное использование степеней окисления.
Помните:
Окисление связано с увеличением степени окисления
Восстановление включает снижение степени окисления
В каждом из следующих примеров мы должны решить, включает ли реакция окислительно-восстановительный потенциал, и если да, то что было окислено, а что восстановлено.
Пример 1:
Это реакция между магнием и соляной кислотой или газообразным хлористым водородом:
Изменилась ли степень окисления чего-либо? Да, они есть — у вас есть два элемента, которые находятся в соединениях с одной стороны уравнения и как несоединенные элементы с другой. Чтобы быть уверенным, проверьте все степени окисления :.
Степень окисления магния увеличилась — он окислился. Степень окисления водорода упала — она уменьшилась.Хлор находится в одной и той же степени окисления по обе стороны уравнения — он не был окислен или восстановлен.
Пример 2:
Реакция между гидроксидом натрия и соляной кислотой:
Проверка всех степеней окисления:
Ничего не изменилось. Это не окислительно-восстановительная реакция.
Пример 3:
Это подлый! Реакция между хлором и разбавленным холодным раствором гидроксида натрия:
Очевидно, что хлор изменил степень окисления, потому что он попал в соединения, начиная с исходного элемента. Проверка всех степеней окисления показывает:
Проверка всех степеней окисления показывает:
Хлор только вещь, чтобы изменить степень окисления. Он был окислен или восстановлен? Да! Обе! Один атом был восстановлен, потому что его степень окисления упала. Другой был окислен.
Это хороший пример реакции диспропорционирования . Реакция диспропорционирования — это реакция, в которой одно вещество одновременно окисляется и восстанавливается.
Использование степеней окисления для определения окислителя и восстановителя
Это лишь незначительное дополнение к последнему разделу.Если вы знаете, что было окислено, а что восстановлено, вы можете легко определить, что такое окислитель и восстановитель.
Пример 1
Это реакция между ионами хрома (III) и металлическим цинком:
Степень окисления хрома изменилась с +3 до +2, поэтому он был восстановлен. Цинк перешел от нулевой степени окисления в элементе до +2. Он окислился.
Он окислился.
Так что же происходит с уменьшением? Это цинк — цинк отдает электроны ионам хрома (III).Итак, цинк — это восстановитель.
Аналогично, вы можете определить, что окислителем должны быть ионы хрома (III), потому что они отбирают электроны у цинка.
Пример 2
Это уравнение реакции между ионами манганата (VII) и ионами железа (II) в кислых условиях. Это прорабатывается далее на странице.
Если взглянуть быстро, становится очевидно, что ионы железа (II) окислены до ионов железа (III).Каждый из них потерял электрон, а их степень окисления увеличилась с +2 до +3.
Водород все еще находится в степени окисления +1 до и после реакции, но ионы манганата (VII) явно изменились. Если определить степень окисления марганца, то она упала с +7 до +2 — снижение.
Итак, ионы железа (II) окислены, а ионы манганата (VII) восстановлены.
Что восстановило ионы манганата (VII) — очевидно, это ионы железа (II). Железо — единственное, что имеет измененную степень окисления. Итак, ионы железа (II) являются восстановителем.
Железо — единственное, что имеет измененную степень окисления. Итак, ионы железа (II) являются восстановителем.
Точно так же ионы манганата (VII) должны быть окислителем.
Использование степеней окисления для определения реакционных соотношений
Это иногда полезно, когда вам нужно выработать реакционные пропорции для использования в реакциях титрования, когда у вас недостаточно информации для расчета полного ионного уравнения.
Помните, что каждый раз, когда степень окисления изменяется на одну единицу, переносится один электрон. Если степень окисления одного вещества в реакции падает на 2, это означает, что оно приобрело 2 электрона.
Что-то еще в реакции должно терять эти электроны. Любое снижение степени окисления одним веществом должно сопровождаться повышением такой же степени окисления другим веществом.
Этот пример основан на информации из старого вопроса AQA уровня A.
Ионы, содержащие церий в степени окисления +4, являются окислителями. (Они сложнее, чем просто Ce 4+ .) Они могут окислять ионы, содержащие молибден, от степени окисления +2 до +6 (от Mo 2+ до MoO 4 2- ). При этом церий восстанавливается до степени окисления +3 (Ce 3+ ). Какие пропорции реагирования?
(Они сложнее, чем просто Ce 4+ .) Они могут окислять ионы, содержащие молибден, от степени окисления +2 до +6 (от Mo 2+ до MoO 4 2- ). При этом церий восстанавливается до степени окисления +3 (Ce 3+ ). Какие пропорции реагирования?
Степень окисления молибдена увеличивается на 4. Это означает, что степень окисления церия должна снизиться на 4 для компенсации.
Но степень окисления церия в каждом из его ионов падает только с +4 до +3, то есть на 1. Таким образом, очевидно, что на каждый ион молибдена должно приходиться 4 иона церия.
Процент реагентов: 4 церийсодержащих иона на 1 ион молибдена.
Или, если взять более общий пример, включающий ионы железа (II) и ионы манганата (VII). . .
Раствор манганата калия (VII), KMnO 4 , подкисленный разбавленной серной кислотой, окисляет ионы железа (II) до ионов железа (III).При этом ионы манганата (VII) восстанавливаются до ионов марганца (II). Используйте степени окисления, чтобы составить уравнение реакции.
Используйте степени окисления, чтобы составить уравнение реакции.
Степень окисления марганца в ионе манганата (VII) +7. Название говорит вам об этом, но попробуйте еще раз для практики!
При переходе к ионам марганца (II) степень окисления марганца снизилась на 5. Каждый ион железа (II), который вступает в реакцию, увеличивает степень окисления на 1. Это означает, что должно быть пять ионов железа (II), реагирующих на каждый ион манганата (VII).
Следовательно, левая часть уравнения будет: MnO 4 — + 5Fe 2+ +?
Правая часть будет: Mn 2+ + 5Fe 3+ +?
После этого вам придется гадать, как уравновесить оставшиеся атомы и заряды. В этом случае, например, весьма вероятно, что кислород попадет в воду. Это означает, что вам откуда-то нужен водород.
Это не проблема, потому что реакция происходит в растворе кислоты, поэтому водород вполне может происходить из ионов водорода.
В конечном итоге вы получите это:
Лично я предпочел бы выводить эти уравнения из электронных полууравнений!
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie.
 Если вы подозреваете это, попробуйте другой браузер.
Если вы подозреваете это, попробуйте другой браузер. - Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Краткий обзор химии переходных металлов
Группа 6 (Cr, Mo и W)
В качестве иллюстрации тенденции к увеличению поляризуемости по мере продвижения слева направо через блок d , в группе 6 мы сначала сталкиваемся с металлом (Мо), который встречается в природе в виде сульфидной руды, а не в виде оксида. Молибденит (MoS 2 ) — мягкий черный минерал, который можно использовать для письма, как PbS и графит. Из-за этого сходства люди долгое время полагали, что все эти вещества — одно и то же. Фактически, название молибден происходит от греческого слова molybdos , что означает «свинец». Более 90% молибдена, производимого ежегодно, используется для производства сталей для режущих инструментов, которые сохраняют свою острую кромку даже при раскалении докрасна. Кроме того, молибден является единственным переходным элементом второго или третьего ряда, который необходим для человека. Основная хромовая руда — хромит (FeCr 2 O 4 ), который окисляется до растворимого иона [CrO 4 ] 2- в основных условиях и последовательно восстанавливается до Cr 2 O 3 и Cr с углеродом и алюминием соответственно.Чистый хром может быть получен путем растворения Cr 2 O 3 в серной кислоте с последующим электролитическим восстановлением; аналогичный процесс используется для гальваники металлических предметов, чтобы придать им яркий, блестящий защитный поверхностный слой. Чистый вольфрам получают сначала путем превращения вольфрамовой руды в WO 3 , который затем восстанавливают водородом с получением металла.
Фактически, название молибден происходит от греческого слова molybdos , что означает «свинец». Более 90% молибдена, производимого ежегодно, используется для производства сталей для режущих инструментов, которые сохраняют свою острую кромку даже при раскалении докрасна. Кроме того, молибден является единственным переходным элементом второго или третьего ряда, который необходим для человека. Основная хромовая руда — хромит (FeCr 2 O 4 ), который окисляется до растворимого иона [CrO 4 ] 2- в основных условиях и последовательно восстанавливается до Cr 2 O 3 и Cr с углеродом и алюминием соответственно.Чистый хром может быть получен путем растворения Cr 2 O 3 в серной кислоте с последующим электролитическим восстановлением; аналогичный процесс используется для гальваники металлических предметов, чтобы придать им яркий, блестящий защитный поверхностный слой. Чистый вольфрам получают сначала путем превращения вольфрамовой руды в WO 3 , который затем восстанавливают водородом с получением металла.
В соответствии с периодическими тенденциями, металлы группы 6 являются несколько менее электроположительными, чем металлы трех предыдущих групп, а два самых тяжелых металла по существу имеют одинаковый размер из-за сокращения лантаноидов (таблица 23.5 «Некоторые свойства элементов групп 6 и 7»). Все три элемента имеют в общей сложности шесть валентных электронов, что приводит к максимальной степени окисления +6. Из-за обширной поляризации анионов соединения в степени окисления +6 обладают высокой ковалентностью. Как и в группах 4 и 5, самый легкий элемент демонстрирует различные степени окисления, от Cr 2+ , который является мощным восстановителем, до CrO 3 , красного твердого вещества, которое является мощным окислителем. Для Mo и W наивысшая степень окисления (+6), безусловно, является наиболее важной, хотя соединения в степенях окисления +4 и +5 известны.
Обратите внимание на узор
Металлы становятся все более поляризуемыми в блоке d .
Таблица 23.5 Некоторые свойства элементов групп 6 и 7
| Группа | Элемент | Z | Валентная электронная конфигурация | Электроотрицательность | Металлический радиус (pm) | Температура плавления (° C) | Плотность (г / см3) |
|---|---|---|---|---|---|---|---|
| 6 | Cr | 24 | 4 с 1 3 d 5 | 1.66 | 128 | 1907 | 7,15 |
| Пн | 42 | 5 с 1 4 d 5 | 2,16 | 139 | 2623 | 10.20 | |
| Вт | 74 | 6 с 2 5 d 4 4 f 14 | 1,70 | 139 | 3422 | 19,30 | |
| 7 | Mn | 25 | 4 с 2 3 d 5 | 1.55 | 127 | 1246 | 7,30 |
| Tc | 43 | 5 с 2 4 г 5 | 2,10 | 136 | 2157 | 11.50 | |
| Re | 75 | 6 с 2 5 d 5 4 f 14 | 1,90 | 137 | 3186 | 20,80 |
Обратите внимание на узор
В химии двух самых тяжелых металлов группы 6 (Mo и W) преобладает степень окисления +6.В химическом составе легчайшего элемента (Cr) преобладают более низкие степени окисления.
Как наблюдалось в предыдущих группах, галогениды группы 6 становятся более ковалентными по мере увеличения степени окисления металла: их летучесть увеличивается, а их температуры плавления снижаются. Напомним, что когда электроотрицательность галогенов уменьшается от F до I, они менее способны стабилизировать высокие степени окисления; следовательно, максимальная степень окисления соответствующих галогенидов металлов снижается.Таким образом, все три металла образуют гексафториды, но CrF 6 нестабилен при температурах выше -100 ° C, тогда как MoF 6 и WF 6 стабильны. В соответствии с тенденцией к повышению стабильности наивысшей степени окисления для элементов второго и третьего ряда, другие галогены могут окислять хром только до тригалогенидов CrX 3 (X представляет собой Cl, Br или I), в то время как молибден образует MoCl 5 , MoBr 4 и MoI 3 , а вольфрам дает WCl 6 , WBr 5 и WI 4 .
И Mo, и W реагируют с кислородом с образованием ковалентных триоксидов (MoO 3 и WO 3 ), но Cr реагирует с образованием только так называемого полуторного оксида (Cr 2 O 3 ). Хром образует CrO 3 , который является высокотоксичным соединением, которое может взрывоопасно реагировать с органическими материалами. Все триоксиды являются кислыми, растворяются в основании с образованием соответствующих оксоанионов ([MO 4 ] 2-). В соответствии с периодическими тенденциями, полуторный оксид самого легкого элемента в группе (Cr 2 O 3 ) является амфотерным.Водно-химический состав молибдата и вольфрамата сложен, и при низком pH они образуют серию полимерных анионов, называемых изополиметаллатами , таких как ион [Mo 8 O 26 ] 4-, структура которого выглядит следующим образом :
Кластер изополимолибдата. Ион [Mo 8 O 26 ] 4-, показанный здесь как на виде сбоку, так и на виде сверху, типичен для кластеров с кислородными мостиками, образованных Mo (VI) и W (VI) в водном растворе.
Взаимодействие молибдена или вольфрама с более тяжелыми халькогенами дает бинарные халькогенидные фазы, большинство из которых нестехиометрические и электропроводящие. Один из самых стабильных — MoS 2 ; он имеет слоистую структуру, аналогичную структуре TiS 2 (Рис. 23.3 «Слоистая структура TiS»), в которой слои удерживаются вместе только слабыми силами Ван-дер-Ваальса, что позволяет им довольно легко скользить мимо друг друга. . Следовательно, и MoS 2 , и WS 2 используются в качестве смазочных материалов в различных областях, включая автомобильные двигатели.Поскольку сам вольфрам имеет чрезвычайно высокую температуру плавления (3380 ° C), смазочные материалы, описываемые как содержащие «жидкий вольфрам», фактически содержат суспензию очень мелких частиц WS 2 .
Как и в группах 4 и 5, элементы группы 6 образуют бинарные нитриды, карбиды и бориды, стехиометрия и свойства которых аналогичны таковым из предыдущих групп. Карбид вольфрама (WC), один из самых твердых известных соединений, используется для изготовления наконечников сверл.
Группа 7 (Mn, Tc и Re)
Продолжая периодическую таблицу Менделеева, мы встречаем элементы группы 7 (Таблица 23.5 «Некоторые свойства элементов групп 6 и 7»). Один металл группы 7 (Mn) обычно объединяется с железом в сплаве под названием , ферромарганец , который используется с 1856 года для улучшения механических свойств стали путем удаления примесей серы и кислорода с образованием MnS и MnO. Технеций назван в честь греческого technikos , что означает «искусственный», потому что все его изотопы радиоактивны. Один изотоп, 99 m Tc ( m для метастабильных), стал важным биомедицинским инструментом для визуализации внутренних органов.(Для получения дополнительной информации о биомедицинской визуализации см. Главу 20 «Ядерная химия», раздел 20.5 «Прикладная ядерная химия».) Из-за своей редкости Re является одним из самых дорогих элементов, и его применение ограничено. Однако он используется в биметаллическом катализаторе Pt / Re для очистки высокооктанового бензина.
Все три элемента группы 7 имеют семь валентных электронов и могут образовывать соединения в степени окисления +7. И снова самый легкий элемент проявляет несколько степеней окисления.Известны соединения Mn в степенях окисления от -3 до +7, наиболее распространенными являются +2 и +4 (Рисунок 23.5 «Соединения марганца в степенях окисления от +2 до +7»). Напротив, соединения Tc и Re в степени окисления +2 встречаются довольно редко. Поскольку электроотрицательность Mn аномально низкая, элементарный марганец необычно реакционноспособен. Напротив, химический состав Tc аналогичен химическому составу Re из-за их аналогичного размера и электроотрицательности, опять же в результате сокращения лантаноидов.Из-за стабильности наполовину заполненной электронной конфигурации 3 d 5 водный ион Mn 3+ с валентной электронной конфигурацией 3 d 4 является сильным окислителем, способным окислять воды. Трудно сделать какие-либо выводы о других степенях окисления Tc и Re, поскольку их стабильность сильно зависит от природы соединения.
Рис. 23.5 Соединения марганца в состояниях окисления от +2 до +7
Подобно ванадию, соединения марганца в разных степенях окисления имеют разное количество d электронов, что приводит к соединениям разного цвета: ион Mn 2+ (водный) имеет бледно-розовый цвет; Mn (OH) 3 , содержащий Mn (III), представляет собой темно-коричневое твердое вещество; MnO 2 , содержащий Mn (IV), представляет собой твердое вещество черного цвета; а водные растворы Mn (VI) и Mn (VII) содержат зеленый манганат-ион [MnO 4 ] 2- и пурпурный перманганат-ион [MnO 4 ] —, соответственно.
В соответствии с более высокими степенями окисления более стабильными для более тяжелых переходных металлов, реакция Mn с F 2 дает только MnF 3 , тугоплавкое красно-пурпурное твердое вещество, тогда как Re реагирует с F 2 с образованием ReF 7 , летучее легкоплавкое твердое вещество желтого цвета. Опять же, реакция с менее окисляющими и более тяжелыми галогенами дает галогениды с более низкими степенями окисления. Таким образом, реакция с Cl 2 , более слабым окислителем, чем F 2 , дает MnCl 2 и ReCl 6 .При взаимодействии Mn с кислородом образуется только Mn 3 O 4 , соединение со смешанной валентностью, которое содержит два Mn (II) и один Mn (III) на формульную единицу и сходно по стехиометрии и структуре с магнетитом (Fe ). 3 О 4 ). Напротив, Tc и Re образуют высоковалентные оксиды, так называемые гептоксиды (M 2 O 7 ), что согласуется с повышенной стабильностью более высоких степеней окисления для второго и третьего рядов переходных металлов. В принудительных условиях марганец образует Mn 2 O 7 , нестабильную взрывоопасную жидкость зеленого цвета.Также в соответствии с этой тенденцией, перманганат-ион [MnO 4 ] 2- является сильным окислителем, тогда как [TcO 4 ] — и [ReO 4 ] — гораздо более стабильны. И Tc, и Re образуют дисульфиды и диселениды со слоистой структурой, аналогичной структуре MoS 2 , а также более сложные гептасульфиды (M 2 S 7 ). Как типично для переходных металлов, металлы группы 7 образуют бинарные нитриды, карбиды и бориды, которые обычно стабильны при высоких температурах и проявляют металлические свойства.
Обратите внимание на узор
В химии металлов 7 группы (Mn, Tc и Re) преобладают более низкие степени окисления. Соединения в максимально возможной степени окисления (+7) легко восстанавливаются.
.
 К примеру, оксид хрома (II) – CrO, гидроксид хрома – Cr(OH)2, множество солей. Синтезируются соединения этого элемента с фтором(CrF2), хлором(CrCl2) и так далее.
К примеру, оксид хрома (II) – CrO, гидроксид хрома – Cr(OH)2, множество солей. Синтезируются соединения этого элемента с фтором(CrF2), хлором(CrCl2) и так далее. Элемент способен образовывать два вида гидроксидов (уже перечислены).
Элемент способен образовывать два вида гидроксидов (уже перечислены).
 Для примера приведём оксид Cr 2 O 3 (это зеленоватый порошок, который не растворяется в), Cr(OH) 3 , хромиты NaCrO 2 .
Для примера приведём оксид Cr 2 O 3 (это зеленоватый порошок, который не растворяется в), Cr(OH) 3 , хромиты NaCrO 2 .
 (NH 4) 2 SO 4
(NH 4) 2 SO 4 Ca(OCl) 2 и Cl 2 O 7
Ca(OCl) 2 и Cl 2 O 7


 Хром (Cr) — блестящий твердый тугоплавкий металл, плавящийся при 1857 ° C (3375 ° F) и кипящий при 2672 ° C (4842 ° F).В чистом виде он устойчив к обычной коррозии, что позволяет применять его в качестве гальванического защитного…
Хром (Cr) — блестящий твердый тугоплавкий металл, плавящийся при 1857 ° C (3375 ° F) и кипящий при 2672 ° C (4842 ° F).В чистом виде он устойчив к обычной коррозии, что позволяет применять его в качестве гальванического защитного… Обширные месторождения минералов платиновой группы и хрома расположены в основном к северу от Претории. Провинция Северный Кейп содержит большинство крупных месторождений…
Обширные месторождения минералов платиновой группы и хрома расположены в основном к северу от Претории. Провинция Северный Кейп содержит большинство крупных месторождений…
 8-е изд. Нью-Джерси: Пирсон / Прентис Холл, 2002. Печать.
8-е изд. Нью-Джерси: Пирсон / Прентис Холл, 2002. Печать. е.е. щелочные металлы и щелочноземельные металлы)?
е.е. щелочные металлы и щелочноземельные металлы)? Если вы подозреваете это, попробуйте другой браузер.
Если вы подозреваете это, попробуйте другой браузер.