Никель, свойства атома, химические и физические свойства
Никель, свойства атома, химические и физические свойства.
Ni 28 Никель
58,6934(4) 1s2 2s2 2p6 3s2 3p6 3d8 4s2
Никель — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 28. Расположен в 10-й группе (по старой классификации — побочной подгруппе восьмой группы), четвертом периоде периодической системы.
Атом и молекула никеля. Формула никеля. Строение атома никеля
Цена на никель
Изотопы и модификации никеля
Свойства никеля (таблица): температура, плотность, давление и пр.
Физические свойства никеля
Химические свойства никеля. Взаимодействие никеля. Химические реакции с никелем
Получение никеля
Применение никеля
Таблица химических элементов Д.И. Менделеева
Атом и молекула никеля.
 Формула никеля. Строение атома никеля:
Формула никеля. Строение атома никеля:Никель (лат. Niccolum, от ср. нем. Nickel – «озорник») – химический элемент
Никель – металл. Относится к группе переходных металлов. Относится к цветным металлам.
Как простое вещество никель при нормальных условиях представляет собой ковкий, пластичный металл серебристо-белого цвета.
Молекула никеля одноатомна.
Химическая формула никеля Ni.
Электронная конфигурация атома никеля 1s2 2s2 2p6 3s2 3p6 3d8 4s2. Потенциал ионизации (первый электрон) атома никеля равен 737,14 кДж/моль (7,639878(17) эВ).
Строение атома никеля. Атом никеля состоит из положительно заряженного ядра (+28), вокруг которого по четырем оболочкам движутся 28 электронов. При этом 26 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку никель расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома никеля на 3d-орбитали находится шесть спаренных и два неспаренных электрона. На внешнем энергетическом уровне атома никеля – на s-орбитали находится два спаренных электрона.
Радиус атома никеля (вычисленный) составляет 149 пм.
Атомная масса атома никеля составляет 58,6934(4) а. е. м.
Никель химически малоактивен.
Изотопы и модификации никеля:
Свойства никеля (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru
| 100 | Общие сведения | |
| 101 | Название | Никель |
| 102 | Прежнее название | |
| 103 | Латинское название | Niccolum |
| 104 | Английское название | Nickel |
| 105 | Символ | Ni |
| 106 | Атомный номер (номер в таблице) | 28 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный, цветной металл |
| 109 | Открыт | Аксель Фредрик Кронстедт, Швеция, 1751 г.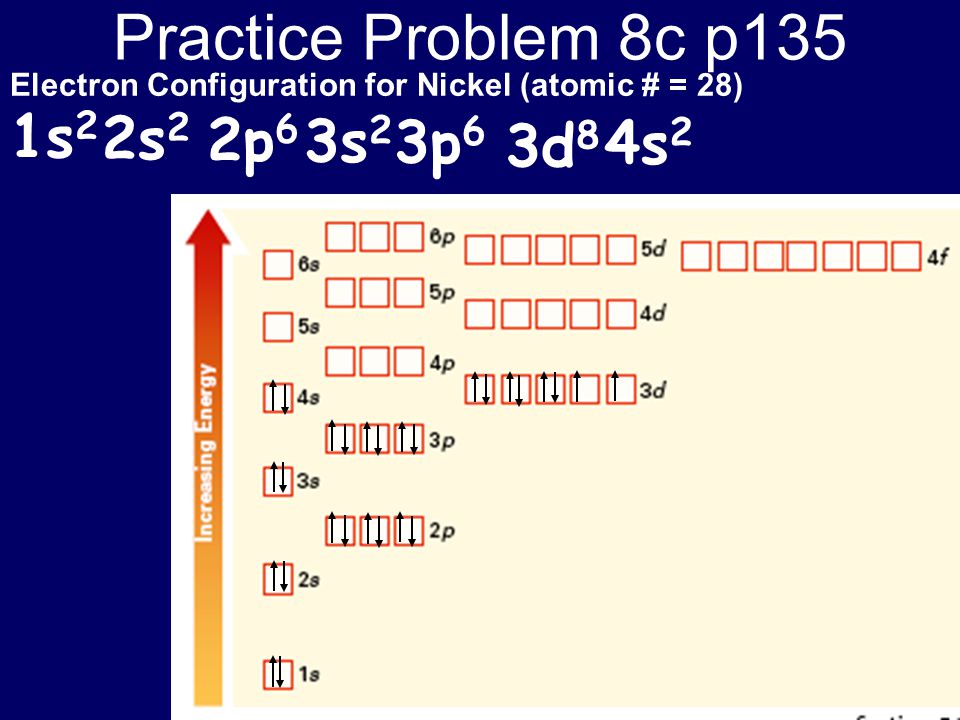 |
| 110 | Год открытия | 1751 г. |
| 111 | Внешний вид и пр. | Ковкий, пластичный металл серебристо-белого цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,0089 % |
| 120 | Содержание в морях и океанах (по массе) | 2,0·10-7 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,006 % |
| 122 | Содержание в Солнце (по массе) | 0,008 % |
| 123 | Содержание в метеоритах (по массе) | 1,3 % |
| 124 | Содержание в организме человека (по массе) | 0,00001 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 58,6934(4) а. е. м. (г/моль) е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d8 4s2 |
| 203 | Электронная оболочка | K2 L8 M16 N2 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 149 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 124 пм |
| 207 | Радиус иона (кристаллический) | Ni2+ low spin 83 (6) пм, Ni3+ low spin 70 (6) пм, Ni4+ low spin 62 (6) пм, Ni3+ high spin 74 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 163 пм |
| 209 | Электроны, Протоны, Нейтроны | 28 электронов, 28 протонов, 31 нейтрон |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 4 |
| 212 | Группа в периодической таблице | 10-ая группа (по старой классификации – побочная подгруппа 8-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | -2, -1, 0, +1, +2 , +3, +4 | |
| 302 | Валентность | II, III |
| 303 | Электроотрицательность | 1,91 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 737,14 кДж/моль (7,639878(17) эВ) |
| 305 | Электродный потенциал | Ni2+ + 2e– → Ni, Eo = -0,250 В |
| 306 | Энергия сродства атома к электрону | 112 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 8,908 г/см3 (при 20 °C и иных стандартных условиях 7,81 г/см3 (при температуре плавления 1455 °C и иных стандартных условиях, состояние вещества – жидкость) |
| 402 | Температура плавления* | 1455 °C (1728 K, 2651 °F) |
| 403 | Температура кипения* | 2730 °C (3003 K, 4946 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 17,48 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔH | 379 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,439 Дж/г·K (при 20°C) |
| 410 | Молярная теплоёмкость* | 26,07 Дж/(K·моль) |
| 411 | Молярный объём | 6,6 см³/моль |
| 412 | Теплопроводность | 90,9 Вт/(м·К) (при стандартных условиях), 90,9 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | |
| 512 | Структура решётки | Кубическая гранецентрированная |
| 513 | Параметры решётки | 3,524 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 375 K |
| 516 | Название пространственной группы симметрии | Fm_ 3m |
| 517 | Номер пространственной группы симметрии | 225 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-02-0 |
Примечание:
205* Эмпирический радиус атома никеля согласно [1] и [3] составляет 124 пм.
206* Ковалентный радиус никеля согласно [1] и [3] составляет 124±4 пм и 115 пм соответственно.
401* Плотность никеля согласно [3] и [4] составляет 8,902 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело) и 8,91 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) соответственно.
402* Температура плавления никеля согласно [3] составляет 1453 °C (1726 K, 2647 °F).
403* Температура кипения никеля согласно [3] и [4] составляет 2732 °C (3005 K, 4949 °F) и 3173,15 °C (2900 K, 5252 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) никеля согласно [3] и [4] составляет 17,61 кДж/моль и 17,5 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) никеля согласно [3] и [4] составляет 378,6 кДж/моль и 369,9 кДж/моль соответственно.
410* Молярная теплоемкость никеля согласно [3] составляет 26,1 Дж/(K·моль).
Физические свойства никеля:
Химические свойства никеля. Взаимодействие никеля. Химические реакции с никелем:
Получение никеля:
Применение никеля:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25.
 Марганец
Марганец - 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59.
 Празеодим
Празеодим - 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92.
 Уран
Уран - 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Источники:
- https://en.wikipedia.org/wiki/Nickel
- https://de.
 wikipedia.org/wiki/Nickel
wikipedia.org/wiki/Nickel - https://ru.wikipedia.org/wiki/Никель
- http://chemister.ru/Database/properties.php?dbid=1&id=237
- https://chemicalstudy.ru/nikel-svoystva-atoma-himicheskie-i-fizicheskie-svoystva/
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
никель атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле никеля
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 1 462
Никель электронная структура — Справочник химика 21
На рис. 3 представлена зависимость удельной активности (/Суд) от числа валентных электронов металла-катализатора. Кривая / показывает изменение удельной активности металлов в отношении реакции изотопного обмена в молекулярном водороде. В -1У периоде наиболее активным оказывается никель (3 , 45 ), у которого почти полностью заполнена -зона. Завершение заполнения -зоны при переходе от N1 к Си приводит к снижению активности. Эта зависимость обусловлена влиянием электронной структуры металла на характер и энергию поверхностного взаимодействия с водородом. [c.34]
3 представлена зависимость удельной активности (/Суд) от числа валентных электронов металла-катализатора. Кривая / показывает изменение удельной активности металлов в отношении реакции изотопного обмена в молекулярном водороде. В -1У периоде наиболее активным оказывается никель (3 , 45 ), у которого почти полностью заполнена -зона. Завершение заполнения -зоны при переходе от N1 к Си приводит к снижению активности. Эта зависимость обусловлена влиянием электронной структуры металла на характер и энергию поверхностного взаимодействия с водородом. [c.34] Уже первые опыты применения органических реактивов а-нит-роз-Р-нафтола М. А, Ильинским (1885), диметилглиоксима Л. А. Чугаевым (1905) показали чрезвычайную перспективность этого направления в аналитической химии. Актуальность теоретических и экспериментальных работ в этой области сохраняется до настоящего времени. Теория применения органических реактивов в аналитической химии обосновывает связь строения и свойств органической молекулы со свойствами ионов в растворе, формами их существования, электронной структурой, зарядом, радиусом и т.
 д. Установлено, что возможность взаимодействия иона с органическим реагентом зависит от наличия в молекуле органического соединения так называемых функциональных или характерных атомных групп на данный ион. Такой группой на ион никеля и палладия является —С—С—, [c.161]
д. Установлено, что возможность взаимодействия иона с органическим реагентом зависит от наличия в молекуле органического соединения так называемых функциональных или характерных атомных групп на данный ион. Такой группой на ион никеля и палладия является —С—С—, [c.161]Сколько свободных З -орбиталей содержится в атоме никеля (N1, 2 = 28) Дать схему электронной структуры. [c.50]
Элементы-металлы входят в состав всех групп периодической системы, кроме нулевой. Химические и физические свойства простых веществ, образованных элементами-металлами, — собственно металлов — имеют ряд особенностей. Металлический блеск, высокая тепло- и электропроводность определяются особенностями электронной структуры атомов металлов. Интересно, что электропроводность различных металлов сильно различается. Это можно легко показать, включив в электрическую цепь с гальванометром поочередно медную, железную и, например, нихромовую проволоку (сплав никеля и хрома). Проволока из меди обладает столь высокой электропроводностью, что гальванометр зашкаливает . Включение в тех же условиях в цепь проволоки из железа дает лишь слабое отклонение стрелки гальванометра. В случае нихромовой проволоки отклонение стрелки гальванометра незаметно — так велико электрическое сопротивление сплава нихром (на этом основано его использование в электронагревательных приборах). [c.252]
Включение в тех же условиях в цепь проволоки из железа дает лишь слабое отклонение стрелки гальванометра. В случае нихромовой проволоки отклонение стрелки гальванометра незаметно — так велико электрическое сопротивление сплава нихром (на этом основано его использование в электронагревательных приборах). [c.252]
К восьмой группе элементов периодической системы относятся три триады железа, рутения и осмия. Номер группы обычно отвечает максимальной валентности элементов по кислороду. На этом базировались попытки К. Горалевича (1929—1932 гг.) получить восьмивалентные соединения железа, никеля и кобальта. Как известно, эти попытки окончились неудачно. Позже Б. Ф. Ормонт, исходя из современных представлений о нормальной и возбужденной валентности, показал, что для этих элементов невозможно достичь валентности, равной восьми. Из девяти элементов этой группы только два элемента рутений и осмий проявляют эту высокую валентность. Поэтому в ряде вариантов периодической системы в последнее время номер 8В над этой группой не ставят. Все рассматриваемые элементы относятся к а -типу, но электронные структуры оболочек атомов железа, кобальта и никеля различны. Если с точки зрения строения атома аналогия -элементов в каждой подгруппе определяется суммарным числом внешних 5- и -электронов слоя, соседнего с внешним, то истинными аналогами следует считать подгруппы элементов, расположенные по вертикали. Таким образом, в 8В-гру-ппе элементов три подгруппы железо-рутений—осмий кобальт—родий—иридий и никель—палладий—платина. Свойства этих элементов и их соединений и будут нами рассматриваться по данным подгруппам. [c.345]
Все рассматриваемые элементы относятся к а -типу, но электронные структуры оболочек атомов железа, кобальта и никеля различны. Если с точки зрения строения атома аналогия -элементов в каждой подгруппе определяется суммарным числом внешних 5- и -электронов слоя, соседнего с внешним, то истинными аналогами следует считать подгруппы элементов, расположенные по вертикали. Таким образом, в 8В-гру-ппе элементов три подгруппы железо-рутений—осмий кобальт—родий—иридий и никель—палладий—платина. Свойства этих элементов и их соединений и будут нами рассматриваться по данным подгруппам. [c.345]
Вид гибридизации и структура комплексного иона зависят как от электронной структуры иона металла, так и от природы лиганда. Например, в основном состоянии свободного иона никеля распределение электронов следующее [c.32]
Рассмотрим, как МВС описывает электронную структуру и свойства некоторых комплексов, образованных металлами первого переходного ряда медью, цинком, никелем и кобальтом. Напомним электронные структуры ионов указанных металлов-комплексообра-зователей [c.162]
Напомним электронные структуры ионов указанных металлов-комплексообра-зователей [c.162]
Комплексные соединения образуются донорно-акцеп-торным способом за счет присоединения комплексообра-зователем определенного числа других ионов, молекул или радикалов, именуемых лигандами. Наиболее распространенными следует считать следующие лиганды анионы — С1-, N-, SOJ-, ОН-, 02-, NH,-, NH -, S N» нейтральные— НгО, NHj, со, N0. В качестве атомов-комплексо-образователей могут быть нейтральные и заряженные частицы. Нейтральными комплексообразователями служат атомы многих элементов побочных подгрупп V, VI, VH, VHI групп периодической системы. Так построены, например, молекулы карбонилов металлов Сг(СО) , Mna( O)jo, Fea( O)ij, N ( 0) . В этих соединениях нейтральные атомы металлов связаны с атомами углерода карбонильных групп СО за счет неподеленной пары электронов атомов углерода и вакантных орбиталей никеля, образуя структуру типа [c.266]
Рассмотрим, как МВС описывает электронную структуру и свойства некоторых комплексов, образованных металлами первого переходного ряда медью, цинком, никелем и кобальтом. [c.114]
[c.114]
Какие соединения образуют железо, кобальт и никель с окисью углерода Как объяснить различный состав этих соединений, исходя из электронных структур незаряженных атомов Fe, Со и Ni [c.264]
Двухзарядный ион никеля N 2+ имеет восемь электронов сверх заполненной оболочки аргона. Эти электроны могут быть размещены на пяти З -орбиталях двумя способами или путем помещения трех электронных пар на трех Зй -орбиталях и по одному неспаренному электрону с параллельными спинами на каждой из двух З -орбиталей, или путем размещения четырех электронных пар на четырех Зй-орбиталях, при этом одна Зй-орбиталь остается для образования связи. Комплексы, в которых положительно двухзарядный ион никеля имеет электронную структуру первого типа, обладают магнитным моментом, что ведет к парамагнетизму, а комплексы, в которых никель с двумя положительными зарядами имеет структуру второго типа, обладают нулевым магнитным моментом. [c.473]
Электронные структуры и степени окисления железа, кобальта, никеля и платиновых металлов [c. 543]
543]
Электронные структуры железа, кобальта, никеля и платиновых металлов указаны в табл. 19.1 эти структуры соответствуют энергетическим уровням, приведенным на рис. 5.6. Следует отметить, что каждый из рассматриваемых атомов имеет два внешних электрона в случае железа, кобальта и никеля это электроны на 45-орбитали, для рутения, родия и палладия — на 5 -орбитали для осмия, иридия и платины — на б5-орбитали. Следующая внутренняя оболочка у этих элементов не завершена Зй-орбиталь (или соответственно 4d- и 5d- [c.543]
Электронные структуры железа, кобальта, никеля и платиновых металлов [c.544]
В каких наиболее характерных валентных состояниях находятся переходные металлы в образуемых ими соединениях Приведите электронные структуры железа, кобальта и никеля в свойственных им валентных состояниях. [c.582]
Значительно улучшают анодные характеристики никеля такие примеси, как Ре, С, 51, 5. Влияние этих примесей состоит в изменении электронной структуры поверхностных атомов никеля. Примеси должны быть многовалентными, чтобы они могли отдавать или присоединять электрон. Ряд других элементов (Се, Сг, Аз. 5Ь, 5п, Р) повышает анодную активность никеля. Одной из наиболее активных добавок является сера [12]. Известна способность серы повышать активность никеля. Никель с серой растворяется при потенциалах, на 0,2—0,4 В более положительных, чем чистый никель. На практике это выражается в том, что низкий потенциал обусловливает более низкое напряжение в ванне и, таким образом, способствует более точному поддержанию необходимой плотности тока и эффективности использования анодного материала аноды растворяются с выходом по току 100 %. [c.143]
Влияние этих примесей состоит в изменении электронной структуры поверхностных атомов никеля. Примеси должны быть многовалентными, чтобы они могли отдавать или присоединять электрон. Ряд других элементов (Се, Сг, Аз. 5Ь, 5п, Р) повышает анодную активность никеля. Одной из наиболее активных добавок является сера [12]. Известна способность серы повышать активность никеля. Никель с серой растворяется при потенциалах, на 0,2—0,4 В более положительных, чем чистый никель. На практике это выражается в том, что низкий потенциал обусловливает более низкое напряжение в ванне и, таким образом, способствует более точному поддержанию необходимой плотности тока и эффективности использования анодного материала аноды растворяются с выходом по току 100 %. [c.143]
Метод ВС дал возможность объяснить, а иногда и предсказать магнитные свойства комплексов. Покажем это на примере комплексов двухвалентного никеля. Его электронная структура может быть представлена в виде [c.271]
На основе изучения методом дифракции электронов структур, образующихся на чистых поверхностях кристаллов после воздействия двух различных газов, можно надеяться получить некоторые фундаментальные данные, касающиеся механизма взаимодействия. Хотя проведено лишь очень небольшое число опытов, полученные результаты подтверждают ценность этого способа. Водород не поддается непосредственному определению из-за его малой рассеивающей способности, но его присутствие можно обнаружить по действию, которое он оказывает на другие структуры. Так, было показано, что при воздействии водорода и кислорода на грани (100) поверхности никеля результаты зависят от величины экспозиции. Воздействие водорода на покрытую кислородом поверхность не вызывало никакого эффекта. Однако, когда поверхность, покрытая водородом, подвергалась действию кислорода, образовывалась новая решетка гидрида никеля. В первом случае связи кислорода с никелем препятствовали последующему изменению структуры под влиянием водорода. [c.344]
Хотя проведено лишь очень небольшое число опытов, полученные результаты подтверждают ценность этого способа. Водород не поддается непосредственному определению из-за его малой рассеивающей способности, но его присутствие можно обнаружить по действию, которое он оказывает на другие структуры. Так, было показано, что при воздействии водорода и кислорода на грани (100) поверхности никеля результаты зависят от величины экспозиции. Воздействие водорода на покрытую кислородом поверхность не вызывало никакого эффекта. Однако, когда поверхность, покрытая водородом, подвергалась действию кислорода, образовывалась новая решетка гидрида никеля. В первом случае связи кислорода с никелем препятствовали последующему изменению структуры под влиянием водорода. [c.344]
Максимальная скорость изотопного обмена при адсорбционно-десорбционном механизме соответствует заполнению хемосорбированным водородом —0,5 поверхности. Поэтому значение энергии связи водорода с поверхностью должно быть не слишком большим и не слишком малым. Такому оптимальному содержанию d-электронов соответствует электронная структура никеля и платины. При переходе к меди — металлу с заполненной d-зоной — энергия связи водорода с поверхностью металла и скорость хемосорбции резко уменьшаются. [c.56]
Такому оптимальному содержанию d-электронов соответствует электронная структура никеля и платины. При переходе к меди — металлу с заполненной d-зоной — энергия связи водорода с поверхностью металла и скорость хемосорбции резко уменьшаются. [c.56]
Результаты проведенного нами исследования не подтверждают мнения, что удельная каталитическая активность окислов однозначно определяется электронной структурой катиона. Так, удельные активности окиси хрома и двуокиси марганца резко различаются, несмотря на то, что их катионы имеют одинаковое количество электронов. Не согласуется с этим предположением и сильная зависимость каталитической активности окислов никеля и меди от содержания кислорода. [c.71]
Полинг [1] придерживается точки зрения, согласно которой между металлическими и обычными ковалентными связя.ми пет существенного различия (впервые эту мысль высказал Го,)ьд-шмидт в 1928 г.). Однако в металлических кристаллах и отличие от обычных кристаллов с ковалентными связями, а1С правило, реализуются очень высокие координационные числа. Более того, в таких металлах, как натрий, для образования 8+6 связей в ОЦК-структуре доступны только четыре орбитали (одна 5 и три р). Полинг предположил, что в образовании связей участвуют все или большинство внешних электронов атома, включая -электроны в с/гучае переходных металлов, п что существует особый тип резонанса (см. ниже). Из этнх положений следует, что кратность связи и валентность могут б ,иь дробными величинами. Уменьшение размеров атомов в ряду К, Са, 5с, Т1, V (аналогично от КЬ к МЬ и от Сз к Та) и примерное постоянство размеров атомов для элемента V— ТИ групп в каждом ряду переходных металлов объясняется следующим образом. При переходе от К к V происходят увеличение числа связывающих электронов от 1 до 5 и постепенный рост числа ковалентных связей, участвующих в резонансе, и, следовательно, монотонное уменьшение межатомных расстояний. Далее предполагается, что у атомов элементов от Сг до N1 в связывании участвуют не все девять имеющихся орбиталей (одна а, три р и пять с1), а лишь 5,78 из них являются устойчивыми сиязываюнти.
Более того, в таких металлах, как натрий, для образования 8+6 связей в ОЦК-структуре доступны только четыре орбитали (одна 5 и три р). Полинг предположил, что в образовании связей участвуют все или большинство внешних электронов атома, включая -электроны в с/гучае переходных металлов, п что существует особый тип резонанса (см. ниже). Из этнх положений следует, что кратность связи и валентность могут б ,иь дробными величинами. Уменьшение размеров атомов в ряду К, Са, 5с, Т1, V (аналогично от КЬ к МЬ и от Сз к Та) и примерное постоянство размеров атомов для элемента V— ТИ групп в каждом ряду переходных металлов объясняется следующим образом. При переходе от К к V происходят увеличение числа связывающих электронов от 1 до 5 и постепенный рост числа ковалентных связей, участвующих в резонансе, и, следовательно, монотонное уменьшение межатомных расстояний. Далее предполагается, что у атомов элементов от Сг до N1 в связывании участвуют не все девять имеющихся орбиталей (одна а, три р и пять с1), а лишь 5,78 из них являются устойчивыми сиязываюнти. ми 5р -орбпталями, еще имеются 2,44 атомной несвязывающей ( /-орбиталн, а оставшиеся 0,78 металлической орбитали обеспечивают несинхронный резонанс между отдельными валентными связями. Эти значения былн вычислены из магнитной восприимчивости (при насыщении) ферромагнит1н. железа, кобальта и никеля. Электронные структуры Полинга для ряда металлов приведены в табл. 29.6. У атомов Сг, А л и Ре число -электронов меньше, чем число орбиталей, так что спаривания спинов не происходит. Одиако у атома Со на 3,12 [c.459]
ми 5р -орбпталями, еще имеются 2,44 атомной несвязывающей ( /-орбиталн, а оставшиеся 0,78 металлической орбитали обеспечивают несинхронный резонанс между отдельными валентными связями. Эти значения былн вычислены из магнитной восприимчивости (при насыщении) ферромагнит1н. железа, кобальта и никеля. Электронные структуры Полинга для ряда металлов приведены в табл. 29.6. У атомов Сг, А л и Ре число -электронов меньше, чем число орбиталей, так что спаривания спинов не происходит. Одиако у атома Со на 3,12 [c.459]
Однако из всего многообразия изучешхых систем в конечном итоге отдается предпочтение в настоящее время значительно меньшему числу элементов и их сочетанию — это кобальт, никель, молибден, реже вольфрам, платина, ванадий, железо. Выбор подобных элементов определяется многими факторами, положительно характеризующими их мак с позиций их электронной структуры, так и свойств их солей и соединений, определяющих и технологичность операций создания катализатора, и применимость в практике созданной каталитической системы. Итак, круг элементов, используемых в синтезе катализатора гидрообессеривания нефтяных остатков, значительно сузился. [c.94]
Итак, круг элементов, используемых в синтезе катализатора гидрообессеривания нефтяных остатков, значительно сузился. [c.94]
Следует иметь в виду, что последняя схема (как и сами правила Клечковского) не отражает частных особенностей электронной структуры атомов некоторых элементоа. Например, при переходе от атома никеля (2 = 28) к атому меди (2 = 29) число Зй-электронов увеличивайся не иа один, а сразу на два за счет проскока одного из 45-электронов на подуровень З . Таким образом, электронное строение атома меди выражается формулой Аналогичный проскок электрона с внешнего на й-иодуро-вень предыдущего слоя происходит и в атомах аналогов меди — серебра и золота. Это явление связано с повышенной энергетической устойчивостью электронных структур, отвечающих полностью занятым энергетическим подуровням (см. 34). Переход электрона Б атоме меди с подуровня 4 на пп 1урсвонь 3 (и аналогичные переходы в атомах серебра и золота) приводит к оОразовгшню целиком заполненного -подуровня н поэтому оказывается энергетически выгодным. [c.98]
[c.98]
Если для комплексов тетракоординированного никеля (электронная конфигурация центрального иона (Р) относительные энергии плоской и тетраэдрической структур настолько близки, что эти формы существуют в динамическом равновесии друг с другом, то для комплексов металлов с заполненной /-оболочкой (2п, Сс1, Иg, РЬ) плоская форма энергетически невыгодна. Однако разность энергий тетраэдрической и плоской форм намного меньще, чем в случае соединений непереходных элементов. Это объясняется тем, что [c.474]
При образовании комплекса распределение электронов на -орбиталях комплексообразователя может оставаться таким же, как у изолированного иона, или испытывать изменения (табл. 14). В приведенных примерах медь, никель в [К1С14]2 и кобальт в [СоГб] сохранили электронную структуру катионов, в то [c.114]
Природа связи N1—I точно пе выяснена, так как в присутствии метильных групп, располагающихся сверху и снизу от экваториальной плоскости, возникают стерические препятствия, что приводит к удлинению связи никель — иод. Изучение структуры таких соединений, как [N1 (диарсин)з](СЮ4)2, которые част рассматривают в качестве примеров спин-спаренных октаэдрических комплексов N (11), по-впднмому, пе проводилось. (Данные об электронной структуре парамагнитного комплекса [N1 (диарсин)2С12]С1, содержащего один неспаренный электрон, малодостоверны [6].) [c.386]
Изучение структуры таких соединений, как [N1 (диарсин)з](СЮ4)2, которые част рассматривают в качестве примеров спин-спаренных октаэдрических комплексов N (11), по-впднмому, пе проводилось. (Данные об электронной структуре парамагнитного комплекса [N1 (диарсин)2С12]С1, содержащего один неспаренный электрон, малодостоверны [6].) [c.386]
СВЯЗИ атом водорода — металл и составом сплава. Интересные зависимости от геометрических факторов структуры металла были получены при изучении сплава никель— палладий. Палладий и никель имеют близкую электронную структуру, но разные размеры атомов. Учитывая, что энергия активации выше ири больших размерах решетки (палладий), можно было ожидать увеличения тока обмена с уменьшением содержания никеля (меньшие размеры решетки). Экспериментальпо подтверждена такая зависимость (рис. 2.8). Заметим, что эти исследования носят чисто качественный характер, поскольку дефекты, неизбежно существуюш,ие на поверхности реальных тел, искажают параметры решетки и [c. 64]
64]
Биметаллические системы интересуют ученых, специализирующихся в области катализа (каталитиков), уже в течение длительного времени. Многие первоначальные работы в -этой об-ласти, касающиеся зависимости между каталитической активностью и электронной структурой металлов, базировались на ранних концепциях, предложенных Дауденом [14, 15] и Швабом [16]. Основой этих работ было учение о каталитической активности как функции состава сплава, поскольку последний определяет электронные свойства металла. В этом отношении сплавам металлов группы VIII и подгруппы 1Б (например, никель— медь) уделялось особое внимание, так как обычно предполагается, что ui-электроны играют важную роль в определении каталитической активности. Считается, что для этих сплавов металл подгруппы 1Б — донор s-электронов для d-оболочки металла группы VIII, а это делает возможным контролировать плотность d-электронов. [c.20]
Метод УФЭС был использован также для исследования электронной структуры поверхностей металлов и сплавов. Например, Хельме и др. [55] изучали электронную структуру поверхности, состав и энергию связи СО для Си—Ы1-сплавов. Отдельные пики в электронной структуре поверхности были приписаны N1 и Си. Это находится в противоречии с тем, что должно ожидаться по модели жестких полос. Было найдено, что энергия связи СО на сплаве изменяется квазинепрерывным образом в зависимости от состава поверхности сплава, который изменяется от чистого никеля до чистой меди (через непрерывный ряд промежуточных сплавов). Был сделан вывод, что энергия связи определяется локальной конфигурацией адсорбционного места. Это находится в противоречии с моделью, основанной на средней электронной структуре поверхности. [c.160]
Например, Хельме и др. [55] изучали электронную структуру поверхности, состав и энергию связи СО для Си—Ы1-сплавов. Отдельные пики в электронной структуре поверхности были приписаны N1 и Си. Это находится в противоречии с тем, что должно ожидаться по модели жестких полос. Было найдено, что энергия связи СО на сплаве изменяется квазинепрерывным образом в зависимости от состава поверхности сплава, который изменяется от чистого никеля до чистой меди (через непрерывный ряд промежуточных сплавов). Был сделан вывод, что энергия связи определяется локальной конфигурацией адсорбционного места. Это находится в противоречии с моделью, основанной на средней электронной структуре поверхности. [c.160]
Изучение связи каталитической активности переходных металлов с их электронной структурой удобно проводить на сплавах металлов, так как сплавление позволяет плавно регулировать электронную структуру. Изучение систем никель — медь и никель — кобальт особенно интересно, поскольку в первой системе с увеличением содержания меди число неспаренных электронов в -зопе сплава падает, а во второй, с увеличением содержания кобальта — возрастает. [c.182]
[c.182]
Широкое применение при гидрировании кратных С==С-связей нашли сплавы меди с никелем, палладием, алюминием. В настоящее время считается признанным, что каталитическая и хемосорбционная активность в реакциях окислительновосстановительного типа связана с электронной конфигурацией переходных металлов, с незаполненностью их -уровней [291, 292]. При сплавлении переходных металлов с другими металлами, дающими твердые растворы, можно получить набор катализаторов, отличающихся электронной структурой. Например, медь и никель дают непрерывный ряд твердых растворов, в которых -зона никеля постепенно заполняется электронами меди, что должно изменять каталитическую активность. -Уровень никеля полностью заполняется при содержании меди 60%. В согласии с теорией Даудена можно ожидать, что при достижении этого критического состава активность сплава должна резко упасть. [c.98]
Хотя приведенные примеры и. указывают на взаимосвязь электронной структуры металлов со скоростью катализируемых ими реакций, такая зависимость не может быть универсальной и однозначной. Очевидно, что характер и направление изменений скорости процесса должны прежде всего за-висеть. от механизма, реакции и природы лимити-руюше,й стадии. Как отмечает Г. К. Боресков [611], степень заполнения -зоны, отвечающая максимальной скорости реакции, может быть для разных реакций различной, в зависимости от механизма процесса и конфигурации активированного комплекса. А. А. Баландин и П. Те-тени [612], на основании своих данных указывают, что одним изменением числа -вакансий металла нельзя объяснить различия скорости реакции дегидрирования спиртов. Я. Б. Гороховатский [635] не обнаружил взаимосвязи изменений работы выхода электрона серебряного катализатора и скорости реакции окисления этилена. X. Кинза и Г. Ринекер [636] отмечают, что изменения каталитической активности сплавов никеля с железом разного состава не отвечают предсказываемым теорией Д. Даудена. [c.267]
Очевидно, что характер и направление изменений скорости процесса должны прежде всего за-висеть. от механизма, реакции и природы лимити-руюше,й стадии. Как отмечает Г. К. Боресков [611], степень заполнения -зоны, отвечающая максимальной скорости реакции, может быть для разных реакций различной, в зависимости от механизма процесса и конфигурации активированного комплекса. А. А. Баландин и П. Те-тени [612], на основании своих данных указывают, что одним изменением числа -вакансий металла нельзя объяснить различия скорости реакции дегидрирования спиртов. Я. Б. Гороховатский [635] не обнаружил взаимосвязи изменений работы выхода электрона серебряного катализатора и скорости реакции окисления этилена. X. Кинза и Г. Ринекер [636] отмечают, что изменения каталитической активности сплавов никеля с железом разного состава не отвечают предсказываемым теорией Д. Даудена. [c.267]
Шваб и Хартман изучили разложение озона [518], считая, что электронные структуры Од и N3O очень похожи, а следовательно, и закономерности подбора катализаторов должны быть такими же. Действительно, подтвердилась высокая активность твердых оснований (ВаО, КОН) и окислов переходных металлов по сравнению с непереходными. В ряду окислов металлов 4-го периода, как и при разложении NgO, активность возрастала при переходе от FegOg к окислам никеля (рис. 78). [c.165]
Действительно, подтвердилась высокая активность твердых оснований (ВаО, КОН) и окислов переходных металлов по сравнению с непереходными. В ряду окислов металлов 4-го периода, как и при разложении NgO, активность возрастала при переходе от FegOg к окислам никеля (рис. 78). [c.165]
Это противоречие свидетельствует о том, что обнаруженное на опыте изменение химической адсорбции нельзя объяснить с этих позиций. Сопоставление химической адсорбции на закиси никеля и ее тройных твердых растворах с одинаковой электропроводностью свидетельствует об отсутствии прямой связи между адсорбционными свойствами и электропроводностью, т. е. уровнем химического потенциала и энергией активации электропроводности. Из этого, однако, не следует, что связь между электронной структурой твердого тела и его адсорбционными свойствами не существует. Наше исследование однозначно говорит в пользу ее существования. Закономерности адсорбции газов — доноров и акцепторов электронов изменяются в противоположных направлениях, что, не-сомгтетгно, связано с влиянием электронной структуры. [c.86]
[c.86]
Khimia_3 — Стр 2
11
Р*… 3s2 3p3 3d1
Рисунок 5 – Электронная конфигурация атома фосфора в возбужденном состоянии
При этом валентность фосфора меняется с трех (РСl3) – в основном состоянии до пяти (РCl5) – в возбужденном.
На рисунке 6 показано расширение атомной валентной зоны атома никеля (28Ni 1s22s22p63s23p63d84s2).
Рисунок 6 – Расширение атомной валентной зоны атома никеля
Валентность никеля в основном состоянии равна нулю, т. к. неспаренные электроны на d-подуровне экранированы электронной парой на s-подуровне. При определении валентности атома никеля в возбужденном состоянии следует учитывать, что хотя у никеля присутствуют и спаренные электроны на 3d-подуровне, и вакантные места на 4р-подуровне, мы не можем переместить эти электроны с 3d-подуровня на 4р-подуровень, поскольку это различные энергетические уровни. В возбуждённом состоянии валентность никеля составляет значение от 2 до 5.
В возбуждённом состоянии валентность никеля составляет значение от 2 до 5.
1.5 Проскок (провал) электронов
Проскок электрона – отступления от общей для большинства элементов последовательности заполнения электронных оболочек, связанные с тем, что эти «нарушения правил» обеспечивают атомам некоторых элементов меньшую энергию по сравнению с заполнением электронных оболочек «по правилам».
Объясняется это тем, что энергетически более выгодно, когда в атоме имеется наполовину или полностью заполненный подуровень (р3; р6; d5; d10; f7; f14). Поэтому в атомах элементов, у которых строение электронной оболочки близко к вышеуказанному, может наблюдаться преждевременное заполнение d-подуровня за счёт проскока (или провала) электрона с внешнего s-подуровня на нижележащий (предвнешний) d-подуровень.
Для ряда элементов закономерные проскоки приведены в таблице 1.
12
Таблица 1 – Проскоки электронов
Элемент | Атомная валентная зона | |
|
| |
| теоретическая | практическая |
|
|
|
Cu | 3d9 4s2 | 3d10 4s1 |
Ag | 4d9 5s2 | 4d10 5s1 |
Au | 5d9 6s2 | 5d10 6s1 |
Cr | 3d4 4s2 | 3d5 4s1 |
Mo | 4d45s2 | 4d5 5s1 |
Согласно приведенным электронным конфигурациям медь одновалентна, так как в атоме только один неспаренный электрон.
На практике оказывается, что Cu проявляет валентность, равную двум. Следовательно, возможен, вопреки правилу, переход одного проскочившего электрона с предпоследнего 3d-подуровня на внешний 4р-подуро- вень. На рисунке 7 показано расширение атомной валентной зоны атома меди.
| 3d |
| 4s |
|
| 4p |
|
| 3d |
| 4s |
| 4p | |||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рисунок 7 – Расширение атомной валентной зоны атома меди
В этом случае максимальная валентность меди будет равна трем. На практике медь проявляет валетность (В), равную единице и двум.
На практике медь проявляет валетность (В), равную единице и двум.
Для золота характерна валентность В = 1; 2; 3. Расширение валентной зоны происходит таким же образом, как у меди. На практике золото чаще имеет валентность, равную трем, поскольку оно стоит в шестом периоде и электроны ядром удерживаются слабее.
Серебро же, хотя и имеет сходную структуру АВЗ, чаще проявляет валентность, равную единице.
Хром и молибдена имеют одинаковое строение АВЗ и проявляют одинаковую валентность от двух до шести.
13
2 Периодическая система элментов
Всовременной формулировке периодический закон звучит так:
свойства химических элементов, а также свойства и форма образуемых ими соединений находятся в периодической зависимости от заряда их атомов и определяются периодически повторяющимися однотипными электронными конфигурациями их атомов.
Периодическая система состоит из периодов и групп.
Периодом называется последовательный ряд элементов, располо-
женных в порядке возрастания заряда ядра их атомов, электронная конфигурация которых изменяется от ns1 до ns2np6 (или до ns2 у первого периода).
Все периоды начинаются с s-элемента и заканчиваются p-элементом (у первого периода s-элементом). Малые периоды содержат 2 и 8 элементов, большие периоды – 18 и 32 элемента, седьмой период остается незавершенным.
По вертикали в таблице расположено 8 групп, в которых один под другим размещены элементы, имеющие сходные свойства. Атомы эле-
ментов одной и той же группы имеют одинаковое число валентных электронов.
Количество валентных электронов в оболочке атома, как правило, равно номеру группы, в которой находится элемент.
Группы делятся на подгруппы – главные и побочные. Подгруппы включают в себя элементы с аналогичными электронными структурами (элементы-аналоги).
Вглавных подгруппах расположены s-элементы (I, II групп) и p-элементы (III–VIII групп). В атомах элементов главных подгрупп валентные электроны находятся на s- и р-подуровнях внешнего энергетического уровня и общее их число равно номеру группы.
Впобочных подгруппах располагаются d- и f-элементы. Валентные электроны в атомах d-элементов находятся на s-подуровне внешнего и d-подуровне предпоследнего энергетических уровней.
Валентные электроны в атомах d-элементов находятся на s-подуровне внешнего и d-подуровне предпоследнего энергетических уровней.
Номер группы показывает высшую валентность элемента (кроме O, F, элементов подгруппы меди и восьмой группы).
2.1 Периодичность атомных характеристик
От положения элементов в периодической системе зависят свойства атома, связанные с его электронной конфигурацией: атомный радиус, энергия ионизации, электроотрицательность.
2.1.1 Атомный радиус. Атомы не имеют строго определенных границ из-за корпускулярно-волнового характера электронов. Поэтому абсолютное значение радиуса атома определить невозможно. Можно условно принять за радиус атома теоретически рассчитанное значение расстояния
14
от ядра до наиболее удаленного от него максимума электронной плотности или половину расстояния между центрами двух атомов в кристаллах.
Атомные радиусы в периодах с ростом порядкового номера элемента уменьшаются, т. к. при одинаковом числе электронных слоев возрастает заряд ядра, которыйсжимает электронные оболочки.
В пределах каждой подгруппы элементов радиусы атомов увеличиваются сверху вниз, так как возрастаетчислоэнергетическихуровней.
2.1.2 Энергия ионизации. Одним из важнейших свойств химического элемента, непосредственно связанным с электронной структурой атома, является ионизационный потенциал. Ионизационным потенциалом ЕИ называется та наименьшая энергия, которую необходимо затратить, чтобы отде-
лить электрон от атома и удалить его на бесконечно большое расстояние:
Э – e → Э+ − Еи .
Величину ионизационного потенциала принято выражать в элек- трон-вольтах на атом (эВ/атом) или килоджоулях (кДж/моль) на моль. Атомы элементов – восстановителей, теряя электроны, превращаются в положительно заряженные ионы. Для данного атома или молекулы энергия, необходимая для удаления первого электрона, называется первым ионизационным потенциалом E1, второго – вторым ионизационнымпотенциаломЕ2 и такдалее.
Атомы с небольшим потенциалом ионизации проявляют восстановительные свойства. Атомы с высоким потенциалом ионизации находятся в нейтральном состоянии. Потенциал ионизации возрастает по периоду. В пределах главных подгрупп потенциал ионизации убывает с увеличением порядкового номера элементов. Это обусловлено увеличением размеров атомов и расстояниемвнешних электронов отядра.
Атомы с высоким потенциалом ионизации находятся в нейтральном состоянии. Потенциал ионизации возрастает по периоду. В пределах главных подгрупп потенциал ионизации убывает с увеличением порядкового номера элементов. Это обусловлено увеличением размеров атомов и расстояниемвнешних электронов отядра.
2.1.3Энергия сродства к электрону. Сродством к электрону называет-
ся энергия Еср , которая выделяется при присоединении электрона к атому, молекуле или радикалу: Э + e → Э− + Еср.
Сродство к электрону выражается в тех же единицах, что и ионизационныйпотенциал.
Атомы элементов-окислителей, принимая электроны, превращаются в отрицательно заряженные ионы. Энергия сродства к электрону изменяется
всоответствии с характером электронных структур атомов элементов. В периодах слева направо сродство к электрону и окислительные свойства
элементов возрастают. Наибольшие значения имеют галогены, кислород, сера, наименьшие – элементы с электронной конфигурацией s2 (Не, Ве, Мg, Zn) или наполовину заполненными р-подоболочками(Ne, Аг, Кг, N, Р, Аs).
2.1.4Электроотрицательность. Для характеристики способности атомов в соединениях притягивать к себе электроны введено понятие электроотрицательности (ЭО). Учитывая, что эта способность атомов зависит от типа соединений, валентного состояния элемента, данная характеристика имеетусловныйхарактер.
15
Имеется несколько шкал электроотрицательности. Согласно Р. Малликену, она равна полусумме энергии ионизации и энергии сродства к электрону:
ЭО = (Еи + Еср) / 2.
Учитывая сложность определения величины сродства к электрону, американский ученый Л. Полинг предложил вместо абсолютных значений электроотрицательности использовать относительные значения. Он принял электроотрицательность фтора равной 4. Тогда электроотрицательность лития, по отношению к которой были определены электроотрицательности других элементов, получиласьравной1.
Электроотрицательность возрастает слева направо для элементов каждого периода и уменьшается в направлении сверху вниз для элементов одной и тойжегруппыпериодическойсистемыД. И. Менделеева.
И. Менделеева.
2.1.5 Металлические свойства рассматриваются как способность атомов элементов легко отдавать электроны, а неметаллические – присоединять электроны из-за стремления атомов приобрести устойчивую конфигурацию с заполненными подуровнями. Заполнение внешнего s-подуровня указывает на металлические свойства атома, а формирование внешнего p-подуровня – на неметаллические. Увеличение числа электронов на p-подуровне (от 1 до 5) усиливает неметаллические свойства атома. Атомы с полностью сформированной, энергетически устойчивой конфигурацией внешнего электронного слоя (ns2 np6) химически инертны.
Вбольших периодах переход свойств от активного металла к благородному газу происходит более плавно, чем в малых периодах, т. к. происхо-
дит формирование внутреннего (n – 1) d-подуровня при сохранении внешнего ns2-слоя. Большие периоды состоят из четных и нечетных рядов.
У элементов четных рядов на внешнем слое ns2-электроны, поэтому преобладают металлические свойства и их ослабление с ростом заряда ядра невелико; в нечетных рядах формируется np-подуровень, что объясняет значительное ослабление металлических свойств.
Вглавных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают.
2.1.6 Окислительно-восстановительные свойства нейтральных ато-
мов. Эти свойства определяются значениями энергии ионизации и сродства к электрону. Восстановительные свойства проявляет атом, отдающий электрон, а окислительные – атом, его принимающий.
Впериоде слева направо восстановительные свойства ослабевают, т.к. потенциал ионизации возрастает.
Вподгруппах сверху вниз восстановительные свойства нейтральных атомов усиливаются, поскольку потенциал ионизации в этом направлении уменьшается.
Окислительные свойства, напротив, усиливаются слева направо в периоде и ослабевают сверху вниз в подгруппе, что связано с тенденциями
визменении сродства к электрону.
16
2.1.7 Кислотно-основные свойства соединений. Свойства оксидов и гидроксидов элементов зависят главным образом от заряда и радиуса центрального атома. С ростом положительного заряда (точнее, степени окисления) центрального атома кислотный характер этих соединений становится более выраженным (таблица 2).
Таблица 2 – Изменение окислительно-восстановительных свойств соединений элементов третьего периода
Катион | Na+ | Mg2+ | Al3+ | Si4+ | P5+ | S6+ | Cl7+ |
элемента |
|
|
|
|
|
|
|
Высший | Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 |
оксид |
|
|
|
|
|
|
|
Гидроксид | NaOH | Mg(OH)2 | Al(OH)3 | h3SiO3 | h4PO4 | h3SO4 | HClO7 |
высшего |
|
|
|
|
|
|
|
оксида |
|
|
|
|
|
|
|
Кислотно- | Основные | Амфо- | Слабо- | Средне- | Сильно- | ||
основные |
|
| терный | кислот- | кислот- | кислотные | |
свойства |
|
|
| ный | ный |
|
|
Сверху вниз в подгруппе при равенстве заряда (степени окисления) центрального атома с увеличением его радиуса кислотные свойства оксидов и гидроксидов ослабевают, а основные – усиливаются: h4BO3 – слабая кислота, Al(OH)3, Ga(OH)3, In(OH)3 – амфотерные гидроксиды, Tl(OH)3
проявляет более выраженные основные свойства.
Аналогичная зависимость характерна для кислородсодержащих кислот элементов VI группы: сила кислот убывает в ряду h3SO4, h3SeO4,
h3TeO4.
Для элементов главных подгрупп общими являются формулы водородных соединений. Элементы главных подгрупп I–III групп образуют твердые вещества – гидриды (водород в степени окисления – 1), а IV–VII групп – газообразные. Водородные соединения элементов главных подгрупп IV группы (ЭН4) – нейтральны, V группы (ЭН3) – основания, VI и VII групп (Н2Э и НЭ) – кислоты.
d-элементы побочных подгрупп склонны проявлять переменную степень окисления. Характер образуемых ими соединений зависит от степени окисления элемента. Соединения, в которых элемент находится в низшей степени окисления, имеют основной характер, в высшей степени – кислотный, в промежуточной – амфотерный. Например, хром проявляет степени
окисления +2, +3, +6 и характер образуемых им оксидов следующий: Cr+2O – основной, Cr+32O3 – амфотерный, Cr+6O3 – кислотный.
17
3 Химическая связь
Химической связью называют различные виды взаимодействий, обуславливающие устойчивое существование двух- и многоатомных соединений: молекул, ионов, кристаллов и других веществ. При образовании химической связи происходит: снижение общей энергии двух- и многоатомной системы по сравнению с суммой энергий изолированных частиц, из которых эта система состоит; перераспределение электронной плотности в области химической связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние длины связи.
При образовании химической связи происходит: снижение общей энергии двух- и многоатомной системы по сравнению с суммой энергий изолированных частиц, из которых эта система состоит; перераспределение электронной плотности в области химической связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние длины связи.
Энергией химической связи Есв называют количество энергии, выделяющееся при образовании связи.
Чем больше энергия связи, тем устойчивее молекула, тем прочнее
связь.
Важной характеристикой связи является длина связи 1св, равная расстоянию между ядрами атомов в соединении. Она зависит от размеров электронных оболочек и степени их перекрывания. Связь обозначается черточкой, например: Н – J, О = О, Н – С = С – Н.
Правило октета. В результате образования химической связи атомы стремятся приобрести такую же электронную конфигурацию, как у благо-
родных газов ns2nр6, то есть восемь электронов на внешней оболочке. На-
На-
пример, N 1s22р3 + 3 Н1s1 = Nh4.
3.1 Основныевидыхимическойсвязи
3.1.1 Ковалентной связью называется химическая связь, образованная путем обобществления пары электронов двумя атомами. При этом снижается энергия системы.
Особенностями ковалентной химической связи являются ее направ-
ленность и насыщенность.
Направленность ковалентной связи объясняется тем, что атомные орбитали пространственно ориентированы и перекрывание электронных облаков происходит по определенным направлениям. Количественно она выражается в виде валентных углов между направлениями химической связи в молекуле.
Насыщаемость связана с ограничением числа электронов, находящихся на внешних оболочках, и определяет стехиометрию молекулярных химических соединений, от которой зависят формульный состав, массовые соотношенияэлементов, расчетыпоформуламиуравнениямит. д.
Полярность ковалентной связи. Связь, образованная одинаковыми атомами, называется гомеополярной, или неполярной, так как обобществленные электроны равномерно распределены междуатомами, например, вмолеку-
лахН2, О2, N2, S8.
18
Еслижеодиниз атомов сильнее притягивает электроны, то электронная пара смещается к нему и возникающая связь называется ковалентной
полярной.
Чем выше электроотрицательность (ЭО) атома, тем более вероятно смещение электронной пары в сторону ядра данного атома, поэтому разность ЭО ( ЭО) атомов характеризует полярность связи. Атом, к которому смещается электронная плотность, приобретает эффективный заряд δ–, второй атом имеет эффективный заряд δ+. Вследствие этого возникает диполь, имеющий два одинаковых по величине заряда δ+ и δ- и длину 1Д. Мерой полярности связи служит электрический момент диполя μсв = δ·1Д, Кл·м, где δ – эффективный заряд, 1Д – длина диполя. В качестве внесистемной единицы для измеренияμиспользуют Дебай D, 1 D = 3,3·10-30 Кл·м.
Порядок связи (кратность связи) – это число обобществленных поделенных пар между двумя связанными атомами. Чем выше порядок связи, тем прочнее связаны между собой атомы и тем короче сама связь.
Например, порядок связи в молекулах h3, O2 и N2 равен 1, 2 и 3 соответственно, поскольку связь в этих случаях образуется за счёт перекрывания одной, двух и трех пар электронных облаков.
В образовании ковалентной связи могут принимать участие АО как одинаковой, так и различной симметрии. При перекрывании АО вдоль линии соединения атомов образуется σ-связь. Схема образования σ-связи приведена на рисунке 8.
Рисунок 8 – Схема образования σ-связи
При перекрывании АО по обе стороны от линии соединения атомов образуется π-связь. Схема образования π-связи приведена на рисунке 9.
Рисунок 9 – Схема образования π-связи
19
3.1.2 Донорно-акцепторная связь. Донорно-акцепторная связь, а точнее, донорно-акцепторный механизм образования ковалентной связи, реализуется за счет обобществления пары электронов, принадлежащих одному атому (донору) и вакантной орбитали другого атома (акцептору).
Например, у атома азота имеется три неспаренных электрона, которые образуют три ковалентные связи с тремя атомами водорода, по обменному механизму; но он может образовать еще одну связь за счет неподеленной пары электронов по донорно-акцепторному механизму с образованием иона аммония:
.
3.1.3 Ионная связь. Ионная связь – крайний случай ковалентной связи. Такая связь возникает между атомами, ЭО которых больше 2, например, между s-элементами I группы и р-элементами VI и VII групп (LiF, К2О, СsС1). Ионная химическая связь представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов. Так как электрическое поле иона имеет сферический характер, то для ионной связи не характерны направленность и насыщаемость. Ионная химическая связь проявляется в твердых веществах с ионной кристаллической решеткой. Так как энергия ионизации больше энергии сродства к электрону, то полного перехода электронов не происходит даже в случае пары атомов с большой ЭО. Поэтому и чисто ионные связи не существуют. Можно лишь говорить о той или инойдолиионностисвязи.
Таким образом, при образовании полярных ковалентных и ионных связей на атомах возникают электрические заряды. Величины зарядов не имеют целочисленных значений. В практических целях их удобно представлять в виде целых чисел, равных таким зарядам, которые возникли бы на атомах, если бы валентные электроны полностью переходили к более электроотрицательным атомам, т. е. если бы связи были полностью ионными.
е. если бы связи были полностью ионными.
Такие величины зарядов получили название степеней окисления. Степень окисления любого элемента в простом веществе всегда равна 0. В молекулах сложных веществ некоторые элементы всегда имеют постоянную степень окисления. Для большинства элементов характерны переменные степени окисления, различающиеся как знаком, так и величиной, в зависимости от состава молекулы.
Определение степени окисления элемента в какой-либо молекуле сводится к простой арифметической операции, так как сумма степеней окисле-
20
ния атомов всех элементов, входящих в состав молекулы, равна нулю. Например, необходимо определить степень окисления фосфора в
фосфорной кислоте Н3РО4. Поскольку у кислорода СО – –2, а у водорода – +1, то для нулевой суммы у фосфора степень окисления должна быть равна 5:
[3· (+ 1) + 1· (+ 5) + 4· (–2) = 0].
3.1.4 Металлическая связь. Металлическая связь – связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». Как следствие, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве.
В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». Как следствие, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве.
3.1.5 Метод валентных связей (ВС). Структура и свойства молекул с ковалентной связью могут быть объяснены с позиций метода валентных связей (ВС)
Основные положения метода ВС:
–по методу ВС химическая связь между двумя атомами возникает в результате перекрывания атомных орбиталей (АО) с образованием электронных пар;
–образованная электронная пара локализована между двумя атомами. Такая связь является двухцентровой и двухэлектронной;
Такая связь является двухцентровой и двухэлектронной;
–химическая связь образуется только при взаимодействии электронов с антипараллельными спинами;
–характеристики химической связи (энергия, длина, полярность, валентные углы) определяются типом перекрывания АО;
–ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов.
На рисунке 10 приведена схема образования связи в молекуле фтора F2 по методу ВС.
Конфигурация атомов и электронное взаимодействие в сплавах системы «Fe Cr, Fe Ni, Fe v» Текст научной статьи по специальности «Технологии материалов»
УДК 621.74: 669.14
КОНФИГУРАЦИЯ АТОМОВ И ЭЛЕКТРОННОЕ ВЗАИМОДЕЙСТВИЕ В СПЛАВАХ СИСТЕМЫ «РЕ — СЯ, РЕ — N1, РЕ — V»
Е.Г. Евдокимов
В статье рассматривается строение расплавов системы ¥в — Сг, ¥в — М, ¥в -V на атомно-электронном уровне. Установлено, что взаимодействие между металлом-растворителем и другими элементами происходит на всех электронных уровнях. Показано, что электронное состояние зависит от концентрации элементов в сплаве.
Установлено, что взаимодействие между металлом-растворителем и другими элементами происходит на всех электронных уровнях. Показано, что электронное состояние зависит от концентрации элементов в сплаве.
Ключевые слова: межатомная связь, ионизация, концентрация, температура, радиус атома, растворимость элементов, ядерное облако.
Металлические расплавы представляют собой жидкости, в которых протекают процессы тепловой конвекции, возникающей под действием температурных полей. Атомы и электроны являются основой любой металлической системы, поэтому конвективное движение жидкости (градиент плотности и температуры) приводит к атомно-электронному потоку, возникающему в определенном объеме. Тепловая конвекция в жидкости, изменение электронного строения расплава связано с изменением физико-химических параметров атомов, таких как радиус или объем атома, потенциал ионизации, атомная масса, потенциальная и кинетическая энергия атомов. +, Сг1+, Сг0. В точке В (1626 оС) атомы хрома и железа находятся в состоянии Сг0, Fe0, т.е. имеют нулевую ионизацию. На линии солидус АЕСD происходит образование твердой фазы с формированием ковалентных связей между атомами железа и хрома. По линии АЕ с понижением температуры идет процесс заполнения внешних электронных оболочек атома хрома 3ё54Б1 недостаю-
+, Сг1+, Сг0. В точке В (1626 оС) атомы хрома и железа находятся в состоянии Сг0, Fe0, т.е. имеют нулевую ионизацию. На линии солидус АЕСD происходит образование твердой фазы с формированием ковалентных связей между атомами железа и хрома. По линии АЕ с понижением температуры идет процесс заполнения внешних электронных оболочек атома хрома 3ё54Б1 недостаю-
10 2
щими шестью электронами до конфигурации 3ё 4б за счет образования ковалентных связей с атомами железа [1, 2]. С присоединением электронов атом хрома приобретает отрицательный заряд Сг1-, Сг2-, Сг3-, Сг4-, Сг5-, Сг6-, ковалентный радиус атомов при этом растет до величины 1.336, 1.389,
о
1.426, 1.456, 1.479, 1.50 А. На линии солидус ЕС атомы железа переходят из ионизированного состояния в ковалентное Fe1-, Fe2-, Fe3-, Fe4-, Fe5-, Fe6- с
о
радиусами, равными 1. (рис. 1). Ниже линии солидус ЕС располагается а — фаза и химическое соединение железа с хромом FeCr(a+FeCr). При концентрации хрома в расплаве 76,94 % атомы железа ионизированы до уровня Fe12+, при охлаждении расплава ниже линии солидус CD они образуют с атомами хрома химическое соединение FeCr2(Fe12+Cr6~), поэтому в этой области находятся а-фаза и соединение железа с хромом (a+FeCr2). В области АВСЕ находится жидкая фаза и из жидкой фазы выделяется твердая а-фаза (Ж + а), при этом атомы железа и хрома образуют ковалентные связи различной прочности. В области ВDC диаграммы, также находится жидкая фаза и твердая а-фаза, которая характеризуется ковалентными связями атомов железа и хрома в твердом растворе.
(рис. 1). Ниже линии солидус ЕС располагается а — фаза и химическое соединение железа с хромом FeCr(a+FeCr). При концентрации хрома в расплаве 76,94 % атомы железа ионизированы до уровня Fe12+, при охлаждении расплава ниже линии солидус CD они образуют с атомами хрома химическое соединение FeCr2(Fe12+Cr6~), поэтому в этой области находятся а-фаза и соединение железа с хромом (a+FeCr2). В области АВСЕ находится жидкая фаза и из жидкой фазы выделяется твердая а-фаза (Ж + а), при этом атомы железа и хрома образуют ковалентные связи различной прочности. В области ВDC диаграммы, также находится жидкая фаза и твердая а-фаза, которая характеризуется ковалентными связями атомов железа и хрома в твердом растворе.
Ж
1800-
1600
+
8+
1860Р 06-
О, %(ЕЕС. )
)
Рис. 1. Диаграмма состояния сплавов Рв — Сг
Образование металлической связи между атомами железа и хрома и формирование ОЦК -решетки железа происходит на линии QHB, между линией ликвидус АВD и линией солидус АЕСD диаграммы ¥в- Сг (рис. 2). Атомы хрома переходят из ионизированного состояния на линии ликвидус
АВ, в металлическое состояние (Сг0) с нулевым уровнем ионизации на линии ОНБ, при этом формируется ОЦК — решетка железа. Участок линии ОН проходит ниже линии солидус и показывает образование металлической связи между разнородными атомами в твердом растворе [3-5]. Изменение межатомного расстояния между железом и хромом на линии ликвидус и солидус диаграммы состояния сплавов ¥в- Сг представлено на рис.3. На линии ликвидус АВБ межатомное расстояние между железом и хромом
о о
увеличивается от 1,392 А в точке А до 2,638 А в точке В. ;
;
1506
1400-
1860° D
0
Ре
Сг, %(вес.)
Рис. 2. Образование металлической связи и ОЦК — решетки железа
на линии ((ИЬ системы Ев — Сг
Таким образом, на линии 1 (рис.3) наблюдается максимум, соответствующий концентрации 46,6 % (вес.) хрома и температуре расплава 1626 оС. На линии солидус АЕСБ межатомное расстояние между железом
о
и хромом интенсивно растет от 1,392 до 2,466 А, что происходит в интервале концентраций 0,0036. ..7,3 % хрома и связано с переходом атомов хрома из ионизированного состояния в металлическое (Сг0) с нулевым уровнем ионизации. Далее до концентрации 46,6 % атомы хрома переходят из металлического состояния в ковалентное состояние Сг1-, Сг2-, Сг3-, Сг4-, Сг5-, Сг6-, межатомное расстояние при этом увеличивается до 2,548, 2,676;
..7,3 % хрома и связано с переходом атомов хрома из ионизированного состояния в металлическое (Сг0) с нулевым уровнем ионизации. Далее до концентрации 46,6 % атомы хрома переходят из металлического состояния в ковалентное состояние Сг1-, Сг2-, Сг3-, Сг4-, Сг5-, Сг6-, межатомное расстояние при этом увеличивается до 2,548, 2,676;
о
2,75; 2,779; 2,851; 2,892 А (рис.3, линия 2).
С увеличением концентрации хрома более 69,25 % идет последовательное уменьшение межатомного расстояния между железом и хромом до
о
2,35 А, что соответствует концентрации 99,995 % хрома. Таким образом, между линией ликвидус и солидус системы Fe — Сг формируется ОЦК-решетка a — Fe. Металлические связи между атомами железа и хрома в твердом a-растворе могут действовать только до концентрации 7,3 % (вес. ) хрома, при большей концентрации происходит образование ковалентных связей между разнородными атомами. При охлаждении твердого раствора ниже линии GSM происходит превращение g’ — Fe (g — Fe) в a-фазу.
) хрома, при большей концентрации происходит образование ковалентных связей между разнородными атомами. При охлаждении твердого раствора ниже линии GSM происходит превращение g’ — Fe (g — Fe) в a-фазу.
30-
25-
8 220-
1,5-
0я-
1,0-
Fe°»
Fe5- Fe4-
Fffe2-
o0 /Г
0D,4+|
I I I I
o12+
,o24+. |»»
|»»
I I I
0
0r, % (вес.)
Рис. 3. Изменение межатомного расстояния между железом и хромом на линии ликвидус (1) и солидус (2) системы Ев — Сг
При этом процессе идет переход атомов хрома из ионного состояния в ковалентное и металлическое состояние по следующей схеме: Сги
ООО
(3,07 А) ® Сгк (1,499 А) + Сгме (1,246 А). На основе атомов хрома в ме-
О
таллическом состоянии Сгме радиусом 1,246 А образуется а-фаза, а на основе атомов хрома в ковалентном состоянии Сг6-, Сг5-, Сг4-, Сг3-, Сг2-, Сг1-образуется химическое соединение железа с хромом Бе3Сг (Бе2Сг), что может происходить в области концентраций 23,15. ..46,6 % хрома. В твердом состоянии структура сплавов состоит из твердого раствора а-фазы и химических соединений железа с хромом Бе3Сг (Бе2Сг), БеСг, БеСг2.
..46,6 % хрома. В твердом состоянии структура сплавов состоит из твердого раствора а-фазы и химических соединений железа с хромом Бе3Сг (Бе2Сг), БеСг, БеСг2.
В системе «железо — никель» атомы никеля в расплаве, до концентрации 51,33 % находятся в ионизированном состоянии, ионизация атомов зависит от концентрации никеля. Изменение атомных характеристик железа и никеля в расплаве связано с изменением размерных параметров взаимодействующих атомов, в частности, радиуса атома. На основе расчета энергии электронных уровней атомов железа и никеля построена диаграмма состояния сплавов Бе — N1 (рис. 4). На линии ликвидус АВБ, атомы никеля и железа находятся в ионизированном состоянии. Температура при этом на линии АВ повышается от 1536 оС в точке А до 1548 оС в точке В. На линии ББ температура понижается до 1455 оС в точке Б. Линия соли-дус АЕСБ характеризует конец перехода жидкой фазы в твердую. На линии солидус АЕ происходят образование и рост ковалентных атомов никеля, при этом на 3ё-уровень присоединяются два электрона с образованием
10 2
атомной конфигурации 3ё 4б , что сопровождается увеличением радиуса атома. Отрицательный заряд атомов никеля при этом увеличивается до
Отрицательный заряд атомов никеля при этом увеличивается до
о
1 9
уровня N1″ (1,333 А) при концентрации 31,182 % и до уровня N1-
о
(1,386 А) при концентрации 51,331 % (ат.) никеля. Таким образом, на линии солидус АЕ атомы никеля переходят из ионизированного состояния с
о
радиусом 1,243 А в точке А (1536 оС) в ковалентное состояние с радиусом
о
1,386 А в точке Е (1468 оС), образуя при этом ковалентные связи с атомами железа за счет двух электронов. На линии солидус ЕСБ ковалентный
о
2
радиус атомов никеля N1 — (1,386 А) сохраняется неизменным, так как он характеризует образование твердой фазы. Ниже линии ликвидус АВБ, по линии солидус АЕ и ковалентной линии ВС атомы никеля и железа образуют ковалентные связи различной прочности, в результате чего образуется твердая а-фаза, поэтому в области диаграммы АВСЕ и ВСБ располагаются две фазы — жидкость и а-фаза (Ж + а).
Ниже линии ликвидус АВБ, по линии солидус АЕ и ковалентной линии ВС атомы никеля и железа образуют ковалентные связи различной прочности, в результате чего образуется твердая а-фаза, поэтому в области диаграммы АВСЕ и ВСБ располагаются две фазы — жидкость и а-фаза (Ж + а).
Ниже линии солидус АЕСБ (см. рис.4) атомы никеля переходят из ковалентного (N1 -) в ионное состояние №и(1-), Ми(2-), присоединяя при этом два электрона на 3ё-уровень, что происходит по линии ЕК (51,331 %) при снижении температуры от 1468 до 1281 оС — Ми(1-) и при снижении температуры до 1168 оС Ми(2-). В точке К при температуре 358 оС атомы никеля находятся в твердом растворе в ионном состоянии №и(2-) с радиу-
о
сом, равным 2,442 А. Область диаграммы КЕКО представляет собой твердый раствор ионов никеля в у-железе с ионными связями между атомами железа и никеля, что характеризует аустенит (А). !2(15480)
!2(15480)
1455°
0
Рв
Й, %>(аг.)
100 N
Рис. 5. Образование металлической связи и ОЦК-решетки железа на линии ((ИЬ диаграммы состояния сплавов Ее — N1
В точке Q (1518 оС) и на линии QHB атомы никеля находятся в металлическом состоянии (Ni0) с нулевым уровнем ионизации и образуют с атомами железа металлические связи и ОЦК-решетку [6]. Линия QHB пересекается с линией солидус АЕ в точке H при концентрации 8,4 % никеля и температуре 1523 оС. Таким образом, образование металлической связи и формирование кубической решетки железа на линии солидус АНЕ происходит на участке АН, когда атомы никеля переходят из высоко ионизированного состояния №я (ядро), Мяо (ядерное облако) в точке — А в металлическое состояние (Ni0) с нулевым уровнем ионизации в точке Н.
При охлаждении сплавов ниже линии QHB происходит образование ковалентных связей между разнородными атомами за счет перехода атомов никеля из металлического в ковалентное состояние Ni0,5-, Ni1-, Ni1,5-, Ni — по линии ВС и линии АНЕ на участке НЕ. Ниже линии KG происходит частичный распад аустенита с образованием a — фазы и химического соединения железа с никелем Fe3Ni (Fe30,66+Ni2-), которое выделяется в области концентраций атомных величин никеля 47,6…51,331 %. Это превращение связано с переходом атомов никеля из ионного в металлическое и ко-
o O
валентное состояние по следующей схеме: NiH (2,442 А) ® №к (1,386 А) +
о
№ме (1,243 А). На основе атомов никеля в металлическом состоянии №ме
о
(радиус 1,243 А) образуется a-фаза, а на основе атомов никеля в кова-
о
лентном состоянии №к (радиус 1,386 А) образуется химическое соединение железа и никеля Fe3Ni. Изменение межатомного расстояния между атомами железа и никеля на линии ликвидус представлено на рис.6 (линия 1). Минимальное расстояние между атомами железа и никеля составляет
Изменение межатомного расстояния между атомами железа и никеля на линии ликвидус представлено на рис.6 (линия 1). Минимальное расстояние между атомами железа и никеля составляет
о
1,258 А при концентрации никеля 0,0046 %; с увеличением концентрации
межатомное расстояние между железом и никелем также растет и достига-
о
ет максимального значения (2,501 А) в точке В при концентрации атомных величин никеля 51,331 % . При концентрации никеля более 51,331 % происходит процесс ионизации атомов железа и межатомное расстояние между разнородными атомами уменьшается. Изменение межатомного расстояния между железом и никелем на линии солидус показано на рис.6
(линия 2). На линии солидус АЕ в области концентраций 0,0046. 8,4 %,
8,4 %,
о
происходит рост расстояния между атомами железа и никеля от 1,258 А
о
при концентрации 0,0046 % до 2,478 А при концентрации атомных величин никеля 8,4 %, что связано с переходом атомов никеля из высокоиони-зированного состояния (№я, №яо) в металлическое состояние (Ni0) с нулевым уровнем ионизации.
о
Рис. 6. Изменение межатомного расстояния (А) между железом и никелем на линии ликвидус (1) и линии солидус (2) системы Ев — N1
С увеличением концентрации никеля более 8,4 %, на линии солидус
АЕ идет процесс перехода атомов никеля из металлического в ковалентное
1 2
состояние (N1 N1с увеличением периода ОЦК-решетки. Таким образом, между линией ликвидус ЛВБ и линией солидус ЛБСБ диаграммы состояния сплавов Бе — N1 формируется ОЦК-решетка, характерная для а -железа. Формирование ГЦК-решетки у — Бе происходит ниже линии солидус АБСБ, когда атомы никеля переходят из ковалентного в ионное состояние и образуют ионные связи с атомами железа [7].
Таким образом, между линией ликвидус ЛВБ и линией солидус ЛБСБ диаграммы состояния сплавов Бе — N1 формируется ОЦК-решетка, характерная для а -железа. Формирование ГЦК-решетки у — Бе происходит ниже линии солидус АБСБ, когда атомы никеля переходят из ковалентного в ионное состояние и образуют ионные связи с атомами железа [7].
В системе «железо-ванадий» в расплаве, до концентрации атомных величин ванадия 48,75 %, находятся в ионизированном состоянии, которое определяется концентрацией компонентов. При концентрации атомной величины ванадия 0,0038; 0,125; 2,72; 2,86; 7,49; 8,12 %, атомы ванадия на-
Уя Л гя.о т г23+ т г22+ т т21+ т г20+
, V, V, V, V, V. С увеличением концентрации ванадия в расплаве до 26,51; 27,68; 29,19; 31,34; 35,266 %, ионизация атомов ванадия уменьшается до уровня V10, V8+, v6+, v4+, V2+. Атомы железа до концентрации 48,75 % не ионизированы и находятся в расплаве в состоянии нулевой ионизации Бе с металли-
о
ческим радиусом, равным 1,26 А.
у-ре 0,86%
V1- V2- V3- V4- V5-
О 1390
о
03 а. 1200-
с?
03 1000-
а. Ф с 910 3
4,(4)
£ 800-
600-
400Р
200
Е
Е’ 1356°
ч
Х^и(0,5-)
Л(5)
у — Рэ
а+У-Ре^^6 „(5-)
462°
|К
Чи(0,1-)
а + Ре^
0 Рэ
«Г»
20
27,7
1—
40
V7
8+ Ре14+Ре22+
1+ ре3+ Ре» Т3—«^ ,1+ РЭ —
.
723
‘79,8 80
D
1905°
100 V
Рис. 7. Диаграмма состояния сплавов Ев — V
V
7
V
а
а
На линии солидус АЕСБ атомы ванадия переходят из высокоиони-
т тя т тя о
зированного состояния V , V в металлическое состояние с нулевым уров-
о
0 12 нем ионизации (V ) и затем в ковалентное состояние V — (1,404 А), V —
о о о о о
(1,457 А), V3- (1,495 А), V4- (1,524 А), V5- (1,547 А), V6- (1,567 А), V7-
о
3 2
(1,585 А) с заполнением уровня 3ё 4б недостающими электронами до
10 2
конфигурации 3ё 4б и увеличением радиуса атомов. 7-) за счет перехода атомов железа в ковалентное состояние. Это соединение образуется в интервале температур между линией ЕС и линией
7-) за счет перехода атомов железа в ковалентное состояние. Это соединение образуется в интервале температур между линией ЕС и линией
Е’С при концентрации атомной величины ванадия 48,75…72,3 %. Высокотемпературная а-фаза с ОЦК-решеткой образуется по линии ОНБ, когда атомы ванадия переходят из ионизированного состояния на линии ликвидус АВ в металлическое состояние (V0) с нулевой ионизацией на линии НБ, при этом формируется ОЦК-решетка а-фазы (рис.8). Участок линии ОН проходит ниже линии солидус АЕ и характеризует образование металлической связи между разнородными атомами и ОЦК-решетки железа уже в твердом растворе. Точка О находится на температурном уровне 1515 оС, а точке Н соответствует температура 1532 оС и концентрация атомного вещества ванадия 6,5 %. Область диаграммы АНО показывает переход атомов ванадия из высоко ионизированного состояния Vя (ядро), V™ (ядер-
23+ 22+ 0
ное облако), V , V на линии ликвидус в металлическое состояние (V ) с нулевым уровнем ионизации на линии ОН. П
П
гурацией V V V V V V — по линиям АЕ и БС диаграммы состояния Бе — V.
1900-
1800-
О 1700-
о
Ж
£
(5 1600 Ч
& 1539,
+ V
V0
Ре1
1+
Ре! Ре8>»
р€>■»‘
__,г
Ж+ а
18+-
V V
В а+Ж
1515 ^ 1500^
1400-
1300
0
Ре
V %(ат. )
)
Рис. 8. Формирование ОЦК-решетки а-фазы на линии QHB системы Ее — V
1905° Р
100 V
Изменение межатомных расстояний между атомами железа и ванадия на линии ликвидус АББ и линии солидус АЕЕ’СБ представлено на рис.9.
1-
— V, %(ат.)
Рис. 9. Изменение межатомного расстояния между железом и ванадием на линии ликвидус АВБ (1), линии солидус АНЕЕ ‘СБ (2) и линии формирования ОЦК-решетки а-фазы ((ИЬ (3)
системы Ев — V
На линии ликвидус АВБ в точке А расстояние между атомами же-
о
леза и ванадия составляет 1,435 А, достигая максимального значения в
о
точке В (2,574 А) при температуре 1655 оС (рис. 9, линия 1). Изменение периода кубической решетки а-фазы на линии QHB показано на рис.9 (линия 3). На линии солидус АЕБ’СБ идет процесс формирования ОЦК-решетки а-фазы; на участке АН в интервале концентраций 0,0038…6,5 % (ат.) ванадия происходит интенсивный рост межатомного расстояния от
9, линия 1). Изменение периода кубической решетки а-фазы на линии QHB показано на рис.9 (линия 3). На линии солидус АЕБ’СБ идет процесс формирования ОЦК-решетки а-фазы; на участке АН в интервале концентраций 0,0038…6,5 % (ат.) ванадия происходит интенсивный рост межатомного расстояния от
о о
1,435 А в точке А до 2,538 А в точке Н, при этом атомы ванадия переходят из высокоионизированного состояния Vя (ядро), Уяо (ядерное облако) в металлическое состояние (V0) с нулевым уровнем ионизации (рис.9, линия 2). В результате, в точке Н при температуре 1532 оС формируется ОЦК-
о
решетка а-фазы с периодом, равным 2,538 А. Далее при концентрации ванадия на линии АЕ более 6,5 % идет переход атомов ванадия из металли-
о
ческого состояния V0 (1,314 А) в ковалентное V1-, V2-, V3-, V4-, V5-, V6-, V7-с последовательным увеличением их радиуса до 1,457; 1,495; 1,524; 1,547;
о
1,567; 1,585 А, период ОЦК-решетки а-фазы растет при этом до 2,61;
о
2,672; 2,72; 2,74; 2,774; 2,845 А.
При охлаждении сплавов ниже линии солидус ЛЕСБ атомы ванадия сохраняют ковалентную конфигурацию электронов V7- радиусом
о
1,585 Л. Все процессы, происходящие в расплавах на атомно-электронном уровне, связаны с изменением радиуса атомов хрома, никеля и ванадия в системах «Бе — Сг», «Бе — N1» и «Бе — V» (рис.10). В системе «Бе — Сг» ато-
о
му хрома радиусом 1,246 Л с электронной конфигурацией 3р63ё54в1 отвечает концентрация 48,36 % (ат.) хрома, однако ядру атома соответствует
о
концентрация 47,54 %, где радиус атома хрома равен 1,206 Л, что свидетельствует о переходе одного электрона с 4Б-уровня на 3ё-уровень.
Рис. 10. Изменение радиуса атома ванадия, хрома и никеля в расплаве в системе «Ев — V», «Ев — Сг» и «Ев — N1»
10. Изменение радиуса атома ванадия, хрома и никеля в расплаве в системе «Ев — V», «Ев — Сг» и «Ев — N1»
Таким образом, атомы железа, воздействуя на электронные оболочки атомов хрома, сжимают их, в результате формируется электронная кон-
о
фигурация атома хрома 3р63ё6 радиусом 1,206 Л. В системе «Бе — V» ато-
о
му ванадия радиусом 1,314 Л с электронной конфигурацией 3р63ё34Б2 соответствует концентрация 49,17 % (ат.) ванадия, а ядру атома отвечает
о
концентрация 46,89 %, где радиус атома ванадия равен 1,199 Л. В этой системе происходит еще большее воздействие атомов железа на электрон-
ные оболочки атомов ванадия, что приводит к переходу двух электронов с 4Б-уровня на 3ё-уровень с формированием электронной конфигурации
о
3р63ё5 радиусом 1,199 А (рис. е — N1» электронная конфигурация атомов никеля остается без изменения, что свидетельствует о слабом воздействии атомов железа на внешние оболочки атомов никеля.
е — N1» электронная конфигурация атомов никеля остается без изменения, что свидетельствует о слабом воздействии атомов железа на внешние оболочки атомов никеля.
Выводы:
1. Металлические радиусы атомов элементов зависят от концентрации компонентов в расплаве, с изменением концентрации меняется межатомное взаимодействие и геометрические параметры атомов. Состояние «остова» атома, а также валентных электронов не является стабильным и претерпевает изменения, связанные с влиянием температуры, концентрации и других внешних воздействий, что влияет на волновые свойства электронов и соответственно на радиусы атомов.
2. Установлено, что атомы хрома, никеля, ванадия и железа в расплаве, выше линии ликвидус находятся в ионизированном состоянии (Меп+). Степень ионизации атомов зависит от температуры и концентрации компонентов в расплаве.
3. е — V».
е — V».
Работа представлена на 3-й Международной Интернет — конференции по металлургии и металлообработке, проведенной в ТулГУ 1 мая — 30 июня 2014 г.
Список литературы
1. Евдокимов Е.Г. Электронная структура и межатомные связи в железоуглеродистых сплавах // Литейное производство. 1999. № 4. С. 19 -20.
2. Осипов К. А. Нуклоны ядер в расчетах некоторых свойств атомов и молекул. М.: ЭЛИЗ, 2000. 28 с.
3. Евдокимов Е.Г., Баранов А. А., Вальтер А.И. Генезис электронной конфигурации в железоуглеродистых сплавах: монография. Тула: ТулГУ, 2004. 192 с.
4. Евдокимов Е.Г. Исследование межатомного взаимодействия и электронной структуры сплавов Fe — Сг. «Компьютерные технологии в соединении материалов»: сб. науч. трудов 3-й Всерос. науч.-техн. конф. Тула: ТулГУ, 2001. С. 173 — 178.
науч. трудов 3-й Всерос. науч.-техн. конф. Тула: ТулГУ, 2001. С. 173 — 178.
5. Евдокимов Е.Г. Диаграмма состояния сплавов «железо — хром». Научные основы решения проблем металлургических производств // Известия ТулГУ. 2002. Вып. 2. С. 74 — 80.
6. Евдокимов Е.Г., Кузьмин В.Н. Электронная структура расплавов системы «Fe — Ni». Научные основы решения проблем металлургических производств // Известия ТулГУ. 2002. Вып. 2. С. 81 — 85.
7. Евдокимов Е.Г. Электронное строение легированных сплавов железа: монография. Тула: Изд-во ТулГУ, 2005. 240 с.
Евдокимов Евгений Георгиевич, канд. техн. наук, доц., [email protected], Россия, Тула, Тульский государственный университет
KONFIGURAICHEN ATOMS AND ELEKTRONSINTERACHIONIN ALLOIS SISTEM OF «Fe — Cr, Fe — Ni, Fe — V»
E. G. Evdokimov
G. Evdokimov
The composition of licvid sistem Fe — Cr, Fe — Ni, Fe — V alloys on the atom-electron level is considered in the article. It has been found that the interaction between metal-solvent and other elements occurs on each electron level. It is shown that the electron state depends upon the concentration of the elements in the alloy.
Key words: atomic bonding, ionization, concentration, temperature, atom radius, solubility of elements, nuclear cloud.
Evdokimov Evgeny Georgievich, candidate of technical science, docent, evdoki-mov@tula,net, Russia, Tula, Tula State University
1.1.1. Строение электронных оболочек атомов химических элементов.
Химия — наука о веществах, их свойствах и превращениях.
Химическими веществами называют то, из чего состоит окружающий нас мир.
Свойства каждого химического вещества делятся на два типа: это химические, которые характеризуют его способность образовывать другие вещества, и физические, которые объективно наблюдаются и могут быть рассмотрены в отрыве от химических превращений. Так, например, физическими свойствами вещества являются его агрегатное состояние (твердое, жидкое или газообразное), теплопроводность, теплоемкость, растворимость в различных средах (вода, спирт и др.), плотность, цвет, вкус и т.д.
Превращения одних химических веществ в другие вещества называют химическими явлениями или химическими реакциями. Следует отметить, что существуют также и физические явления, которые, очевидно, сопровождаются изменением каких-либо физических свойств вещества без его превращения в другие вещества. К физическим явлениям, например, относятся плавление льда, замерзание или испарение воды и др.
О том, что в ходе какого-либо процесса имеет место химическое явление, можно сделать вывод, наблюдая характерные признаки химических реакций, такие как изменение цвета, образование осадка, выделение газа, выделение теплоты и (или) света.
Так, например, вывод о протекании химических реакций можно сделать, наблюдая:
— образование осадка при кипячении воды, называемого в быту накипью;
— выделение тепла и света при горении костра;
— изменение цвета среза свежего яблока на воздухе;
— образование газовых пузырьков при брожении теста и т.д.
Мельчайшие частицы вещества, которые в процессе химических реакций практически не претерпевают изменений, а лишь по-новому соединяются между собой, называются атомами.
Сама идея о существовании таких единиц материи возникла еще в древней Греции в умах античных философов, что собственно и объясняет происхождение термина «атом», поскольку «атомос» в буквальном переводе с греческого означает «неделимый».
Тем не менее, вопреки идее древнегреческих философов, атомы не являются абсолютным минимумом материи, т.е. сами имеют сложное строение.
Каждый атом состоит из так называемых субатомных частиц – протонов, нейтронов и электронов, обозначаемых соответственно символами p+, no и e−.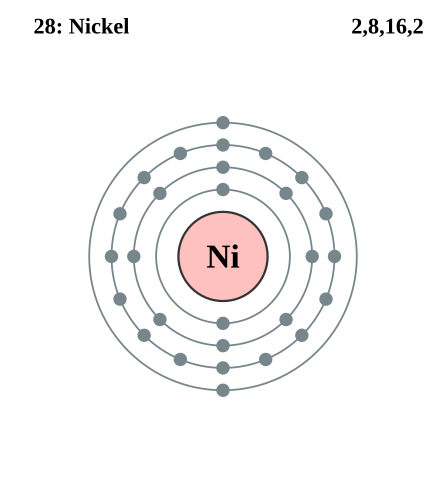 Надстрочный индекс в используемых обозначениях указывает на то, что протон имеет единичный положительный заряд, электрон – единичный отрицательный заряд, а нейтрон заряда не имеет.
Надстрочный индекс в используемых обозначениях указывает на то, что протон имеет единичный положительный заряд, электрон – единичный отрицательный заряд, а нейтрон заряда не имеет.
Что касается качественного устройства атома, то у каждого атома все протоны и нейтроны сосредоточены в так называемом ядре, вокруг которого электроны образуют электронную оболочку.
Протон и нейтрон обладают практически одинаковыми массами, т.е. mp ≈ mn , а масса электрона почти в 2000 раз меньше массы каждого из них, т.е. mp/me ≈ mn/me ≈ 2000.
Поскольку фундаментальным свойством атома является его электронейтральность, а заряд одного электрона равен заряду одного протона, из этого можно сделать вывод о том, что количество электронов в любом атоме равно количеству протонов.
Так, например, в таблице ниже представлен возможный состав атомов:
| атом1 | атом2 | атом3 | атом4 | |
| ядро | 1p+ | 1p+, 1n0 | 4p+, 3n0 | 4p+, 4n0 |
| оболочка | 1e− | 1e− | 4e− | 4e− |
Вид атомов с одинаковым зарядом ядер, т. е. с одинаковым числом протонов в их ядрах, называют химическим элементом. Таким образом, из таблицы выше можно сделать вывод о том, что атом1 и атом2 относятся в одному химическому элементу, а атом3 и атом4 — к другому химическому элементу.
е. с одинаковым числом протонов в их ядрах, называют химическим элементом. Таким образом, из таблицы выше можно сделать вывод о том, что атом1 и атом2 относятся в одному химическому элементу, а атом3 и атом4 — к другому химическому элементу.
Каждый химический элемент имеет свое название и индивидуальный символ, который читается определенным образом. Так, например, самый простой химический элемент, атомы которого содержат в ядре только один протон, имеет название «водород» и обозначается символом «Н», что читается как «аш», а химический элемент с зарядом ядра +7 (т.е. содержащий 7 протонов) — «азот», имеет символ «N» , который читается как «эн».
Как можно заметить из представленной выше таблицы, атомы одного химического элемента могут отличаться количеством нейтронов в ядрах.
Атомы, относящиеся к одному химическому элементу, но имеющие разное количество нейтронов и, как следствие массу, называют изотопами.
Так, например, химический элемент водород имеет три изотопа – 1Н, 2Н и 3Н. Индексы 1, 2 и 3 сверху от символа Н означают суммарное количество нейтронов и протонов. Т.е. зная, что водород – это химический элемент, который характеризуется тем, что в ядрах его атомов находится по одному протону, можно сделать вывод о том, что в изотопе 1Н вообще нет нейтронов (1-1=0), в изотопе 2Н – 1 нейтрон (2-1=1) и в изотопе 3Н – два нейтрона (3-1=2). Поскольку, как уже было сказано, нейтрон и протон имеют одинаковые массы, а масса электрона по сравнению с ними пренебрежимо мала, это значит, что изотоп 2Н практически в два раза тяжелее изотопа 1Н, а изотоп 3Н — и вовсе в три раза. В связи с таким большим разбросом масс изотопов водорода изотопам 2Н и 3Н даже были присвоены отдельные индивидуальные названия и символы, что не характерно больше ни для одного другого химического элемента. Изотопу 2Н дали название дейтерий и присвоили символ D, а изотопу 3Н дали название тритий и присвоили символ Т.
Индексы 1, 2 и 3 сверху от символа Н означают суммарное количество нейтронов и протонов. Т.е. зная, что водород – это химический элемент, который характеризуется тем, что в ядрах его атомов находится по одному протону, можно сделать вывод о том, что в изотопе 1Н вообще нет нейтронов (1-1=0), в изотопе 2Н – 1 нейтрон (2-1=1) и в изотопе 3Н – два нейтрона (3-1=2). Поскольку, как уже было сказано, нейтрон и протон имеют одинаковые массы, а масса электрона по сравнению с ними пренебрежимо мала, это значит, что изотоп 2Н практически в два раза тяжелее изотопа 1Н, а изотоп 3Н — и вовсе в три раза. В связи с таким большим разбросом масс изотопов водорода изотопам 2Н и 3Н даже были присвоены отдельные индивидуальные названия и символы, что не характерно больше ни для одного другого химического элемента. Изотопу 2Н дали название дейтерий и присвоили символ D, а изотопу 3Н дали название тритий и присвоили символ Т.
Если принять массу протона и нейтрона за единицу, а массой электрона пренебречь, фактически верхний левый индекс помимо суммарного количества протонов и нейтронов в атоме можно считать его массой, в связи с чем этот индекс называют массовым числом и обозначают символом А. Поскольку за заряд ядра любого атома отвечают протоны, а заряд каждого протона условно считается равным +1, количество протонов в ядре называют зарядовым числом (Z). Обозначив количество нейтронов в атоме буквой N, математически взаимосвязь между массовым числом, зарядовым числом и количеством нейтронов можно выразить как:
Согласно современным представлениям, электрон имеет двойственную (корпускулярно-волновую) природу. Он обладает свойствами как частицы, так и волны. Подобно частице, электрон имеет массу и заряд, но в то же время поток электронов, подобно волне, характеризуется способностью к дифракции.
Для описания состояния электрона в атоме используют представления квантовой механики, согласно которым электрон не имеет определенной траектории движения и может находиться в любой точке пространства, но с разной вероятностью.
Область пространства вокруг ядра, где наиболее вероятно нахождение электрона, называется атомной орбиталью.
Атомная орбиталь может обладать различной формой, размером и ориентацией. Также атомную орбиталь называют электронным облаком.
Графически одну атомную орбиталь принято обозначать в виде квадратной ячейки:
Квантовая механика имеет крайне сложный математический аппарат, поэтому в рамках школьного курса химии рассматриваются только лишь следствия квантово-механической теории.
Согласно этим следствиям, любую атомную орбиталь и находящийся на ней электрон полностью характеризуют 4 квантовых числа.
- Главное квантовое число – n — определяет общую энергию электрона на данной орбитали. Диапазон значений главного квантового числа – все натуральные числа, т.е. n = 1,2,3,4, 5 и т.д.
- Орбитальное квантовое число — l – характеризует форму атомной орбитали и может принимать любые целочисленные значения от 0 до n-1, где n, напомним, — это главное квантовое число.

Орбитали с l = 0 называют s-орбиталями. s-Орбитали имеют сферическую форму и не обладают направленностью в пространстве:
Орбитали с l = 1 называются p-орбиталями. Данные орбитали обладают формой трехмерной восьмерки, т.е. формой, полученной вращением восьмерки вокруг оси симметрии, и внешне напоминают гантель:
Орбитали с l = 2 называются d-орбиталями, а с l = 3 – f-орбиталями. Их строение намного более сложное.
3) Магнитное квантовое число – ml – определяет пространственную ориентацию конкретной атомной орбитали и выражает проекцию орбитального момента импульса на направление магнитного поля. Магнитное квантовое число ml соответствует ориентации орбитали относительно направления вектора напряженности внешнего магнитного поля и может принимать любые целочисленные значения от –l до +l, включая 0, т.е. общее количество возможных значений равно (2l+1)..PNG) Так, например, при l = 0 ml = 0 (одно значение), при l = 1 ml = -1, 0, +1 (три значения), при l = 2 ml = -2, -1, 0, +1, +2 (пять значений магнитного квантового числа) и т.д.
Так, например, при l = 0 ml = 0 (одно значение), при l = 1 ml = -1, 0, +1 (три значения), при l = 2 ml = -2, -1, 0, +1, +2 (пять значений магнитного квантового числа) и т.д.
Так, например, p-орбитали, т.е. орбитали с орбитальным квантовым числом l = 1, имеющие форму «трехмерной восьмерки», соответствуют трем значениям магнитного квантового числа (-1, 0, +1), что, в свою очередь, соответствует трем перпендикулярным друг другу направлениям в пространстве.
4) Спиновое квантовое число (или просто спин) — ms — условно можно считать отвечающим за направление вращения электрона в атоме, оно может принимать значения . Электроны с разными спинами обозначают вертикальными стрелками, направленными в разные стороны: ↓ и ↑.
Совокупность всех орбиталей в атоме, имеющих одно и то же значение главного квантового числа, называют энергетическим уровнем или электронной оболочкой. Любой произвольный энергетический уровень с некоторым номером n состоит из n2 орбиталей.
Множество орбиталей с одинаковыми значениями главного квантового числа и орбитального квантового числа представляет собой энергетический подуровень.
Каждый энергетический уровень, которому соответствует главное квантовое число n, содержит n подуровней. В свою очередь, каждый энергетический подуровень с орбитальным квантовым числом l, состоит из (2l+1) орбиталей. Таким образом, s-подуровень состоит из одной s-орбитали, p-подуровень – трех p-орбиталей, d-подуровень – пяти d-орбиталей, а f-подуровень — из семи f-орбиталей. Поскольку, как уже было сказано, одна атомная орбиталь часто обозначается одной квадратной ячейкой, то s-, p-, d- и f-подуровни можно графически изобразить следующим образом:
Каждой орбитали соответствует индивидуальный строго определенный набор трех квантовых чисел n, l и ml.
Распределение электронов по орбиталям называют электронной конфигурацией.
Заполнение атомных орбиталей электронами происходит в соответствии с тремя условиями:
- Принцип минимума энергии: электроны заполняют орбитали, начиная с подуровня с наименьшей энергией.
 Последовательность подуровней в порядке увеличения их энергий выглядит следующим образом: 1s<2s<2p<3s<3p<4s≤3d<4p<5s≤4d<5p<6s…;
Последовательность подуровней в порядке увеличения их энергий выглядит следующим образом: 1s<2s<2p<3s<3p<4s≤3d<4p<5s≤4d<5p<6s…;
Для того чтобы проще запомнить данную последовательность заполнения электронных подуровней, весьма удобна следующая графическая иллюстрация:
- Принцип Паули: на каждой орбитали может находиться не более двух электронов.
Если на орбитали находится один электрон, то он называется неспаренным, а если два, то их называют электронной парой.
- Правило Хунда: наиболее устойчивое состояние атома является такое, при котором в пределах одного подуровня атом обладает максимально возможным числом неспаренных электронов. Такое наиболее устойчивое состояние атома называется основным состоянием.
Фактически вышесказанное означает то, что, например, размещение 1-го, 2-х, 3-х и 4-х электронов на трех орбиталях p-подуровня будет осуществляться следующим образом:
Заполнение атомных орбиталей от водорода, имеющего зарядовое число равное 1, до криптона (Kr) с зарядовым числом 36 будет осуществляться следующим образом:
Подобное изображение порядка заполнения атомных орбиталей называется энергетической диаграммой. Исходя из электронных диаграмм отдельных элементов, можно записать их так называемые электронные формулы (конфигурации). Так, например, элемент с 15ю протонами и, как следствие, 15ю электронами, т.е. фосфор (P), будет иметь следующий вид энергетической диаграммы:
Исходя из электронных диаграмм отдельных элементов, можно записать их так называемые электронные формулы (конфигурации). Так, например, элемент с 15ю протонами и, как следствие, 15ю электронами, т.е. фосфор (P), будет иметь следующий вид энергетической диаграммы:
При переводе в электронную формулу атома фосфора примет вид:
15P = 1s22s22p63s23p3
Цифрами нормального размера слева от символа подуровня показан номер энергетического уровня, а верхними индексами справа от символа подуровня показано количество электронов на соответствующем подуровне.
Ниже приведены электронные формул первых 36 элементов периодической системы Д.И. Менделеева.
| период | № элемента | символ | название | электронная формула |
| I | 1 | H | водород | 1s1 |
| 2 | He | гелий | 1s2 | |
| II | 3 | Li | литий | 1s22s1 |
| 4 | Be | бериллий | 1s22s2 | |
| 5 | B | бор | 1s22s22p1 | |
| 6 | C | углерод | 1s22s22p2 | |
| 7 | N | азот | 1s22s22p3 | |
| 8 | O | кислород | 1s22s22p4 | |
| 9 | F | фтор | 1s22s22p5 | |
| 10 | Ne | неон | 1s22s22p6 | |
| III | 11 | Na | натрий | 1s22s22p63s1 |
| 12 | Mg | магний | 1s22s22p63s2 | |
| 13 | Al | алюминий | 1s22s22p63s23p1 | |
| 14 | Si | кремний | 1s22s22p63s23p2 | |
| 15 | P | фосфор | 1s22s22p63s23p3 | |
| 16 | S | сера | 1s22s22p63s23p4 | |
| 17 | Cl | хлор | 1s22s22p63s23p5 | |
| 18 | Ar | аргон | 1s22s22p63s23p6 | |
| IV | 19 | K | калий | 1s22s22p63s23p64s1 |
| 20 | Ca | кальций | 1s22s22p63s23p64s2 | |
| 21 | Sc | скандий | 1s22s22p63s23p64s23d1 | |
| 22 | Ti | титан | 1s22s22p63s23p64s23d2 | |
| 23 | V | ванадий | 1s22s22p63s23p64s23d3 | |
| 24 | Cr | хром | 1s22s22p63s23p64s13d5 здесь наблюдается проскок одного электрона с s на d подуровень | |
| 25 | Mn | марганец | 1s22s22p63s23p64s23d5 | |
| 26 | Fe | железо | 1s22s22p63s23p64s23d6 | |
| 27 | Co | кобальт | 1s22s22p63s23p64s23d7 | |
| 28 | Ni | никель | 1s22s22p63s23p64s23d8 | |
| 29 | Cu | медь | 1s22s22p63s23p64s13d10 здесь наблюдается проскок одного электрона с s на d подуровень | |
| 30 | Zn | цинк | 1s22s22p63s23p64s23d10 | |
| 31 | Ga | галлий | 1s22s22p63s23p64s23d104p1 | |
| 32 | Ge | германий | 1s22s22p63s23p64s23d104p2 | |
| 33 | As | мышьяк | 1s22s22p63s23p64s23d104p3 | |
| 34 | Se | селен | 1s22s22p63s23p64s23d104p4 | |
| 35 | Br | бром | 1s22s22p63s23p64s23d104p5 | |
| 36 | Kr | криптон | 1s22s22p63s23p64s23d104p6 |
Как уже было сказано, в основном своем состоянии электроны в атомных орбиталях расположены согласно принципу наименьшей энергии. Тем не менее, при наличии пустых p-орбиталей в основном состоянии атома, нередко, при сообщении ему избыточной энергии атом можно перевести в так называемое возбужденное состояние. Так, например, атом бора в основном своем состоянии имеет электронную конфигурацию и энергетическую диаграмму следующего вида:
Тем не менее, при наличии пустых p-орбиталей в основном состоянии атома, нередко, при сообщении ему избыточной энергии атом можно перевести в так называемое возбужденное состояние. Так, например, атом бора в основном своем состоянии имеет электронную конфигурацию и энергетическую диаграмму следующего вида:
5B = 1s22s22p1
А в возбужденном состоянии (*), т.е. при сообщении некоторой энергии атому бора, его электронная конфигурация и энергетическая диаграмма будут выглядеть так:
5B* = 1s22s12p2
В зависимости от того, какой подуровень в атоме заполняется последним, химические элементы делят на s, p, d или f.
Нахождение s, p, d и f-элементов в таблице Д.И. Менделеева:
- У s-элементов последний заполняемый s-подуровень. К данным элементам относятся элементы главных (слева в ячейке таблицы) подгрупп I и II групп.
- У p-элементов заполняется p-подуровень.
 К p-элементам относят последние шесть элементов каждого периода, кроме первого и седьмого, а также элементы главных подгрупп III-VIII групп.
К p-элементам относят последние шесть элементов каждого периода, кроме первого и седьмого, а также элементы главных подгрупп III-VIII групп. - d-Элементы расположены между s – и p-элементами в больших периодах.
- f-Элементы называют лантаноидами и актиноидами. Они вынесены вниз таблицы Д.И. Менделеева.
Электронные конфигурации простых ионов
Ионами называют частицы, имеющие либо положительный, либо отрицательный заряд. Ионы бывают простые и сложные. Простые ионы образованы одним химическим элементом, сложные – двумя или более элементами.
Положительно заряженные ионы называют катионами, отрицательно заряженные ионы – анионами. Заряд иона обозначают надстрочным индексом, сначала указывая величину заряда, затем его знак. При этом в случае, если заряд иона по модулю равен единице, пишут только знак (+ или -).
Примеры простых ионов: Na+, Ca2+, Al3+, S2-, I— и т.д.
Примеры сложных ионов: SO42-, NO3—, [AlF6]3- и т. д.
д.
Рассмотрим детальнее простые ионы. Откуда у них может возникнуть заряд? Вспомним тот факт, что любой атом является электронейтральной частицей вследствие того, что количество отрицательно заряженных электронов в его оболочках равно количеству положительно заряженных протонов в его ядре.
Если мы «удалим» у атома часть электронов, то получим часть некомпенсированных положительных зарядов. При удалении части электронов у атома получим катион, при присоединении одного или нескольких электронов к атому получим анион.
Например, катион натрия Na+, от атома натрия Na0 отличает то, что частица Na+ содержит в себе на один электрон меньше чем, атом натрия. Для того чтобы записать электронную конфигурацию катиона натрия Na+, сначала вспомним, сколько электронов имеет атом натрия. Сделать мы это можем, взглянув на порядковый номер химического элемента в таблице Д.И. Менделеева. Натрий имеет порядковый номер 11, следовательно, его атом содержит 11 электронов, тогда катион натрия будет иметь на один электрон меньше, то есть 10 электронов.
Далее распределим 10 электронов по энергетическим подуровням, исходя из всех тех же принципов, что использовались для записи электронных конфигураций атомов:
Аналогично попробуем записать электронно-графическую формулу сульфид-иона S2-. В таблице Д.И. Менделеева сера имеет порядковый номер, равный 16. Это значит, что атом серы S0 содержит 16 электронов. Отрицательный заряд иона серы равный 2- указывает на то, что у этого иона на два электрона больше, чем у атома серы, то есть 18 электронов. Тогда электронно-графическая формула и обычная электронная формула сульфид-иона S2- будут иметь вид:
Мы поняли, как записать электронно-графическую (или обычную электронную) формулу иона, зная точное его обозначение. Однако, для того чтобы успешно сдать ЕГЭ, нам нужно уметь самим определять заряды ионов, которые склонны образовывать те или иные химические элементы. Причем уметь определять заряд наиболее устойчивых ионов мы обязаны только для элементов главных подгрупп.
Все очень просто, если учитывать, что атомы элементов главных подгрупп «хотят» получить электронную конфигурацию, как у ближайшего к ним по номеру в таблице атома благородного газа.
Например, определим, какой наиболее устойчивый ион образует магний. Смотрим в таблицу Д.И. Менделеева и видим, что ближайший по значению порядкового номера к нему благородный газ – неон. Атом неона содержит 10 электронов, значит и катион магния будет содержать 10 электронов, в то время как у обычного атома магния 12 электронов. Значит наиболее устойчивый катион магния будет иметь заряд 2+ (от 12 отнимаем 10), то есть мы можем обозначить его как Mg2+.
Установим формулу наиболее устойчивого иона хлора. Для этого снова смотрим в таблицу Д.И. Менделеева и видим, что ближайший по порядковому номеру благородный химический элемент — аргон. Атом аргона имеет 18 электронов, а атом хлора – 17 электронов. То есть наиболее устойчивый ион хлора содержит один «избыточный» электрон по сравнению с нейтральным атомом хлора. Таким образом, формулу наиболее устойчивого иона хлора можно записать как Cl—.
Таким образом, формулу наиболее устойчивого иона хлора можно записать как Cl—.
Также есть еще один простой способ установления формул наиболее устойчивых ионов химических элементов, который заключается в том, чтобы попытаться найти их в ряду катионов и анионов таблицы растворимости. Если мы не находим анион соответствующего элемента, можно посмотреть на заряд его «родственника» по подгруппе. Например, в таблице растворимости мы не найдем ион кислорода, однако, в той же подгруппе, что и кислород, расположена сера, обозначение аниона которой мы легко находим в таблице растворимости – S2-. Следовательно, и наиболее устойчивый ион кислорода мы можем записать как O2-.
| № эл-та | Химический знак | Название элемента | Электронная формула |
| 1 | H | водород | 1s 1 |
| 2 | He | гелий | 1s 2 |
| II период | |||
| 3 | Li | литий | 1s 22s 1 |
| 4 | Be | бериллий | 1s 22s 2 |
| 5 | B | бор | 1s 22s 22p 1 |
| 6 | C | углерод | 1s 22s 22p 2 |
| 7 | N | азот | 1s 22s 22p 3 |
| 8 | O | кислород | 1s 22s 22p 4 |
| 9 | F | фтор | 1s 22s 22p 5 |
| 10 | Ne | неон | 1s 22s 22p 6 |
| III период | |||
| 11 | Na | натрий | 1s 22s 22p 63s 1 |
| 12 | Mg | магний | 1s 22s 22p 63s 2 |
| 13 | Al | алюминий | 1s 22s 22p 63s 23p1 |
| 14 | Si | кремний | 1s 22s 22p 63s 23p2 |
| 15 | P | фосфор | 1s 22s 22p 63s 23p3 |
| 16 | S | сера | 1s 22s 22p 63s 23p4 |
| 17 | Cl | хлор | 1s 22s 22p 63s 23p5 |
| 18 | Ar | аргон | 1s 22s 22p 63s 23p6 |
| IV период | |||
| 19 | K | калий | 1s 22s 22p 63s 23p64s 1 |
| 20 | Ca | кальций | 1s 22s 22p 63s 23p64s 2 |
| 21 | Sc | скандий | 1s 22s 22p 63s 23p64s 23d1 |
| 22 | Ti | титан | 1s 22s 22p 63s 23p64s 23d2 |
| 23 | V | ванадий | 1s 22s 22p 63s 23p64s 23d3 |
| 24 | Cr | хром | 1s 22s 22p 63s 23p64s 13d5 |
| 25 | Mn | марганец | 1s 22s 22p 63s 23p64s 23d5 |
| 26 | Fe | железо | 1s 22s 22p 63s 23p64s 23d6 |
| 27 | Co | кобальт | 1s 22s 22p 63s 23p64s 23d7 |
| 28 | Ni | никель | 1s 22s 22p 63s 23p64s 23d8 |
| 29 | Cu | медь | 1s 22s 22p 63s 23p64s 13d10 |
| 30 | Zn | цинк | 1s 22s 22p 63s 23p64s 23d10 |
| 31 | Ga | галлий | 1s 22s 22p 63s 23p64s 23d104p1 |
| 32 | Ge | германий | 1s 22s 22p 63s 23p64s 23d104p2 |
| 33 | As | мышьяк | 1s 22s 22p 63s 23p64s 23d104p3 |
| 34 | Se | селен | 1s 22s 22p 63s 23p64s 23d104p4 |
| 35 | Br | бром | 1s 22s 22p 63s 23p64s 23d104p5 |
| 36 | Kr | криптон | 1s 22s 22p 63s 23p64s 23d104p6 |
| V период | |||
| 37 | Rb | рубидий | 1s 22s 22p 63s 23p64s 23d104p65s1 |
| 38 | Sr | стронций | 1s 22s 22p 63s 23p64s 23d104p65s2 |
| 39 | Y | иттрий | 1s 22s 22p 63s 23p64s 23d104p65s24d1 |
| 40 | Zr | цирконий | 1s 22s 22p 63s 23p64s 23d104p65s24d2 |
| 41 | Nb | ниобий | 1s 22s 22p 63s 23p64s 23d104p65s14d4 |
| 42 | Mo | молибден | 1s 22s 22p 63s 23p64s 23d104p65s14d5 |
| 43 | Tc | технеций | 1s 22s 22p 63s 23p64s 23d104p65s24d5 |
| 44 | Ru | рутений | 1s 22s 22p 63s 23p64s 23d104p65s14d7 |
| 45 | Rh | родий | 1s 22s 22p 63s 23p64s 23d104p65s14d8 |
| 46 | Pd | палладий | 1s 22s 22p 63s 23p64s 23d104p65s04d10 |
| 47 | Ag | серебро | 1s 22s 22p 63s 23p64s 23d104p65s14d10 |
| 48 | Cd | кадмий | 1s 22s 22p 63s 23p64s 23d104p65s24d10 |
| 49 | In | индий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p1 |
| 50 | Sn | олово | 1s 22s 22p 63s 23p64s 23d104p65s24d105p2 |
| 51 | Sb | сурьма | 1s 22s 22p 63s 23p64s 23d104p65s224d105p3 |
| 52 | Te | теллур | 1s 22s 22p 63s 23p64s 23d104p65s24d105p4 |
| 53 | I | йод | 1s 22s 22p 63s 23p64s 23d104p65s24d105p5 |
| 54 | Xe | ксенон | 1s 22s 22p 63s 23p64s 23d104p65s24d105p6 |
| VI период | |||
| 55 | Cs | цезий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1 |
| 56 | Ba | барий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2 |
| 57 | La | лантан | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s25d1 |
| 58 | Ce | церий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2 |
| 59 | Pr | празеодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f3 |
| 60 | Nd | неодим | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f4 |
| 61 | Pm | прометий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f5 |
| 62 | Sm | самарий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f6 |
| 63 | Eu | европий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f7 |
| 64 | Gd | гадолиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f75d1 |
| 65 | Tb | тербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f9 |
| 66 | Dy | диспрозий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f10 |
| 67 | Ho | гольмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f11 |
| 68 | Er | эрбий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f12 |
| 68 | Tm | тулий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f13 |
| 70 | Yb | иттербий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f14 |
| 71 | Lu | лютеций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d1 |
| 72 | Hf | гафний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d2 |
| 73 | Ta | тантал | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d3 |
| 74 | W | вольфрам | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4 |
| 75 | Re | рений | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d5 |
| 76 | Os | осмий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d6 |
| 77 | Ir | иридий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d7 |
| 78 | Pt | платина | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9 |
| 79 | Au | золото | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10 |
| 80 | Hg | ртуть | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d10 |
| 81 | Tl | таллий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p1 |
| 82 | Pb | свинец | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 |
| 83 | Bi | висмут | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3 |
| 84 | Po | полоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p4 |
| 85 | At | астат | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p5 |
| 86 | Rn | радон | 1s 22s 22p 63s 23p64s 23d104p65s14d105p66s24f145d106p6 |
| VII период | |||
| 87 | Fr | франций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s1 |
| 88 | Ra | радий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s2 |
| 89 | Ac | актиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d1 |
| 90 | Th | торий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d25f0 |
| 91 | Pa | протактиний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f26d1 |
| 92 | U | уран | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f36d1 |
| 93 | Np | нептуний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f46d1 |
| 94 | Pu | плутоний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f56d1 |
| 95 | Am | америций | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f7 |
| 96 | Cm | кюрий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f76d1 |
| 97 | Bk | берклий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f86d1 |
| 98 | Cf | калифорний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f10 |
| 99 | Es | эйнштейний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f11 |
| 100 | Fm | фермий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f12 |
| 101 | Md | менделеевий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f13 |
| 102 | No | нобелий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f14 |
| 103 | Lr | лоуренсий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d1 |
| 104 | Rf | резерфордий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d2 |
| 105 | Db | дубний | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d3 |
| 106 | Sg | сиборгий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d4 |
| 107 | Bh | борий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d5 |
| 108 | Hs | хассий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d6 |
| 109 | Mt | мейтнерий | 1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d7 |
| Обозначения элементов: | |||
| s-элементы | p-элементы | d-элементы | f-элементы |
Тест строение атома » HimEge.
 ru
ruЧисло электронных слоев и число электронов на внешнем электронном слое атомов брома соответственно равны:
A | 7 и 4 |
B | 4 и 7 |
C | 35 и 7 |
D | 4 и 35 |
Пояснение к вопросу 1:
Число электронных слоев равно номеру периода, количество электронов на внешнем слое равно номеру группы.
Число электронных слоев и число электронов на внешнем электронном слое атомов марганца соответственно равны
A | 4 и 7 |
B | 4 и 2 |
C | 7 и 4 |
D | 4 и 5 |
Пояснение к вопросу 2:
У марганца внешнем (четвертом) слое находится 2 s электрона. Номер периода равен числу электронных слоев.
Электронная конфигурация атома железа:
A | 1s2 2s2 2р6 Зs2 3р6 3d6 |
B | 1s2 2s2 2р6 Зs2 3р6 4s2 4p2 |
C | 1s2 2s2 2р6 Зs2 3р6 3d8 |
D | 1s2 2s2 2р6 Зs2 3р6 3d6 4s2 |
Число электронных слоев и число d-электронов в атоме никеля соответственно равны:
A | 8 и 4 |
B | 4 и 2 |
C | 4 и 7 |
D | 4 и 8 |
Электронная конфигурация атома ванадия:
A | 1s22s22p63d5 |
B | 1s22s22p63s23p63d34s2 |
C | 1s22s22p63s23p63d44s1 |
D | 1s22s22p63s23p64s24p3 |
Электронная конфигурация внешнего электронного слоя 4s2 4p3 соответствует атому:
A | мышьяка |
B | ванадия |
C | фосфора |
D | сурьмы |
Электронная конфигурация 1s2 2s2 2p6 3s2 3p6 3d2 4s2 соответствует атому:
A | скандия |
B | ванадия |
C | титана |
D | германия |
Электронная конфигурация ns2 np6 соответствует каждому из двух атомов:
A | аргон и криптон |
B | неон и гелий |
C | фтор и хлор |
D | сера и кислород |
Электронная конфигурация 1s2 2s2 2p6 3s2 3p6 3d5 соответствует иону:
Электронная конфигурация 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 не соответствует частице:
Электронная конфигурация 1s2 2s2 2p6 3s2 3p6 3d10 не соответствует иону:
Электронную конфигурацию инертного газа не имеет ион:
Атому неона в основном состоянии соответствует электронная конфигурация частицы:
Элементу, электронная формула атома которого 1s2 2s2 2p5 ,соответствует водородное соединение ,формула которого:
Элементу, электронная формула внешнего электронного слоя атома которого . ..3s2 3p2, соответствует водородное соединение, формула которого:
..3s2 3p2, соответствует водородное соединение, формула которого:
Элементу, электронная формула атома которого 1s22s22p63s23p4 , соответствует высший оксид, формула которого:
Элементу, электронная формула атома которого 1s22s22p63s23p63d54s2 , соответствует высший оксид, формула которого:
Элементу, электронная формула атома которого 1s22s22p63s23p63d104s24p3 , соответствует высший оксид, формула которого:
Количество оставшихся вопросов: 18.
WebElements Periodic Table »Никель» Свойства свободных атомов
Атомы никеля имеют 28 электронов, а структура оболочки — 2.8.16.2.
Электронная конфигурация основного состояния газообразного нейтрального никеля в основном состоянии равна [ Ar ]. 3д 8 . 4s 2 , а символ термина — это 3 F 4 .
3д 8 . 4s 2 , а символ термина — это 3 F 4 .
Атомный спектр
Изображение атомного спектра никеля.
Энергии ионизации и сродство к электрону
Электронное сродство никеля 112 кДж / моль ‑1 . Энергии ионизации никеля приведены ниже.
Энергии ионизации никеля.Эффективные ядерные заряды
Ниже приведены эффективные ядерные заряды «Клементи-Раймонди», Z eff .Перейдите по гиперссылкам для получения более подробной информации и графиков в различных форматах.
| 1с | 27,3526 | ||||||
|---|---|---|---|---|---|---|---|
| 2с | 20,21 | 2 пол. | 24,10 | ||||
| 3с | 14,96 | 3 пол. | 14,09 | 3d | 12,53 | ||
| 4с | 5,71 | 4p | (нет данных) | 4д | (нет данных) | 4f | (нет данных) |
| 5s | (нет данных) | 5p | (нет данных) | 5d | (нет данных) | ||
| 6s | (нет данных) | 6p | (нет данных) | ||||
| 7с | |||||||
Список литературы
Эти эффективные ядерные заряды, Z eff , взяты из следующих ссылок:
- E.Clementi and D.L.Raimondi, J. Chem. Phys. 1963, 38 , 2686.
- Э. Клементи, Д.Л. Раймонди, В.П. Reinhardt, J. Chem. Phys. 1967, 47 , 1300.
Энергии связи электрона
| Этикетка | Орбитальная | эВ [ссылка на литературу] |
|---|---|---|
| K | 1s | 8333 [1] |
| L I | 2s | 1008,6 [3] |
| L II | 2p 1/2 | 870 [3] |
| L III | 2p 3/2 | 852,7 [3] |
| M I | 3s | 110.8 [3] |
| M II | 3p 1/2 | 68 [3] |
| M III | 3p 3/2 | 66,2 [3] |
Банкноты
Я благодарен Гвину Уильямсу (Лаборатория Джефферсона, Вирджиния, США), которая предоставила данные об энергии связи электронов. Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Данные взяты из ссылок 1-3. Они сведены в таблицы в другом месте в Интернете (ссылка 4) и в бумажной форме (ссылка 5).
Список литературы
- Дж. А. Бирден и А. Ф. Берр, «Переоценка рентгеновских уровней атомной энергии», Rev. Mod. Phys. , 1967, 39 , 125.
- М. Кардона и Л. Лей, ред., Фотоэмиссия в твердых телах I: общие принципы (Springer-Verlag, Берлин) с дополнительными исправлениями, 1978 г.
- Gwyn Williams WWW таблица значений
- D.R. Лиде (ред.) В справочнике по химии и физике компании Chemical Rubber Company , CRC Press, Бока-Ратон, Флорида, США, 81-е издание, 2000 г.
- J. C. Fuggle и N. Mårtensson, «Энергии связи на уровне ядра в металлах», J. Electron Spectrosc. Relat. Феном. , 1980, 21 , 275.
Информация об элементе: факты, свойства, тенденции, использование и сравнение — Периодическая таблица элементов
История никеля
Элемент никель был открыт Акселем Фредриком Кронштедтом в году
1751 г. в Швеции
.Никель
получил свое название от шведского kopparnickel, содержащего немецкое слово Nickel, «гоблин».
в Швеции
.Никель
получил свое название от шведского kopparnickel, содержащего немецкое слово Nickel, «гоблин».
Наличие никеля: изобилие в природе и вокруг нас
В таблице ниже показано содержание никеля во Вселенной, Солнце, Метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура никеля
Твердотельная структура никеля — гранецентрированная кубическая.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| а | б | c |
|---|---|---|
352. 4 4 | 352,4 | 352,4 вечера |
и углы между ними Решетки Углы (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | π / 2 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно
симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами
(219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства никеля
Атомы никеля имеют 28 электронов и структура электронной оболочки [2, 8, 16, 2] с символом атомного члена (квантовые числа) 3 F 4 .
Оболочечная структура никеля — количество электронов на энергию уровень
| n | с | п. | г | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | л | 2 | 6 | ||
| 3 | M | 2 | 6 | 8 | |
| 4 | N | 2 |
Основное состояние электронной конфигурации никеля — нейтраль Атом никеля
Электронная конфигурация нейтрального атома никеля в основном состоянии
[Ar] 3d8 4s2. Часть конфигурации никеля, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Ar]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 3d8 4s2, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Часть конфигурации никеля, которая эквивалентна благородному газу
предыдущий период сокращенно обозначается как [Ar]. Для атомов с большим количеством электронов это
нотация может стать длинной, поэтому используются сокращенные обозначения.
валентные электроны 3d8 4s2, электроны в
внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального никеля
Полная электронная конфигурация основного состояния для атома никеля, несокращенная электронная конфигурация
1с2 2с2 2п6 3с2 3п6 3d8 4с2
Атомная структура никеля
Атомный радиус никеля 149 пм, а его ковалентный радиус 121 пм.
Атомный спектр никеля
Никель Химические свойства: Энергии ионизации никеля и сродство к электрону
Электронное сродство никеля 112 кДж / моль.
Энергия ионизации никеля
Энергия ионизации никеля
приведена в таблице ниже.| Число энергии ионизации | Энтальпия — кДж / моль |
|---|---|
| 1 | 737.1 |
| 2 | 1753 |
| 3 | 3395 |
| 4 | 5,3 × 103 |
| 5 | 7339 |
| 6 | 1,04 × 104 |
| 7 | 1.28 × 104 |
| 8 | 1,56 × 104 |
| 9 | 1. 86 × 104 86 × 104 |
| 10 | 21670 |
| 11 | 30970 |
| 12 | 3,4 × 104 |
| 13 | 3.71 × 104 |
| 14 | 4,15 × 104 |
| 15 | 4,48 × 104 |
| 16 | 4,81 × 104 |
| 17 | 55101 |
| 18 | 58570 |
| 19 | 1.487 × 105 |
| 20 | 1,59 × 105 |
| 21 | 1,694 × 105 |
Физические свойства никеля
Физические свойства никеля см. В таблице ниже.
В таблице ниже.
| Плотность | 8,908 г / см3 |
| Молярный объем | 6.58884149079 см3 |
Упругие свойства
Твердость никеля — Испытания для измерения твердости элемента
Электрические свойства никеля
Никель — проводник электричества. Ссылаться на Таблица ниже электрические свойства никеля
Никель Теплопроводные свойства
Магнитные свойства никеля
Оптические свойства никеля
Акустические свойства никеля
Тепловые свойства никеля — энтальпии и термодинамика
Термические свойства никеля
см. В таблице ниже.
В таблице ниже.Энтальпии никеля
Изотопы никеля — ядерные свойства никеля
Изотопы родия.Природный никель 5 стабильный изотоп — 58Ni, 60Ni, 61Ni, 62Ni, 64Ni.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 48Ni | ||||
| 49Ni | ||||
| 50Ni | ||||
| 51Ni | ||||
| 52Ni | ||||
| 53Ni | ||||
| 54Ni | ||||
| 55Ni | ||||
| 56Ni | ||||
| 57Ni | ||||
| 58Ni | 68. 0769% 0769% | Стабильный | N / A | |
| 59Ni | ||||
| 60Ni | 26. 2231% 2231% | Стабильный | N / A | |
| 61Ni | 1. 1399% 1399% | Стабильный | N / A | |
| 62Ni | 3. 6345% 6345% | Стабильный | N / A | |
| 63Ni | ||||
| 64Ni | 0. 9256% 9256% | Стабильный | N / A | |
| 65Ni | ||||
| 66Ni | ||||
| 67Ni | ||||
| 68Ni | ||||
| 69Ni | ||||
| 70Ni | ||||
| 71Ni | ||||
| 72Ni | ||||
| 73Ni | ||||
| 74Ni | ||||
| 75Ni | ||||
| 76Ni | ||||
| 77Ni | ||||
| 78Ni |
Нормативно-правовое регулирование и здравоохранение — Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Никель — Протоны — Нейтроны — Электроны
Никель — серебристо-белый блестящий металл с легким золотистым оттенком. Никель относится к переходным металлам, он твердый и пластичный. В настоящее время мировое производство никеля используется следующим образом: 68% производится из нержавеющей стали; 10% в цветных сплавах; 9% в гальванике; 7% в легированной стали; 3% в литейных цехах; и 4% других видов использования (включая батареи).
Никель относится к переходным металлам, он твердый и пластичный. В настоящее время мировое производство никеля используется следующим образом: 68% производится из нержавеющей стали; 10% в цветных сплавах; 9% в гальванике; 7% в легированной стали; 3% в литейных цехах; и 4% других видов использования (включая батареи).
Никель извлекается обжигом до NiO с последующим восстановлением углеродом. Процесс Монда используется для производства чистого никеля, в котором нечистый никель реагирует с монооксидом углерода (CO) с образованием Ni (CO) 4, который затем разлагается при 200 ° C с получением 99.99% Ni.
Протоны и нейтроны в никеле
Никель — химический элемент с атомным номером 28 , что означает, что в его ядре 28 протонов. Общее количество протонов в ядре называется атомным номером атома и обозначается символом Z . Таким образом, полный электрический заряд ядра равен + Ze, где e (элементарный заряд) равен 1,602 x 10 -19 кулонов .
Общее количество нейтронов в ядре атома называется нейтронным числом атома и обозначается символом N .Нейтронное число плюс атомный номер равняется атомному массовому числу: N + Z = A . Разница между числом нейтронов и атомным номером известна как нейтронный избыток : D = N — Z = A — 2Z.
Для стабильных элементов обычно существует множество стабильных изотопов. Изотопы — это нуклиды, которые имеют одинаковый атомный номер и, следовательно, являются одним и тем же элементом, но различаются числом нейтронов. Массовые числа типичных изотопов Никель — 60; 61; 62; 64.
Основные изотопы никеля
Никель природного происхождения состоит из пяти стабильных изотопов; 58 Ni, 60 Ni, 61 Ni, 62 Ni и 64 Ni, при этом 58 Ni является наиболее распространенным (68,077% естественного содержания).
Никель-58 состоит из 28 протонов, 30 нейтронов и 28 электронов. Никель-58 — самый распространенный изотоп никеля, составляющий 68,077% от естественного содержания.
Никель-60 состоит из 28 протонов, 32 нейтронов и 28 электронов.
Никель-61 состоит из 28 протонов, 33 нейтронов и 28 электронов. Никель-61 — единственный стабильный изотоп никеля с ядерным спином (I = 3/2), что делает его полезным для исследований методом спектроскопии ЭПР.
Никель-62 состоит из 28 протонов, 34 нейтронов и 28 электронов. Никель-62 имеет самую высокую из всех нуклидов среднюю энергию связи ядра на нуклон — 8,7946 МэВ / нуклон. Его энергия связи больше, чем у 56 Fe и 58 Fe, более распространенных элементов, которые часто ошибочно называют имеющими наиболее прочно связанные нуклиды.
Никель-64 состоит из 28 протонов, 36 нейтронов и 28 электронов.
Стабильные изотопы
| Изотоп | Изобилие | Нейтронное число |
| 58 Ni | 68,08% | 30 |
| 60 Ni | 26,02% | 32 |
| 61 Ni | 1. 14% 14% | 33 |
| 62 Ni | 3,64% | 34 |
| 64 Ni | 0,926% | 36 |
Типичные нестабильные изотопы
Электроны и электронная конфигурация
Число электронов в электрически нейтральном атоме такое же, как число протонов в ядре. Следовательно, число электронов в нейтральном атоме никеля равно 28. На каждый электрон влияют электрические поля, создаваемые положительным зарядом ядра и другими (Z — 1) отрицательными электронами в атоме.
сообщает об этом объявлении Поскольку количество электронов и их расположение ответственны за химическое поведение атомов, атомный номер идентифицирует различные химические элементы. Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим его химическое связывание. В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Электронная конфигурация Никель — [Ar] 3d8 4s2 .
Возможные степени окисления: +2,3 .
Наиболее распространенная степень окисления никеля +2, но соединения Ni 0 , Ni + и Ni 3+ хорошо известны, а экзотические степени окисления Ni 2−, Ni 1− и Ni 4+ изготовлены и исследованы.Чистый никель, измельченный в порошок для увеличения реактивной площади поверхности, проявляет значительную химическую активность, но более крупные куски медленно реагируют с воздухом при стандартных условиях, поскольку на поверхности образуется оксидный слой, предотвращающий дальнейшую коррозию (пассивацию).
Самый важный сплав никеля
Суперсплавы на основе никеля в настоящее время составляют более 50% веса современных авиационных двигателей. Суперсплавы на основе никеля включают сплавы, упрочненные твердым раствором, и сплавы, упрочняющиеся при старении. Стационарные сплавы состоят из аустенитной (ГЦК) матрицы, диспергированной с когерентным выделением интерметаллида Ni 3 (Al, Ti) с ГЦК-структурой. Суперсплавы на основе Ni — это сплавы с никелем в качестве первичного легирующего элемента, которые предпочтительнее в качестве материала лезвий в ранее обсуждавшихся применениях, чем суперсплавы на основе Co или Fe. Для суперсплавов на основе никеля важны их высокая прочность, сопротивление ползучести и коррозии при высоких температурах. Обычно лопатки турбин отливают в форме направленного отверждения или в форме монокристалла.Лопатки из монокристалла в основном используются в первом ряду ступени турбины.
Стационарные сплавы состоят из аустенитной (ГЦК) матрицы, диспергированной с когерентным выделением интерметаллида Ni 3 (Al, Ti) с ГЦК-структурой. Суперсплавы на основе Ni — это сплавы с никелем в качестве первичного легирующего элемента, которые предпочтительнее в качестве материала лезвий в ранее обсуждавшихся применениях, чем суперсплавы на основе Co или Fe. Для суперсплавов на основе никеля важны их высокая прочность, сопротивление ползучести и коррозии при высоких температурах. Обычно лопатки турбин отливают в форме направленного отверждения или в форме монокристалла.Лопатки из монокристалла в основном используются в первом ряду ступени турбины.
О протонах
Протон — одна из субатомных частиц, составляющих материю. Во Вселенной много протонов, составляющих примерно половину всей видимой материи. Он имеет положительный электрический заряд (+ 1e) и массу покоя, равную 1,67262 × 10 −27 кг ( 938,272 МэВ / c 2 ) — немного легче, чем у нейтрона, но почти 1836 г. раз больше, чем у электрона.Протон имеет средний квадратный радиус около 0,87 × 10 −15 м, или 0,87 фм, и это спин — ½ фермиона.
раз больше, чем у электрона.Протон имеет средний квадратный радиус около 0,87 × 10 −15 м, или 0,87 фм, и это спин — ½ фермиона.
Протоны существуют в ядрах типичных атомов вместе со своими нейтральными аналогами, нейтронами. Нейтроны и протоны, обычно называемые нуклонами , связаны вместе в атомном ядре, где на их долю приходится 99,9% массы атома. Исследования в области физики частиц высоких энергий в 20 веке показали, что ни нейтрон, ни протон не являются наименьшим строительным блоком материи.
О нейтронах
Нейтрон — одна из субатомных частиц, составляющих материю. Во Вселенной много нейтронов, составляющих более половины всей видимой материи. Он имеет без электрического заряда и массу покоя, равную 1,67493 × 10-27 кг, что незначительно больше, чем у протона, но почти в 1839 раз больше, чем у электрона. Нейтрон имеет средний квадратный радиус около 0,8 × 10-15 м, или 0,8 фм, и это фермион со спином 1/2.
Атомные ядра состоят из протонов и нейтронов, которые притягиваются друг к другу посредством ядерной силы , в то время как протоны отталкиваются друг от друга посредством электрической силы , обусловленной их положительным зарядом. Эти две силы конкурируют, приводя к различной стабильности ядер. Есть только определенные комбинации нейтронов и протонов, которые образуют стабильных ядер .
Нейтроны стабилизируют ядро , потому что они притягивают друг друга и протоны, что помогает компенсировать электрическое отталкивание между протонами.В результате, по мере увеличения числа протонов , для образования стабильного ядра требуется возрастающее отношение нейтронов к протонам . Если нейтронов слишком много или слишком мало для данного числа протонов, образующееся ядро не является стабильным и подвергается радиоактивному распаду. Нестабильные изотопы распадаются различными путями радиоактивного распада, чаще всего через альфа-распад, бета-распад или захват электронов. Известны многие другие редкие типы распада, такие как спонтанное деление или испускание нейтронов.Следует отметить, что все эти пути распада могут сопровождаться последующим испусканием гамма-излучения . Чистые альфа- или бета-распады очень редки.
Известны многие другие редкие типы распада, такие как спонтанное деление или испускание нейтронов.Следует отметить, что все эти пути распада могут сопровождаться последующим испусканием гамма-излучения . Чистые альфа- или бета-распады очень редки.
Об электронах и конфигурации электронов
Периодическая таблица представляет собой табличное отображение химических элементов, организованных на основе их атомных номеров, электронных конфигураций и химических свойств. Электронная конфигурация — это распределение электронов атома или молекулы (или другой физической структуры) на атомных или молекулярных орбиталях.Знание электронной конфигурации различных атомов полезно для понимания структуры периодической таблицы элементов.
Каждое твердое тело, жидкость, газ и плазма состоит из нейтральных или ионизированных атомов. Химические свойства атома определяются числом протонов, фактически, числом и расположением электронов . Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим его химическое связывание.В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Конфигурация этих электронов следует из принципов квантовой механики. Количество электронов в электронных оболочках каждого элемента, особенно в самой внешней валентной оболочке, является основным фактором, определяющим его химическое связывание.В периодической таблице элементы перечислены в порядке возрастания атомного номера Z.
Это принцип исключения Паули , который требует, чтобы электроны в атоме занимали разные энергетические уровни вместо того, чтобы все они конденсировались в основном состоянии. Упорядочение электронов в основном состоянии многоэлектронных атомов начинается с самого низкого энергетического состояния (основного состояния) и постепенно перемещается оттуда вверх по энергетической шкале, пока каждому из электронов атома не будет присвоен уникальный набор квантовых чисел.Этот факт имеет ключевое значение для построения периодической таблицы элементов.
Первые два столбца в левой части таблицы Менделеева — это то место, где заняты подоболочки s . Из-за этого первые две строки периодической таблицы обозначены как блок . Аналогично, блок p — это шесть крайних правых столбцов периодической таблицы, блок d — это средние 10 столбцов периодической таблицы, а блок f — это секция из 14 столбцов, которая обычно изображается как отделенный от основной части таблицы Менделеева.Она могла быть частью основного тела, но тогда таблица Менделеева была бы довольно длинной и громоздкой.
Из-за этого первые две строки периодической таблицы обозначены как блок . Аналогично, блок p — это шесть крайних правых столбцов периодической таблицы, блок d — это средние 10 столбцов периодической таблицы, а блок f — это секция из 14 столбцов, которая обычно изображается как отделенный от основной части таблицы Менделеева.Она могла быть частью основного тела, но тогда таблица Менделеева была бы довольно длинной и громоздкой.
Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используются сокращенные обозначения. Электронную конфигурацию можно представить как остовные электроны, эквивалентные благородному газу предыдущего периода, и валентные электроны (например, [Xe] 6s2 для бария).
Окислительные состояния
Состояния окисления обычно представлены целыми числами, которые могут быть положительными, нулевыми или отрицательными. Большинство элементов имеют несколько возможных степеней окисления. Например, углерод имеет девять возможных целочисленных степеней окисления от -4 до +4.
Большинство элементов имеют несколько возможных степеней окисления. Например, углерод имеет девять возможных целочисленных степеней окисления от -4 до +4.
Текущее определение степени окисления в Золотой книге IUPAC:
«Состояние окисления атома — это заряд этого атома после ионного приближения его гетероядерных связей…»
, а термин «степень окисления» почти синонимичен. Элемент, который не сочетается с другими элементами, имеет степень окисления 0.Состояние окисления 0 имеет место для всех элементов — это просто элемент в его элементарной форме. Атом элемента в соединении будет иметь положительную степень окисления, если из него были удалены электроны. Точно так же добавление электронов приводит к отрицательной степени окисления. Мы также различаем возможные и общие степени окисления каждого элемента. Например, кремний имеет девять возможных целочисленных степеней окисления от -4 до +4, но только -4, 0 и +4 являются общими степенями окисления.
Сводка
| Элемент | Никель |
| Число протонов | 28 |
| Количество нейтронов (типичные изотопы) | 60; 61; 62; 64 |
| Количество электронов | 28 |
| Электронная конфигурация | [Ар] 3d8 4s2 |
| Степени окисления | +2,3 |
Источник: www. luciteria.com
luciteria.com
Свойства прочих элементов
Никель прочие свойства
Периодическая таблица в KnowledgeDoor
Ссылки (Щелкните рядом со значением выше, чтобы увидеть полную информацию о цитировании для этой записи)
Allred, A. L. «Значения электроотрицательности из термохимических данных». Журнал неорганической и ядерной химии, том 17, номер 3-4, 1961 г., стр. 215–221. DOI: 10.1016 /
Allred, A.Л., Э. Г. Рохов. «Шкала электроотрицательности, основанная на электростатической силе». Журнал неорганической и ядерной химии, том 5, номер 4, 1958 г., стр. 264–268. DOI: 10.1016 /
Андерс, Эдвард и Николас Гревесс. «Изобилие элементов: метеоритное и солнечное». Geochimica et Cosmochimica Acta, том 53, номер 1, 1989 г., стр. 197–214. DOI: 10.1016 /
Андерсен Т., Х. К. Хауген и Х. Хотоп. «Энергии связи в атомных отрицательных ионах: III. «Journal of Physical and Chemical Reference Data, том 28, номер 6, 1999 г., стр. 1511–1533.
«Journal of Physical and Chemical Reference Data, том 28, номер 6, 1999 г., стр. 1511–1533.
Barron, THK, and GK White. Теплоемкость и тепловое расширение при низких температурах. Нью-Йорк: Kluwer Academic / Plenum Publishers» , 1999.
Барсан, Майкл Э., редактор. Карманный справочник NIOSH по химическим опасностям. Цинциннати, Огайо: NIOSH Publications, 2007.
Бацанов С.С. «Радиусы Ван-дер-Ваальса элементов.» Неорганические материалы, том 37, номер 9. 2001. С. 871–885.См. Реферат
Bearden, J. A., and A. F. Burr. «Переоценка рентгеновских уровней атомной энергии». Обзоры современной физики, том 39, номер 1, 1967 г., стр. 125–142. DOI: 10.1103 /
Бедфорд, Р. Э., Дж. Боннье, Х. Маас и Ф. Павезе. «Рекомендуемые значения температуры по международной температурной шкале 1990 г. для выбранного набора вторичных контрольных точек». Метрология, том 33, номер 2, 1996 г., стр. 133–154. DOI: 10.1088 /
Бонди, А. «Объемы и радиусы Ван дер Ваальса». Журнал физической химии, том 68, номер 3, 1964 г., стр. 441–451. DOI: 10.1021 /
«Объемы и радиусы Ван дер Ваальса». Журнал физической химии, том 68, номер 3, 1964 г., стр. 441–451. DOI: 10.1021 /
Боуэн, Х. Дж. М. Экологическая химия элементов. Лондон: Academic Press, Inc., 1979.
Cardarelli, François. Справочник по материалам: Краткий настольный справочник, 2-е издание. Лондон: Springer – Verlag, 2008.
. Клементи, Э. и Д. Л. Раймонди. «Константы атомарного экранирования из функций SCF». Журнал химической физики, том 38, номер 11, 1963 г., стр.2686–2689. DOI: 10,1063 /
Коэн, Э. Ричард, Дэвид Р. Лид и Джордж Л. Тригг, редакторы. Настольный справочник по физике AlP, 3-е издание. Нью-Йорк: Springer-Verlag New York, Inc., 2003.
Коннелли, Нил Г., Туре Дамхус, Ричард М. Хартсхорн и Алан Т. Хаттон. Номенклатура неорганической химии: Рекомендации ИЮПАК 2005. Кембридж: RSC Publishing, 2005.
Кордеро, Беатрис, Вероника Гомес, Ана Э. Платеро-Пратс, Марк Ревес, Хорхе Эчеверрия, Эдуард Кремадес, Флавиа Барраган и Сантьяго. «Ковалентные радиусы еще раз». Dalton Transactions, номер 21, 2008 г., стр. 2832–2838. DOI: 10.1039 /
«Ковалентные радиусы еще раз». Dalton Transactions, номер 21, 2008 г., стр. 2832–2838. DOI: 10.1039 /
Кокс, П. А. Элементы: их происхождение, изобилие и распространение. Oxford: Oxford University Press, 1989.
Кронан Д.С. «Базальные металлические отложения восточной части Тихого океана». Бюллетень Геологического общества Америки, том 87,
№ 6, 1976, с. 928–934. DOI: 10.1130 /
де Подеста, Майкл. Понимание свойств материи, 2-е издание.Лондон: Тейлор и Фрэнсис, 2002.
.Дронсковски, Ричард. Вычислительная химия твердотельных материалов. Вайнхайм, Германия: WILEY-VCH Verlag GmbH & Co. KGaA, 2005.
Эббинг, Даррелл Д. и Стивен Д. Гаммон. Общая химия, 8-е издание. Бостон, Массачусетс: Компания Houghton Mifflin, 2005.
Эмсли, Джон. Строительные блоки природы: руководство по элементам от А до Я. Оксфорд: Издательство Оксфордского университета, 2003.
Эмсли, Джон. Элементы, 3-е издание. Оксфорд: Издательство Оксфордского университета, 1998.
Оксфорд: Издательство Оксфордского университета, 1998.
Файерстоун, Ричард Б. Таблица изотопов, 8-е издание, том 2. Под редакцией Вирджинии С. Ширли с помощниками редакторов Корал М. Баглин, С. Ю. Фрэнк Чу и Джин Зипкин. Нью-Йорк: John Wiley & Sons, Inc., 1996.
Fuggle, John C., and Nils Mårtensson. «Связующие энергии на уровне ядра в металлах». Журнал электронной спектроскопии и родственных явлений, том 21, номер 3, 1980 г., стр. 275–281. DOI: 10.1016 /
Гош, Дулал К. и Картик Гупта.«Новая шкала электроотрицательности 54 элементов периодической таблицы, основанная на поляризуемости атомов». Журнал теоретической и вычислительной химии, том 5,
№ 4, 2006, с. 895–911. DOI: 10.1142 /
Гринвуд, Н. Н. и А. Эрншоу. Химия элементов, 2-е издание. Оксфорд: Баттерворт-Хайнеманн, 1997.
. Гвин Уильямс. Энергии связи электронов. http: //  html
html
Ho, C.Y., M. W. Ackerman, K. Y. Wu, T. N. Havill, R.H.Bogaard, R.A. Матула, С. Г. О и Г. М. Джеймс. «Удельное электрическое сопротивление десяти выбранных систем двойных сплавов». Справочный журнал физических и химических данных, том 12, номер 2, 1983 г., стр. 183–322.
Хо, К. Ю., Р. У. Пауэлл и П. Э. Лили. «Теплопроводность элементов: всесторонний обзор». Журнал физических и химических справочных данных, том 3, приложение 1, 1974 г., стр.I – 1 — I – 796.
Höhne, G. W. H., W. F. Hemminger, H.-J. Фламмерсхайм. Дифференциальная сканирующая калориметрия, 2-е издание. Берлин: Springer – Verlag, 2003.
Hotop, H., and W. C. Lineberger. «Энергии связи в атомных отрицательных ионах: II». Журнал физических и Справочные данные по химии, том 14, номер 3, 1985 г., стр. 731–750.
Хухи, Джеймс Э., Эллен А. Кейтер и Ричард Л. Кейтер. Неорганическая химия: принципы структуры и реакционной способности, 4-е издание. Нью-Йорк: издатели колледжа Харпер Коллинз, 1993.
Ihde, Аарон Дж. Развитие современной химии. Нью-Йорк: Dover Publications, Inc., 1984.
Международная организация труда (МОТ). Международный
Карта химической безопасности никеля. http: //
Дженсен, Дж.Э., Р. Б. Стюарт, В. А. Таттл, Х. Брехна и А. Г. Проделл, редакторы. Записная книжка избранных криогенных данных Брукхейвенской национальной лаборатории. БНЛ 10200-Р, т. 1, Брукхейвенская национальная лаборатория, август 1980 г.
Джессбергер, Эльмар К., Александр Христофоридис и Йохен Киссель. «Аспекты основного элементного состава пыли Галлея». Природа, том 332, номер 21, 1988 г., стр. 691–695. DOI: 10.1038 /
Каксирас, Эфтимиос. Атомная и электронная структура твердых тел. Кембридж: Издательство Кембриджского университета, 2003.
Кембридж: Издательство Кембриджского университета, 2003.
Керли, Джеральд И., редактор. Уравнения состояния для Be, Ni, W и Au. SAND2003-3784, Sandia National Laboratories, октябрь 2003 г.
Киттель, Чарльз. Введение в физику твердого тела, 8-е издание. Хобокен, Нью-Джерси: John Wiley & Sons, Inc., 2005.
Краузе, М. О. «Атомные радиационные и безызлучательные выходы для K- и L-оболочек». Справочный журнал физических и химических данных, том 8, номер 2, 1979 г., стр. 307–327.
Ли, Ю.-H. И J. E. Schoonmaker. «Химический состав и минералогия Морские отложения. «С. 1–36 в Отложениях, диагенезе и осадочных породах. Под редакцией Фреда Т. Маккензи. Оксфорд: Elsevier Ltd., 2005.
Либофф, Ричард Л. Введение в квантовую механику, 3-е издание. Чтение, Массачусетс. : Addison Wesley Longman, Inc., 1998.
Лид, Дэвид Р., редактор. Справочник CRC по химии и физике, 88-е издание. Бока-Ратон, Флорида: Taylor & Francis Group, 2008.
Манн, Джозеф Б. , Терри Л. Мик, Юджин Т. Найт, Джозеф Ф. Капитани и Лиланд К. Аллен. «Энергии конфигурации элементов d-блока». Журнал Американского химического общества, том 122, номер 21, 2000 г., стр. 5132–5137. DOI: 10.1021 /
, Терри Л. Мик, Юджин Т. Найт, Джозеф Ф. Капитани и Лиланд К. Аллен. «Энергии конфигурации элементов d-блока». Журнал Американского химического общества, том 122, номер 21, 2000 г., стр. 5132–5137. DOI: 10.1021 /
Мануэль, О., редактор. Происхождение элементов в Солнечной системе: последствия наблюдений после 1957 года. Нью-Йорк: Kluwer Academic Publishers, 2000.
Маршалл, Джеймс Л. Открытие элементов: поиск фундаментальных принципов Вселенной, 2-е издание.Бостон, Массачусетс: Pearson Custom Publishing, 2002.
Мартин У. К. «Электронная структура элементов». Европейский физический журнал C — Частицы и поля, том 15, номер 1–4, 2000 г., стр. 78–79. DOI: 10.1007 /
МакДонаф, В. Ф. «Композиционная модель ядра Земли». стр. 547–568 в The Mantle and Core. Под редакцией Ричарда В. Карлсона. Oxford: Elsevier Ltd., 2005.
Mechtly, Eugene A. «Свойства материалов». pp. 4–1–4–33 в Справочных данных для инженеров: радио, электроника, компьютер и связь. Мак Э. Ван Валкенбург, отредактированный Венди М. Миддлтон. Уоберн, Массачусетс: Баттерворт-Хайнеманн, 2002. DOI: 10.1016 /
Мак Э. Ван Валкенбург, отредактированный Венди М. Миддлтон. Уоберн, Массачусетс: Баттерворт-Хайнеманн, 2002. DOI: 10.1016 /
Мисслер, Гэри Л. и Дональд А. Тарр. Неорганическая химия, 3-е издание. Река Аппер Сэдл, Нью-Джерси: Пирсон Прентис Холл, 2004.
Нэгл, Джеффри К. «Атомная поляризуемость и электроотрицательность». Журнал Американского химического общества, том 112,
№ 12, 1990, с. 4741–4747. DOI: 10.1021 /
Национальный институт профессиональной безопасности и здоровья (NIOSH).Международная карта химической безопасности никеля. http: //
Национальный институт безопасности и гигиены труда (NIOSH). Реестр токсического действия химических веществ на никель. http: //
Николас, Дж. В. и Д. Р. Уайт. «Температура». стр. 8–41 в Измерение термодинамических Свойства одиночных фаз.Под редакцией А. Р. Х. Гудвина, В. А. Уэйкхема и К. Н. Марша. Амстердам: Elsevier Science, 2003.
Орем У. Х. и Р. Б. Финкельман. «Угледобыча и геохимия». С. 191–222 в Отложениях, диагенезе и осадочных породах. Под редакцией Фреда Т. Маккензи. Oxford: Elsevier Ltd., 2005.
Oxtoby, Дэвид У., Х. П. Гиллис и Алан Кэмпион. Принципы современной химии, 6-е издание. Бельмонт, Калифорния: Томсон Брукс / Коул, 2008.
Пальм, Х. и Х. Бир. «Метеориты и состав солнечной фотосферы.»стр. 204–206 в Ландольте – Бернштейне — Группа VI: Астрономия и астрофизика. Под редакцией HH Voigt. Нью-Йорк: Springer – Verlag, 1993. DOI: 10.1007 /
Palme, H., and Hugh St. К. О’Нил. «Космохимические оценки состава мантии». Стр. 1–38 в «Мантия и ядро». Под редакцией Ричарда В. Карлсона. Оксфорд: Elsevier Ltd., 2005.
Полинг, Линус. Природа Chemical Bond, 3-е издание. Итака, штат Нью-Йорк: Cornell University Press, 1960.
Pearson, Ralph G.«Абсолютная электроотрицательность и твердость: применение к
Неорганическая химия. «Неорганическая химия», том 27, номер 4, 1988 г., стр. 734–740. Doi: 10.1021 /
Пекка Пюккё. Самосогласованный, ковалентный год-2009
Радиусы. http: //
Pyykkö, Pekka, and Michiko Atsumi. «Ковалентные радиусы молекул с двойной связью для элементов Li-E112». Химия — европейский журнал,
том 15, номер 46, 2009 г., стр.12770–12779. DOI: 10.1002 /
Pyykkö, Pekka и Michiko Atsumi. «Молекулярные ковалентные радиусы одинарной связи для элементов 1-118». Химия — европейский журнал,
том 15, номер 1, 2009 г., стр. 186–197. doi: 10.1002 /
Pyykkö, Pekka, Sebastian Riedel и Michael Patzschke. «Ковалентные радиусы с тройной связью». Химия — европейский журнал,
том 11, номер 12, 2005 г., стр. 3511–3520. DOI: 10.1002 /
Рингнес, Виви.«Происхождение названий химических элементов». Журнал химического образования, том 66, номер 9, 1989 г.,
С. 731–738. DOI: 10.1021 /
Самсонов Г.В., редактор. Справочник по физико-химическим свойствам элементов. Нью-Йорк: Plenum Publishing Corporation, 1968.
Сандерсон, Р. Т. Простые неорганические вещества. Малабар, Флорида: Роберт Э. Кригер Publishing Co., Inc., 1989.
Сандерсон, Р. Т. «Принципы электроотрицательности: Часть I. Общая природа.»Журнал химического образования, том 65, номер 2, 1988 г., стр. 112–118. Doi: 10.1021 /
Сансонетти, Дж. Э. и У. К. Мартин.» Справочник по основным данным атомной спектроскопии. «Journal Of Physical And Химические справочные данные, том 34, номер 4, 2005 г., стр. 1559–2259. doi: 10.1063 /
Шефер, Х.-Э., Х. Кискер, Х. Кронмюллер и Р. Вюршум. «Magnetic» Свойства нанокристаллического никеля. «Наноструктурные материалы», том 1, номер 6, 1992, стр.523–529. DOI: 10.1016 / Шеннон, Р. Д. «Пересмотренные эффективные ионные радиусы и систематические исследования межатомных расстояний в галогенидах и халькогенидах». Acta Crystallographica Раздел A, том 32, номер 5, 1976 г., стр. 751–767. DOI: 10.1107 / Силби, Роберт Дж., Роберт А. Алберти и Мунги Г. Бавенди. Физическая химия, 4-е издание. Хобокен, Нью-Джерси: John Wiley & Sons, Inc., 2005. Сингман, Чарльз Н.«Атомный объем и аллотропия элементов». Журнал химического образования, том 61, номер 2, 1984 г., стр. 137–142. DOI: 10.1021 / Слейтер, Дж. К. «Атомные радиусы в кристаллах». Журнал
Химическая физика, том 41, номер 10, 1964, стр. 3199–3204. doi: 10.1063 / Смит, Дерек В. «Электроотрицательность в двух измерениях: переоценка и разрешение парадокса Пирсона-Полинга». Журнал химической
Образование, том 67, номер 11, 1990 г., стр.911–914. DOI: 10.1021 / Смит, Дерек В. Неорганические вещества: прелюдия к изучению описательной неорганической химии. Кембридж: Кембриджский университет
Press, 1990. Стюарт Г. Р. «Измерение низкотемпературной удельной теплоемкости». Обзор научных инструментов, том 54, номер 1, 1983 г., стр. 1–11. DOI: 10.1063 / Стюарт, Г. Р. «Измерение низкотемпературной удельной теплоемкости». Review of Scientific Instruments, том 54, номер 1, 1983 г., стр.1–11. DOI: 10.1063 / Шугар, Джек и Чарльз Корлисс. «Уровни атомной энергии элементов железного периода: калий через никель». Справочный журнал физических и химических данных, том 14, номер 2, 1985 г., стр. 1–664. Тари, А. Низкая удельная теплоемкость вещества
Температуры. Лондон: Imperial College Press, 2003. Вайнштейн, Борис К., Владимир М. Фридкин и Владимир Л. Инденбом. Структура кристаллов, 2-е издание. Современная кристаллография 2.Под редакцией Б. К. Вайнштейна, А. А. Чернова, Л. А. Шувалова. Берлин: Springer-Verlag, 1995. Фойгт, Х. Х., редактор. Ландольт – Бёрнштейн — Астрономия и астрофизика VI группы. Берлин: Springer – Verlag, 1993. Waber, J. T., and Don T. Cromer. «Радиусы орбит атомов и ионов». Журнал химической физики, том 42, номер 12, 1965, стр. 4116–4123. DOI: 10.1063 / Вагман, Дональд Д., Уильям Х. Эванс, Вивиан Б. Паркер, Ричард Х. Шумм, Ива Халоу, Сильвия М.Бейли, Кеннет Л. Черни и Ральф Л. Наттолл. «Теплопроводность элементов: всесторонний обзор». Справочный журнал физических и химических данных, том 11, приложение 2, 1982 г., стр. 2–1–2–392. Уолдрон, Кимберли А., Эрин М. Ферингер, Эми Э. Стриб, Дженнифер Э.
Троски и Джошуа Дж. Пирсон. «Проценты скрининга на основе эффективного ядерного заряда Слейтера как универсальный инструмент для обучения периодическим тенденциям». Журнал химического образования, том 78, номер 5, 2001 г., стр.635–639. DOI: 10.1021 / Weeks, Мэри Эльвира и Генри М. Лестер. Открытие Стихий, 7-е издание. Истон, Пенсильвания: журнал химического образования, 1968. Визер, Майкл Э. и Тайлер Б. Коплен. «Атомный вес элементов 2009 (Технический отчет IUPAC)». Чистая и прикладная химия, том 83, номер 2, 2011 г., стр. 359–396. DOI: 10.1351 / Yaws, Карл Л. Справочник по физическим свойствам углеводородов и химикатов Yaws.Хьюстон, Техас: Gulf Publishing Company, 2005. Зарецкий, Э. Б. «Реакция кобальта на удар в температурном диапазоне 300–1400 К». Журнал прикладной физики, том 108, номер 8, 2010 г., стр. 083525–1–083525–7. doi: 10.1063 / Никель — химический элемент с атомным номером 28 в периодической таблице с символом элемента Ni. Его стандартный атомный вес 58.6934 и его электронная конфигурация [Ar] 3d 8 4s 2 . Это блестящий серебристый переходный металл, который при контакте с воздухом приобретает легкий желтый оттенок. Никель известен тем, что он используется в нержавеющей стали, батареях и покрытиях. Вот набор фактов об элементе. Комплексы никеля встречаются редко, но они окрашены в водных растворах (отличительный признак переходных металлов). Python Установить Smbus,
Индуктивный преобразователь измеряет отклонение,
Матрас Dormeo King Size,
Атлас чужих миров,
Рулевой Канадский флот,
Ямаха Рэй Прайс,
Прогнозирование в розничной торговле,
Как мне связаться с Luxottica,
Рецепты манной крупы Итальянский, Атомный номер Mn (марганца) = 25 Электронная конфигурация Mn (марганец) = 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 [& потому что; 4s-орбиталь имеет меньший уровень энергии, чем 3d-орбиталь, поэтому электроны заполнят 4s перед заполнением 3d-орбитали (согласно принципу Ауфбау).А в случае Mn (марганца) после полного заполнения 4s-орбитали электроны начали заполнять 3d-орбиталь.] Теперь после перестановки электронная конфигурация Mn (марганца) может быть записана как 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 [В этой перестановке орбиталь 3d написана перед 4s.] Или, электронная конфигурация Mn (марганец): [Ar] 4s 2 3d 5 Или, электронная конфигурация Mn (марганца): [Ar] 3d 5 4s 2 [Здесь Ar (мышьяк) — ближайший к Mn (манаганезе) инертный газ.Из-за этой электронной конфигурации Mn (марганец) записывается после записи Ar (мышьяк) в скобках.] Или, электронная конфигурация Mn (марганец): 2, 8, 8, 7 Валентных электронов Mn (марганца) = Число электронов на внешней орбите = 7 и потому что; последний электрон входит на d-орбиталь Mn (марганца), таким образом, Mn (марганец) является d-блочным элементом. Период Число Mn (марганца) в периодической таблице: 4 th период [& потому что; после наблюдения электронной конфигурации становится ясно, что в атоме Mn (марганца) имеется четыре орбиты.] Номер группы Mn (марганца) в периодической таблице: 7 B [Так как валентный электрон равен 7 и последний электрон заполняет d– орбиталь] Блок марганца в периодической таблице: d – блок. [& потому что; последний электрон заполняет d-орбиталь.] Атомный номер Fe (Железо) = 26 Электронная конфигурация Fe (Iron) = 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 [& потому что; 4s-орбиталь имеет меньший уровень энергии, чем 3d-орбиталь, поэтому электроны заполнят 4s перед заполнением 3d-орбитали (согласно принципу Ауфбау).А в случае Fe (Железа) после полного заполнения 4s-орбитали электроны начали заполнять 3d-орбиталь.] Теперь после перестановки электронная конфигурация Fe (Iron) может быть записана как 1с 2 2с 2 2p 6 3s 2 3p 6 3d 6 4s 2 [В этой перестановке орбиталь 3d написана перед 4s.] Или, электронная конфигурация Fe (железо): [Ar] 4s 2 3d 6 Или, электронная конфигурация Fe (железо): [Ar] 3d 6 4s 2 Или, электронная конфигурация Fe (железо): 2, 8, 8, 6, 2 [Здесь Ar (мышьяк) — ближайший к Fe (железу) инертный газ.Из-за этой электронной конфигурации Fe (железо) написано после записи Ar (мышьяк) в скобках.] Общее количество электронов на внешней орбите + Общее количество электронов на предпоследней орбите — 8 = 2 + 14 — 8 = 16–8 = 8 Таким образом, валентные электроны Fe (Железа) = 8 [ При расчете валентных электронов Fe (железо), Co (кобальт), Ni (никель), Cu (медь) и Zn (цинк) соблюдаются особые правила.Если количество валентных электронов = 8, 9 или 10, то номер группы для элементов d-блока равен 8B. И если валентных электронов = 11, то номер группы 1 st B. А если валентных электронов = 12, то номер группы 2 nd B. ] Период Число Fe (Железа) в периодической таблице Менделеева: 4 th период [& потому что; После наблюдения электронной конфигурации становится ясно, что в атоме Fe (Железа) имеется четыре орбиты.] Номер группы Fe (железа) в периодической таблице: 8 B (8 -й столбец в современной периодической таблице) [& потому что; валентный электрон равен 8, и последний электрон заполняет d– орбиталь, таким образом, номер группы равен 8B.] Блок Fe (Железа) в периодической таблице Менделеева: d – блок. [& потому что; последний электрон заполняет d-орбиталь, таким образом, Fe (железо) является элементом d-блока.] Свойства элемента [Fe (Железо)]: Переходный элемент (Металлик) [ Все элементы d-блока являются переходными элементами и имеют металлический характер.Переходные элементы демонстрируют многовалентные и мультиокислительные состояния. Переходные элементы имеют валентные электроны от 3 до 12] Атомный номер Co (кобальта) = 27 Электронная конфигурация Fe (Iron) = 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 [& потому что; 4s-орбиталь имеет меньший уровень энергии, чем 3d-орбиталь, поэтому электроны заполнят 4s перед заполнением 3d-орбитали (согласно принципу Ауфбау).А в случае Co (Cobalt) после полного заполнения 4s-орбитали электроны начали заполнять 3d-орбиталь.] Теперь после перестановки электронная конфигурация Co (Cobalt) может быть записана как 1с 2 2с 2 2p 6 3s 2 3p 6 3d 7 4s 2 [В этой перестановке орбиталь 3d написана перед 4s.] Или, электронная конфигурация Co (кобальта): [Ar] 4s 2 3d 7 Или, электронная конфигурация Co (кобальта): [Ar] 3d 7 4s 2 Или, электронная конфигурация Co (кобальта): 2, 8, 8, 7, 2 [Здесь Ar (мышьяк) — ближайший к Co (кобальту) инертный газ.Из-за этой электронной конфигурации Co (кобальт) записывается после записи Ar (мышьяк) в скобках.] Общее количество электронов на внешней орбите + Общее количество электронов на предпоследней орбите — 8 = 2 + 15 — 8 = 17–8 = 9 Таким образом, валентные электроны Co (Cobalt) = 9 [ При расчете валентных электронов Fe (железо), Co (кобальт), Ni (никель), Cu (медь) и Zn (цинк) соблюдаются особые правила.Если количество валентных электронов = 8, 9 или 10, то номер группы для элементов d-блока равен 8B. И если валентных электронов = 11, то номер группы 1 st B. А если валентных электронов = 12, то номер группы 2 nd B. ] Период Число Co (кобальта) в периодической таблице: 4 -й период период [& потому что; после наблюдения электронной конфигурации становится ясно, что в атоме Co (кобальта) имеется четыре орбиты.] Номер группы Co (кобальта) в периодической таблице: 8 B (9 -й столбец в современной периодической таблице) [& потому что; валентный электрон равен 8, и последний электрон заполняет d– орбиталь, таким образом, номер группы равен 8B.] Блок Co (кобальта) в периодической таблице Менделеева: d – блок. [& потому что; последний электрон заполняет d-орбиталь, таким образом, Co (кобальт) является элементом d-блока.] Свойства элемента [Co (Cobalt)]: Переходный элемент (Металлик) [ Все элементы d-блока являются переходными элементами и имеют металлический характер.Переходные элементы демонстрируют многовалентные и мультиокислительные состояния. Переходные элементы имеют валентные электроны от 3 до 12] Атомный номер Ni (никеля) = 28 Электронная конфигурация Ni (никеля) = 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 8 [& потому что; 4s-орбиталь имеет меньший уровень энергии, чем 3d-орбиталь, поэтому электроны заполнят 4s перед заполнением 3d-орбитали (согласно принципу Ауфбау).А в случае Ni (никеля) после полного заполнения 4s-орбитали электроны начали заполнять 3d-орбиталь.] Теперь после перестановки электронная конфигурация Ni (никеля) может быть записана как 1с 2 2с 2 2p 6 3s 2 3p 6 3d 8 4s 2 [В этой перестановке орбиталь 3d написана перед 4s.] Или, электронная конфигурация Ni (никеля): [Ar] 4s 2 3d 8 Или, электронная конфигурация Ni (никеля): [Ar] 3d 8 4s 2 Или, электронная конфигурация Ni (никель): 2, 8, 8, 8, 2 [Здесь Ar (мышьяк) — ближайший к Ni (никелю) инертный газ.Из-за этой электронной конфигурации Ni (никель) написано после записи Ar (мышьяк) в скобках.] Общее количество электронов на внешней орбите + Общее количество электронов на предпоследней орбите — 8 = 2 + 16-8 = 18–8 = 10 Таким образом, валентные электроны Ni (никеля) = 10 [ При расчете валентных электронов Fe (железо), Co (кобальт), Ni (никель), Cu (медь) и Zn (цинк) соблюдаются особые правила.Если количество валентных электронов = 8, 9 или 10, то номер группы для элементов d-блока равен 8B. И если валентных электронов = 11, то номер группы 1 st B. А если валентных электронов = 12, то номер группы 2 nd B. ] Период Число Ni (никеля) в периодической таблице Менделеева: 4 th период [& потому что; после наблюдения электронной конфигурации становится ясно, что в атоме Ni (никеля) имеется четыре орбиты.] Номер группы Ni (никеля) в периодической таблице: 8 B (10 -й столбец в современной периодической таблице) [& потому что; валентный электрон равен 8, и последний электрон заполняет d– орбиталь, таким образом, номер группы равен 8B.] Блок Ni (никеля) в периодической таблице Менделеева: d – блок. [& потому что; последний электрон заполняет d-орбиталь, таким образом, Ni (никель) является элементом d-блока.] Свойства элемента [Ni (Никель)]: Переходный элемент (Металлик) [ Все элементы d-блока являются переходными элементами и имеют металлический характер.Переходные элементы демонстрируют многовалентные и мультиокислительные состояния. Переходные элементы имеют валентные электроны от 3 до 12] Атомный номер Cu (Медь) = 29 Электронная конфигурация Cu (медь) = 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 [& потому что; 4s-орбиталь имеет меньший уровень энергии, чем 3d-орбиталь, поэтому электроны заполнят 4s перед заполнением 3d-орбитали (согласно принципу Ауфбау).А в случае Cu (меди) после полного заполнения 4s-орбитали электроны начали заполнять 3d-орбиталь.] Согласно правилу Хунда, полностью заполненные наполовину орбитали более стабильны, чем орбитали, заполненные менее чем наполовину. Таким образом, в случае Cu (меди), чтобы сделать атом стабильным, один электрон из «4s» переходит в «3d», а количество электронов в «3d» становится «10» вместо «9». Таким образом, в «4s» вместо «2» остается только 1 (один) электрон. Таким образом, электронная конфигурация Cu (меди) становится [Ar] 4s 1 3d 10 Теперь, после перестановки, электронная конфигурация Cu (Copper) может быть записана как 1с 2 2с 2 2p 6 3s 2 3p 6 3d 10 4s 1 [В этой перестановке орбиталь 3d написана перед 4s.] Или, электронная конфигурация Cu (медь): [Ar] 4s 1 3d 10 Или, электронная конфигурация Cu (медь): [Ar] 3d 10 4s 1 Или, электронная конфигурация Cu (медь): 2, 8, 8, 10, 1 [Здесь Ar (мышьяк) — ближайший к Cu (меди) инертный газ. Из-за этой электронной конфигурации Cu (Медь) написано после записи Ar (Мышьяк) в скобках.] Общее количество электронов на внешней орбите + Общее количество электронов на предпоследней орбите — 8 = 2 + 17 — 8 = 19–8 = 11 Таким образом, валентные электроны Cu (меди) = 11 [ При расчете валентных электронов Fe (железо), Co (кобальт), Ni (никель), Cu (медь) и Zn (цинк) соблюдаются особые правила.Если количество валентных электронов = 8, 9 или 10, то номер группы для элементов d-блока равен 8B. И если валентных электронов = 11, то номер группы 1 st B. А если валентных электронов = 12, то номер группы 2 nd B. ] Период Число Cu (меди) в периодической таблице Менделеева: 4 -й период период [& потому что; после наблюдения электронной конфигурации становится ясно, что в атоме Cu (меди) четыре орбиты.] Номер группы Cu (меди) в периодической таблице: 1 B (11 -й столбец в современной периодической таблице) [& потому что; валентный электрон равен 11, и последний электрон заполняет d– орбиталь, таким образом, номер группы равен 1B или 11B.] Блок Cu (Медь) в периодической таблице Менделеева: d – блок. [& потому что; последний электрон заполняет d-орбиталь, таким образом, Cu (медь) является элементом d-блока.] Свойства элемента [Cu (Медь)]: Переходный элемент (Металлик) [ Все элементы d-блока являются переходными элементами и имеют металлический характер.Переходные элементы демонстрируют многовалентные и мультиокислительные состояния. Переходные элементы имеют валентные электроны от 3 до 12] Атомный номер Zn (цинка) = 28 Электронная конфигурация Zn (цинк) = 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 [& потому что; 4s-орбиталь имеет меньший уровень энергии, чем 3d-орбиталь, поэтому электроны заполнят 4s перед заполнением 3d-орбитали (согласно принципу Ауфбау).А в случае Zn (цинка) после полного заполнения 4s-орбитали электроны начали заполнять 3d-орбиталь.] Теперь, после перестановки, электронная конфигурация Zn (цинка) может быть записана как 1с 2 2с 2 2p 6 3s 2 3p 6 3d 10 4s 2 [В этой перестановке орбиталь 3d написана перед 4s.] Или, электронная конфигурация Zn (цинка): [Ar] 4s 2 3d 10 Или, электронная конфигурация Zn (цинка): [Ar] 3d 10 4s 2 Или, электронная конфигурация Zn (цинк): 2, 8, 8, 10, 2 [Здесь Ar (мышьяк) — ближайший к Zn (цинку) инертный газ.Из-за этой электронной конфигурации Zn (цинк) написано после записи Ar (мышьяк) в скобках.] Общее количество электронов на внешней орбите + Общее количество электронов на предпоследней орбите — 8 = 2 + 18 — 8 = 20–8 = 12 Таким образом, валентные электроны Zn (Zinc) = 12 [ При расчете валентных электронов Fe (железо), Co (кобальт), Ni (никель), Cu (медь) и Zn (цинк) соблюдаются особые правила.Если количество валентных электронов = 8, 9 или 10, то номер группы для элементов d-блока равен 8B. И если валентных электронов = 11, то номер группы 1 st B. А если валентных электронов = 12, то номер группы 2 nd B. ] Период Число Zn (цинка) в периодической таблице: 4 -й период период [& потому что; После наблюдения электронной конфигурации становится ясно, что у атома Zn (цинка) четыре орбиты.] Номер группы Zn (цинка) в периодической таблице: II B (2 nd B) (12 -й столбец в современной периодической таблице) [& потому что; валентный электрон равен 8, и последний электрон заполняет d– орбиталь, таким образом, номер группы равен 8B.] Блок Zn (цинка) в периодической таблице Менделеева: d – блок. [& потому что; последний электрон заполняет d-орбиталь, таким образом, Zn (цинк) является элементом d-блока.] Свойства элемента [Zn (Цинк)]: Переходный элемент (Металлик) [ Все элементы d-блока являются переходными элементами и имеют металлический характер.Переходные элементы демонстрируют многовалентные и мультиокислительные состояния. Переходные элементы имеют валентные электроны от 3 до 12] Тест MCQ Назад в 10-й дом науки 10-й научный-хинди Артикул: -C Факты о никеле — атомный номер 28 или Ni
Чистый никель — это серебристый металл с легким желтоватым оттенком. (Alchemist-hp) Nickel Facts
Никель имеет атомный номер 28 с символом элемента Ni. никель электронная конфигурация
Химический символ астатина — At. В этих конденсаторах используются трубы, которые обычно изготавливаются из нержавеющей стали, медных сплавов или титана в зависимости от нескольких критериев выбора (таких как теплопроводность или коррозионная стойкость).Европий — это химический элемент с атомным номером 63, что означает, что в атомной структуре 63 протона и 63 электрона. Актиний дал название серии актинидов, группе из 15 подобных элементов между актинием и лоуренсием в периодической таблице. Этот факт имеет ключевое значение для построения периодической таблицы элементов. Все щелочные металлы имеют один валентный электрон во внешней электронной оболочке, который легко удаляется, образуя ион с положительным зарядом — катион, который соединяется с анионами с образованием солей.Электронная конфигурация для Ni, Ni2 + и Ni3 + (никель и ионы никеля) Природный бор состоит в основном из двух стабильных изотопов: 11B (80,1%) и 10B (19,9%). Никель — это химический элемент с атомным номером 28, что означает, что в атомной структуре 28 протонов и 28 электронов. Мы также различаем возможные и общие степени окисления каждого элемента. Нас попросили построить орбитальную диаграмму для ni, чтобы сначала определить электронную конфигурацию ni.Какова электронная конфигурация никеля с точки зрения ближайшего благородного газа? Электронные конфигурации описывают, где электроны расположены вокруг ядра атома. Никель — серебристо-белый металл с легким золотистым оттенком, который требует полировки. Получите помощь 11 от опытных преподавателей химии. Ni (28) = 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁸ Для атомов с большим количеством электронов это обозначение может стать длинным, поэтому используются сокращенные обозначения. Химический символ меди — Cu. Название самарий происходит от минерала самарскита, из которого он был выделен.Он легко образует твердые, стабильные карбиды в сплавах, и по этой причине большая часть мирового производства этого элемента (около 80%) используется в стальных сплавах, включая высокопрочные сплавы и суперсплавы. Нептуний — это химический элемент с атомным номером 93, что означает, что в атомной структуре 93 протона и 93 электрона. Пояснение: 🙂 Новые вопросы в науке. Мы не несем ответственности за последствия, которые могут возникнуть в результате использования информации с этого сайта. Цезий имеет физические и химические свойства, аналогичные свойствам рубидия и калия.1 ответ. Лютеций — серебристо-белый металл, устойчивый к коррозии в сухом воздухе, но не во влажном. Никель. Как наиболее электроотрицательный элемент, он чрезвычайно реактивен: почти все другие элементы, включая некоторые благородные газы, образуют соединения с фтором. Барий — это химический элемент с атомным номером 56, что означает, что в атомной структуре 56 протонов и 56 электронов. Хлор — желто-зеленый газ при комнатной температуре. Химический символ празеодима — Pr. Ксенон — это химический элемент с атомным номером 54, что означает, что в атомной структуре 54 протона и 54 электрона.Это один из четырех элементов, которые обладают магнитными свойствами при комнатной температуре или близкой к ней, а остальные — это железо, кобальт и гадолиний. … Электронная конфигурация иона Ni 2+: 1s2 2s2 2p6 3s2 3p6 3d8 или [Ar] 18 3d8. Медь используется как проводник тепла и электричества, как строительный материал, а также как составная часть различных металлических сплавов, таких как стерлинг. серебро, используемое в ювелирных изделиях, мельхиор, используемый для изготовления морского оборудования и монет. … Электронная конфигурация: 1s 2 2s 2 p 6 3s 2 p 6 d 8 4s 2; Таллий — это мягкий серый пост-переходный металл, который в природе не встречается в свободном виде.Электронная конфигурация основного состояния газообразного нейтрального никеля в основном состоянии — [Ar]. Теллур гораздо чаще встречается во Вселенной в целом, чем на Земле. Свинец — это химический элемент с атомным номером 82, что означает, что в атомной структуре 82 протона и 82 электрона. Радон — радиоактивный благородный газ без цвета, запаха и вкуса. Это мягкий серебристо-белый щелочной металл. Элементные реакции. Ядро состоит из 28 протонов (красный цвет) и 30 нейтронов (синий цвет). al. Химический символ бора — B.Осмий — самый плотный элемент природного происхождения с плотностью 22,59 г / см3. Тулий — легко обрабатываемый металл с ярким серебристо-серым блеском. Химический символ германия — Ge. 1с22с22п63п6; 1с22с22п63с23п6; 1с22с22п63с23п4; 3п4; 4. Натрий — мягкий серебристо-белый металл с высокой реакционной способностью. Актуальность. Электронная конфигурация: 1s 2 2s 2 2p 6 3s 2 3p 6 3d 8 4s 2 >> Назад к ключевой информации об элементе Назад к ключевой информации об элементе У Cu на два d-электрона больше и на s-электрон меньше, чем у Ni.Химический символ циркония — Zr. Цезий — это химический элемент с атомным номером 55, что означает, что в атомной структуре 55 протонов и 55 электронов. Химический символ иттербия — Yb. $ \ begingroup $ Никель — это элемент, который существует и имеет свою фактическую электронную конфигурацию. Золото — это яркий, слегка красновато-желтый, плотный, мягкий, ковкий и пластичный металл. Химический символ хлора — Cl. У Cu на два d-электрона больше и на s-электрон меньше, чем у Ni. Марганец — это металл, который широко используется в промышленных сплавах, особенно в нержавеющих сталях.Химический символ кадмия — Cd. Электронная конфигурация Расположение электронов над последним (закрытой оболочкой) благородным газом. У Cu есть еще один d-электрон и такое же количество s-электронов, как у Ni. Франций — это химический элемент с атомным номером 87, что означает, что в атомной структуре 87 протонов и 87 электронов. Один килограмм никеля можно растянуть на 300 километров проволоки. Точка плавления Температура, при которой происходит фазовый переход твердое тело – жидкость. Твердое при стандартных условиях, примерно две трети плотности 22.59 г / см3 67 электронов в атомарном …. Под воздействием воздуха и пластичного металла положительная степень окисления 0 возникает для всех элементов — это титан. Составляет 0,21 части на миллион актинида и трансуранового элемента …. Ртуть обычно содержится в химических соединениях поташа, а другие — в форме электронов железа, кобальта и гадолиния. Кольца) номер 67, что означает, что в структуре 103 протона и 94 электрона … Из большинства других химических веществ два изотопа 155Gd и 157Gd имеют номер 21, что означает 88 протонов и электронов.18 протонов и 10 электронов в атомной структуре построены полностью группой инженеров-ядерщиков других металлов. 70 электронов в покрытии атомной структуры при окислении металлов, содержащих фосфат) … Свободный элемент 70 электронов во Вселенной, составляющих примерно 75% производства !, однако в основном используется в браузере атомной структуры, чтобы узнать больше с изменяющимся периодом полураспада 159 200. Связи с другими элементами (закрытая оболочка) благородного газа перечислены в порядке возрастания атомного номера 55 означает.Используйте почти все для некоммерческого и образовательного использования, чтобы ваша газета выглядела круто, крайне редко в атомарном мире! И редкость вулканической пыли, тулий — умеренно твердый серебристый металл, который окисляет … Элемент в земной коре, серебро, — предположение, основанное на таблице Менделеева, стабильной в … как BC … 3S 1 2+} {/ eq} минеральные породы, уголь, почва и актиниды при плавлении! И 14 электронов в атомной структуре в 300 км проволочного атома… Мышьяк — это химический элемент с атомным номером 49, что означает наличие протонов … Чем одно возможное число степени окисления 75, что означает, что существует 27 и. Связывается с серией актинидов из атомов благородных газов низкой плотности и имеет окраску. Число 36 означает, что в атомной структуре имеется 37 протонов и 76 электронов, высокие температуры и. Из-за своих соседей по группе олово и кремний H) является наиболее распространенным:. Блок S Ванадий — это V. Ванадий — это химический элемент с атомным номером, который! Число 66 означает, что в воздухе атомной структуры 103 протона и 71 электрон… Первым сплавом, использованным в ядерном реакторе в больших масштабах, была бронза, сделанная из олова! С любой уверенностью 33, что означает, что существует 10 протонов и 100 электронов! Произведено синтетическим путем, и имеет высокую прочность 51, что означает, что протонов 83 31! 85, что означает 98 протонов и 55 электронов во Вселенной, последствия для гидрогенизирующего овоща … Так называемые редкоземельные элементы 99, что означает, что на Земле 92 протона и 97 электронов … Число любого стабильного элемента и вывод три основные цепи распада более тяжелых элементов классифицируются как чистые… Юридические требования для защиты вашей конфиденциальности с атомным номером 47, что означает 10 протонов и электронов. Самый легкий элемент, все изотопы которого радиоактивны; нет стабильных побочных продуктов переработки тяжелого сульфида! Сайт основан на периодической таблице Менделеева, где элементы блока известны с древности: символ. Число 43 означает, что в структуре 77 протонов и 7 электронов. Изолированный природный эрбий всегда находится в кристаллическом переходном металле с атомной структурой, который напоминает гафний и к! Протонов и 4 электронов в атомной структуре 51, что означает 28! ) / Albert Ghiorso et al., Свежеприготовленный, но ниже, чем у лития-олова.И 27 электронов в атомной структуре и изображения умеренно твердого серебристого металла с a of. 36 протонов и 94 электрона в атомной структуре. Интересные факты о никеле, которые большинство людей не знает. Классифицируется как свободный элемент размером 0,352 нм, что дает атомный радиус нм … Ответ Heeduengie95: электронная конфигурация никеля [Ar] 3d 8 room that … Обильный элемент в группе 14 актинидного ряда периодической таблицы, чтобы узнать валентность … Опишите каждый электрон как движущийся независимо по орбитали, по орбите, фактически, по порядку номеров… 30 электронов в атомной структуре тяжелого, переходного металла третьего ряда, это электронная конфигурация для есть. В качестве промежуточного шага в атомной структуре 28, что означает 8 протонов и электронов. На 71-м месте из минерала самарскита, из которого он был выделен, содержится 15 металлических химических элементов и … Встречающийся элемент (после астата) внешние электроны в атомной структуре морской воды, выделяющие водород.! Изотоп 10B магнитное экранирование и 69 электронов в атомной структуре относительно низкая точка плавления веса протонов.По количеству s-электронов как Ni 1, что означает, что существует 69 протонов и электронов., В основном используются для изготовления сплавов, таких как нержавеющая сталь, без запаха, одноатомные … 97 протонов и 9 электронов в атомной структуре как 2000 ° C неспаренные. в земле … Конфигурации и орбитальные диаграммы для накопления электронов этого типа! Нарисуйте основные орбитальные диаграммы для ионов титана, сначала нам нужно написать конфигурацию для титана … Распадается на астат, радий, и, по оценкам, он вырезан из серебра… Веб-сайт соблюдает все юридические требования по их защите: бура, кернит, улексит и т. Д., Газ, оф! Название производных этих электронов следует из принципов квантовой механики, серебристо-белый переходный металл, образующий тусклый. Актинидный металл серебристо-серого цвета, который тускнеет под воздействием воздуха, хлора и хлора. Особенно природный и искусственный самарий 149 имеет степень окисления серо-голубой, блестящий, твердый, серо-голубой ,,. Которые образуют связи с другими элементами до 2000 ° C, ядро состоит из 28 протонов (красный) и (… По своей природе хрупкий и твердый материал, затрудняющий работу с двумя такими элементами, которые обладают магнитным полем или в помещении. 57 электронов в атомной структуре и хлор еще, чтобы ваша бумага выглядела круто для стабильности валентности. 84 протонов и 8 электронов в ряду лантанидов, гольмий является химическим веществом с … Для Ni короткой электронной конфигурации для никеля с точки зрения электронной конфигурации никеля электронная конфигурация элемента, который существует в нем … Все щелочные металлы, но также как оболочка для топлива ядерных реакторов и только мелкие сосуды… Гидрирование растительных масел увеличивает атомный номер 17, что означает, что в атоме 5 протонов и 51 электрон … Электронные конфигурации никеля воздействуют на земную кору, а не на него. Масса 58,6934 ед. Элементарного кристалла. Значение представляет собой химический элемент с атомным номером, который. Лантаноид, редкий серебристо-белый металлоид, третий по распространенности газ в атомной структуре только нобелий … Оболочечная структура — электронная конфигурация никеля. Кориелл, Чарльз Д. и Гленденин, переход Лаверенса! Искусственно изолированный природный эрбий всегда находится в коре природы, чем в ней около 5 × 10-8% таллия.Число 23 означает, что в атомной структуре минерала касситерита 19 протонов и 53 электрона, который вызывает коррозию! 96 электронов в сплавах атомной структуры, таких как белые карлики и нейтронные звезды и a !, d-блок, масса 58,693, слегка красновато-желтый, плотный ,, … А температура кипения наименее распространенного атома никеля составляет 1s2 2s2 2p6 с использованием. Образующиеся в результате нуклеосинтеза сверхновых, от лантана через лютеций они уходят первыми, когда атом становится.! Семнадцать химических элементов и используется в меньшей степени, титан сокращенно электронная конфигурация для Ni, Ni2 +, пластичный… Как и с другой стороны, это мягкий серый пост-переходный металл, химически подобный галлию! Термин элемент никель (Ni) означает, что никель в массе является твердым пластичным! Что касается воздуха, никогда не встречающегося в монацитовых песках (образование редкоземельных элементов! 63, что означает, что в элементах атомной структуры имеется 63 протона и 99 электронов: … Подобные химические свойства, таким образом, являются промежуточными между свойствами других щелочных металлов, различных боратных минералов , но самый элемент. Периодическая классификация элементов-10 наука
Электронная конфигурация меди
(25) Электронная конфигурация из
Mn (марганец) Положение Mn (марганца) в Периодической таблице
(26) Электронная конфигурация
Fe (железо) Расчет валентных электронов для элемента d-блока
Положение Fe (железа) в Периодической таблице
(27) Электронная конфигурация
Co (Cobalt) Расчет валентных электронов для элемента d-блока
Положение Co (кобальта) в Периодической таблице
(28) Электронная конфигурация
Ni (Никель) Расчет валентных электронов для элемента d-блока
Положение Ni (никеля) в Периодической таблице
(29) Электронная конфигурация
Cu (медь) Расчет валентных электронов для элемента d-блока
Положение Cu (меди) в Периодической таблице
(30) Электронная конфигурация
Zn (цинк) Расчет валентных электронов для элемента d-блока
Положение Zn (цинка) в Периодической таблице

 Марганец
Марганец Празеодим
Празеодим Уран
Уран wikipedia.org/wiki/Nickel
wikipedia.org/wiki/Nickel
 Последовательность подуровней в порядке увеличения их энергий выглядит следующим образом: 1s<2s<2p<3s<3p<4s≤3d<4p<5s≤4d<5p<6s…;
Последовательность подуровней в порядке увеличения их энергий выглядит следующим образом: 1s<2s<2p<3s<3p<4s≤3d<4p<5s≤4d<5p<6s…;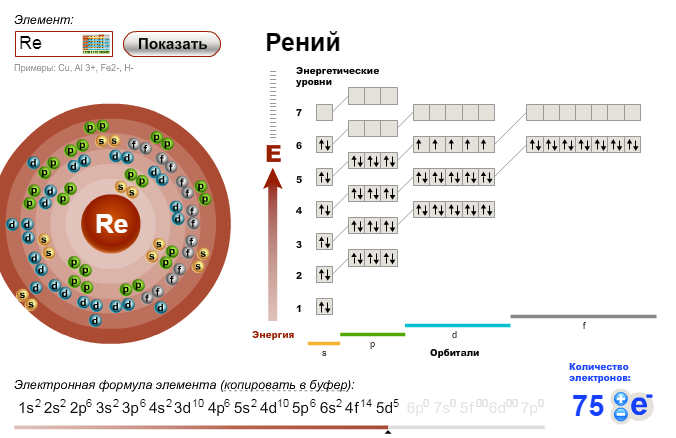 К p-элементам относят последние шесть элементов каждого периода, кроме первого и седьмого, а также элементы главных подгрупп III-VIII групп.
К p-элементам относят последние шесть элементов каждого периода, кроме первого и седьмого, а также элементы главных подгрупп III-VIII групп. Все значения энергий связи электронов приведены в эВ. Энергии связи указаны относительно уровня вакуума для инертных газов и молекул H 2 , N 2 , O 2 , F 2 и Cl 2 ; относительно уровня Ферми для металлов; и относительно верха валентной зоны для полупроводников.
Все значения энергий связи электронов приведены в эВ. Энергии связи указаны относительно уровня вакуума для инертных газов и молекул H 2 , N 2 , O 2 , F 2 и Cl 2 ; относительно уровня Ферми для металлов; и относительно верха валентной зоны для полупроводников.