описание металла, свойства, сферы применения и месторождения
Металл олово был открыт раньше железа, а его сплав с медью — самый первый, созданный людьми.
Люди отметили значимость бронзы, назвав эпоху своего развития Бронзовым веком.
Неизвестная история
История открытия олова и сплавов из него покрыта пылью времен. Никто не назовет имени первооткрывателя металла, никто не знает — кто догадался первым сплавить олово с медью. Зато известно, что еще 6000 лет назад люди пользовались изделиями из металла.

Происхождение латинского названия ученые выводят из санскритского sta — прочный.
Русское наименование относят к греческим корням. Alophoys по-гечески белый, что указывает на цвет металла.
Свойства Sn
 Stannum (Sn) — латинское наименование этого гибкого, пластичного, легкоплавкого металла. Имеет № 50 в периодической таблице Менделеева.
Stannum (Sn) — латинское наименование этого гибкого, пластичного, легкоплавкого металла. Имеет № 50 в периодической таблице Менделеева.
По химическим свойствам металл подобен своим «соседям» — германию и свинцу.
В реакциях проявляет степени окисления +2, +4.
С водой или воздухом не реагирует. Причина этому — пленка оксида на поверхности металла.
Растворяется в разбавленных кислотах; с неметаллами реагирует при нагреве.
Физические свойства олова:
- плотность β-Sn 7,3 г/см3;
- плотность жидкого олова 6,98 г/см³;
- удельная электропроводность 8,69 МСм/м.
Металл обладает редким свойством: плавится при низкой температуре (232°С), а кипит при высокой (2620°С).
В природном олове 10 стабильных изотопов — это рекорд среди всех элементов таблицы Менделеева.
| Свойства атома | |
|---|---|
| Название, символ, номер | О́лово / Stannum (Sn), 50 |
| Атомная масса (молярная масса) | 118,710(7)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Kr] 4d10 5s2 5p2 |
| Радиус атома | 162 пм |
| Химические свойства | |
| Ковалентный радиус | 141 пм |
| Радиус иона | (+4e) 71 (+2) 93 пм |
| Электроотрицательность | 1,96 (шкала Полинга) |
| Электродный потенциал | −0,136 |
| Степени окисления | +4, +2 |
| Энергия ионизации (первый электрон) | 708,2 (7,34) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 7,31 г/см³ |
| Температура плавления | 231,91 °C[2] |
| Температура кипения | 2893 K, 2620 °C[3] |
| Уд. теплота плавления | 7,19[2]; кДж/моль |
| Уд. теплота испарения | 296[4] кДж/моль |
| Молярная теплоёмкость | 27,11[4] Дж/(K·моль) |
| Молярный объём | 16,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | тетрагональная |
| Параметры решётки | a=5,831; c=3,181 Å |
| Отношение c/a | 0,546 |
| Температура Дебая | 170,00 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 66,8 Вт/(м·К) |
| Номер CAS | 7440-31-5 |
Аллотропные свойства олова
Аллотропия — свойство элемента менять свою кристаллическую решетку при изменении температуры. Модификация альфа (серое олово) устойчиво при низких температурах (ниже 13 °С). Имеет кубическую решетку, по типу алмаза. Практического применения не имеет.
Бета-модификация (белое, металлическое олово), из которого делают солдатиков, им же покрывают консервные банки. Кристаллическая структура тетрагональная.

Серое и белое олово
В гамма-модификацию металл переходит при температуре 161-232°С.
Печально: в музее А.В. Суворова случилось несчастье. В запаснике, где хранилась ценная коллекция оловянных солдатиков, зимой лопнули трубы отопления, и коллекция просто рассыпалась в пыль.
Маркировка металла
Промышленность выпускает металл в проволоке, чушках, прутках.
| Марки олова | Форма выпуска, содержание Sn |
| ОВЧ-000 | Допустимо не более 0,001% примесей |
| О1пч О1 | Содержание Sn 99,915% Примесей не более 0,1% |
| О2 | 99,565% Sn |
| О3 | Содержит 98,49% олова |
| О4 | Самое «грязное» олово; допустимо содержание примесей до 3,5% |
Месторождения оловянных руд
Д.И. Менделеев писал:
«Олово встречается в природе редко, в жилах древних пород, почти исключительно в виде окиси SnO2, называемой оловянным камнем».
Олово относится к редким рассеянным металлам. В природе среди элементов занимает 47-е место по распространенности.
Мировые запасы оловянных руд расположены в:
- Китае;
- Малайзии;
- Индонезии;
- Бразилии;
- Перу;
- Австралии.
Значимые месторождения российских оловянных руд сосредоточены на Дальнем Востоке (в Приморском крае, в Якутии, в Хабаровском крае). Добыча металла большей частью происходит в подземных шахтах.
Основные руды:
- оловянный камень, касситерит — содержит до 78% металла;

Кристаллы касситерита
- оловянный колчедан (станин), 27,5% олова;
- тиллит.
Печально: по подсчетам ученых, оловосодержащих минералов на Земле осталось лет на 30. Потом придется добывать его из лома, или искать замену…
Сплавы
По своей классификации оловянные сплавы делятся на припои, подшипниковые и легкоплавкие.
- Баббиты. В них добавляют свинец, медь, сурьма. Баббиты могут иметь легирующие присадки. Маркировки баббитов: Б88, Б83, Б83С.
- Бронза — сплав меди с оловом.
- Пьютер. Сплав с висмутом, сурьмой, медью, изредка со свинцом.
- Припои. Бывают твердые и легкоплавкие. В сплав добавляют свинец и другие элементы. Марки припоев: ПОС-30, ПОС-40, ПОС-90.
Плюсы и минусы олова
К достоинствам относим:
- Нетоксичность, это позволяет использовать металл в пищевой промышленности, в производстве посуды.
- Достойная антикоррозионная устойчивость в агрессивных средах.
- Не реагирует с серой; поэтому используют везде, где металл «завернут» в резиновую или пластиковую изоляцию.
Недостатки:
- Подвержен «оловянной чуме».
- Довольно высокая стоимость ограничивает широкое применение металла.
- Невысокая температура плавления (всего 232°С).
Производство изделий из олова и его сплавов
Продукция из олова была востребована с давних времен. Дети играют в оловянных солдатиков уже 4000 лет.
Познавательно: в музеях Санкт-Петербурга хранятся крупные коллекции оловянных солдатиков.
- Электроника с ее платами сейчас повсюду, и любые контакты соединяются припоем из олова и его сплавов. Оловянное напыление для медных проводов полезно, это защита от воздействия серы (она входит в состав резиновой изоляции).
- Оловянные сплавы баббиты обладают прекрасными антифрикционными свойствами. Ни один из механизмов (от велосипеда до могучего КРАЗа) не обходится без подшипников.
- Используют металл в типографском сплаве гарте. Полиграфическое производство невозможно без оловянных сплавов.

Расплавленное олово
Воздействие на организм оловянных изделий минимально. Поэтому применение металла в пищевой промышленности вполне оправдано.
Простая консервная банка и гибель полярной экспедиции
Французский повар Франсуа Аппер придумал, как долго хранить пищу. Он предложил герметично закрывать продукты в банки из белой жести (это тонкий лист из железа, покрытый оловянным напылением). Теперь мы не можем представить жизни без баночки вкусных консервов.
Но те же консервные банки (вернее, «оловянная чума») способствовали гибели экспедиции Р. Скотта к Южному полюсу. Из баков, запаянных оловянным припоем, вылилось горючее. Металл перешел в альфа-модификацию и просто раскрошился на морозе.
Стоимость олова
Главная мировая площадка инвесторов в металлы находится в Лондоне. Это LME (Лондонская биржа металлов).
Цена тонны олова на LME составляла 15590,0 US$ за тонну (данные на 28.05.2020).
химический элемент, Sn, 5 букв, сканворд
химический элемент, Sn
Альтернативные описания• металл, защищающий другие металлы от коррозии
• металл, из которого был сделан стойкий солдатик в сказке Андерсена
• металл, который в избытке можно добыть с поверхности консервных банок
• металл, применяемый в качестве припоя
• мягкий ковкий серебристо-белый металл
• мягкий металл, применяемый для пайки
• один из семи металлов, которые персы носили от сглаза
• серебристо-белый металл, мягкий и пластичный
• солдатский металл (сказочное)
• химический элемент, мягкий серебристо-белый металл
• по-латински «Stannum» (станнум)
• полуда
• металл для лужения
• касситерид
• химический элемент, металл
• металл, ставший причиной гибели экспедиции Роберта Скотта на Южный полюс
• серебристая капелька на паяльнике
• металл для лудильщика
• мягкий металл колец Альманзора
• смесь солей этого металла — «желтая композиция» — издавна использовалась как краситель для шерсти
• из какого металла делают «белую жесть»?
• латинское название этого металла переводится, как «твердый», хотя он один из самых мягких и легкоплавких
• металл-припой
• переведите с латинского слово «станнум»
• основа станиоли
• материал для стойких солдатиков
• металл, «станнум»
• тяжелый и мягкий металл
• лудильный металл
• солдатики, металл
• после индия
• металл для солдатиков
• хрупкий на морозе металл
• мягкий металл
• побратим свинца
• после индия у Менделеева
• металл, Sn
• покрытие консервных банок
• компонент касситерита
• металл для стойких солдатиков
• плоть игрушечной армии
• металл для пайки
• «Sn» для химика
• металл лудильщиков
• касситерит это чья руда?
• солдатский металл (сказоч.)
• металл колец Альманзора
• латинское «станнум»
• из чего делают «белую жесть»?
• капелька на паяльнике
• металл в составе припоев
• между индием и сурьмой
• защитное покрытие жести
• металл, «болеющий чумой»
• менделеев его назначил 60-м
• мягкий и легкий металл
• предшественник сурьмы в таблице
• металл для ложек и солдатиков
• преемник индия в таблице
• в таблице он после индия
• менделеев его определил шестидесятым по счету
• вслед за индием в таблице
• металл номер шестьдесят
• металл в основе фольги
• Менделеев его назначил шестидесятым
• шестидесятая графа Менделеева
• металл Свадьбы роз
• Менделеев его назначил шестидесятым по счету
• металл в составе пьютера
• метал для припоя
• химический элемент для солдатиков
• предтеча сурьмы в таблице
• в таблице он перед сурьмой
• перед сурьмой в таблице
• металл, пригодный для пайки
• серебристый металл
• «мягкотелый» металл
• спаивающий металл
• между индием и сурьмой в таблице
• пятидесятый элемент
• идущий следом за индием в таблице
• Sn в таблице
• металл для солдатика
• металл, погубивший Скотта
• материал для мундирных пуговиц
• пятидесятый металл в таблице
• до сурьмы в таблице
• основа медали за четвертое место для участников чемпионата США по фигурному катанию
• последыш индия в таблице
• материал для солдатиков
• после индия в таблице
• последователь индия
• металл с символом Sn
• металл игрушечных солдатиков
• химический элемент под названием Sn
• химический элемент под номером пятьдесят
• последователь индия в таблице
• Химический элемент, мягкий ковкий серебристо-белый металл
• Наименование химического элемента
• «Sn» для химика
• «Мягкотелый» металл
• из какого металла делают «белую жесть»
• из чего делают «белую жесть»
• касситерит это чья руда
• латинское «станнум»
• латинское название этого металла переводится, как «твердый», хотя он один из самых мягких и легкоплавких
• менделеев его назначил 60-м в таблице
• металл
• металл, «болеющий чумой»
• металл, «станнум»
• переведите с латинского слово «станнум»
• по-латински «Stannum» (станнум)
• смесь солей этого металла — «желтая композиция» — издавна использовалась как краситель для шерсти
• ср. крушец (металл) пепельно-серебристый, белее свинца, весьма мягкий, легкоплавкий, легкий весом, более прочих удобный для паянья и для отливки простых мелких вешиц; стар. свинец, откуда пословица: Слово олово, веско. Лить олово, святочное гаданье. Только у молодца и золотца, что пуговка оловца! Оловянная кружка или оловянка ж. и оловяник м. Оловянная руда, колчедан, припой. Оловяничник, оловянщик м. отливающий, работающий оловянную посуду. Оловолей, оловолитель м. церк. оловогадатель, отливающий олово в воду, для гаданья, предсказаний. Оловянные глаза, мутные и бездушные; оловянный глаз, с бельмом. Оловок м. зап. карандаш
• химическ. элемент по «фамилии» Sn
• что за химический элемент Sn?
• химическ. элемент по «фамилии» Sn
Строение атома олова (Sn), схема и примеры
Общие сведения о строении атома олова
Относится к элементам p-семейства. Металл. Обозначение – Sn. Порядковый номер – 50. Относительная атомная масса – 118,69 а.е.м.
Электронное строение атома олова
Атом олова состоит из положительно заряженного ядра (+50), внутри которого есть 50 протонов и 69 нейтронов, а вокруг, по пяти орбитам движутся 50 электронов.
Рис.1. Схематическое строение атома олова.
Распределение электронов по орбиталям выглядит следующим образом:
+50Sn)2)8)18)18)4;
1s22s22p63s23p63d104s24p64d105s25p2.
Внешний энергетический уровень атома олова содержит 4 электрона, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Наличие двух неспаренных электронов свидетельствует о том, что для олова характерна степень окисления +2. За счет наличия вакантных орбиталей 5d-подуровня для атома олова возможно возбужденное состояние (степень окисления +4):
Валентные электроны атома олова можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
|
Подуровень |
n |
l |
ml |
s |
|
s |
5 |
0 |
0 |
+1/2 |
|
s |
5 |
0 |
0 |
-1/2 |
|
p |
5 |
1 |
-1 |
+1/2 |
|
p |
5 |
1 |
0 |
+1/2 |
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Что за химический элемент Sn? 5 букв
Похожие ответы в сканвордах
Вопрос: Химический элемент, мягкий ковкий серебристо-белый металл
Ответ: Олово
Вопрос: Химический элемент
Ответ: Олово
Вопрос: Химический элемент, металл
Ответ: Олово
Вопрос: Металл
Ответ: Олово
Вопрос: Металл, защищающий другие металлы от коррозии
Ответ: Олово
Вопрос: Металл «пайщик
Ответ: Олово
Вопрос: Металл для пайки
Ответ: Олово
Вопрос: Металл, из которого был сделан стойкий солдатик в сказке Андерсена
Ответ: Олово
Вопрос: Металл, который в избытке можно добыть с поверхности консервных банок
Ответ: Олово
Вопрос: Металл, применяемый в качестве припоя
Ответ: Олово
Вопрос: Мягкий ковкий серебристо-белый металл
Ответ: Олово
Вопрос: Мягкий металл, применяемый для пайки
Ответ: Олово
Вопрос: Один из семи металлов, которые персы носили от сглаза
Ответ: Олово
Вопрос: Основным сырь м для добычи этого металла является кассетирит и консервные банки
Ответ: Олово
Вопрос: Причина ссоры рядового Пупкина и рядового Сидорова в детском саду
Ответ: Олово
Вопрос: С чем связано название десятой годовщины свадьбы
Ответ: Олово
Вопрос: Серебристо-белый металл, мягкий и пластичный
Ответ: Олово
Вопрос: Солдатский металл (сказ.)
Ответ: Олово
Вопрос: Химический элемент, мягкий серебристо-белый металл
Ответ: Олово
Вопрос: Химический элемент; мягкий, ковкий, серебристо-белый металл, применяемый для пайки, лужения, приготовления сплавов и т. п
Ответ: Олово
Вопрос: Что нужно, чтобы впаять, как следует
Ответ: Олово
Вопрос: Элемент главной подгруппы четвёртой группы, пятого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 50. Относится к группе лёгких металлов. При нормальных условиях простое вещество олово
Ответ: Олово
Вопрос: Из этого металла в сказке Андерсена отлит верный друг
Ответ: Олово
Вопрос: Металл номер шестьдесят
Ответ: Олово
Вопрос:
7 элементов в таблице Менделеева, которые здравому смыслу не оставляют ни единого шанса
Какой самый интересный и сумасшедший элемент в периодической таблице химических элементов?

Почти любой элемент в периодической таблице Менделеева удивителен и имеет долю сумасшествия. Сера, похоже, не принадлежит к сумасшедшему клубу. Но тем не менее факты о ней удивительно интересны.
Учтите, что вода – это H20. Это необходимо для жизни. Она не пахнет. Это жидкость.
Чуть ниже кислорода в периодической таблице находится сера. У нее, по логике, должны быть похожие свойства. Но это не так. Согласитесь, это поразительно. Но есть в нашем мире химии и более необычные элементы, которые могут удивить еще больше. Мы в 1Gai.Ru изучили всю таблицу Менделеева, отобрав для вас самые интересные факты о самых удивительных элементах.
Цезий как эталон самого точного времени в мире

Цезий – прекрасный пример управляемого хаоса. Этот элемент известен как радиоактивный отход от ядерных взрывов. Цезий является одним из пяти элементов, которые находятся в жидком состоянии при комнатной температуре.
Но самое удивительное изменение состояния цезия происходит, когда вы помещаете его в воду. Вот что при этом происходит:

Также у цезия электронные переходы настолько точны, что он стал использоваться в качестве основного стандарта для определения самого точного в мире времени.
Так, секунда – это время, равное 9 192 631 770 периодам излучения, соответствующего переходу между двумя сверхтонкими уровнями основного состояния атома цезия-133.
Цезий применяется в атомных часах. Вот как они выглядят:

hodinkee.com
Эти атомные часы настолько точны, что не потеряют ни секунды за 20 миллионов лет. Это безумие, как такой нестабильный элемент может быть использован, чтобы стать нашим точным определением времени.
Смотрите также
Олово – элемент, который совершает самоубийство!
Олово (Sn) – это 50-й элемент периодической таблицы Менделеева.
 drrajeshv.com
drrajeshv.com
Олово издавна известно человечеству. Так, есть доказательства, что человек знал об олове уже в IV тысячелетии до нашей эры. Этот металл был очень дорог и мало кому доступен. Именно поэтому изделия из него редко встречаются среди римских и греческих древних находок. Примечательно, что об олове даже есть информация в Библии (Четвертой Книге Моисея).
Обычно олово существует в его так называемой бета-форме (олово белое β-форма). Олово в этой форме белое, блестящее и сохраняет свою форму. Но когда температура опускается ниже 13 ° C, олово начинает менять свою красивую форму – переходит в альфа-форму (α-модификация серого олова), которая в основном представляет собой сероватый порошок. Этот переход металлического олова в бесполезный пепел называется «оловянной чумой».

Бета-форма

Альфа-форма
Примечательно, что вокруг олова в нашем мире есть множество интересных легенд. Одна из самых интересных – это легенда о том, как свойства олова сыграли с Наполеоном Бонапартом злую шутку.
Легенда гласит, что это необычное химическое поведение олова способствовало падению императора Наполеона Бонапарта. В те времена олово использовалось для изготовления пуговиц и других застежек солдатской формы. Пока армия французов шла в сторону России, с пуговицами солдат было все порядке. Но все изменилось, когда солдаты ступили на российскую землю, где свирепствовали морозы.
 Wikipedia
Wikipedia
Вот тут-то и началась метаморфоза с оловянными пуговицами, которые начали разрушаться, в результате чего форма не могла согреть солдат. В действительности же олову требуется несколько месяцев, чтобы буквально уничтожить себя, преобразовавшись в другую форму. Но, с другой стороны, когда французы вторглись в Россию, температура была ниже минус 30 ° C.
Так что, как полагают некоторые историки и химики, это и послужило сильным толчком для перехода оловянных пуговиц в порошкообразную форму. Правда, все это исторически не подтверждено. А согласитесь, легенда хорошая. Ведь один факт, что легендарный Наполеон потерпел крах своей армии на территории России из-за проблем с форменным обмундированием и виной всему химические свойства олова… Звучит красиво!
Если вам интересно, вот видео, которое показывает переход олова из его бета-формы в альфа-форму:
Висмут
Обычно это выглядит так:

nexmetal.com
Но при правильных условиях это может выглядеть так:

Wikipedia
Мы рекомендуем воспользоваться поиском картинок на Яндексе или в Google по запросу «Кристаллы висмута», чтобы увидеть все чудеса, которые может произвести висмут.
Некоторые другие интересные факты о висмуте:
- Висмут (висмут-209, самый распространенный изотоп) радиоактивен, но имеет один из самых длинных периодов полураспада из когда-либо измеренных. Его период полураспада составляет 1,9×10 ^ 19 лет, или примерно в миллиард раз дольше, чем существует Вселенная.
- Висмут — самый сильный природный диамагнитный металл из известных. Диамагнитные материалы при воздействии магнитного поля создают в ответ отталкивающее поле. Итак, с некоторыми сильными магнитами вы можете заставить висмут подниматься.
- Висмут обладает необычайно низкой токсичностью для тяжелых металлов. Его соседи по периодической диаграмме – полоний, сурьма и свинец – довольно токсичны, но висмут относительно безвреден. Из-за этого висмут исследуется как альтернатива свинцу для некоторых применений.
- Большинство людей употребляют висмут в своей жизни. Активным ингредиентом пепто-висмола является субсалицилат висмута.
Франций
Франций ОЧЕНЬ реактивный и имеет атомный номер 87.
Франций очень реакционноспособный и радиоактивный элемент. Поскольку период его полураспада составляет 22 минуты, он очень реактивный.
Фактически это никогда не проверялось из-за рисков, которые это несет. Тем не менее ученые сделали копию того, на что это было бы похоже, если бы вы уронили его в воду.
Посмотрите, к чему это привело бы:
Вот некоторые фотографии, на которых тестировался франций (но только с небольшим количеством)
Наконец, вот так выглядит франций.
Московий

Фото: Shutterstock
Московий – это искусственно синтезированный радиоактивный элемент. То есть этот элемент в нашей природе не встречается. В 2004 году российские ученые во время исследований на циклотроне У-400 в Объединённом институте ядерных исследований (Дубна, Россия) получили 115-й элемент периодической таблицы Менделеева, представив миру новый элемент, получивший название «Московий».
Для справки:
Предполагается, что московий – непереходный металл, похожий на висмут. Плотность его ожидается на уровне 13,5 г/см3, что выше плотности свинца и несколько меньше плотности ртути. Расчетная температура плавления московия ожидается около 400 °C, то есть он должен быть несколько менее легкоплавким, чем висмут.
Галлий

fineartamerica.com
Галлий был предсказан Дмитрием Менделеевым до его открытия. При создании периодической таблицы химических элементов Менделеев на основе ранеее открытого периодического закона оставил в таблице вакантные места для третьей группы неизвестных элементов.
Галлий же был открыт, выделен и изучен в виде простого вещества французским химиком Полем Эмилем Лекоком де Буабодраном. Это произошло 20 сентября 1875 года.
Этот элемент является постпереходным металлом, перекрывающим промежуток между переходными металлами и металлоидами, и поэтому имеет тенденцию быть мягче с низкой электропроводностью, чем переходные металлы.
Галлий имеет температуру плавления в 29,7 ° С, в то время как его температура кипения находится на уровне около 2204 ° С, что делает этот металл элементом с самым высоким соотношением температуры кипения и температуры плавления.
Он менее токсичен, чем ртуть, поэтому является более экологически чистым выбором для высокотемпературного термометра.
Жидкий галлий расширяется на 3,1 процента при затвердевании.
Жидкий галлий очень легко охлаждается.
Водород

Многие химические элементы каждый по-своему удивителен и уникален. Например, уран способен к массовому разрушению, цезий (читайте о нем выше) имеет крутой эффект взрыва при контакте с водой, а галлий обладает очень низкой температурой плавления и не такой вредный, как ртуть.
Но это всего лишь цветочки по сравнению с настоящим безумным элементом периодической таблицы Менделеева. Один элемент намного, намного более удивительный, чем любой в этой таблице, – речь идет о невероятном водороде. Вот лишь некоторые из уникальных свойств водорода.
Это основной компонент звезд во Вселенной – солнечных гигантских огненных шаров с невероятным количеством энергии. Вы только вдумайтесь: 0,0000066% энергии нашего Солнца питает всю Землю.

thoughtco.com
Водород стоит за созданием всех других элементов. Этот элемент самый распространенный во Вселенной. От всей барионной массы водород во Вселенной составляет 75 процентов. Звезды чаще всего состоят из водородной плазмы. По сути, без водорода не было бы ничего.
Вы наверняка еще со школы помните, что водород является компонентом воды. А вода именно та вещь, из чего состоят практически большинство всех живых существ на нашей планете.
Также некоторые спирты в значительной степени зависят от водорода. Да-да, речь идет о знакомом нам этаноле (алкоголе), который может затуманить нам мозг на какой-нибудь вечеринке.
На самом деле есть безумное количество вещей, за которыми стоит водород. Включая каждого из нас. То есть без водорода не было бы и нас.
Хотите узнать, на что способен чистый водород? Тогда посмотрите на аварию дирижабля Гинденбург. Это была настоящая трагедия, виной которой был безумный водород.
Водород особняком стоит в периодической таблице химических элементов. Он изолирован от любого другого элемента и является единственным элементом, который не имеет ни одного нейтрона.
Если вы хотите игрушку, тогда используйте галлий. Это очень весело. Но если вы хотите почувствовать вкус настоящего безумия, ни один элемент не может быть более безумным, чем всем знакомый водород. Да, для всех нас водород – знакомый всем элемент, но это не меняет его свойства.
Обложка: 1Gai.Ru / Freepik.com/ Petrovsky.spb.ru / Favpng.com
Таблица Менделеева для чайников – HIMI4KA
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.
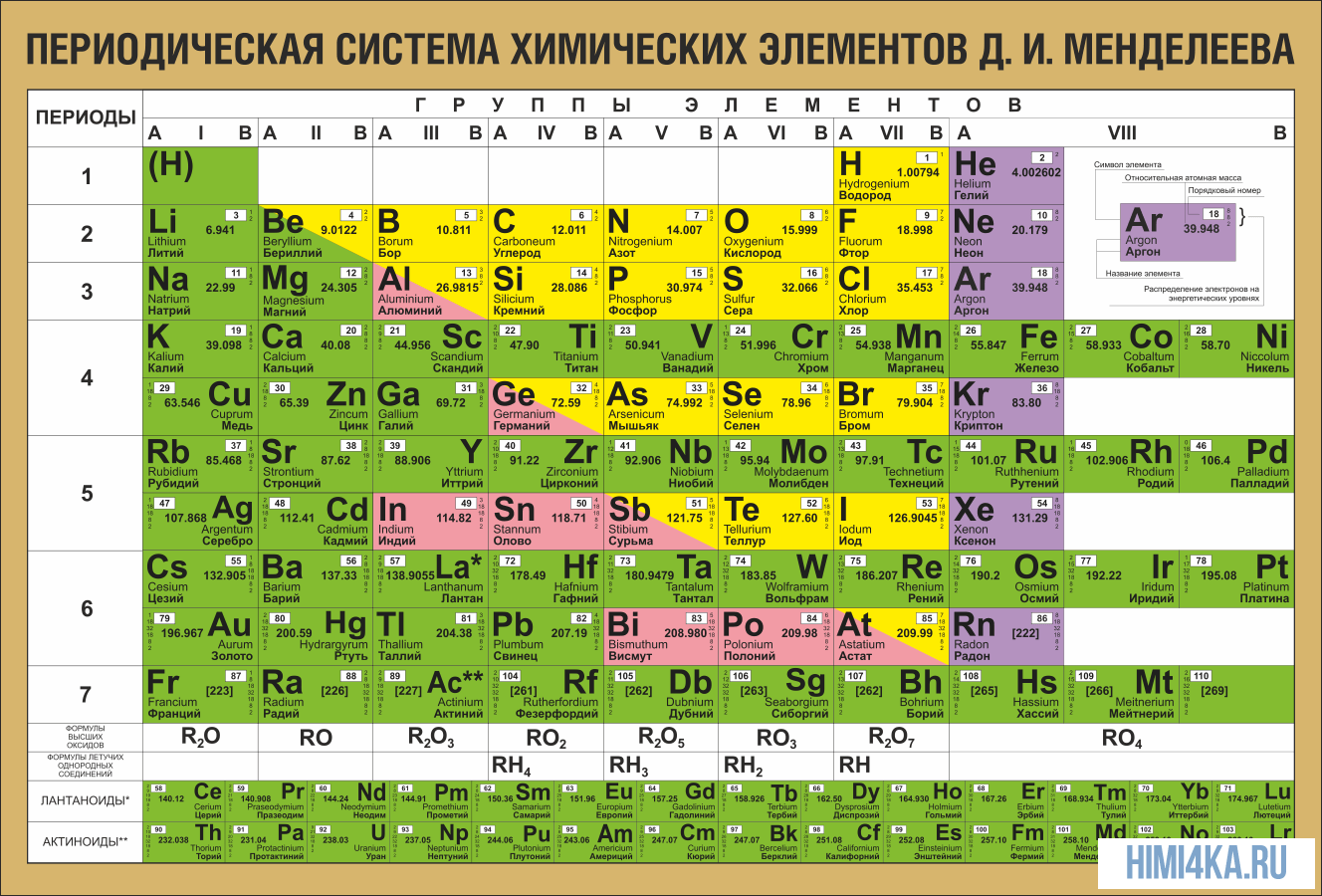
 Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. МенделееваНа первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.


Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.


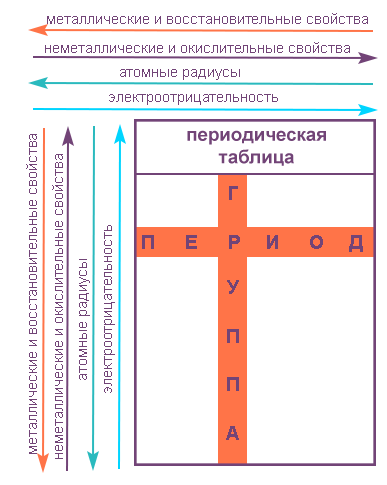
Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.

Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Список химических элементов — это… Что такое Список химических элементов?
Список химических элементов упорядочен в порядке возрастания атомных номеров с возможностью сортировки по другим параметрам. В таблице приводятся название химического элемента, используемый для его обозначения символ (признанный Международным союзом теоретической и прикладной химии), группа и период в Периодической системе химических элементов, атомная масса (наиболее стабильного изотопа), плотность, температура плавления, температура кипения, год открытия, фамилия первооткрывателя. Цвета строк отвечают семействам элементов:
| № | Название | Символ | Латинское название | Период, группа | Атомная масса (г/моль) | Плотность (г/см³) при 20 °C | Температура плавления (°C) | Температура кипения (°C) | Год открытия | Первооткрыватель |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Водород | H | Hydrogenium | 1, 1 | 1,00794 (7)[1][2][3] | 0,084 г/л | -259,1 | -252,9 | 1766 | Кавендиш |
| 2 | Гелий | He | Helium | 1, 18 | 4,002602 (2)[1][3] | 0,17 г/л | -272,2 (при 2,5 МПа) | -268,9 | 1895 | Локьер, Жансен (в спектре Солнца), Рамзай (на Земле) |
| 3 | Литий | Li | Lithium | 2, 1 | 6,941 (2)[1][2][3][4] | 0,53 | 180,5 | 1317 | 1817 | Арфведсон |
| 4 | Бериллий | Be | Beryllium | 2, 2 | 9,012182 (3) | 1,85 | 1278 | 2970 | 1797 | Воклен |
| 5 | Бор | B | Borum | 2, 13 | 10,811 (7)[1][2][3] | 2,46 | 2300 | 2550 | 1808 | Дэви и Гей-Люссак |
| 6 | Углерод | C | Carboneum | 2, 14 | 12,0107 (8)[1][3] | 3,51 | 3550 | 4827 | доисторический период | неизвестен |
| 7 | Азот | N | Nitrogenium | 2, 15 | 14,0067 (2)[1][3] | 1,17 г/л | -209,9 | -195,8 | 1772 | Резерфорд |
| 8 | Кислород | O | Oxygenium | 2, 16 | 15,9994 (3)[1][3] | 1,33 г/л | -218,4 | -182,9 | 1774 | Пристли и Шееле |
| 9 | Фтор | F | Ftorum, Fluorum | 2, 17 | 18,9984032 (5) | 1,58 г/л | -219,6 | -188,1 | 1886 | Муассан |
| 10 | Неон | Ne | Neon | 2, 18 | 20,1797 (6)[1][2] | 0,84 г/л | -248,7 | -246,1 | 1898 | Рамзай и Траверс |
| 11 | Натрий | Na | Natrium | 3, 1 | 22,98976928 (2) | 0,97 | 97,8 | 892 | 1807 | Дэви |
| 12 | Магний | Mg | Magnesium | 3, 2 | 24,3050 (6) | 1,74 | 648,8 | 1107 | 1808 | Дэви |
| 13 | Алюминий | Al | Aluminium | 3, 13 | 26,9815386 (8) | 2,70 | 660,5 | 2467 | 1825 | Эрстед |
| 14 | Кремний | Si | Silicium | 3, 14 | 28,0855 (3)[3] | 2,33 | 1410 | 2355 | 1824 | Берцелиус |
| 15 | Фосфор | P | Phosphorum | 3, 15 | 30,973762 (2) | 1,82 | 44 (P4) | 280 (P4) | 1669 | Бранд |
| 16 | Сера | S | Sulfurum | 3, 16 | 32,065 (5)[1][3] | 2,06 | 113 | 444,7 | доисторический период | неизвестен |
| 17 | Хлор | Cl | Chlorum | 3, 17 | 35,453 (2)[1][2][3] | 2,95 г/л | -101 | -34,6 | 1774 | Шееле |
| 18 | Аргон | Ar | Argon | 3, 18 | 39,948 (1)[1][3] | 1,66 г/л | -189,4 | -185,9 | 1894 | Рамзай и Рэлей |
| 19 | Калий | K | Kalium, Calium | 4, 1 | 39,0983 (1) | 0,86 | 63,7 | 774 | 1807 | Дэви |
| 20 | Кальций | Ca | Calcium | 4, 2 | 40,078 (4)[1] | 1,54 | 839 | 1487 | 1808 | Дэви |
| 21 | Скандий | Sc | Scandium | 4, 3 | 44,955912 (6) | 2,99 | 1539 | 2832 | 1879 | Нильсон |
| 22 | Титан | Ti | Titanium | 4, 4 | 47,867 (1) | 4,51 | 1660 | 3260 | 1791 | Грегор и Клапрот |
| 23 | Ванадий | V | Vanadium | 4, 5 | 50,9415 (1) | 6,09 | 1890 | 3380 | 1801 | дель Рио |
| 24 | Хром | Cr | Chromium | 4, 6 | 51,9961 (6) | 7,14 | 1857 | 2482 | 1797 | Воклен |
| 25 | Марганец | Mn | Manganum, Manganesium | 4, 7 | 54,938045 (5) | 7,44 | 1244 | 2097 | 1774 | Ган |
| 26 | Железо | Fe | Ferrum | 4, 8 | 55,845 (2) | 7,87 | 1535 | 2750 | доисторический период | неизвестен |
| 27 | Кобальт | Co | Cobaltum | 4, 9 | 58,933195 (5) | 8,89 | 1495 | 2870 | 1735 | Брандт |
| 28 | Никель | Ni | Niccolum | 4, 10 | 58,6934 (2) | 8,91 | 1453 | 2732 | 1751 | Кронштедт |
| 29 | Медь | Cu | Cuprum | 4, 11 | 63,546 (3)[3] | 8,92 | 1083,5 | 2595 | доисторический период | неизвестен |
| 30 | Цинк | Zn | Zincum | 4, 12 | 65,409 (4) | 7,14 | 419,6 | 907 | доисторический период | неизвестен |
| 31 | Галлий | Ga | Gallium | 4, 13 | 69,723 (1) | 5,91 | 29,8 | 2403 | 1875 | де Буабодран |
| 32 | Германий | Ge | Germanium | 4, 14 | 72,64 (1) | 5,32 | 937,4 | 2830 | 1886 | Винклер |
| 33 | Мышьяк | As | Arsenicum | 4, 15 | 74,92160 (2) | 5,72 | 613 | 613 (subl.) | ca. 1250 | Альберт Великий |
| 34 | Селен | Se | Selenium | 4, 16 | 78,96 (3)[3] | 4,82 | 217 | 685 | 1817 | Берцелиус |
| 35 | Бром | Br | Bromum | 4, 17 | 79,904 (1) | 3,14 | -7,3 | 58,8 | 1826 | Балар |
| 36 | Криптон | Kr | Krypton, Crypton | 4, 18 | 83,798 (2)[1][2] | 3,48 г/л | -156,6 | -152,3 | 1898 | Рамзай и Траверс |
| 37 | Рубидий | Rb | Rubidium | 5, 1 | 85,4678 (3)[1] | 1,53 | 39 | 688 | 1861 | Бунзен и Кирхгоф |
| 38 | Стронций | Sr | Strontium | 5, 2 | 87,62 (1)[1][3] | 2,63 | 769 | 1384 | 1790 | Кроуфорд |
| 39 | Иттрий | Y | Yttrium | 5, 3 | 88,90585 (2) | 4,47 | 1523 | 3337 | 1794 | Гадолин |
| 40 | Цирконий | Zr | Zirconium | 5, 4 | 91,224 (2)[1] | 6,51 | 1852 | 4377 | 1789 | Клапрот |
| 41 | Ниобий | Nb | Niobium | 5, 5 | 92,90638 (2) | 8,58 | 2468 | 4927 | 1801 | Хэтчетт |
| 42 | Молибден | Mo | Molybdaenum | 5, 6 | 95,94 (2)[1] | 10,28 | 2617 | 5560 | 1778 | Шееле |
| 43 | Технеций | Tc | Technetium | 5, 7 | [98,9063][5] | 11,49 | 2172 | 5030 | 1937 | Перрье и Сегре |
| 44 | Рутений | Ru | Ruthenium | 5, 8 | 101,07 (2)[1] | 12,45 | 2310 | 3900 | 1844 | Клаус |
| 45 | Родий | Rh | Rhodium | 5, 9 | 102,90550 (2) | 12,41 | 1966 | 3727 | 1803 | Волластон |
| 46 | Палладий | Pd | Palladium | 5, 10 | 106,42 (1)[1] | 12,02 | 1552 | 3140 | 1803 | Волластон |
| 47 | Серебро | Ag | Argentum | 5, 11 | 107,8682 (2)[1] | 10,49 | 961,9 | 2212 | доисторический период | неизвестен |
| 48 | Кадмий | Cd | Cadmium | 5, 12 | 112,411 (8)[1] | 8,64 | 321 | 765 | 1817 | Штромейер |
| 49 | Индий | In | Indium | 5, 13 | 114,818 (3) | 7,31 | 156,2 | 2080 | 1863 | Райх и Рихтер |
| 50 | Олово | Sn | Stannum | 5, 14 | 118,710 (7)[1] | 7,29 | 232 | 2270 | доисторический период | неизвестен |
| 51 | Сурьма | Sb | Stibium | 5, 15 | 121,760 (1)[1] | 6,69 | 630,7 | 1750 | доисторический период | неизвестен |
| 52 | Теллур | Te | Tellurium | 5, 16 | 127,60 (3)[1] | 6,25 | 449,6 | 990 | 1782 | фон Райхенштайн |
| 53 | Иод | I | Iodium, Jodium | 5, 17 | 126,90447 (3) | 4,94 | 113,5 | 184,4 | 1811 | Куртуа |
| 54 | Ксенон | Xe | Xenon | 5, 18 | 131,293 (6)[1][2] | 4,49 г/л | -111,9 | -107 | 1898 | Рамзай и Траверс |
| 55 | Цезий | Cs | Caesium | 6, 1 | 132,9054519 (2) | 1,90 | 28,4 | 690 | 1860 | Бунзен и Кирхгоф |
| 56 | Барий | Ba | Barium | 6, 2 | 137,327 (7) | 3,65 | 725 | 1640 | 1808 | Дэви |
| 57 | Лантан | La | Lantanum | 6 | 138,90547 (7)[1] | 6,16 | 920 | 3454 | 1839 | Мосандер |
| 58 | Церий | Ce | Cerium | 6 | 140,116 (1)[1] | 6,77 | 798 | 3257 | 1803 | фон Хисингер и Берцелиус |
| 59 | Празеодим | Pr | Prasaeodymum | 6 | 140,90765 (2) | 6,48 | 931 | 3212 | 1895 | Ауэр фон Вельсбах |
| 60 | Неодим | Nd | Neodymum | 6 | 144,242 (3)[1] | 7,00 | 1010 | 3127 | 1895 | Ауэр фон Вельсбах |
| 61 | Прометий | Pm | Prometium | 6 | [146,9151][5] | 7,22 | 1080 | 2730 | 1945 | Маринский и Гленденин |
| 62 | Самарий | Sm | Samarium | 6 | 150,36 (2)[1] | 7,54 | 1072 | 1778 | 1879 | де Буабодран |
| 63 | Европий | Eu | Europium | 6 | 151,964 (1)[1] | 5,25 | 822 | 1597 | 1901 | Демарсе |
| 64 | Гадолиний | Gd | Gadolinium | 6 | 157,25 (3)[1] | 7,89 | 1311 | 3233 | 1880 | де Мариньяк |
| 65 | Тербий | Tb | Terbium | 6 | 158,92535 (2) | 8,25 | 1360 | 3041 | 1843 | Мосандер |
| 66 | Диспрозий | Dy | Dysprosium | 6 | 162,500 (1)[1] | 8,56 | 1409 | 2335 | 1886 | де Буабодран |
| 67 | Гольмий | Ho | Holmium | 6 | 164,93032 (2) | 8,78 | 1470 | 2720 | 1878 | Соре |
| 68 | Эрбий | Er | Erbium | 6 | 167,259 (3)[1] | 9,05 | 1522 | 2510 | 1842 | Мосандер |
| 69 | Тулий | Tm | Thulium | 6 | 168,93421 (2) | 9,32 | 1545 | 1727 | 1879 | Клеве |
| 70 | Иттербий | Yb | Ytterbium | 6 | 173,04 (3)[1] | 6,97 | 824 | 1193 | 1878 | де Мариньяк |
| 71 | Лютеций | Lu | Lutetium | 6, 3 | 174,967 (1)[1] | 9,84 | 1656 | 3315 | 1907 | Урбэн |
| 72 | Гафний | Hf | Hafnium | 6, 4 | 178,49 (2) | 13,31 | 2150 | 5400 | 1923 | Костер и де Хевеши |
| 73 | Тантал | Ta | Tantalum | 6, 5 | 180,9479 (1) | 16,68 | 2996 | 5425 | 1802 | Экеберг |
| 74 | Вольфрам | W | Wolfrahmium | 6, 6 | 183,84 (1) | 19,26 | 3407 | 5927 | 1783 | Элюяр |
| 75 | Рений | Re | Rhenium | 6, 7 | 186,207 (1) | 21,03 | 3180 | 5873 | 1925 | Ноддак, Такке и Берг |
| 76 | Осмий | Os | Osmium | 6, 8 | 190,23 (3)[1] | 22,61 | 3045 | 5027 | 1803 | Теннант |
| 77 | Иридий | Ir | Iridium | 6, 9 | 192,217 (3) | 22,65 | 2410 | 4130 | 1803 | Теннант |
| 78 | Платина | Pt | Platinum | 6, 10 | 195,084 (9) | 21,45 | 1772 | 3827 | 1557 | Скалигер |
| 79 | Золото | Au | Aurum | 6, 11 | 196,966569 (4) | 19,32 | 1064,4 | 2940 | доисторический период | неизвестен |
| 80 | Ртуть | Hg | Hydrargyrum | 6, 12 | 200,59 (2) | 13,55 | -38,9 | 356,6 | доисторический период | неизвестен |
| 81 | Таллий | Tl | Thallium | 6, 13 | 204,3833 (2) | 11,85 | 303,6 | 1457 | 1861 | Крукс |
| 82 | Свинец | Pb | Plumbum | 6, 14 | 207,2 (1)[1][3] | 11,34 | 327,5 | 1740 | доисторический период | неизвестен |
| 83 | Висмут | Bi | Bismuthum, Wismatum | 6, 15 | 208,98040 (1) | 9,80 | 271,4 | 1560 | 1753 | Жоффруа |
| 84 | Полоний | Po | Polonium | 6, 16 | [208,9824][5] | 9,20 | 254 | 962 | 1898 | Мария и Пьер Кюри |
| 85 | Астат | At | Asthatum | 6, 17 | [209,9871][5] | 302 | 337 | 1940 | Д. Р. Корсон, К. Р. Маккензи и Э. Сегре | |
| 86 | Радон | Rn | Radon | 6, 18 | [222,0176][5] | 9,23 г/л | -71 | -61,8 | 1900 | Дорн |
| 87 | Франций | Fr | Francium | 7, 1 | [223,0197][5] | 1,87 | 27 | 677 | 1939 | Перей |
| 88 | Радий | Ra | Radium | 7, 2 | [226,0254][5] | 5,50 | 700 | 1140 | 1898 | Мария и Пьер Кюри |
| 89 | Актиний | Ac | Actinium | 7 | [227,0278][5] | 10,07 | 1047 | 3197 | 1899 | Дебьерн |
| 90 | Торий | Th | Thorium | 7 | 232,03806 (2)[5][1] | 11,72 | 1750 | 4787 | 1829 | Берцелиус |
| 91 | Протактиний | Pa | Protactinium | 7 | 231,03588 (2)[5] | 15,37 | 1554 | 4030 | 1917 | Содди, Кранстон и Ган |
| 92 | Уран | U | Uranium | 7 | 238,02891 (3)[5][1][2] | 18,97 | 1132,4 | 3818 | 1789 | Клапрот |
| 93 | Нептуний | Np | Neptunium | 7 | [237,0482][5] | 20,48 | 640 | 3902 | 1940 | Макмиллан и Абелсон |
| 94 | Плутоний | Pu | Plutonium | 7 | [244,0642][5] | 19,74 | 641 | 3327 | 1940 | Сиборг |
| 95 | Америций | Am | Americium | 7 | [243,0614][5] | 13,67 | 994 | 2607 | 1944 | Сиборг |
| 96 | Кюрий | Cm | Curium | 7 | [247,0703][5] | 13,51 | 1340 | 1944 | Сиборг | |
| 97 | Берклий | Bk | Berklium | 7 | [247,0703][5] | 13,25 | 986 | 1949 | Сиборг | |
| 98 | Калифорний | Cf | Californium | 7 | [251,0796][5] | 15,1 | 900 | 1950 | Сиборг | |
| 99 | Эйнштейний | Es | Einsteinium | 7 | [252,0829][5] | 860 | 1952 | Сиборг | ||
| 100 | Фермий | Fm | Fermium | 7 | [257,0951][5] | 1952 | Сиборг | |||
| 101 | Менделевий | Md | Mendelevium, Mendeleevium, Mendeleievium | 7 | [258,0986][5] | 1955 | Сиборг | |||
| 102 | Нобелий | No | Nobelium | 7 | [259,1009][5] | 1958 | Сиборг | |||
| 103 | Лоуренсий | Lr | Lawrencium, Laurentium | 7, 3 | [260,1053][5] | 1961 | Гиорсо | |||
| 104 | Резерфордий | Rf | Rutherfordium | 7, 4 | [261,1087][5] | 1964/69 | Флёров | |||
| 105 | Дубний | Db | Dubnium | 7, 5 | [262,1138][5] | 1967/70 | Флёров | |||
| 106 | Сиборгий | Sg | Seaborgium | 7, 6 | [263,1182][5] | 1974 | Флёров | |||
| 107 | Борий | Bh | Bohrium | 7, 7 | [262,1229][5] | 1976 | Оганесян | |||
| 108 | Хассий | Hs | Hassium | 7, 8 | [265][5] | 1984 | GSI (*) | |||
| 109 | Мейтнерий | Mt | Meitnerium | 7, 9 | [266][5] | 1982 | GSI | |||
| 110 | Дармштадтий | Ds | Darmstadtium | 7, 10 | [269][5] | 1994 | GSI | |||
| 111 | Рентгений | Rg | Roentgenium | 7, 11 | [272][5] | 1994 | GSI | |||
| 112 | Коперниций | Cn | Copernicium | 7, 12 | [285][5] | 1996 | GSI | |||
| 113 | Унунтрий | Uut | 7, 13 | [284][5] | 2004 | ОИЯИ (*), LLNL (*) | ||||
| 114 | Флеровий | Fl | Flerovium, Fliorovium | 7, 14 | [289][5] | 1999 | ОИЯИ | |||
| 115 | Унунпентий | Uup | 7, 15 | [288][5] | 2004 | ОИЯИ, LLNL | ||||
| 116 | Ливерморий | Lv | Livermorium | 7, 16 | [292][5] | 2000 | ОИЯИ, LLNL | |||
| 117 | Унунсептий | Uus | 7, 17 | [295][5] | 2010 | ОИЯИ | ||||
| 118 | Унуноктий | Uuo | 7, 18 | [294][5] | 2004 | ОИЯИ |
Аббревиатуры
- GSI — Gesellschaft für Schwerionenforschung (Институт тяжёлых ионов), Виксхаузен, Дармштадт, Германия
- ОИЯИ — Объединённый институт ядерных исследований, Дубна, Московская область, Россия (JINR, Joint Institute for Nuclear Research)
- LLNL — Lawrence Livermore National Laboratory (Ливерморская национальная лаборатория им. Э. Лоуренса), Ливермор, Калифорния, США
- LBNL — Lawrence Berkeley National Laboratory (Национальная лаборатория имени Лоуренса в Беркли), Беркли, Калифорния, США
Примечания
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 Изотопный состав этого элемента различается в различных геологических образцах, и отклонения могут превышать указанную в таблице погрешность.
- ↑ 1 2 3 4 5 6 7 8 Изотопный состав элемента может различаться в различных продажных материалах, что может приводить к существенным отклонениям от приведённых значений.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Изотопный состав различается в земных материалах настолько, что более точный атомный вес не может быть приведён.
- ↑ Атомный вес продажного лития может варьироваться между 6,939 и 6,996, для получения более точного значения необходим анализ конкретного материала.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 Данный элемент не имеет стабильных изотопов, и значение в скобках, например, [209], обозначает массовое число наиболее долгоживущего изотопа элемента или характерный изотопный состав.
Ссылки
Tin — Информация об элементе, свойства и использование
Расшифровка:
Химия в ее стихии: олово
(Promo)
Вы слушаете Химию в ее стихии, представленную вам журналом Chemistry World , журналом Королевского химического общества.
(Конец промо)
Крис Смит
Здравствуйте, на этой неделе элемент, который изменил курс индустрии, а также породил бронзовый век.Мы узнаем, почему римляне пришли в Британию и почему ваш орган зимой может необратимо выйти из строя. Но любителям олова следует быть начеку, потому что многое из того, что мы называем оловом, — нет.
Кэтрин Холт
Жестяные банки, оловянная фольга, оловянные свистки, оловянные солдатики… это то, что приходит на ум, когда мы думаем о олове. Что прискорбно, поскольку жестяные банки на самом деле сделаны из стали; оловянная фольга сделана из алюминия и оловянных свистков …. ну вы поняли. Быть связанным со списком устаревших расходных материалов особенно прискорбно для олова, если учесть, что оно буквально изменило цивилизацию! Вы слышали о бронзовом веке? Что ж, некоторые предприимчивые рабочие-металлисты в конце каменного века обнаружили, что добавление небольшого количества олова в расплавленную медь привело к получению нового сплава.Она была тверже, чем медь, но ее было гораздо легче формировать, отливать и точить. Это открытие было настолько революционным, что родился бронзовый век — название, данное любой цивилизации, которая делала инструменты и оружие из этого сплава меди и олова.
Олово было настолько важным, что секреты его производства тщательно охранялись. Древние греки говорили о «Касситеридах» или «Оловянных островах», которые, как полагали, лежали у северо-западного побережья Европы. Эти загадочные острова никогда не были идентифицированы и, вероятно, никогда не существовали.Все, что знали греки, это то, что олово пришло к ним по морю и с северо-запада, и так возникла история о оловянных островах. Вероятно, олово пришло из северной Испании и из Корнуолла. Фактически, стратегическое значение оловянных рудников Корнуолла считается одной из причин вторжения Римской империи в Британию.
Олово могло сыграть и другую историческую роль — на этот раз в разгроме армии Наполеона в русской кампании 1812 года. Утверждалось, что в суровые холода оловянные пуговицы на солдатской форме рассыпались в порошок, что привело к серьезной потере жизнь от переохлаждения.Правильность этой истории спорна, но превращение олова из блестящего металла в серый порошок при низких температурах — химический факт.
Холодными зимами Северной Европы утрата оловянных органных трубок, когда они начали рассыпаться в пыль, веками была известна как «оловянный вредитель», «оловянная болезнь» или «оловянная проказа». На самом деле этот процесс представляет собой очень простое химическое преобразование одной структурной формы олова — серебристого, металлического «белого олова» или «бета-олова» — в другую — хрупкое неметаллическое «серое олово» или «альфа-олово».Для чистого олова переход происходит при 13,2 oC, но температура перехода ниже или не происходит вообще, если присутствует достаточно примесей, например, если олово легировано другим металлом.
Таким образом, возникла современная проблема с «оловянными вредителями», поскольку сплавы олово-свинец, используемые для покрытия выводов в электрическом оборудовании, иногда заменяются чистым оловом в связи с новым законодательством по охране окружающей среды. При низких температурах покрытие из металлического бета-олова превращается в непроводящее, хрупкое альфа-олово и падает с выводов.Затем рыхлый порошок альфа-олова перемещается внутри оборудования, но, поскольку он не проводит ток, это не вызывает проблем. Однако при более высоких температурах этот порошок альфа-олова снова превращается в проводящее бета-олово, что приводит к коротким замыканиям и всевозможным проблемам.
Чтобы победить «оловянных вредителей», нужно смешивать олово с другими металлами, и в наши дни олово в основном используется для образования сплавов — например, бронзы, олова и припоев. Поскольку олово является наиболее тонально резонансным из всех металлов, оно используется в металлах колоколов и для изготовления органных труб, которые обычно представляют собой смесь олова и свинца в соотношении 50:50.От количества олова обычно зависит тон трубы.
Итак, мы возвращаемся к скромной консервной банке. Хотя банки не сделаны из жести, они часто покрываются оловом изнутри для предотвращения коррозии. Таким образом, хотя сейчас может показаться, что олово играет небольшую роль в нашей повседневной жизни, помните, что когда-то оно участвовало в подъеме и падении цивилизаций.
Крис Смит
Итак, это жесть заманила римлян в Британию — забавно, что я подумал, что это была чудесная погода.Историю Тина рассказала Кэтрин Холт из UCL. На следующей неделе вещество, которое заставляет вас видеть красный цвет.
Брайан Клегг
Если вы слушаете этот подкаст на компьютере с традиционным цветным монитором, Европиум улучшит ваше представление о веб-сайте Chemistry World. Когда впервые были разработаны цветные телевизоры, красные пиксели были относительно слабыми, что означало, что весь цветовой спектр должен был оставаться приглушенным. Но люминофор, легированный европием, оказался гораздо лучшим и ярким источником красного цвета и до сих пор присутствует в большинстве сохранившихся мониторов и телевизоров, предшествующих революции плоских экранов.
Крис Смит
И вы можете услышать от Брайана Клегга о том, как в первую очередь использовалась сила европия и как он был обнаружен на следующей неделе в «Химии в ее элементе». Надеюсь, вы присоединитесь к нам. А пока я Крис Смит, спасибо за внимание и до свидания.
(промо)
(конец промо)
. Что такое олово в Периодической таблице? Определение оловянного элемента Что такое олово? Группа Периодической таблицы и классификация элемента олова Что такое олово? Свойства олова Факты об открытии и История оловянного элемента Что такое олово? Элемент олова Что такое олово? Использование олова Содержание элемента в различных средах Связанное использование олова |
— имена, символы и атомные номера элементов

 В настоящее время известно и названо 118 элементов.
В настоящее время известно и названо 118 элементов.
Вот список элементов периодической таблицы, их атомные номера и символы элементов. Список упорядочен по возрастанию атомного номера, который представляет собой количество протонов в атоме этого элемента. У каждого элемента есть символ, который представляет собой одно- или двухбуквенное сокращение его имени. Иногда символ представляет собой старое название (например, Ag для серебра, Pb для свинца, Au для aurum).
Этот список доступен для загрузки в виде текстового файла CSV и файла PDF. Файл PDF оптимизирован для печати.
| НОМЕР | СИМВОЛ | ЭЛЕМЕНТ | |||
| 1 | H | Водород | |||
| 2 | He | Гелий | |||
| 3 | Li | Литий | |||
| 4 | Be | Бериллий | |||
| 5 | B | Бор | |||
| 6 | C | Углерод | |||
| 7 | N | Азот | |||
| 8 | O | Кислород | |||
| 9 | F | Фтор | |||
| 10 | Ne | Неон | |||
| 11 | Na | Натрий | |||
| 12 | Mg | Магний | |||
| 13 | Al | Алюминий | |||
| 14 | Si | Si licon | |||
| 15 | P | Фосфор | |||
| 16 | S | Сера | |||
| 17 | Cl | Хлор | |||
| 18 | Ar | Аргон | |||
| 19 | K | Калий | |||
| 20 | Ca | Кальций | |||
| 21 | Sc | Скандий | |||
| 22 | Ti | Титан | |||
| 23 | V | Ванадий | |||
| 24 | Cr | Хром | |||
| 25 | Mn | Марганец | |||
| 26 | Fe | Железо | |||
| 27 | Co | Кобальт | |||
| 28 | Ni | Никель | |||
| 29 | Cu | 900 13 Медь||||
| 30 | Zn | Цинк | |||
| 31 | Ga | Галлий | |||
| 32 | Ge | Германий | |||
| 33 | As | Мышьяк | |||
| 34 | Se | Селен | |||
| 35 | Br | Бром | |||
| 36 | Kr | Криптон | |||
| 37 | Rb | Рубидий | |||
| 38 | Sr | Стронций | |||
| 39 | Y | Иттрий | |||
| 40 | Zr | Цирконий | |||
| 41 | Nb | Ниобий | |||
| 42 | Mo | Молибден | Tc | Технеций | |
| 44 | Ru | Рутений | |||
| 45 | Rh | Родий | |||
| 46 | Pd | Палладий | |||
| 47 | Ag | Серебро | |||
| 48 | Cd | Кадмий | |||
| 49 | In | Индий | |||
| 50 | Sn | Олово | |||
| 51 | Sb | Сурьма | |||
| 52 | Te | Теллур | |||
| 53 | I | Йод | |||
| 54 | Xe | Ксенон | |||
| 55 | Cs | Цезий | |||
| 56 | Ba | Барий | |||
| 57 | La | Лантан | 58 | Ce | Церий |
| 59 | 9001 3 PrПразеодим | ||||
| 60 | Nd | Неодим | |||
| 61 | Pm | Прометий | |||
| 62 | Sm | Самарий | |||
| 63 | Eu | Europium | |||
| 64 | Gd | Гадолиний | |||
| 65 | Tb | Тербий | |||
| 66 | Dy | Диспрозий | |||
| 67 | Ho | Гольмий | |||
| Er | Эрбий | ||||
| 69 | Tm | Тулий | |||
| 70 | Yb | Иттербий | |||
| 71 | Lu | Лютеций | |||
| 72 | Hf | Hafn||||
| 73 | Ta | Тантал | 74 | W | Вольфрам |
| 75 | Re | Рений | |||
| 76 | Os | Осмий | |||
| 77 | Ir | Иридий | |||
| 78 | Pt | Платина | |||
| 79 | Au | Золото | |||
| 80 | Hg | Ртуть | |||
| 81 | Tl | Таллий | |||
| 82 | Pb | Свинец | |||
| 83 | Bi | Висмут | |||
| 84 | Po | Полоний | |||
| 85 | At | Астатин | |||
| 86 | Rn | Радон | |||
| 87 | Fr | Франций | |||
| 88 | Ra | Радий | 89 | Ac | Актиний |
| 90 | Th | Торий | |||
| 91 | Па | Протактиний | |||
| 92 | U | Уран | |||
| 93 | N | Нептуний | |||
| 94 | Pu | Плутоний | |||
| 95 | Am | Америций | |||
| 96 | Cm | Curium | |||
| 97 | Bk | Berkelium | 98 | Cf | Калифорний |
| 99 | Es | Эйнштейний | |||
| 100 | Fm | Фермий | |||
| 101 | Md | Менделевий | |||
| Нобелий | |||||
| 103 | Lr 90 014 | Лоуренсий | |||
| 104 | Rf | Резерфордиум | |||
| 105 | Db | Дубний | |||
| 106 | Sg | Сиборгий | |||
| 107 | Bh | Бориум108 | Hs | Калий | |
| 109 | Mt | Meitnerium | |||
| 110 | DS | Дармштадций | |||
| 111 | Rg | Roentgenium | |||
| 112 | Copernicium | ||||
| 113 | Nh | Nihonium | |||
| 114 | Fl | Flerovium | |||
| 115 | Mc | Moscovium | |||
| 116 | Lv | Livermorium | 117Ц | Tennessine | |
| 118 | Og | Oganesson |
Имена будущих элементов
Прямо сейчас в периодической таблице до 118-го элемента нет пробелов.В данной таблице 7 периодов. Однако ученые пытаются синтезировать еще более тяжелые элементы. После синтеза нового элемента исследование должно быть рассмотрено IUPAC, прежде чем будет одобрено новое имя и символ. Первооткрыватель может предложить новое имя и символ, но последнее слово остается за ИЮПАК. Пока новое имя не утверждено, используется систематическое имя элемента. Это имя описывает атомный номер элемента, за которым следует суффикс -ium . Например, элемент 120 имеет временное имя unbinilium.Временные имена громоздки, поэтому вполне допустимо ссылаться на непроверенный элемент по его атомному номеру (например, элемент 122, элемент 145).
.It’s Elemental — The Element Tin
Что в названии? От англосаксонского слова олово . Атомный символ олова происходит от латинского слова stannum , обозначающего олово.
Сказать что? Олово произносится как ИНН .
Археологические данные свидетельствуют о том, что люди использовали олово не менее 5500 лет. Олово в основном получают из минерала касситерита (SnO 2 ) и извлекают путем обжига касситерита в печи с углеродом.Олово составляет всего около 0,001% земной коры и в основном добывается в Малайзии.
Две аллотропы олова встречаются при комнатной температуре. Первая форма олова называется серым оловом и устойчива при температуре ниже 13,2 ° C (55,76 ° F). Серого олова мало, если оно вообще есть. При температуре выше 13,2 ° C серое олово медленно превращается во вторую форму олова — белое олово. Белое олово — это нормальная форма металла, имеющая множество применений. К сожалению, белое олово превратится в серое, если его температура упадет ниже 13.2 ° С. Этого изменения можно избежать, если добавить в белое олово небольшое количество сурьмы или висмута.
Олово устойчиво к коррозии и используется в качестве защитного покрытия для других металлов. Консервные банки, вероятно, являются наиболее знакомым примером этого применения. Жестяная банка на самом деле сделана из стали. На внутреннюю и внешнюю стороны банки наносится тонкий слой олова, чтобы сталь не ржавела. Когда-то широко использовавшиеся консервные банки были заменены пластиковыми и алюминиевыми.
Олово используется в процессе Pilkington для производства оконного стекла.В процессе Pilkington расплавленное стекло выливается в ванну с расплавленным оловом. Стекло плавает на поверхности олова и охлаждается, образуя твердое стекло с плоскими параллельными поверхностями. Таким образом производится большая часть оконного стекла, производимого сегодня.
Олово используется для образования многих полезных сплавов. Бронза — это сплав олова и меди. Олово и свинец сплавлены для получения олова и припоя. Сплав олова и ниобия используется для изготовления сверхпроводящей проволоки. Типовой металл, плавкий металл, раструб и баббитовый металл — другие примеры оловянных сплавов.
Соли олова можно распылять на стекло для создания электропроводящих покрытий. Затем их можно использовать для изготовления панельного освещения и лобовых стекол, защищающих от мороза. Фторид олова (SnF 2 ) используется в некоторых типах зубных паст.
.
