Соединения хрома
Оксид хрома(II) и гидроксид хрома(II) имеют основной характер
Cr(OH) +2HCl→CrCl
+2HCl→CrCl +2H
+2H O
O
Соединение хрома(II)-сильные восстановители; переходят в соединение хрома(III) под действием кислорода воздуха.
2CrCl +
2HCl
→ 2CrCl
+
2HCl
→ 2CrCl +
H
+
H
4Cr(OH) +O
+O +
2H
+
2H O→4Cr(OH)
O→4Cr(OH)
Оксид
хрома(III) Cr O
O —
зеленый, нерастворимый в воде порошок.
Может быть получен при прокаливании
гидроксида хрома(III)
или дихроматов калия и аммония:
—
зеленый, нерастворимый в воде порошок.
Может быть получен при прокаливании
гидроксида хрома(III)
или дихроматов калия и аммония:
2Cr(OH) —
—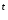 →Cr
→Cr O
O +
3H
+
3H O
O
4K Cr
Cr
 —
—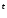 →
2Cr
→
2Cr O
O + 4K
+ 4K CrO
CrO + 3O
+ 3O
(NH )
) Cr
Cr O
O —
—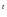 →
Cr
→
Cr O
O + N
+ N
 O
OС концентрированными растворами кислот и щелочей взаимодействует с трудом:
Сr2О3 + 6 КОН + 3Н2О = 2К3[Сr(ОН)6]
Сr2О3 + 6НСl = 2СrСl3 + 3Н2О
Гидроксид хрома (III) Сr(ОН)3 получают при действии щелочей на на растворы солей хрома (III):
СrСl3 +3КОН = Сr(ОН)3↓ + 3КСl
Гидроксид хрома (III) представляет собой осадок серо – зеленого цвета, при получении которого, щелочь надо брать в недостатке. Полученный таким образом гидроксид хрома (III), в отличие от соответствующего оксида легко взаимодействует с кислотами и щелочами, т.е. проявляет амфотерные свойства:
Сr(ОН)3 + 3НNО3 = Сr(NО3)3 + 3Н2О
Сr(ОН)3 + 3КОН = К3[Сr(ОН)6](гексагидроксохромит К)
При сплавлении Сr(ОН)3 со щелочами получаются метахромиты и ортохромиты:
Cr(OH)3 + KOH = KCrO2(метахромит К) + 2H2O
Cr(OH)3 + KOH = K3CrO3(ортохромит К)+ 3H2O
Соединения хрома(VI).
Оксид хрома (VI) — СrО3 – темно – красное кристаллическое вещество, хорошо растворимо в воде – типичный кислотный оксид. Этому оксиду соответствует две кислоты:
СrО3 + Н2О = Н2СrО4 (хромовая кислота – образуется при избытке воды)
СrО3 + Н2О =Н2Сr2О7 (дихромовая кислота – образуется при большой концентрации оксида хрома (3)).
Оксид хрома (6) – очень сильный окислитель, поэтому энергично взаимодействует с органическими веществами:
Окисляет также иод, серу, фосфор, уголь:
При нагревании до 2500С оксид хрома (6) разлагается:
Оксид хрома (6) можно получить при действии концентрированной серной кислоты на твердые хроматы и дихроматы:
Хромовая и дихромовая кислоты.
Хромовая и дихромовая кислоты существуют только в водных растворах, образуют устойчивые соли, соответственно хроматы и дихроматы. Хроматы и их растворы имеют желтую окраску, дихроматы – оранжевую.
Хромат — ионы СrО42- и дихромат – ионы Сr2О72- легко переходят друг в друга при изменении среды растворов
В кислой среде раствора хроматы переходят в дихроматы:
В щелочной среде дихроматы переходят в хроматы:
При разбавлении дихромовая кислота переходит в хромовую кислоту:
Зависимость свойств соединений хрома от степени окисления.
Степень окисления | +2 | +3 | +6 |
Оксид | СrО | Сr2О3 | СrО3 |
Характер оксида | основной | амфотерный | кислотный |
Гидроксид | Сr(ОН)2 | Сr(ОН)3 – Н3СrО3 | Н2СrО4 Н2Сr2О7 |
Характер гидроксида | основной | амфотерный | кислотный |
→ ослабление основных свойств и усиление кислотных→ | |||
Окислительно – восстановительные свойства соединений хрома.
Реакции в кислотной среде.
В кислотной среде соединения Сr+6 переходят в соединения Сr+3 под действием восстановителей: H2S, SO2, FeSO4
Реакции в щелочной среде.
В щелочной среде соединения хрома Сr+3 переходят в соединения Сr+6 под действием окислителей: J2, Br2, Cl2, Ag2O, KClO3, h3O2, KMnO4:
studfile.net
Хром, железо и медь, подготовка к ЕГЭ по химии
Хром
Твердый металл голубовато-белого цвета. Этимология слова «хром» берет начало от греч. χρῶμα — цвет, что связано с большим разнообразием цветов соединений хрома. Массовая доля этого элемента в земной коре составляет 0.02% по массе.

Для хрома характерны степени окисления +2, +3 и +6. У соединений, где хром принимает степень окисления +2, свойства основные, +3 — амфотерные, +6 — кислотные.

В природе хром встречается в виде следующих соединений.
- FeCrO
- (Mg, Fe)Cr2O4 — магнохромит
- (Fe, Mg)(Cr, Al)2O4 — алюмохромит

Получение
В промышленности хром получают прокаливанием хромистого железняка с углеродом. Также применяют алюминотермию для вытеснения хрома из его оксида.
Fe(CrO2)2 + C = Fe + Cr + CO
Cr2O3 + Al = Al2O3O + Cr
Химические свойства
- Реакции с неметаллами
- Реакция с водой
- Реакции с кислотами
- Реакции с солями менее активных металлов
Уже на воздухе вступает в реакцию с кислородом: на поверхности металла образуется пленка из оксида хрома III — Cr2O3 — происходит пассивирование. Реагирует с неметаллами при нагревании.
Cr + O2 = (t) Cr2O3
Cr + S = (t) Cr2S3
Cr + N2 = (t) CrN
Cr + C = Cr2C3

Протекает в раскаленном состоянии.
Cr + H2O = (t) Cr(OH)3 + H2↑
Cr + HCl = CrCl2 + H2↑

Cr + H2SO4(разб.) = CrSO4 + H2↑
С холодными концентрированными серной и азотной кислотой реакция не идет. Она начинается только при нагревании.
Cr + H2SO4 = (t) Cr2(SO4)3 + SO2↑ + H2O
Хром способен вытеснить из солей металлы, стоящие в ряду напряжений правее него.
Cr + CuSO4 = CrSO4 + Cu
Соединения хрома II
Соединение хрома II носят основный характер. Оксид хрома II окисляется кислородом воздуха до более устойчивой формы — оксида хрома III, реагирует с кислотами, кислотными оксидами.

CrO + O2 = Cr2O3
CrO + H2SO4 = CrSO4 + H2O
CrO + SO3 = CrSO4
Гидроксид хрома II, как нерастворимый гидроксид, легко разлагается при нагревании на соответствующий оксид и воду, реагирует с кислотами, кислотными оксидами.

Cr(OH)2 = (t) CrO + H2O
Cr(OH)2 + HCl = CrCl2 + H2O
Cr(OH)2 + SO3 = CrSO4 + H2O
Соединения хрома III
Это наиболее устойчивые соединения, которые носят амфотерный характер. К ним относятся оксид хрома III гидроксид хрома III.

Оксид хрома III реагирует как с растворами щелочей, образуя комплексные соли, так и с кислотами.
Cr2O3 + Ba(OH)2 = Ba(CrO2) + H2O (прокаливание, хромит бария)
Cr2O3 + NaOH + H2O = Na3[Cr(OH)6] (нет прокаливания — в водном растворе, гексагидроксохромат натрия)
Cr2O3 + HCl = CrCl3 + H2O (сохраняем степень окисления)

Оксид хрома III реагирует с более активными металлами (например, при алюминотермии).
Cr2O3 + Al = Al2O3 + Cr
При окислении соединение хрома III получают соединения хрома VI (в щелочной среде).
K3[Cr(OH)6] + H2O2 = K2CrO4
Cr2O3 + 8NaOH + O2 = (t) Na2CrO4 + H2O
Соединения хрома VI
В этой степени окисления хром проявляет кислотные свойства. К ним относится оксид хрома VI — CrO3, и две кислоты, находящиеся в растворе в состоянии равновесия: хромовая — H2CrO4 и дихромовая кислоты — H2Cr2O7.
Принципиально важно помнить окраску хроматов и дихроматов (часто она бывает дана в заданиях в качестве подсказки). Хроматы окрашивают раствор в желтый цвет, а дихроматы — в оранжевый цвет.

Хроматы переходят в дихроматы с увеличением кислотности среды (часто в реакциях с кислотами). Цвет раствора меняется с желтого на оранжевый.
Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + H2O
Если же оранжевому раствору дихромата прилить щелочь, то он сменит свой цвет на желтый — образуется хромат.
Na2Cr2O7 + NaOH = Na2CrO4 + H2O
Разложение дихромата аммония выглядит очень эффектно и носит название «вулканчик» 🙂
(NH4)2Cr2O7 = (t) Cr2O3 + N2↑ + H2O
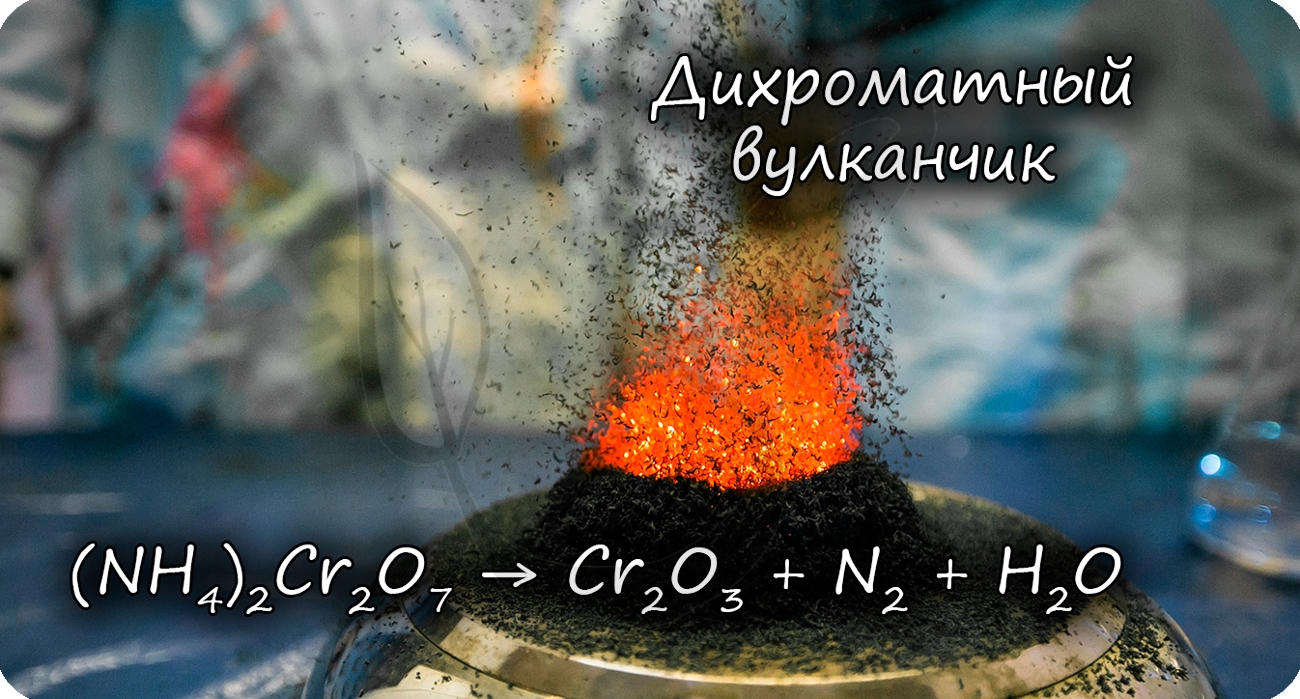
В степени окисления +6 соединения хрома проявляют выраженные окислительные свойства.
Na2Cr2O7 + HCl = CrCl3 + KCl + Cl2↑ + H2O
Железо
Является одним из самых распространенных элементов в земной коре (после алюминия), составляет 4,65% ее массы.

Для железа характерны две основные степени окисления +2, +3, +6.

В природе железо встречается в виде следующих соединений:
- Fe2O3 — красный железняк, гематит
- Fe3O4 — магнитный железняк, магнетит
- Fe2O3*H2O — бурый железняк, лимонит
- FeS2 — пирит, серый или железный колчедан
- FeCO3 — сидерит

Получение
Получают железо восстановлением из его оксида — руды. Восстанавливают с помощью угарного газа, водорода.
CO + Fe2O3 = Fe + CO2↑
H2 + Fe2O3 = Fe + H2O
Основными сплавами железа являются чугун и сталь. В стали содержание углерода менее 2%, меньше содержится P, Mn, Si, S. Чугун отличается бо́льшим содержанием углерода (2-6%), содержит больше P, Mn, Si, S.

Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- Реакции с солями
- Восстановительные свойства
Fe + S = FeS (t > 700°C)
Fe + S = FeS2 (t < 700°C)
Fe + O2 = Fe3O4 (при горении железа образуется железная окалина — Fe3O4 — смесь двух оксидов FeO*Fe2O3)
С нагреванием железо взаимодействует с галогенами, азотом, фосфором, углеродом, кремнием и другими.
Fe + Cl2 = (t) FeCl3
Fe + P = (t) FeP
Fe + C = (t) Fe3C
Fe + Si = (t) FeSi

Железо активнее водорода, способно вытеснить его из кислот.
Fe + HCl = FeCl2 + H2↑
На воздухе железо покрывается пленкой оксида, из-за чего пассивируется во многих реакциях, в том числе с концентрированными холодными серной и азотной кислотами.
Fe + H2SO4(разб.) = FeSO4 + H2↑
Реакция с концентрированными кислотами идет только при нагревании. В холодных серной и азотной кислотах железо пассивируется.

Fe + H2SO4(конц.) = Fe2(SO4)3 + SO2↑ + H2O
Железо способно вытеснить из солей металлы, стоящие в ряду напряжений правее железа.
CuCl2 + Fe = FeCl2 + Cu
Железо способно восстанавливать соединения железа III до II.
Fe + Fe2O3 = (t) FeO
Fe + FeCl3 = (t) FeCl2
Соединения железа II проявляют основные свойства. Реагируют c кислотами. При разложении гидроксид железа II распадается на соответствующий оксид и воду.
FeO + H2SO4 = FeSO4 + H2O
Fe(OH)2 + HCl = FeCl2 + H2O
Fe(OH)2 = (t) FeO + H2O

При хранении на открытом воздухе соли железа II приобретают коричневый цвет из-за окисления до железа III.
FeCl2 + H2O + O2 = Fe(OH)Cl2
Качественной реакцией на ионы Fe2+ в растворе является реакция с красной кровяной солью — K3[Fe(CN)6] — гексацианоферратом III калия. В результате реакции образуется берлинская лазурь (прусский синий).
FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Качественной реакцией на ионы Fe2+ также является взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок зеленого цвета.
FeCl2 + NaOH = Fe(OH)2 + Na2SO4
Соединения железа III проявляют амфотерные свойства. Осид и гидроксид железа III реагирует и с кислотами, и с щелочами.
Fe(OH)3 + H2SO4 = Fe2(SO4)3 + H2O
Fe(OH)3 + KOH = K3[Fe(OH)6] (гексагидроксоферрат калия)
При сплавлении комплексные соли не образуются из-за испарения воды.
Fe(OH)3 + KOH = (t) KFeO2 + H2O
Гидроксид железа III — ржавчина, образуется на воздухе в результате взаимодействия железа с водой в присутствии кислорода. При нагревании легко распадается на воду и соответствующий оксид.

Fe + H2O + O2 = Fe(OH)3
Fe(OH)3 = (t) Fe2O3 + H2O
Качественной реакцией на ионы Fe3+ является взаимодействие с желтой кровяной солью K4[Fe(CN)6]. В результате реакции образуется берлинская лазурь (прусский синий).
FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] + KCl
Реакция хлорида железа III с роданидом калия также является качественной, в результате нее образуется характерный раствор ярко красного цвета.
FeCl 3 + KCNS = Fe(CNS)3 + KCl

И еще одна качественная реакция на ионы Fe2+ — взаимодействие с щелочью (гидроксидом натрия). В результате выпадает осадок бурого цвета.
FeCl3 + NaOH = Fe(OH)3 + Na2SO4
Соединения железа VI — ферраты — соли несуществующей в свободном виде железной кислоты. Обладают выраженными окислительными свойствами.
Ферраты можно получить в ходе электролизом щелочи на железном аноде, а также действием хлора на взвесь Fe(OH)3 в щелочи.
Fe + NaOH + H2O = (электролиз) K2FeO4 + H2↑
Fe(OH)3 + Cl2 + KOH = K2FeO4 + KCl + H2O

Медь
Один из первых металлов, освоенных человеком вследствие низкой температуры плавления и доступности получения руды.

Основные степени окисления меди +1, +2.

Медь встречается в самородном виде и в виде соединений, наиболее известные из которых:
- CuFeS2 — медный колчедан, халькопирит
- Cu2S — халькозин
- Cu2CO3(OH)2 — малахит

Получение
Пирометаллургический метод получения основан на получении меди путем обжига халькопирита, который идет в несколько этапов.
CuFeS2 + O2 = Cu2S + FeS + SO2↑
Cu2S + O2 = Cu2O + SO2
Cu2O + Cu2S = Cu + SO2
Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте и дальнейшем вытеснении меди более активными металлами, например — железом.
CuSO4 + Fe = Cu + FeSO4

Медь, как малоактивный металл, выделяется при электролизе солей в водном растворе на катоде.
CuSO4 + H2O = Cu + O2 + H2SO4 (медь — на катоде, кислород — на аноде)
Химические свойства
- Реакции с неметаллами
- Реакции с кислотами
- С оксидами неметаллов
Во влажном воздухе окисляется с образованием основного карбоната меди.
Cu + CO2 + H2O + O2 = (CuOH)2CO3
При нагревании реагирует с кислородом, селеном, серой, при комнатной температуре с: хлором, бромом и йодом.
4Cu + O2 = (t) 2Cu2O (при недостатке кислорода)
2Cu + O2 = (t) 2CuO (в избытке кислорода)

Cu + Se = (t) Cu2Se
Cu + S = (t) Cu2S
Медь способна реагировать с концентрированными серной и азотной кислотами. С разбавленной серной не реагирует, с разбавленной азотной — реакция идет.
Cu + H2SO4(конц.) = (t) CuSO4 + SO2↑ + H2O
Cu + HNO3(конц.) = Cu(NO3)2 + NO2↑ + H2O
Cu + HNO3(разб.) = Cu(NO3)2 + NO↑ + H2O
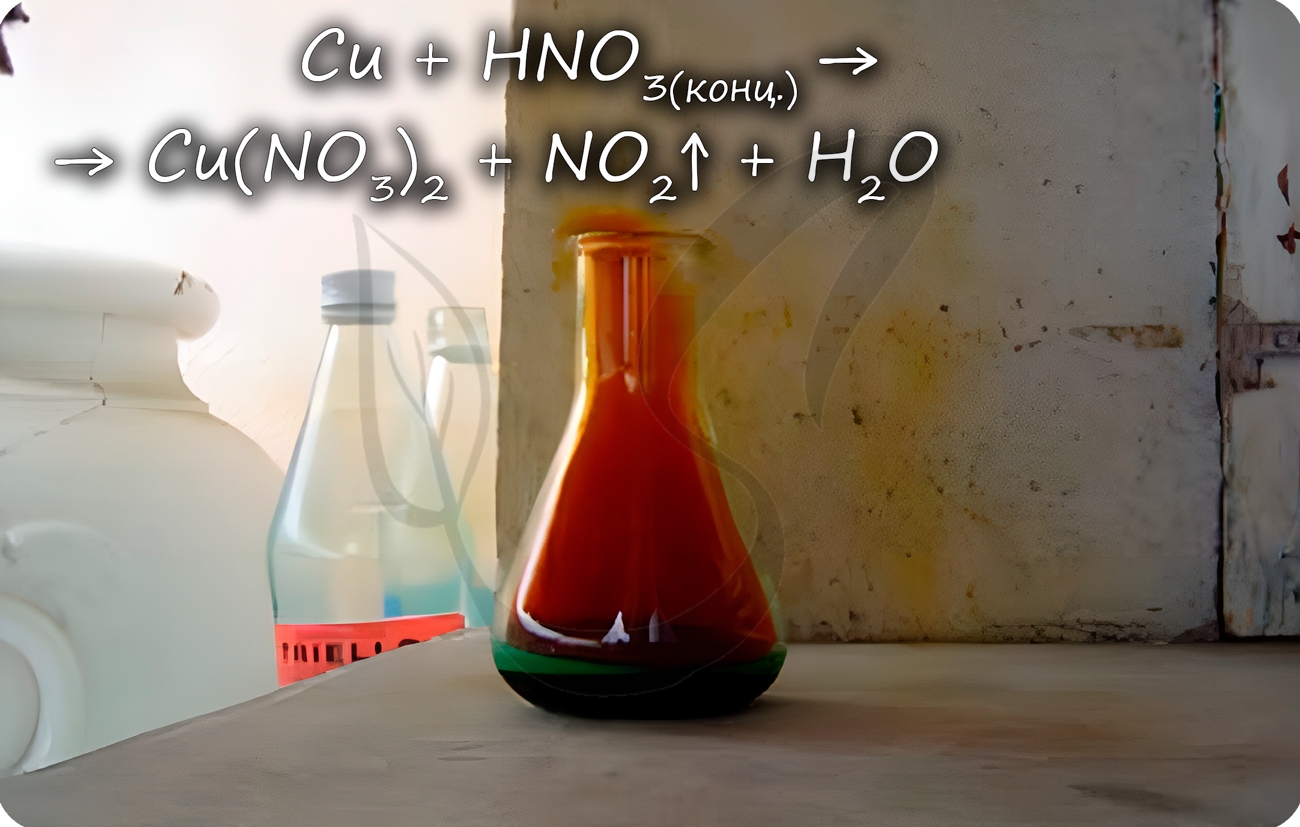
Реагирует с царской водкой — смесью соляной и азотной кислот в соотношении 1 объем HNO3 к 3 объемам HCl.
Cu + HCl + HNO3 = CuCl2 + NO + H2O
Медь способна восстанавливать неметаллы из их оксидов.
Cu + SO2 = (t) Cu2S
Cu + NO2 = (t) CuO + N2↑
Cu + NO = (t) CuO + N2↑
Соединения меди I
В степени окисления +1 медь проявляет основные свойства. Соединения меди I можно получить путем восстановления соединений меди II.
CuCl2 + Cu = CuCl
Оксид меди I можно восстановить до меди различными восстановителями: угарным газом, алюминием (алюминотермией), водородом.
Cu2O + CO = (t) Cu + CO2
Cu2 + Al = (t) Cu + Al2O3
Cu2O + H2 = (t) Cu + H2O
Оксид меди I окисляется кислородом до оксида меди II.
Cu2O + O2 = (t) CuO
Оксид меди I вступает в реакции с кислотами.
Cu2O + HCl = CuCl + H2O
Гидроксид меди CuOH неустойчив и быстро разлагается на соответствующий оксид и воду.
CuOH → Cu2O + H2O
Соединения меди II
Степень окисления +2 является наиболее стабильной для меди. В этой степени окисления у меди есть оксид CuO и гидроксид Cu(OH)2. Данные соединения проявляют преимущественно основные свойства.
Оксид меди II получают в реакциях термического разложения гидроксида меди II, реакцией избытка кислорода с медью при нагревании.
Cu(OH)2 = (t) CuO + H2O
Cu + O2 = (t) CuO
Химические свойства
- Реакции с кислотами
- Разложение
- Восстановление
CuO + H2SO4 = CuSO4 + H2
CuO + HCl = CuCl2 + H2O
CuO = (t) Cu2O + O2
CuO + CO = Cu + CO 2
CuO + C = Cu + CO
CuO + H2 = Cu + H2O
Гидроксид меди II — Cu(OH)2 — получают в реакциях обмена между растворимыми солями меди и щелочью.

CuSO4 + KOH = K2SO4 + Cu(OH)2↓
- Разложение
- Реакции с кислотами
- Реакции с щелочами
- Реакции с кислотными оксидами
При нагревании гидроксид меди II, как нерастворимое основание, легко разлагается на соответствующий оксид и воду.
Cu(OH)2 = (t) CuO + H2O
Cu(OH)2 + HNO3 = Cu(NO3)2 + H2O
Cu(OH)2 + HCl = CuCl2 + H2O
Как сказано выше, гидроксид меди II носит преимущественно основный характер, однако способен проявлять и амфотерные свойства. В растворе концентрированной щелочи он растворяется, образуя гидроксокомлпекс.
Cu(OH)2 + LiOH = Li2[Cu(OH)4]
Cu(OH)2 + CO2 = (CuOH)2CO3 + H2O (дигидроксокарбонат меди II — (CuOH)2CO3)
©Беллевич Юрий Сергеевич
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
studarium.ru
Соединения хрома. Исследование свойств хрома и его соединений (стр. 1 из 4)
Соединения хрома
Оксид хрома(II) и гидроксид хрома(II) имеют основной характер
Cr(OH)+2HCl→CrCl+2HO
Соединение хрома(II)-сильные восстановители; переходят в соединение хрома(III) под действием кислорода воздуха.
2CrCl+ 2HCl → 2CrCl+ H
4Cr(OH)+O+ 2HO→4Cr(OH)
Оксид хрома(III) CrO- зеленый, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома(III) или дихроматов калия и аммония:
2Cr(OH)-→CrO+ 3HO
4KCrO-→ 2CrO + 4KCrO + 3O
(NH)CrO-→ CrO+ N + HO
С концентрированными растворами кислот и щелочей взаимодействует с трудом:
Сr2О3 + 6 КОН + 3Н2О = 2К3[Сr(ОН)6]
Сr2О3 + 6НСl = 2СrСl3 + 3Н2О
Гидроксид хрома (III) Сr(ОН)3 получают при действии щелочей на на растворы солей хрома (III):
СrСl3 +3КОН = Сr(ОН)3↓ + 3КСl
Гидроксид хрома (III) представляет собой осадок серо – зеленого цвета, при получении которого, щелочь надо брать в недостатке. Полученный таким образом гидроксид хрома (III), в отличие от соответствующего оксида легко взаимодействует с кислотами и щелочами, т.е. проявляет амфотерные свойства:
Сr(ОН)3 + 3НNО3 = Сr(NО3)3 + 3Н2О
Сr(ОН)3 + 3КОН = К3[Сr(ОН)6](гексагидроксохромит К)
При сплавлении Сr(ОН)3 со щелочами получаются метахромиты и ортохромиты:
Cr(OH)3 + KOH = KCrO2(метахромит К) + 2h4O
Cr(OH)3 + KOH = K3CrO3(ортохромит К)+ 3h4O
Соединения хрома(VI).
Оксид хрома (VI) — СrО3 – темно – красное кристаллическое вещество, хорошо растворимо в воде – типичный кислотный оксид. Этому оксиду соответствует две кислоты:
СrО3 + Н2О = Н2СrО4 (хромовая кислота – образуется при избытке воды)
СrО3 + Н2О =Н2Сr2О7 (дихромовая кислота – образуется при большой концентрации оксида хрома (3)).
Оксид хрома (6) – очень сильный окислитель, поэтому энергично взаимодействует с органическими веществами:
Окисляет также иод, серу, фосфор, уголь:
При нагревании до 2500С оксид хрома (6) разлагается:
Оксид хрома (6) можно получить при действии концентрированной серной кислоты на твердые хроматы и дихроматы:
Хромовая и дихромовая кислоты.
Хромовая и дихромовая кислоты существуют только в водных растворах, образуют устойчивые соли, соответственно хроматы и дихроматы. Хроматы и их растворы имеют желтую окраску, дихроматы – оранжевую.
Хромат — ионы СrО42- и дихромат – ионы Сr2О72- легко переходят друг в друга при изменении среды растворов
В кислой среде раствора хроматы переходят в дихроматы:
В щелочной среде дихроматы пере
www.consei.ru
Статья по химии (11 класс): Хром и его соединения.
Хром и его соединения.
Хром – элемент с порядковым номером 24. Электронная формула атома в невозбужденном состоянии Cr 1s22s22p63s23p63d54s1.
Электроны в атоме хрома заселяют четыре энергетических уровня. Это элемент четвертого периода шестой группы главной подгруппы. На внешнем уровне атома один электрон . Это металл. Размеры атома хрома и катиона Cr2+ намного меньше радиусов атома кальция, s-элемента того же четвертого периода и катиона Са2+.
В соединениях хрома (VI) атом хрома связан с соседними атомами ковалентными связями. Оксид хрома (VI) – кислотный оксид, его гидроксид – кислота. Соединения хрома (VI) – сильные окислители. Соединения хрома (II) – ионные соединения. Оксид хрома (II) – основной оксид. Его гидратная форма – основание. Соединения хрома (II) – сильные восстановители. Соединения хрома (III) наиболее устойчивы и инертны. Оксид и гидроксид хрома (III) амфотерны.
Физические свойства.
Хром – блестящий металл серовато-белого (серо-стального цвета. Его плотность составляет 7,2 г/см3. Температура плавления хрома 1890 градусов. Это тугоплавкий металл. Технический хром – один из самых твердых, но хрупких металлов. Он лишен пластических свойств. Чистый хром, напротив, очень пластичен, ковок и тягуч.
Химические свойства.
В ряду напряжений хром располагается между цинком и железом. Его поверхность покрыта тончайшим, но очень плотным слоем химически малоактивного оксида хрома (III), препятствующего взаимодействию хрома с окислителями. При комнатной температуре хром не взаимодействует ни с кислородом, ни с хлором. При нагревании хром медленно окисляется кислородом. В мелкораздробленном состоянии нагретый хром горит в кислороде с образованием оксида хрома (III) и окисляется хлором, превращаясь в хлорид хрома (III).
4 Cr + 3O2 = 2 Cr2O3
2Cr + 3Cl2 = 2CrCl3
Хром растворяется в разбавленных хлороводородной и серной кислотах. Процесс протекает в две стадии. Первоначально образуются соединения хрома (II). Они взаимодействуют с кислотами, превращаясь в соли хрома (III).
Cr + 2HCl = CrCl2 + h3 2CrCl2 +2HCl = 2CrCl3 + h3
Cr + h3SO4 = CrSO4 + h3 2CrSO4 + h3SO4 = Cr2(SO4)3 + h3
Хром пассивируется холодными концентрированными азотной и серной кислотами. Он медленно восстанавливает нагретую концентрированную серную кислоту, превращая ее в оксид серы (IV):
2Cr + 6h3SO4=Cr2(SO4)3 +3SO2 +6h3O
Взаимодействие хрома со щелочами в присутствии кислорода приводит к образованию соединений хрома (VI) –хроматов:
2Cr + 4KOH +3O2 = 2K2CrO4 + 2h3O
Нахождение в природе, получение, применение
В свободном состоянии хром в природе не встречается. Важнейшими минеральными соединениями, содержащими хром, являются хромистый железняк FeO.Cr2O3 или Fe(CrO2)2 и крокоит PbCrO4.
Хром получают восстановлением хромистого железняка углеродом в электропечах:
FeO.Cr2O3+4CO= Fe + 2Cr +4CO2
Полученный таким образом хром идет на легирование сталей.
Чистый хром получают методом металлотермии, используя в качестве восстановителей алюминий и кремний:
Cr2O3 + 2AL = 2Cr + Al2O3 2Cr2O3 + 3Si = 4Cr + 3Si2O3
Хром широко применяется как легирующий компонент в производстве нержавеющих и инструментальных сталей и жаропрочных сплавов. Хром придает им коррозийную стойкость, прочность, твердость, повышенную износоустойчивость. Декоративные покрытия защищают металлы от коррозии, продлевают срок их службы и придают хромированным изделиям изящный вид. Сплав с никелем – нихром, обладающий высоким электрическим сопротивлением, идет на производство электронагревательных приборов.
Соединения хрома
Хром образует соединения со степенями окисления +2, +3 и +6. Оксид хрома (II) получают разложением карбонила хрома. Это вещество черного цвета, нерастворимое в воде. Оксид хрома (II) – основной оксид. Он растворим в кислотах:
CrO + h3SO4 = CrSO4 + h3O
Его гидратная форма – гидроксид хрома (II) – это нерастворимое в воде основание. Оно растворяется в кислотах:
Cr(OH)2 +2HCl = CrCl2 + 2 h3O
Гидроксид хрома (II) легко окисляется растворенным в воде кислородом, превращаясь в гидроксид хрома (III):
4Cr(OH)2 + O2 +2h3O = 4Cr(OH)3
nsportal.ru
Занятие элективного курса «Хром и его соединения»
Цель: углубить знания учащихся по теме занятия.
Задачи:
- дать характеристику хрома как простого вещества;
- познакомить учащихся с соединениями хрома разной степени окисления;
- показать зависимость свойств соединений от степени окисления;
- показать окислительно – восстановительные свойства соединений хрома;
- продолжить формирование умений учащихся записывать уравнения химических реакций в молекулярном и ионном виде, составлять электронный баланс;
- продолжить формирование умений наблюдать химический эксперимент.
Форма занятия: лекция с элементами самостоятельной работы учащихся и наблюдением за химическим экспериментом.
Ход занятия
I. Повторение материала предыдущего занятия.
1. Ответить на вопросы и выполнить задания:
— Какие элементы относятся к подгруппе хрома?
— Написать электронные формулы атомов
— К какому типу элементов относятся?
— Какие степени окисления проявляют в соединениях?
— Как изменяется радиус атомов и энергия ионизации от хрома к вольфраму?
Можно предложить заполнить учащимся заполнить таблицу, используя табличные величины радиусов атомов, энергии ионизации и сделать выводы.
Образец таблицы:
| Элемент | Электронные формулы | Радиус атома нм | Энергия ионизации эВ | Степень окисления |
| хром | …3s23p63d54s1 | 0,125 | 6,76 | +2,+3,+6 |
| молибден | …4s24p64d55s1 | 0,136 | 7,10 | +3,+4,+5,+6 |
| вольфрам | …5s25p65d46s2 | 0,140 | 7,98 | +3,+4,+5,+6 |
2. Заслушать сообщение учащегося по теме «Элементы подгруппы хрома в природе, получение и применение».
II. Лекция.
План лекции:
- Хром.
- Соединения хрома. (2)
- Оксид хрома; (2)
- Гидроксид хрома. (2)
- Соединения хрома. (3)
- Оксид хрома; (3)
- Гидроксид хрома. (3)
- Соединения хрома (6)
- Оксид хрома; (6)
- Хромовая и дихромовая кислоты.
- Зависимость свойств соединений хрома от степени окисления.
- Окислительно – восстановительные свойства соединений хрома.
1. Хром.
Хром – это белый с голубоватым отливом блестящий металл, очень твердый (плотность 7, 2 г/см3), температура плавления 1890˚С.
Химические свойства: хром при обычных условиях неактивный металл. Это объясняется тем, что его поверхность покрыта оксидной пленкой (Сr2О3). При нагревании оксидная пленка разрушается, и хром реагирует с простыми веществами при высокой температуре:
- 4Сr +3О2 = 2Сr2О3
- 2Сr + 3S = Сr2S3
- 2Сr + 3Cl2 = 2СrСl3
Задание: составить уравнения реакций хрома с азотом, фосфором, углеродом и кремнием; к одному из уравнений составить электронный баланс, указать окислитель и восстановитель.
Взаимодействие хрома со сложными веществами:
При очень высокой температуре хром реагирует с водой:
- 2Сr + 3 Н2О = Сr2О3 + 3Н2↑
Задание: составить электронный баланс, указать окислитель и восстановитель.
Хром реагирует с разбавленной серной и соляной кислотами:
- Сr + Н2SО4 = СrSО4 + Н2↑
- Сr + 2НСl= СrСl2 + Н2↑
Задание: составить электронный баланс, указать окислитель и восстановитель.
Концентрированные серная соляная и азотная кислоты пассивируют хром.
2. Соединения хрома. (2)
1. Оксид хрома (2) — СrО – твердое ярко – красное вещество, типичный основной оксид (ему соответствует гидроксид хрома (2) — Сr(ОН)2), не растворяется в воде, но растворяется в кислотах:
- СrО + 2НСl = СrСl2 + Н2О
Задание: составить уравнение реакции в молекулярном и ионном виде взаимодействия оксида хрома (2) с серной кислотой.
Оксид хрома (2) легко окисляется на воздухе:
Задание: составить электронный баланс, указать окислитель и восстановитель.
Оксид хрома (2) образуется при окислении амальгамы хрома кислородом воздуха:
2Сr (амальгама) + О2 = 2СrО
2. Гидроксид хрома (2) — Сr(ОН)2 – вещество желтого цвета, плохо растворимо в воде, с ярко выраженным основным характером, поэтому взаимодействует с кислотами:
- Сr(ОН)2 + Н2SО4 = СrSO4 + 2Н2О
Задание: составить уравнения реакций в молекулярном и ионном виде взаимодействия оксида хрома (2) с соляной кислотой.
Как и оксид хрома (2), гидроксид хрома (2) окисляется:
- 4 Сr(ОH)2 + О2 + 2Н2О = 4Сr(ОН)3
Задание: составить электронный баланс, указать окислитель и восстановитель.
Получить гидроксид хрома (2) можно при действии щелочей на соли хрома (2):
- CrCl2 + 2KOH = Cr(OH)2↓ + 2KCl
Задание: составить ионные уравнения.
3. Соединения хрома. (3)
1. Оксид хрома (3) — Сr2О3 – порошок темно – зеленого цвета, нерастворим в воде, тугоплавкий, по твёрдости близок к корунду (ему соответствует гидроксид хрома (3) – Сr(ОН)3). Оксид хрома (3) имеет амфотерный характер, однако в кислотах и щелочах растворяется плохо. Реакции со щелочами идут при сплавлении:
- Сr2О3 + 2КОН = 2КСrО2(хромит К) + Н2О
Задание: составить уравнение реакции в молекулярном и ионном виде взаимодействия оксида хрома (3) с гидроксидом лития.
С концентрированными растворами кислот и щелочей взаимодействует с трудом:
- Сr2О3 + 6 КОН + 3Н2О = 2К3[Сr(ОН)6]
- Сr2О3 + 6НСl = 2СrСl3 + 3Н2О
Задание: составить уравнения реакций в молекулярном и ионном виде взаимодействия оксида хрома (3) с конценрированной серной кислотой и концентрированным раствором гидроксида натрия.
Оксид хрома (3) может быть получен при разложении дихромата аммония:
- (NН4)2Сr2О7 = N2 + Сr2О3 +4Н2О
2. Гидроксид хрома (3) Сr(ОН)3 получают при действии щелочей на на растворы солей хрома (3):
- СrСl3 +3КОН = Сr(ОН)3↓ + 3КСl
Задание: составить ионные уравнения
Гидроксид хрома (3) представляет собой осадок серо – зеленого цвета, при получении которого, щелочь надо брать в недостатке. Полученный таким образом гидроксид хрома (3), в отличие от соответствующего оксида легко взаимодействует с кислотами и щелочами, т.е. проявляет амфотерные свойства:
- Сr(ОН)3 + 3НNО3 = Сr(NО3)3 + 3Н2О
- Сr(ОН)3 + 3КОН = К3[Сr(ОН)6](гексагидроксохромит К)
Задание: составить уравнения реакций в молекулярном и ионном виде взаимодействия гидроксида хрома (3) с соляной кислотой и гидроксидом натрия.
При сплавлении Сr(ОН)3 со щелочами получаются метахромиты и ортохромиты:
- Cr(OH)3 + KOH = KCrO2(метахромит К) + 2H2O
- Cr(OH)3 + KOH = K3CrO3(ортохромит К)+ 3H2O
4. Соединения хрома. (6)
1. Оксид хрома (6) — СrО3 – темно – красное кристаллическое вещество, хорошо растворимо в воде – типичный кислотный оксид. Этому оксиду соответствует две кислоты:
- СrО3 + Н2О = Н2СrО4(хромовая кислота – образуется при избытке воды)
- СrО3 + Н2О =Н2Сr2О7(дихромовая кислота – образуется при большой концентрации оксида хрома (3)).
Оксид хрома (6) – очень сильный окислитель, поэтому энергично взаимодействует с органическими веществами:
- С2Н5ОН + 4СrО3 = 2СО2 + 2Сr2О3 + 3Н2О
Окисляет также иод, серу, фосфор, уголь:
- 3S + 4CrO3 = 3SO2 + 2Cr2O3
Задание: составить уравнения химических реакций оксида хрома (6) с йодом, фосфором, углем; к одному из уравнений составить электронный баланс, указать окислитель и восстановитель
При нагревании до 2500С оксид хрома (6) разлагается:
Оксид хрома (6) можно получить при действии концентрированной серной кислоты на твердые хроматы и дихроматы:
- К2Сr2О7 + Н2SО4 = К2SО4 + 2СrО3 + Н2О
2. Хромовая и дихромовая кислоты.
Хромовая и дихромовая кислоты существуют только в водных растворах, образуют устойчивые соли, соответственно хроматы и дихроматы. Хроматы и их растворы имеют желтую окраску, дихроматы – оранжевую.
Хромат — ионы СrО42- и дихромат – ионы Сr2О72- легко переходят друг в друга при изменении среды растворов
В кислой среде раствора хроматы переходят в дихроматы:
- 2К2СrО4 + Н2SО4 = К2Сr2О7 + К2SО4 + Н2О
В щелочной среде дихроматы переходят в хроматы:
- К2Сr2О7 + 2КОН = 2К2СrО4 + Н2О
При разбавлении дихромовая кислота переходит в хромовую кислоту:
5. Зависимость свойств соединений хрома от степени окисления.
| Степень окисления | +2 | +3 | +6 |
| Оксид | СrО | Сr2О3 | СrО3 |
| Характер оксида | основной | амфотерный | кислотный |
| Гидроксид | Сr(ОН)2 | Сr(ОН)3 – Н3СrО3 | Н2СrО4 Н2Сr2О7 |
| Характер гидроксида | основной | амфотерный | кислотный |
|
→ ослабление основных свойств и усиление кислотных→ |
|||
6. Окислительно – восстановительные свойства соединений хрома.
Реакции в кислотной среде.
В кислотной среде соединения Сr+6 переходят в соединения Сr+3 под действием восстановителей: H2S, SO2, FeSO4
- К2Сr2О7 +3Н2S +4Н2SО4 = 3S + Сr2(SО4)3 + K2SO4+ 7Н2О
- S-2 – 2e → S0
- 2Cr+6 + 6e → 2Cr+3
Задание:
1. Уравнять уравнение реакции методом электронного баланса, указать окислитель и восстановитель:
- Na2CrO4 + K2S + H2SO4 = S + Cr2(SO4)3 + K2SO4 + Na2SO4 + H2O
2. Дописать продукты реакции, уравнять уравнение методом электронного баланса, указать окислитель и восстановитель:
- K2Cr2O7 + SO2 + H2SO4 = ? +? +Н2О
Реакции в щелочной среде.
В щелочной среде соединения хрома Сr+3 переходят в соединения Сr+6 под действием окислителей: J2, Br2, Cl2, Ag2O, KClO3, h3O2, KMnO4:
- 2KCrO2 +3 Br2 +8NaOH =2Na2
urok.1sept.ru
§ 23. СОЕДИНЕНИЯ ХРОМА. Токсикологическая химия. В.Ф. Крамаренко
Применение и токсичность соединений хрома. Соединения хрома широко используются в различных отраслях народного хозяйства. Они применяются в кожевенной и текстильной промышленностях, используются для хромирования металлических изделий, для производства спичек, красок, кино- и фотопленок. В химической промышленности соединения хрома применяются как окислители. Ряд соединений хрома применяется в химических лабораториях в качестве реактивов. Ввиду токсичности соединений хрома они не применяются в медицине.
Из соединений хрома, применяемых в различных отраслях народного хозяйства, наиболее ядовитыми являются хроматы и дихроматы. Причем дихроматы более ядовиты, чем хроматы. Хроматы и дихроматы оказывают раздражающее и прижигающее действие на кожу и слизистые оболочки, вызывая изъязвления. Под влиянием хроматов и дихроматов может наступить гемолиз и образуется метгемоглобин. После поступления соединений хрома в организм через пищевой канал может наступать припухлость, а затем ожоги слизистых оболочек рта, пищевода и желудка. Пораженные соединениями хрома участки пищевого канала приобретают желтую окраску. При отравлении соединениями хрома могут наступить понос и кровавая рвота. Иногда рвотные массы имеют желтую или зеленую окраску. При поступлении в организм больших количеств пыли, содержащей соединения хрома, развивается пневмония.
При острых отравлениях соединениями хрома они накапливаются в печени, почках и эндокринных железах. Соединения хрома выводятся из организма в основном через почки. В связи с этим при отравлении указанными соединениями поражаются почки и слизистые оболочки мочевыводящих путей.
Исследование минерализатов на наличие хрома
После разрушения биологического материала серной и азотной кислотами в полученном минерализате хром в основном находится в трехвалентном состоянии. Для обнаружения хрома в минерализатах применяют реакцию образования надхромовой кислоты и реакцию с дифенилкарбазидом.
Реакция образования надхромовой кислоты. Ионы хрома Cr 3+ окисляют при помощи персульфата аммония в присутствии катализатора (соли серебра) до дихромат-ионов. После прибавления пероксида водорода к дихромату образуется надхромовая кислота, имеющая голубую или сине-голубую окраску. Этой кислоте приписывают несколько формул: Н 2 CrO 6, Н 3 CrO 8, Н 7 CrO 10 и др.
Образование надхромовой кислоты можно представить следующими уравнениями:
Чувствительность реакции образования надхромовой кислоты понижается в присутствии солей железа (III) и сурьмы (III), для маскировки которых прибавляют фосфаты. Надхромовая кислота быстро разлагается в водных растворах. Поэтому из водных растворов ее экстрагируют органическими растворителями (этиловый эфир, этилацетат, амиловый спирт и др.), в которых надхромовая кислота более устойчива, чем в воде.
Выполнение реакции. В пробирку вносят 5 мл минерализата, по каплям прибавляют 30%-й раствор гидроксида натрия до рН = 7. Затем в пробирку вносят еще 1 мл минерализата и содержимое пробирки взбалтывают. После этого в пробирку вносят 1—2 капли 10 %-го раствора нитрата серебра, 0,5 г персульфата аммония и нагревают на кипящей водяной бане в течение 20 мин. Затем пробирку с содержимым охлаждают в ледяной воде в течение 10—15 мин. К охлажденной жидкости добавляют 1 мл насыщенного раствора дигидрофосфата натрия и проверяют рН среды. При необходимости жидкость доводят до рН=1,5—1,7. После этого в пробирку вносят уксусно-этиловый эфир, толщина слоя которого должна быть около 0,5—0,6 см, и 2—3 капли 25 %-го раствора пероксида водорода. Содержимое пробирки энергично взбалтывают. При наличии ионов хрома Cr 3+ в мине-рализате слой органического растворителя приобретает окраску (от голубой до синей). Предел обнаружения: 2 мкг хрома в 1 мл. Граница обнаружения: 0,2 мг хрома в 100 г биологического материала.
Реакция с дифенилкарбазидом. При выполнении этой реакции ионы хрома, находящиеся в минерализате, окисляют персульфатом аммония в присутствии катализатора (ионы серебра) до дихромат-ионов. Чувствительность этой реакции понижают ионы железа (III), сурьмы (III) и др. Для маскировки мешающих ионов прибавляют фосфаты.
Образовавшиеся дихромат-ионы реагируют с дифенилкарбазидом. Вначале дихромат-ионы окисляют дифенилкарбазид (I) до дифенилкарбазона (II), который не имеет окраски. При дальнейшем окислении образуется дифенилкарбадиазон (III), имеющий светло-желтую окраску:
При этой реакции дихромат-ионы восстанавливаются до двухвалентного хрома Cr 2+, но не до Cr 3+. Ионы Cr 2+ с енольной формой дифенилкарбазона (IV) дают внутрикомплексную соль (V), имеющую красно-фиолетовую окраску:
Выполнение реакции. В пробирку вносят 1 мл минерализата, к которому прибавляют 4 мл воды, 1 каплю 10 %-го раствора нитрата серебра и 0,5 г персульфата аммония. Пробирку со смесью нагревают на кипящей водяной бане в течение 20 мин, а затем в нее вносят 1 мл насыщенного раствора дигидрофосфата натрия и по каплям добавляют 5 %-й раствор гидроксида натрия до рН=1,5—1,7. После доведения жидкости до указанного рН к ней добавляют 1 мл 0,25 %-го раствора дифенилкарбазида в смеси этилового спирта и ацетона (1:1) и взбалтывают содержимое пробирки. При наличии ионов хрома в минерализате раствор приобретает розовую или красно-фиолетовую окраску. Предел обнаружения: 0,002 мкг хрома в 1 мл. Граница обнаружения: 0,1 мг хрома в 100 г биологического материала.
Обнаружение хромат-ионов в присутствии перманганат-ионов. Обнаружению хромат-ионов при помощи реакции с дифенилкарбазидом мешают перманганат-ионы, имеющие собственную окраску. Поэтому перед выполнением реакции на хромат-ионы с дифенилкарбазидом восстанавливают перманганат-ионы при помощи азида натрия NaN 3, который представляет собой соль азотистоводородной кислоты Η—Ν=Ν≡Ν. Хромат-ионы с азидом натрия практически не реагируют. Несколько кристалликов азида натрия достаточно для быстрого восстановления перманганат-ионов.
Выполнение реакции. В углубление на капельной пластинке вносят каплю исследуемого раствора, прибавляют каплю концентрированной серной кислоты и несколько кристалликов азида натрия. Смесь перемешивают стеклянной палочкой до исчезновения окраски перманганат-ионов. Затем прибавляют каплю 1 %-го спиртового раствора дифенилкарбазида. В присутствии хроматов появляется сине-фиолетовая или красная окраска. Предел обнаружения: 0,5 мкг хромат-ионов в пробе.
СОДЕРЖАНИЕ
ПРЕДЫДУЩАЯ | СЛЕДУЮЩАЯ
www.xumuk.ru
Соединения трехвалентного хрома
Оксид хрома (III) Cr2O3. Зеленые гексагональные микрокристаллы. tпл=2275°С, tкип=3027°С, плотность равна 5,22 г/см3. Проявляет амфотерные свойства. Антиферромагнитны ниже 33°С и парамагнитны выше 55°С. Растворяется в жидком диоксиде серы. Мало растворим в воде, разбавленных кислотах и щелочах. Получают прямым взаимодействием элементов при повышенной температуре, нагреванием CrO на воздухе, прокаливанием хромата или бихромата аммония, гидроксида или нитрата хрома (III), хромата ртути (I), бихромата ртути. Применяют в качестве зеленого пигмента в живописи и для окрашивания фарфора и стекла. Кристаллический порошок используется в качестве абразивного материала. Применяют для получения искусственных рубинов. Служит катализатором процесса окисления аммиака на воздухе, синтеза аммиака из элементов и других.
Таблица 6. [12].
Δ H°обр | -1140,6 кДж/моль; | Δ G°298 | -1059,0 кДж/моль; | Δ S°298 | 81,2 Дж/моль.K |
Его можно получить при непосредственном взаимодействии элементов, прокаливанием нитрата хрома(III) или хромового ангидрида, разложением хромата или дихромата аммония, нагреванием хроматов металлов с углем или серой:
4Cr + 3O2 → 2Cr2O3
4Cr(NO3)3 → 2Cr2O3 + 12NO2 + 3O2
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O
4CrO3 → 2Cr2O3 + 3O2
K2Cr2O7 + S → Cr2O3 + K2SO4
K2Cr2O7 + 2C → Cr2O3 + K2CO3 + CO .
Оксид хрома(III) проявляет амфотерные свойства, но весьма инертен и его трудно растворить в водных кислотах и щелочах. При сплавлении с гидроксидами или карбонатами щелочных металлов переходит в соответствующие хроматы:
Cr2O3 + 4KOH + KClO3 →2K2CrO4 + KCl + 2H2O.
Твердость кристаллов оксида хрома(III) соизмерима с твердостью корунда, поэтому Cr2O3 является действующим началом многих шлифовальных и притирочных паст в машиностроении, оптической, ювелирной и часовой промышленности. Его также применяют в качестве зеленого пигмента в живописи и для окрашивания некоторых стекол, как катализатор гидрирования и дегидрирования некоторых органических соединений. Оксид хрома(III) довольно токсичен. Попадая на кожу, способен вызывать экзему и другие кожные заболевания. Особенно опасно вдыхание аэрозоля оксида, так как это может вызвать тяжелые заболевания. ПДК 0,01 мг/м3. Профилактика – использование средств индивидуальной защиты.
Гидроксид хрома (III) Cr(OH)3. Обладает амфотерными свойствами. Мало растворим в воде. Легко переходит с коллоидное состояние. Растворяется в щелочах и кислотах. Молярная электропроводность при бесконечном разведении при 25оС равна 795,9 Cм.см2/моль. Получают в виде студнеобразного зеленого осадка при обработке солей хрома (III) щелочами, при гидролизе солей хрома (III) с карбонатами щелочных металлов или сульфидом аммония.
Таблица 7. [12].
Δ H°обр | -1013 кДж/моль; | Δ G°298 | -867 кДж/моль. |
Фторид хрома (III) CrF3. Парамагнитные зеленые ромбические кристаллы. tпл=1200°С [13], tкип=1427°С, плотность равна 3,78 г/см3. Растворяется в плавиковой кислоте и мало растворим в воде. Молярная электропроводность при бесконечном разведении при 25оС равна 367,2 см2/моль. Получают действием плавиковой кислоты на оксид хрома (III), пропусканием фтороводорода над нагретым до 500-1100оС хлоридом хрома (III). Водные растворы используют в производстве шелка, при переработке шерсти и фторировании галогенпроизводных этана и пропана.
Хлорид хрома (III) CrCl3. Гексагональные парамагнитные кристаллы имеют окраску цветов персикового дерева. Расплываются на воздухе. tпл=1150°С, плотность равна 2,87 г/см3. Безводный CrCl3 мало растворим в воде, спирте, эфире, ацетальдегиде, ацетоне. Восстанавливается при высокой температуре до металлического хрома кальцием, цинком, магнием, водородом, железом. Молярная электропроводность при бесконечном разведении при 25оС равна 430,05 см2/моль. Получают прямым взаимодействием элементов при нагревании, действием хлора на нагретую до 700-800оС смесь оксида хрома (III) с углем или на нагретый до красного каления сульфид хрома (III). Применяют в качестве катализатора в реакциях органического синтеза.
Таблица 8.
Δ H°обр | -570 кДж/моль; | Δ G°298 | -501 кДж/моль; | Δ S°298 | 124,7 Дж/моль.K [12]. |
в безводном состоянии кристаллическое вещество, имеющее окраску цветов персикового дерева (близкая к фиолетовой), трудно растворимое в воде, спирте, эфире и пр. даже при кипячении. Однако в присутствии следовых количеств CrCl2 растворение в воде наступает быстро с большим выделением тепла. Может быть получен при взаимодействии элементов при температуре красного каления, обработкой хлором смеси оксида металла и угля при 700–800°С, или взаимодействием CrCl3 с парами CCl4 при 700-800°С:
Cr2O3 + 3C + 3Cl2 → 2CrCl3 + 3CO
2Cr2O3 + 3CCl4 → 4CrCl3 + 3CO2.
Образует несколько изомерных гексагидратов, свойства которых зависят от числа молекул воды, находящихся во внутренней координационной сфере металла. Хлорид гексааквахрома (III) (фиолетовый хлорид Рекура) [Cr(H2O)6]Cl3 – кристаллы серовато-синего цвета, хлорид хлорпентааквахрома(III) (хлорид Бьеррума) [Cr(H2O)5Cl]Cl2•H2O – гигроскопичное светло-зеленое вещество; хлорид дихлортетрааквахрома (III) (зеленый хлорид Рекура) [Cr(H2O)4Cl2]Cl•2H2O – темно-зеленые кристаллы. В водных растворах устанавливается термодинамическое равновесие между тремя формами, зависящее от многих факторов. Структуру изомера можно определить по количеству осаждаемого им хлорида серебра из холодного азотнокислого раствора AgNO3, так как хлорид-анион, входящий во внутреннюю сферу, с катионом Ag+ не взаимодействует. Безводный хлорид хрома применяется для нанесения покрытий хрома на стали химическим осаждением из газовой фазы, является составной частью некоторых катализаторов. Гидраты CrCl3 – протрава при крашении тканей. Хлорид хрома(III) токсичен.
Бромид хрома (III) CrBr3. Зеленые гексагональные кристаллы. tпл=1127°С, плотность равна 4,25 г/см3. Сублимируется при 927°С. Восстанавливается до CrBr2 водородом при нагревании. Разлагается щелочами и растворяется в воде только в присутствии солей хрома (II). Молярная электропроводность при бесконечном разведении при 25оС равна 435,3 см2/моль. Получают действием паров брома в присутствии азота на металлический хром или на смесь оксида хрома (III) с углем при высокой температуре.
Иодид хрома (III) CrI3. Фиолетово-черные кристаллы. Устойчив на воздухе при обычной температуре. При 200°С реагирует с кислородом с выделением йода. Растворяется в воде в присутствии солей хрома (II). Молярная электропроводность при бесконечном разведении при 25оС равна 431,4 см2/моль. Получают действием паров йода на нагретый до красного каления хром.
Оксифторид хрома (III) CrOF. Твердое зеленое вещество. Плотность равна 4,20 г/см3 [5]. Устойчив при повышенной температуре и разлагается при охлаждении. Получают действием фтороводорода на оксид хрома (III) при 1100оС.
Сульфид хрома (III) Cr2S3. Парамагнитные черные кристаллы. Плотность равна 3,60 г/см3. Гидролизуется водой. Плохо реагирует с кислотами, но окисляется азотной кислотой, царской водкой или расплавами нитратов щелочных металлов. Получают действием паров серы на металлический хром при температуре выше 700оС, сплавлением Cr2O3 с серой или K2S, пропусканием сероводорода над сильно нагретыми Cr2O3 или CrCl3.
Сульфат хрома (III) Cr2(SO4)3. Парамагнитные фиолетово-красные кристаллы. Плотность равна 3,012 г/см3. Безводный сульфат хрома (III) мало растворим в воде и кислотах. При высокой температуре разлагается. Водные растворы окрашены в фиолетовый цвет на холоду и в зеленый — при нагревании. Известны кристаллогидраты CrSО4•nН2О (n=3, 6, 9, 12, 14, 15, 17, 18). Молярная электропроводность при бесконечном разведении при 25оС равна 882 см2/моль. Получают дегидратацией кристаллогидратов или нагреванием Cr2O3 с метилсульфатом при 160-190оС. Применяют при дублении кож и в качестве протравы при крашении в ситценабивном производстве.
Ортофосфат хрома (III) CrPO4. Черный порошок. tпл=1800°С, плотность равна 2,94 г/см3. Мало растворим в воде. Медленно взаимодействует с горячей серной кислотой. Известны кристаллогидраты CrРО4•nН2О (n=2, 3, 4, 6). Молярная электропроводность при бесконечном разведении при 25оС равна 408 см2/моль. Получают дегидратацией кристаллогидратов.
Хромокалиевые квасцы K2SO4•Cr2(SO4)3•24H2O, темно-фиолетовые кристаллы, довольно хорошо растворимые в воде. Могут быть получены при выпаривании водного раствора, содержащего стехиометрическую смесь сульфатов калия и хрома, или восстановлением дихромата калия этанолом:
Cr2(SO4)3 + K2SO4 + 24H2O →K2SO4•Cr2(SO4)3•24H2O↓ (при выпаривании)
K2Cr2O7 + 3C2H5OH + 4H2SO4 + 17H2O→K2SO4•Cr2(SO4)3•24H2O↓ + 3CH3CHO
Хромокалиевые квасцы применяются главным образом в текстильной промышленности, при дублении кожи.
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетиком и обладает металлической проводимостью [9].
studfile.net
