общая характеристика, строение; свойства и получение — урок. Химия, 8–9 класс.
Алюминий как атом и химический элемент
Алюминий находится в \(IIIA\) группе Периодической системы химических элементов Д. И. Менделеева.
Строение электронной оболочки атома алюминия — 1s22s22p63s23p1.
На внешнем электронном уровне атом содержит \(3\) электрона.
Поэтому в своих соединениях алюминий всегда проявляет только одну степень окисления, равную \(+3\).
Обрати внимание!
По распространённости в земной коре алюминий находится на третьем месте после кислорода и кремния, а среди металлов — на первом.
В земной коре алюминий встречается только в составе соединений.
Основные природные минералы алюминия:
- боксит, состав которого можно примерно выразить формулой Al2O3 \(•\) xh3O,
- нефелин (Na,K)O2 \(•\) Al2O3 \(•\) 2h3O,
- каолинит Al2O3 \(•\) SiO2 \(•\) 2h3O.
Каолинит — образец многочисленных алюмосиликатов, включающих преимущественно атомы кремния и кислорода, которые очень широко распространены в природе.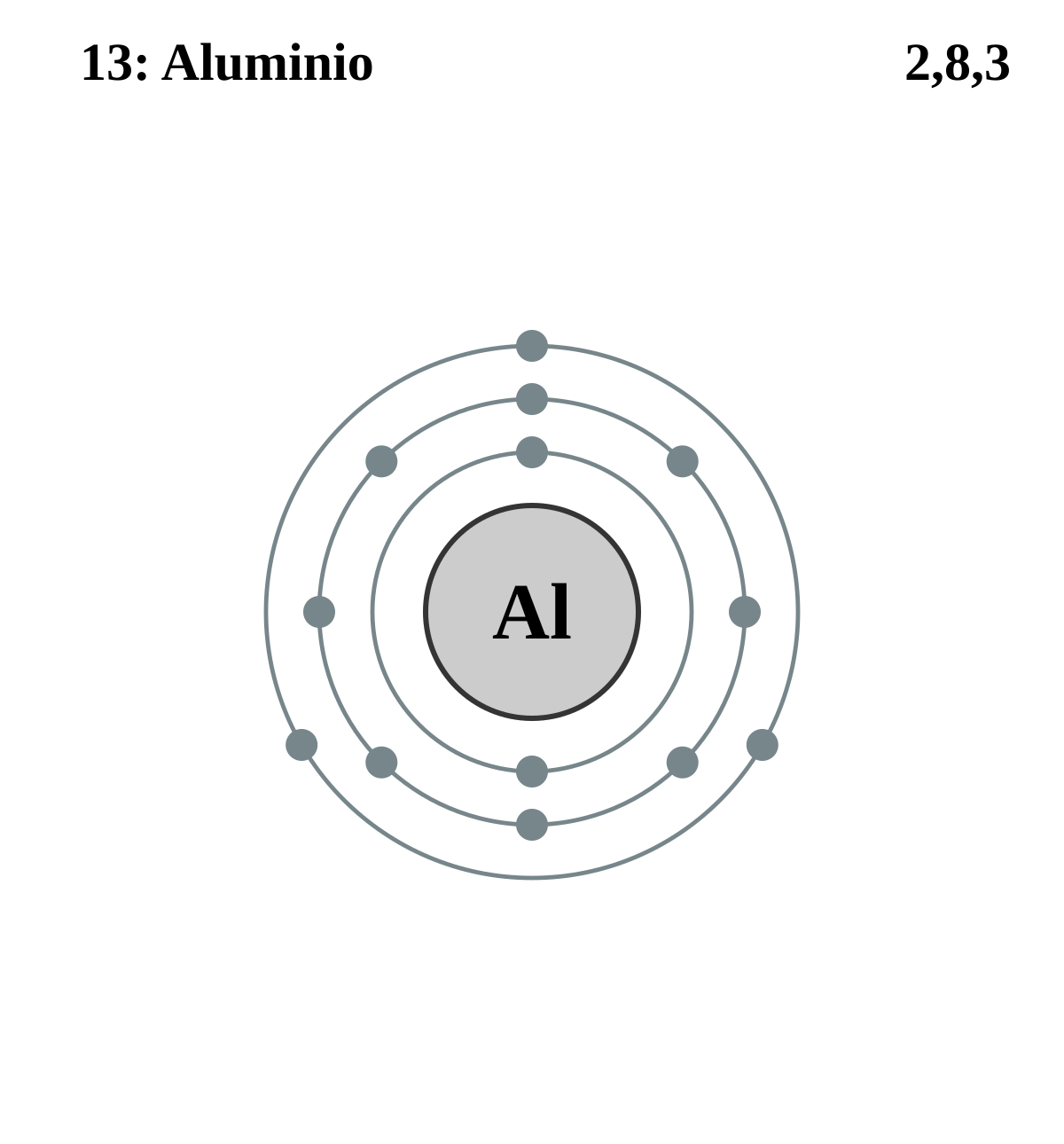
Физические свойства
В свободном состоянии алюминий — светлый блестящий металл, лёгкий, относительно мягкий, легкоплавкий, имеет высокую тепло- и электропроводность.
Алюминий является химически активным металлом, однако при обычных условиях он устойчив на воздухе и сохраняет свой металлический блеск длительное время. Это объясняется тем, что поверхность алюминия покрыта тонкой, невидимой глазу, прозрачной, но плотной плёнкой оксида алюминия, которая препятствует взаимодействию алюминия с компонентами атмосферы (парами воды и кислородом).
Свойства алюминия обусловили его широкое применение и необходимость получения алюминия в свободном виде.
В лабораторных условиях небольшое количество алюминия можно получить путём восстановления хлорида алюминия калием при высокой температуре:
AlCl3+3K=t3KCl+Al.
Так был впервые получен алюминий.
В промышленных условиях алюминий получают из бокситов. При нагревании бокситов образуется оксид алюминия. Восстановить алюминий из оксида с помощью традиционных восстановителей практически невозможно, поэтому его получают методом электролиза.
При этом на катоде восстанавливается алюминий, а на аноде — окисляется кислород.
Суммарная реакция электролиза выражается уравнением:
2Al2O3=4Al+3O2↑.
Общие сведения об алюминии и его атомарном строении
Нахождение в природе
Алюминий — химический элемент III группы Периодической
системы элементов Д.И. Менделеева. Вследствие высокой химической активности
алюминий в природе находится только в связанном виде. По содержанию в
земной коре он (в форме его соединений) занимает первое место среди металлов
— 8,13% и третье место после кислорода и кремния. По данным акад. А. Е.
Ферсмана, насчитывается более 250 минералов алюминия, которые преимущественно
сосредоточены вблизи поверхности земли, и более 40 % из них относится
к алюмосиликатам.
Е.
Ферсмана, насчитывается более 250 минералов алюминия, которые преимущественно
сосредоточены вблизи поверхности земли, и более 40 % из них относится
к алюмосиликатам.
Практически единственным методом получения металлического
алюминия является электролиз криолитоглиноземного расплава. Основное сырье
для этого процесса — глинозем (Al2О3) получают различными
гидрохимическими методами путем переработки минералов, содержащих соединения
алюминия.
Строение атома и кристаллическая решетка
В Периодической системе Д.И. Менделеева порядковый номер алюминия 13, его атомная масса составляет 26,9815 (по углероду 12С) и 26,98974 (по кислороду 16O).
Основным изотопом является 27Al, который
устойчив и состоит из 14 нейтронов и 13 протонов. Кроме одного изотопа
26Al, период полураспада которого равен 106 лет,
установлено существование еще шести изотопов с массовыми числами 23, 24,
25, 26, 28 и 29 и с малыми периодами полураспада (от 0,13 до 396с), а
также пренебрежимо малой распространенностью в природе (от 2×10
Кроме одного изотопа
26Al, период полураспада которого равен 106 лет,
установлено существование еще шести изотопов с массовыми числами 23, 24,
25, 26, 28 и 29 и с малыми периодами полураспада (от 0,13 до 396с), а
также пренебрежимо малой распространенностью в природе (от 2×10
Алюминий трехвалентен, и 13 его электронов распределены на электронных оболочках ls2, 2s2, 2р6, 3s2, 3р1. На внешнем электронном слое М находятся три валентных электрона: два на 3s-орбите с потенциалами ионизации 1800 и 2300 кДж/моль и один на 3

Кристаллическая решетка алюминия — гранецентрированный
куб, которая устойчива при температуре от 4°К до точки плавления. В алюминии
нет аллотропических превращений, т.е. его строение постоянно. Элементарная
ячейка состоит из четырех атомов размером 4,049596×10
Химическая активность
Алюминий обладает большой химической активностью, энергия
образования его соединений с кислородом, серой и углеродом весьма велика.
В ряду напряжений он находится среди наиболее электроотрицательных элементов,
и его нормальный электродный потенциал равен -1,67 В.
Расплавленный алюминий активно реагирует с оксидом и диоксидом углерода и парами воды. Наибольший интерес представляет растворимость водорода в алюминии, так как присутствие водорода в металле негативно влияет на механические свойства алюминия и его сплавов. Водород в алюминии в количествах, превосходящих растворимость в твердом состоянии, рассматривается как вредная примесь.
Алюминий обладает амфотерными свойствами, т. е.
реагируя с кислотами, образует соответствующие соли, а при взаимодействии
с щелочами — алюминаты. Эта особенность существенно расширяет возможности
извлечения алюминия из руд различного состава. Алюминий растворяется в
серной и соляной кислотах, а также в щелочах, но концентрированная азотная
и органическая кислоты на алюминий не действуют.
е.
реагируя с кислотами, образует соответствующие соли, а при взаимодействии
с щелочами — алюминаты. Эта особенность существенно расширяет возможности
извлечения алюминия из руд различного состава. Алюминий растворяется в
серной и соляной кислотах, а также в щелочах, но концентрированная азотная
и органическая кислоты на алюминий не действуют.
Алюминий. Химия алюминия и его соединений
1. Положение алюминия в периодической системе химических элементов
2. Электронное строение алюминия
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой
7.1.3. Взаимодействие с фосфором
7.1.4. Взаимодействие с азотом
7.
 1.5. Взаимодействие с углеродом
1.5. Взаимодействие с углеродом7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с водой
7.2.2. Взаимодействие с минеральными кислотами
7.2.3. Взаимодействие с серной кислотой
7.2.4. Взаимодействие с азотной кислотой
7.2.5. Взаимодействие с щелочами
7.2.6. Взаимодействие с окислителями
Оксид алюминия
1. Способы получения
2.1. Взаимодействие с основными оксидами
2.2. Взаимодействие с основаниями
2.3. Взаимодействие с водой
2.4. Взаимодействие с кислотными оксидами
2.5. Взаимодействие с кислотами
2.6. Взаимодействие с восстановителями
2.7. Вытеснение более летучих оксидов из солей
Гидроксид алюминия
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с кислотами
2.2. Взаимодействие с кислотными оксидами
2.3. Взаимодействие с щелочами
2.4. Разложение при нагревании
Соли алюминия
Бинарные соединения алюминия
Алюминий
Положение в периодической системе химических элементов
Алюминий расположен в  И. Менделеева.
И. Менделеева.
Электронное строение алюминия и свойства
Электронная конфигурация алюминия в основном состоянии:
+13Al 1s22s22p63s23p1 1s 2s 2p 3s 3p
Электронная конфигурация алюминия в возбужденном состоянии:
+13Al* 1s2
Алюминий проявляет парамагнитные свойства. Алюминий на воздухе быстро образует прочные оксидные плёнки, защищающие поверхность от дальнейшего взаимодействия, поэтому устойчив к коррозии.
Физические свойства
Алюминий – лёгкий металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.
Обладает высокой тепло- и электропроводностью.
Температура плавления 660оС, температура кипения 1450оС, плотность алюминия 2,7 г/см
Алюминий — один из наиболее ценных цветных металлов для вторичной переработки. На протяжении последних лет, цена на лом алюминия в пунктах приема непреклонно растет. По ссылке можно узнать о том, как сдать лом алюминия.
Нахождение в природе
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния). Содержание в земной коре — около 8%.
В природе алюминий встречается в виде соединений:
Бокситы Al2O3 · H2O (с примесями SiO2, Fe2O3, CaCO3) — гидрат оксида алюминия.
Корунд Al2O3. Красный корунд называют рубином, синий корунд называют сапфиром.
Способы получения
Алюминий образует прочную химическую связь с кислородом. Поэтому традиционные способы получения алюминия восстановлением из оксида протекают требуют больших затрат энергии. Для промышленного получения алюминия используют процесс Холла-Эру. Для понижения температуры плавления оксид алюминия растворяют в расплавленном криолите (при температуре 960-970оС) Na3AlF6, а затем подвергают электролизу с углеродными электродами. При растворении в расплаве криолита оксид алюминия распадается на ионы:
Al2O3 → Al3+ + AlO33-
На катоде происходит восстановление ионов алюминия:
Катод: Al3+ +3e → Al0
На аноде происходит окисление алюминат-ионов:
Анод: 4AlO33- — 12e → 2Al2O3 + 3O2
Суммарное уравнение электролиза расплава оксида алюминия:
2Al2O3 → 4Al + 3O2
Лабораторный способ получения алюминия заключается в восстановлении алюминия из безводного хлорида алюминия металлическим калием:
AlCl3 + 3K → Al + 3KCl
Качественные реакции
Качественная реакция на ионы алюминия — взаимодействие избытка солей алюминия с щелочами. При этом образуется белый аморфный осадок гидроксида алюминия.
При этом образуется белый аморфный осадок гидроксида алюминия.
Например, хлорид алюминия взаимодействует с гидроксидом натрия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
При дальнейшем добавлении щелочи амфотерный гидроксид алюминия растворяется с образованием тетрагидроксоалюмината:
Al(OH)3 + NaOH = Na[Al(OH)4]
Обратите внимание, если мы поместим соль алюминия в избыток раствора щелочи, то белый осадок гидроксида алюминия не образуется, т.к. в избытке щелочи соединения алюминия сразу переходят в комплекс:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Соли алюминия можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей алюминия с водным раствором аммиака также выпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl
Al3+ + 3NH3·H2O = Al(OH)3 ↓ + 3NH4+
Видеоопыт взаимодействия раствора хлорида алюминия с раствором аммиака можно посмотреть здесь.
Химические свойства
1. Алюминий – сильный восстановитель. Поэтому он реагирует со многими неметаллами.
1.1. Алюминий реагируют с галогенами с образованием галогенидов:
2Al + 3I2 → 2AlI3
1.2. Алюминий реагирует с серой с образованием сульфидов:
2Al + 3S → Al2S3
1. 3. Алюминий реагируют с фосфором . При этом образуются бинарные соединения — фосфиды:
3. Алюминий реагируют с фосфором . При этом образуются бинарные соединения — фосфиды:
Al + P → AlP
1.4. С азотом алюминий реагирует при нагревании до 1000оС с образованием нитрида:
2Al + N2 → 2AlN
1.5. Алюминий реагирует с углеродом с образованием карбида алюминия:
4Al + 3C → Al4C3
1.6. Алюминий взаимодействует с кислородом с образованием оксида:
4Al + 3O2 → 2Al2O3
Видеоопыт взаимодействия алюминия с кислородом воздуха (горение алюминия на воздухе) можно посмотреть здесь.
2. Алюминий взаимодействует со сложными веществами:
2. 1. Реагирует ли алюминий с водой? Ответ на этот вопрос вы без труда найдете, если покопаетесь немного в своей памяти. Наверняка хотя бы раз в жизни вы встречались с алюминиевыми кастрюлями или алюминиевыми столовыми приборами. Такой вопрос я любил задавать студентам на экзаменах. Что самое удивительное, ответы я получал разные — у кого-то алюминий таки реагировал с водой. И очень, очень многие сдавались после вопроса: «Может быть, алюминий реагирует с водой при нагревании?» При нагревании алюминий реагировал с водой уже у половины респондентов))
1. Реагирует ли алюминий с водой? Ответ на этот вопрос вы без труда найдете, если покопаетесь немного в своей памяти. Наверняка хотя бы раз в жизни вы встречались с алюминиевыми кастрюлями или алюминиевыми столовыми приборами. Такой вопрос я любил задавать студентам на экзаменах. Что самое удивительное, ответы я получал разные — у кого-то алюминий таки реагировал с водой. И очень, очень многие сдавались после вопроса: «Может быть, алюминий реагирует с водой при нагревании?» При нагревании алюминий реагировал с водой уже у половины респондентов))
Тем не менее, несложно понять, что алюминий все-таки с водой в обычных условиях (да и при нагревании) не взаимодействует. И мы уже упоминали, почему: из-за образования оксидной пленки. А вот если алюминий очистить от оксидной пленки (например, амальгамировать), то он будет взаимодействовать с водой очень активно с образованием гидроксида алюминия и водорода:
2Al0 + 6H2+O → 2Al+3(OH)3 + 3H20
Амальгаму алюминия можно получить, выдержав кусочки алюминия в растворе хлорида ртути (II):
3HgCl2 + 2Al → 2AlCl3 + 3Hg
Видеоопыт взаимодействия амальгамы алюминия с водой можно посмотреть здесь.
2.2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль и водород.
Например, алюминий бурно реагирует с соляной кислотой:
2Al + 6HCl = 2AlCl3 + 3H2↑
2.3. При обычных условиях алюминий не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат алюминия и вода:
2Al + 6H2SO4(конц.) → Al2(SO4)3 + 3SO2 + 6H2O
2.4. Алюминий не реагирует с концентрированной азотной кислотой также из-за пассивации.
С разбавленной азотной кислотой алюминий реагирует с образованием молекулярного азота:
10Al + 36HNO3 (разб) → 3N2 + 10Al(NO3)3 + 18H2O
При взаимодействии алюминия в виде порошка с очень разбавленной азотной кислотой может образоваться нитрат аммония:
8Al + 30HNO3(оч.разб.) → 8Al(NO3)3 + 3NH4NO3 + 9H2O
2.5. Алюминий – амфотерный металл, поэтому он взаимодействует с щелочами. При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑
Видеоопыт взаимодействия алюминия со щелочью и водой можно посмотреть здесь.
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода:
2Al + 6NaOH → 2Na3AlO3 + 3H2 ↑
Эту же реакцию можно записать в другом виде (в ЕГЭ рекомендую записывать реакцию именно в таком виде):
2Al + 6NaOH → 2NaAlO2 + 3H2↑ + 2Na2O
2.6. Алюминий восстанавливает менее активные металлы из оксидов. Процесс восстановления металлов из оксидов называется алюмотермия.
Например, алюминий вытесняет медь из оксида меди (II). Реакция очень экзотермическая:
2Al + 3CuO → 3Cu + Al2O3
Еще пример: алюминий восстанавливает железо из железной окалины, оксида железа (II, III):
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами в щелочной среде, перманганатами, соединениями хрома (VI):
2Al + 3Na2O2 → 2NaAlO2 + 2Na2O
8Al + 3KNO3 + 5KOH + 18H2O → 8K[Al(OH)4] + 3NH3
10Al + 6KMnO4 + 24H2SO4 → 5Al2(SO4)3 + 6MnSO4 + 3K2SO4 + 24H2O
2Al + NaNO2 + NaOH + 5H2O → 2Na[Al(OH)4] + NH3
Al + 3KMnO4 + 4KOH → 3K2MnO4 + K[Al(OH)4]
4Al + K2Cr2O7 → 2Cr + 2KAlO2 + Al2O3
Оксид алюминия
Способы получения
Оксид алюминия можно получить различными методами:
1. Горением алюминия на воздухе:
Горением алюминия на воздухе:
4Al + 3O2 → 2Al2O3
2. Разложением гидроксида алюминия при нагревании:
2Al(OH)3 → Al2O3 + 3H2O
3. Оксид алюминия можно получить разложением нитрата алюминия:
4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
Химические свойства
Оксид алюминия — типичный амфотерный оксид. Взаимодействует с кислотными и основными оксидами, кислотами, щелочами.
1. При взаимодействии оксида алюминия с основными оксидами образуются соли-алюминаты.
Например, оксид алюминия взаимодействует с оксидом натрия:
Na2O + Al2O3 → 2NaAlO2
2. Оксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли. При этом оксид алюминия проявляет кислотные свойства.
Оксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли. При этом оксид алюминия проявляет кислотные свойства.
Например, оксид алюминия взаимодействует с гидроксидом натрия в расплаве с образованием алюмината натрия и воды:
2NaOH + Al2O3 → 2NaAlO2 + H2O
Оксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
3. Оксид алюминия не взаимодействует с водой.
4. Оксид алюминия взаимодействует с кислотными оксидами (сильных кислот). При этом образуются соли алюминия. При этом оксид алюминия проявляет основные свойства.
Оксид алюминия взаимодействует с кислотными оксидами (сильных кислот). При этом образуются соли алюминия. При этом оксид алюминия проявляет основные свойства.
Например, оксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
Al2O3 + 3SO3 → Al2(SO4)3
5. Оксид алюминия взаимодействует с растворимыми кислотами с образованием средних и кислых солей.
Например, оксид алюминия реагирует с серной кислотой:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
6. Оксид алюминия проявляет слабые окислительные свойства.
Например, оксид алюминия реагирует с гидридом кальция с образованием алюминия, водорода и оксида кальция:
Al2O3 + 3CaH2 → 3CaO + 2Al + 3H2
Электрический ток восстанавливает алюминий из оксида (производство алюминия):
2Al2O3 → 4Al + 3O2
7. Оксид алюминия — твердый, нелетучий. А следовательно, он вытесняет более летучие оксиды (как правило, углекислый газ) из солей при сплавлении.
Например, из карбоната натрия:
Al2O3 + Na2CO3 → 2NaAlO2 + CO2
Гидроксид алюминия
Способы получения
1. Гидроксид алюминия можно получить действием раствора аммиака на соли алюминия.
Гидроксид алюминия можно получить действием раствора аммиака на соли алюминия.
Например, хлорид алюминия реагирует с водным раствором аммиака с образованием гидроксида алюминия и хлорида аммония:
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl
2. Пропусканием углекислого газа, сернистого газа или сероводорода через раствор тетрагидроксоалюмината натрия:
Na[Al(OH)4] + СО2 = Al(OH)3 + NaНCO3
Чтобы понять, как протекает эта реакция, можно использовать несложный прием: мысленно разбить сложное вещество Na[Al(OH)4] на составные части: NaOH и Al(OH)3. Далее мы определяем, как реагирует углекислый газ с каждым из этих веществ, и записываем продукты их взаимодействия. Т.к. Al(OH)3 не реагирует с СО2, то мы записываем справа Al(OH)3 без изменения.
Т.к. Al(OH)3 не реагирует с СО2, то мы записываем справа Al(OH)3 без изменения.
3. Гидроксид алюминия можно получить действием недостатка щелочи на избыток соли алюминия.
Например, хлорид алюминия реагирует с недостатком гидроксида калия с образованием гидроксида алюминия и хлорида калия:
AlCl3 + 3KOH(недост.) = Al(OH)3↓+ 3KCl
4. Также гидроксид алюминия образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, сульфитами и сульфидами. Сульфиды, карбонаты и сульфиты алюминия необратимо гидролизуются в водном растворе.
Например: бромид алюминия реагирует с карбонатом натрия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется бромид натрия:
2AlBr3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 3CO2↑ + 6NaBr
Хлорид алюминия реагирует с сульфидом натрия с образованием гидроксида алюминия, сероводорода и хлорида натрия:
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S↑ + 6NaCl
Химические свойства
1. Гидроксид алюминия реагирует с растворимыми кислотами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
Гидроксид алюминия реагирует с растворимыми кислотами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов и типа соли.
Например, гидроксид алюминия взаимодействует с азотной кислотой с образованием нитрата алюминия:
Al(OH)3 + 3HNO3 → Al(NO3)3 + 3H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Al(OH)3 + 3HBr → AlBr3 + 3H2O
2. Гидроксид алюминия взаимодействует с кислотными оксидами сильных кислот.
Например, гидроксид алюминия взаимодействует с оксидом серы (VI) с образованием сульфата алюминия:
2Al(OH)3 + 3SO3 → Al2(SO4)3 + 3H2O
3. Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли. При этом гидроксид алюминия проявляет кислотные свойства.
Гидроксид алюминия взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—алюминаты, а в растворе – комплексные соли. При этом гидроксид алюминия проявляет кислотные свойства.
Например, гидроксид алюминия взаимодействует с гидроксидом калия в расплаве с образованием алюмината калия и воды:
2KOH + Al(OH)3 → 2KAlO2 + 2H2O
Гидроксид алюминия растворяется в избытке щелочи с образованием тетрагидроксоалюмината:
Al(OH)3 + KOH → K[Al(OH)4]
4. Гидроксид алюминия разлагается при нагревании:
2Al(OH)3 → Al2O3 + 3H2O
Видеоопыт взаимодействия гидроксида алюминия с соляной кислотой и щелочами (амфотерные свойства гидроксида алюминия) можно посмотреть здесь.
Соли алюминия
Нитрат и сульфат алюминия
Нитрат алюминия при нагревании разлагается на оксид алюминия, оксид азота (IV) и кислород:
4Al(NO3)3 → 2Al2O3 + 12NO2 + 3O2
Сульфат алюминия при сильном нагревании разлагается аналогично — на оксид алюминия, сернистый газ и кислород:
2Al2(SO4)3 → 2Al2O3 + 6SO2 + 3O2
Комплексные соли алюминия
Для описания свойств комплексных солей алюминия — гидроксоалюминатов, удобно использоваться следующий прием: мысленно разбейте тетрагидроксоалюминат на две отдельные молекулы — гидроксид алюминия и гидроксид щелочного металла.
Например, тетрагидроксоалюминат натрия разбиваем на гидроксид алюминия и гидроксид натрия:
Na[Al(OH)4] разбиваем на NaOH и Al(OH)3
Свойства всего комплекса можно определять, как свойства этих отдельных соединений.
Таким образом, гидроксокомплексы алюминия реагируют с кислотными оксидами.
Например, гидроксокомплекс разрушается под действием избытка углекислого газа. При этом с СО2 реагирует NaOH с образованием кислой соли (при избытке СО2), а амфотерный гидроксид алюминия не реагирует с углекислым газом, следовательно, просто выпадает в осадок:
Na[Al(OH)4] + CO2 → Al(OH)3↓ + NaHCO3
Аналогично тетрагидроксоалюминат калия реагирует с углекислым газом:
K[Al(OH)4] + CO2 → Al(OH)3 + KHCO3
По такому же принципу тетрагидроксоалюминаты реагирует с сернистым газом SO2:
Na[Al(OH)4] + SO2 → Al(OH)3↓ + NaHSO3
K[Al(OH)4] + SO2 → Al(OH)3 + KHSO3
А вот под действием избытка сильной кислоты осадок не выпадает, т.к. амфотерный гидроксид алюминия реагирует с сильными кислотами.
Например, с соляной кислотой:
Na[Al(OH)4] + 4HCl(избыток) → NaCl + AlCl3 + 4H2O
Правда, под действием небольшого количества (недостатка) сильной кислоты осадок все-таки выпадет, для растворения гидроксида алюминия кислоты не будет хватать:
Na[Al(OH)4] + НCl(недостаток) → Al(OH)3↓ + NaCl + H2O
Аналогично с недостатком азотной кислоты выпадает гидроксид алюминия:
Na[Al(OH)4] + HNO3(недостаток) → Al(OH)3↓ + NaNO3 + H2O
Комплекс разрушается при взаимодействии с хлорной водой (водным раствором хлора) Cl2:
2Na[Al(OH)4] + Cl2 → 2Al(OH)3↓ + NaCl + NaClO + H2O
При этом хлор диспропорционирует.
Также комплекс может прореагировать с избытком хлорида алюминия. При этом выпадает осадок гидроксида алюминия:
AlCl3 + 3Na[Al(OH)4] → 4Al(OH)3↓ + 3NaCl
Если выпарить воду из раствора комплексной соли и нагреть образующееся вещество, то останется обычная соль-алюминат:
Na[Al(OH)4] → NaAlO2 + 2H2O↑
K[Al(OH)4] → KAlO2 + 2H2O
Гидролиз солей алюминия
Растворимые соли алюминия и сильных кислот гидролизуются по катиону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
I ступень: Al3+ + H2O = AlOH2+ + H+
II ступень: AlOH2+ + H2O = Al(OH)2+ + H+
III ступень: Al(OH)2+ + H2O = Al(OH)3 + H+
Однако сульфиды, сульфиты, карбонаты алюминия и их кислые соли гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
Al2(SO4)3 + 6NaHSO3 → 2Al(OH)3 + 6SO2 + 3Na2SO4
2AlBr3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + CO2↑ + 6NaBr
2Al(NO3)3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 6NaNO3 + 3CO2↑
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 6NaCl + 3CO2↑
Al2(SO4)3 + 3K2CO3 + 3H2O → 2Al(OH)3↓ + 3CO2↑ + 3K2SO4
2AlCl3 + 3Na2S + 6H2O → 2Al(OH)3 + 3H2S↑ + 6NaCl
Более подробно про гидролиз можно прочитать в соответствующей статье.
Алюминаты
Соли, в которых алюминий является кислотным остатком (алюминаты) — образуются из оксида алюминия при сплавлении с щелочами и основными оксидами:
Al2O3 + Na2O → 2NaAlO2
Для понимания свойств алюминатов их также очень удобно разбить на два отдельных вещества.
Например, алюминат натрия мы разделим мысленно на два вещества: оксид алюминия и оксид натрия.
NaAlO2 разбиваем на Na2O и Al2O3
Тогда нам станет очевидно, что алюминаты реагируют с кислотами с образованием солей алюминия:
KAlO2 + 4HCl → KCl + AlCl3 + 2H2O
NaAlO2 + 4HCl → AlCl3 + NaCl + 2H2O
NaAlO2 + 4HNO3 → Al(NO3)3 + NaNO3 + 2H2O
2NaAlO2 + 4H2SO4 → Al2(SO4)3 + Na2SO4 + 4H2O
Под действием избытка воды алюминаты переходят в комплексные соли:
KAlO2 + H2O = K[Al(OH)4]
NaAlO2 + 2H2O = Na[Al(OH)4]
Бинарные соединения
Сульфид алюминия под действием азотной кислоты окисляется до сульфата:
Al2 S3 + 8HNO3 → Al2(SO4)3 + 8NO2 + 4H2O
либо до серной кислоты (под действием горячей концентрированной кислоты):
Al2 S3 + 30HNO3(конц. гор.) → 2Al(NO3)3 + 24NO2 + 3H2SO4 + 12H2O
Сульфид алюминия разлагается водой:
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑
Карбид алюминия также разлагается водой при нагревании на гидроксид алюминия и метан:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4
Нитрид алюминия разлагается под действием минеральных кислот на соли алюминия и аммония:
AlN + 4HCl → AlCl3 + NH4Cl
Также нитрид алюминия разлагается под действием воды:
AlN + 3H2O → Al(OH)3↓ + NH3
Алюминий строение и связь — Справочник химика 21
Алюминий — основной представитель металлов главной подгруппы III группы периодической системы химических элементов Д. И. Менделеева. Атомный номер 13, относительная атомная масса 26,98154. У алюминия единственный устойчивый изотоп А1. Свойства аналогов алюминия — галлия, индия и таллия — во многом напоминают свойства алюминия. Этому причина — одинаковое строение внешнего электронного слоя элементов — s p, вследствие которого все они проявляют степень окисления +3. Другие степени окисления нехарактерны, за исключением соединений одновалентного таллия, по свойствам близким к соединениям элементов I группы. В связи с этим будут рассмотрены свойства только одного элемента — алюминия и его соединений. [c.150]Если сравнить химический состав Земли с составом Вселенной, то, казалось бы, между ними не должно быть существенных различий, за исключением, пожалуй, водорода, который легко уходит из атмосферы в межпланетное пространство. К сожалению, судить о составе Земли можно лишь по составам атмосферы, гидросферы и земной коры, изученной в глубину не более чем на 20 км. Главная химическая особенность этих трех сфер — необычайно высокое содержание кислорода, что объясняется уже не строением ядер его атомов, а его химическими свойствами. Атомы кислорода способны образовывать прочные химические связи с атомами многих элементов, в том числе кремния и алюминия. В процессе образования земной коры эти элементы накапливались в ней благодаря легкоплавкости их соединений со щелочами. В итоге на поверхности нашей планеты выкристаллизовалась твердая кремнекислородная оболочка. Кислород, не считая воды, входит в состав 1364 минералов. В атмосфере кислород появился около 1,8 млрд. лет назад в результате действия на минералы микроорганизмов. В настоящее время выделение кислорода растениями за счет фотосинтеза возмещает его убыль в атмосфере в ходе процессов окисления, горения, гниения, дыхания. По числу известных природных соединении (432) второе место занимает кремний. Далее по распространенности атомов в земной коре следуют алюминий, натрий, железо, кальций, магний и калий [c.201]
Различные типы адсорбентов проявляют неодинаковую селективность по отношению к различным соединениям. Трудно установить прямую связь между адсорбируемостью вещества и его химическим строением, а также между химическим строением адсорбента и его адсорбционной емкостью. Поэтому общепринятым считается деление адсорбентов на две основные группы полярные (гидрофильные) — силикагель, оксид алюминия, искусственные и природные силикаты неполярные (гидрофобные) — активированный уголь, кизельгур, диатомит. На полярном адсорбенте энергия адсорбции возрастает с увеличением размеров молекул адсорбированного вещества, причем энергия адсорбции тем выше, чем больше полярность адсорбированного вещества. Неполярные адсорбенты не проявляют селективности по отношению к полярным молекулам. [c.54]
Органические сульфиды образуют стабильные комплексные соединения с галогенами, органическими галоидпроизводными, галогенидами — тяжелых металлов и некоторыми другими веществами. Природа сил взаимодействия при комплексообразовании сульфидов с этими соединениями изучена недостаточно. Полагают [47], что донорно-акцепторная связь осуществляется за счет передачи неподеленной пары электронов атома серы на свободную валентную орбиталь атома металла (ртути, алюминия, олова, титана и др.). На структуру и свойства комплексных соединений влияют условия их образования, химическое строение сульфида и соединения, вступающего с ним в реакцию [48]. При взаимодействии сульфидов с бромом или иодом иногда образуются кристаллические комплексные соединения, а при взаимодействии с йодистыми алкилами и галогенированными жирными кислотами — кристаллические сульфониевые соли. Наиболее стабильны комплексные соединения сульфидов с галогенидами ртути, ацетатом ртути, солями платины, олова, титана, палладия, алюминия. В зависимости от химического строения и условий комплексообразования сульфиды могут присоединять различное число молекул одного и того же комплексообразователя (акцептора). [c.118]
Практически все известные для этиленовых соединений реакции электрофильного присоединения можно провести и с ацетиленовыми углеводородами и их производными. Однако вследствие большей электроотрицательности 5 г7-гибридных атомов углерода ацетилена я-электроны тройной связи более жестко связаны с ядрами, чем в этилене. На это, в частности, указывают значения потенциалов ионизации двойной (10,50 эВ) и тройной (11,40 эВ) связей. Электро-нодонорные свойства тройной связи ниже, чем у двойной, поэтому ацетиленовые соединения вступают в реакции с электрофилами примерно в 10 раз труднее, чем близкие нм по строению этиленовые. Для ускорения этих реакций рекомендуется применение катализаторов. Наиболее часто используются апротонные кислоты (галоге-ниды алюминия, бора, меди н ртути) [c.118]
Органические соединения остальных переходных элементов. Переходные элементы остальных (кроме ПБ) побочных подгрупп периодической системы в проявляемых их атомами степенях окисления имеют незавершенные электронные -подоболочки предвнешнего уровня. Поэтому, наряду с образованием ординарной полярной ковалентной связи с углеродом за счет вклада внешних з- и р-орбиталей, они способны образовывать совершенно иные по строению и свойствам соединения за счет участия ( -орбиталей. В таких соединениях металл можно так же, как и соединения магния, бора, алюминия (см. выше), считать координационно ненасыщенным. Данная ненасыщенность металла теперь определяется наличием вакантных орбиталей не только на внешнем, но и на втором снаружи энергетических уровнях его атома. Природа вакантных орбиталей атома переходного элемента также отличается от орбиталей в- и р-элементов. Симметрия и пространственная протяженность -орбиталей переходного элемента позволяет им эффективно перекрываться с орбиталями большего числа атомов и удаленных на большее расстояние от металла, чем это возможно для з-или р-элемента. Поэтому часто органические соединения переходных металлов являются комплексными. С примерами таких комплексных элементоорганических соединений мы уже встречались ферроцен, дибензолхром, хелаты и др. (разд. 13.4). [c.599]
Хлористый алюминий катализирует самые разнообразные реакции, и его каталитическое действие обычно объясняют образованием либо карбониевых ионов, либо комплексных соединений с участием реагирующих веществ. О составе и строении таких комплексов имеется обширная литература [360, 322]. Коршак и Лебедев [361] объясняют каталитический эффект хлористого алюмииия образованием тройных комплексов (а) между углеводородом, галоидопроизводным и галидом алюминия . Перемещение связей в этих комплексах приводит к распаду последних и образованию продуктов реакции [c.551]
Еще будучи студентом третьего курса, В. С. Гутыри под руководством доцента Е. Познера участвовал в научно-исследовательских работах лаборатории количественного анализа АКИМ им. М. А. Азизбекова. Первая его публикация посвящена применению газообразного аммиака для количественного определения алюминия (1932 г.). Позднее он занимался изучением строения органических соединений, что нашло отражение в ряде статей, посвященных вопросам пространственных форм углеродного тетраэдра, строения молекулы бензола, структуры поливалентных связей, зависимости структурных констант молекулярной рефракции и парахора от характера связей. [c.4]
Окись алюминия является стабильным катализатором — в отличие от алюмосиликата и фторированной окиси алюминия она слабо катализирует реакции крекинга и полимеризации и не дезактивируется за счет этих процессов. Каталитическая активность окиси алюминия связана с ее строением. Используя различную гидроокись алюминия, ее дегидратацией при разных температурах получают семь модификаций окиси алюминия (Х-, х-, у-, 6-, т)-, 6- и а) [14] [c.146]
Полимерными соединениями, или полимерами, называют вещества, молекулы которых состоят из многочисленных элементарных звеньев одинаковой структуры. Элементарные структурные звенья соединены между собой ковалентными связями в длинные цепи линейного или разветвленного строения или же образуют эластичные или жесткие пространственные решетки. Своеобразно построенные, гигантские по размерам молекулы полимерных соединений обычно называют макромолекулами. Основная цепь макромолекул органических полимеров состоит из атомов углерода, иногда с чередованием атомов кислорода, серы, азота, фосфора. В макромолекуляр-ную цепь могут быть введены атомы кремния, титана, алюминия и других элементов, не содержащихся в природных органических соединениях. [c.9]
Из сказанного выше вытекает, что кристаллическое состояние является важным и интересным для изучения, но все-таки одним из частных состояний твердого вещества. Не менее важно и интересно не периодическое, но регулярное состояние вещества. В подобном состоянии находятся высокомолекулярные, в частности, белковые вещества. При таком взгляде на твердое вещество кристаллическая решетка перестает быть основой для его изучения. И все наше внимание сосредоточивается на остове твердого вещества, тем более, что, как отмечалось выше, в отличие от абстрактной кристаллической решетки остов — реальный объект — непрерывная цепь, сеть или каркас, построенные из атомов, соединенных атомными связями. Остов может быть выделен в свободном состоянии, если в него входит достаточное количество вещества, равное, как, например, показывает опыт выделения кремнекислородных и углеродных остовов, по крайней мере 40% массы исходного твердого соединения. Остов — это носитель дальнего порядка, задаваемого межатомным взаимодействием. Отсюда следует, что изучение химического строения, конструирование и сборка атомных моделей вещества — старые надежные методы химического исследования — являются главными методами изучения твердого вещества. Вместе с тем настало время для конструирования и химической сборки твердых веществ и притом не только сравнительно простых, но и самых сложных веществ, в том числе различных материалов. При этом, конечно, следует руководствоваться не только химическими соображениями. Необходимо принимать также в расчет выводы теории устойчивости и прочности материала. Эта теория целиком основывается на учете межатомного и межмолекулярного взаимодействия и химического строения. Например, жесткость материала характеризуется модулем Юнга Е. При этом исходят из того, что, нагружая твердое вещество, мы действуем непосредственно на его межатомные связи. Отсюда ясно, что различие величины Е для разных веществ обусловлено различием жесткости самих химических связей. Модуль Юнга равен для алюминия всего 0,8-10 кГ/мм , для сапфира—4-10 а для алмаза 12-Ю кГ/мм . Именно исключительная прочность и жесткость связей С — С в алмазе делает его самым твердым и жестким из твердых веществ. [c.243]
Одинаковое строение внешней электронной оболочки атома бора и алюминия обусловливает сходство в свойствах этих элементов. Так, для алюминия, как и для бора, характерна только степень окисления +3. Однако при переходе от бора к алюминию сильно возрастает радиус атома (от 91 до 143 пм) и, кроме того, появляется еще один промежуточный восьмиэлектронный слой, экранирующий ядро. Все это приводит к ослаблению связи внешних электронов с ядром и к уменьшению энергии ионизации атома (см. табл. 15.2). Поэтому у алюминия металлические свойства выражены гораздо сильнее, чем у бора. Тем не менее химические связи, образуемые алюминием с другими элементами, имеют в основном ковалентный характер. [c.400]
Разнообразны и сложны а т о м н о — м о л е к у л я р н ы е соединения, в которых структурные единицы связаны межмолекулярными и межатомными связями. К ним относятся обезвоживаемые гидроксиды алюминия, цинка, титана и других d-элементов (см. 1.11). Образующаяся при этом твердая фаза в зависимости от условий дегидратации имеет переменный состав, включает в себя ряды твердых веществ, близких по составу, строению и массе. В пределах таких рядов близких химических соединений, мало отличающихся по составу и стехиометрии, кристаллическая структура может сохраняться — образуется область гомогенности (см. 1.7), имеет место перерыв в непрерывности . [c.137]
Кристаллическую решетку способны достраивать не только ионы, входящие в состав решетки, но и изоморфные с ними. При этом прочную связь с поверхностью кристалла могут образовывать не только ионы, входящие в кристаллическую решетку, но и атомные группы, близкие по строению к атомным группам, находящимся на поверхности кристалла. Так, гидроксиды алюминия и железа прочно связывают группы, содержащие кислород. [c.272]
Каждый из указанных классов подразделяется на отдельные группы в зависимости от строения главной цепи, наличия в ней кратных связей, количества и природы заместителей и боковых цепей. Гетероцепные соединения классифицируют, кроме того, с учетом природы и количества гетероатомов, а элементорганические соединения в зависимости от сочетания углеводородных звеньев —с атомами кремния, титана, алюминия и др. [c.167]
Бор и алюминий — элементы III группы периодической системы. Однако строение их атомов определяет значительные различия в химических свойствах этих элементов. Радиус атома бора (0,91 А) меньше радиуса атома алюминия (1,43 А). Ионизационные потенциалы бора больше соответствующих потенциалов алюминия следовательно, способность отдавать электроны у бора меньше, чем у алюминия. Еще в большей степени отличаются величины радиусов ионов этих элементов = 0,20 А, = 0,57 А. Поэтому величина напряженности ионного поля (частное от деления ааряда иона на квадрат его радиуса) у бора значительна больше. Вследствие этого связи Э — О у бора и алюминия различные. Связи В — О имеют малую степень ионности и обладают основнымн признаками ковалентных связей. Бор [c.138]
Нельзя писать структурную формулу МаС1 как Ма—С1. В кристалле поваренной соли молекулы отсутствуют. В узлах кристаллической решетки соли расположены ионы N3+ и С1 , причем каждый ион натрия окружен шестью ионами хлора, и наоборот. В этом случае формула Ыа—С1 не отражает действительного расположения ионов в молекуле, а потому она не является структурной формулой. То же можно сказать и о всех соединениях, которые имеют ионные кристаллические решетки (окислы металлов, основания, соли). Так, формула 0 = А1— —О—А1 = 0 также не является структурной это ионное соединение. В кристаллической решетке АЬОз тоже отсутствуют молекулы. Написанная формула есть лишь графическое изображение, показывающее, что атомы алюминия не связаны между собой, они связаны с атомами кислорода. Не соединены между собой и атомы кислорода, они соединены с атомами алюминия. Формула указывает валентность элементов, но не указывает порядка соединения атомов друг с другом в веществе (это отражает структурная формула, она очень сложная). Структурными формулами можно выражать строение соединений, имеющих ковалентную связь. К ним относятся большинство органических соединений, многие кислоты и некоторые окислы неметаллов. [c.50]
Строение органических соединений алюминия. В связи с открытием димерности триметилалюминия возник интересный вопрос, касающийся валентности. [c.614]
Гидрид алюминия (А1Нз) — белый порощок, разлагающийся при температуре выше 105°С с выделением водорода. Подобно гидридам бора А1Нз — соединение с дефицитом электронов. Предполагается, что он имеет сетчатое строение. Атомы алюминия находятся в октаэдрическом окружении атомов водорода н каждая пара соседних атомов алюминия связана двумя трехцентровыми двухэлектронными связями через атомы водорода сверху и снизу от плоскости сетки из атомов алюминия. Фрагмент структуры А1Н, показан на рис. 192. [c.460]
Согласно Азингеру при дегидратации высших нормальных первичных спиртов над окисью алюминия при 360—400° получается смесь всех теоретически возможных олефинов нормального строения [5]. Разложение над активной окисью алюминия легко протекает уже при 250°, но 15—20 % спирта остается непрореагировавшим. Даже при этой температуре в значительной мере происходит перемещение двойной связи. Так, из к-доде-цилового спирта получаются главным 1- и 2-додецены, в несколько меньших количествах З-додецсн и примеси 4-, 5- и 6-додсценов. П1)и применении катализаторов слегка кислого характера, например основного сульфата алюминия или окиси алюминия со следами хлористоводородной или кремневой кислот, дегидратация приводит к образованию еще более сложной смеси олефинов. [c.413]
Описанные ранее процессы характеризуются довольно высокими температурами. Выход углеводородов сильно разветвленного строения за один проход получается сравнительно невысокий, в связи с чем приходится из продуктов реакции выделять углеводороды нормального строения и возвращать их снова на реакцию. Разработанный фирмой Стандарт ойл процесс (процесс изомейт) лишен указанного недостатка, поскольку он проводится при низкой температуре — от 93 до 120°, которая способствует получению изомеров сильно разветвленного строения. Катализатором является хлористый алюминий, промотированный безводным хлористым водородом. Сырьем для процесса могут служить пентан-гексановые или узкие гексановые фракции. Указанным способом может перерабатываться также и бутан-пентановая фракция. Процесс проводится в присутствии водорода. [c.145]
ИК-спектры многих окисей биссульфидов и смесей продуктов окисления имеют широкую полосу в области 3200—3600 см , аналогичную полосе в спектрах поглощения растворов пиридина с водой [14]. Удалить воду из ассоциатов окисей вторичных, третичных биссульфидов и окисей биссульфидов из природных меркаптанов довольно трудно, так каК при температуре выше 50—60° происходит разложение продуктов. При перекристаллизации продуктов окисления, отгонке растворителей и хроматографировании на окиси алюминия наблюдается образование примесей с ненасыщенной связью. Появление подобных соединений можно объяснить, вероятнее всего, протеканием реакции Пуммерера [3]. Нам удалось выделить хроматографированием дисульфон ацетилтиоэфира (LIV) предполагаемого строения из продуктов окисления биссульфидов из нефтяных меркаптанов перекисью водорода в уксусной кислоте. [c.65]
Наиболее простым и надежным методом обессеривания средних-и тяжелых дистиллятных нефтепродуктов является каталитическое гидрирование при сравнительно мягких условиях [105 . Процессы эти получили название гидроочнстки или гидрообессеривания. В качестве катализаторов используются сульфиды вольфрама или молибдена, отложенные на активной окиси алюминия, а также катализатор риформинга (окись молибдена и окись кобальта, отложенные на активной окиси алюминия). Из экспериментальных данных, посвященных изучению термических и термокаталитических превращений индивидуальных сераорганических соединений [9, И, 02, 87 1, видно, что прочность связен в сильной иепени зависит от химического строения сераорганических соединении. Зависимость ирочностн связей от строения сераорганических соединений наиболее систематически изучена в работах Тиц-Скворцовой с сотрудниками [88—90. 109, 112]. [c.372]
Смолы — выделяют адсорбцией фуллеровой землей, активированной окисью алюминия или силикагелем после удаления из битума части, нерастворимой в петролейном эфире. Извлекают смолы из адсорбента экстракцией четыреххлористым углеродом, бензолом, или, лучше всего, смесью бензола г небольшим количеством спирта. Это аморфные вещества от красноватого до темно-коричневого цвета, растворимые в петролейном эфире и в растворителях для асфальтенов. Свое название эти продукты получили, по-видимому, в связи с тем, что при испарении растворителя они, подобно природным и синтетическим смолам, образуют сплошную пленку. Химическое строение смол подобно отроению асфальтенов. [c.7]
Рассмотрим пример. Формулой А1С1з обозначают кристаллический хлорид алюминия, его молекулу в газовой фазе, его раствор в воде или других растворителях. Строение же А1С1з в этих условиях весьма различно и отнюдь не следует, что алюминий, атомы которого имеют три валентных электрона, образует три двухцентровые двухэлектронные связи [c.82]
Большие успехи в области применения регулируемой анионной полимеризации достигнуты за последние годы и в связи с открытием комплексных катализаторов Циглера—Натта . Под влиянием этих катализаторов были получены кристаллические полимеры этилек а, пропилена и других а-олефипов, обладающие регулярным строением с определенным расположением заместителей в пространстве (изотактические и синдиотактические полимеры, стр. 57 ел.). По типу полимеров, получаемых под воздействием катализаторов Циглера—Натта, последние называют с т е р е о-специфическими к а т а л и з а т о р а. м и. Стерео-специфические катализаторы состоят из смеси металлорганических соединений металлов П и 1Н гру[И1 и галогенидов металлов [ V и VI групп, включая торий и уран. Наибол ,шее распространение приобрел катализатор, получаемый смешением триалкил-алюминия и х. юридов титана при разл гчном молярном соотно-пн нии компонентов. [c.146]
Поверхность твердых тел жесткая, имеет кристаллическое строение (металлы — сталь, бронза, медь, алюминий и др.). На поверхности твердых тел и жидкостей (нефтепродукты, вода) находятся молекулы с нескомпенси-рованными связями. Поверхность деталей двигателей и механизмов всегда неоднородна и не может быть идеально гладкой. Полированные металлические поверхности состоят из нескольких тонких слоев оксидного, псевдо-аморфного (с электрическим зарядом) и зон деформации основного металла. На твердой поверхности имеются микроскопические участки с химически активными группами атомов основного металла и примесных металлов (активные центры). [c.45]
Роль химической природы растворителя в адсорбционном процессе некоторые исследователи связывают с особенностями химического строения цеолита СаА. Стенки полостей цеолита и его окна образованы атомами кислорода, а атомы кремния и алюминия находятся в глубине алюмоснликатных скелетов за ионами кислорода. Отрицательный заряд алюмосиликатного аниона рассредоточен на внутренних связях 0-А1, а компенсирующий положительный заряд сосредоточен в обменных катионах, находящихся в полостях цеолитов в непосредственной близости к стенкам и окнам, что приводит к образованию в полостях цеолитов областей с резко выраженными не-однородн1лми электростатическими полями. Это и определяет природу взаимодействия цеолита с молекулами разной электронной структуры. [c.288]
Вероятно, таким же образом можно представить и строение молекул в проявляющих коллоидные свойства растворах гидроокиси железа, гидроокиси алюминия и др. Однако известно, что подобные растворы при стоянии или при добавлении электролитов могут приобретать типичные свойства обычных коллоидных систем. Для жидкого стекла это явление можно объяснить наличием у молекул ортокремневой кислоты гидроксильных групп, благодаря чему при добавлении, например, кислоты происходит сшивание молекул поперечными химическими связями. Если растворы достаточно разбавлены, то вследствие сшивания участков одной и той же гибкой макромолекулы могут образоваться отдельные мицеллы, причем роль стабилизатора играет сама кремневая кислота. [c.422]
В последние десятилетия широкое распространение получила анионно-координационная полимеризация в присутствии комплексных катализаторов Циглера — Натта. Этот метод используется в промышленном синтезе стереорегулярных полимеров. Кроме того, этот метод является единственным для полимеризации а-олефинов (пропилена, бутена-1 и др.). В состав катализаторов Циглера — Натта входят металлоорганические соединения I—П1 групп и хлориды IV—VH групп с переходной валентностью. Наиболее часто используются металлоорганические соединения алюминия и хлориды титана. Так как алкильные производные алюминия обладают электроноакцепторными свойствами (алюминий на четыре валентные орбиты имеет три электрона), а металлы переходной валентности являются электронодонорами (имея на -орбитах неспаренный электрон), они легко образуют координационные связи. Такие комплексные катализаторы нерастворимы, и их строение точно не установлено, но па основании данных, полученных при изучении строения растворимых комплексных катализаторов, предполагается, что они представляют собой биметаллический комплекс с координационными связями. При изучении структуры растворимого комплексного катализатора, полученного из дициклопентадиенилхлорида титана и диэтилалюмииийхлорида методом рептгеноструктурного анализа, было установлено, что он имеет следующее строение [c.89]
Мицеллярное строение наиболее распространенных известковоглинистых шламов можно представить следующим образом. В пространственной структуре существуют центры (узлы)—комплексные образования с ядром из карбоната кальция размером 5— 20 мкм. На поверхности этих частиц, заряженных обычно отрицательно, адсорбируются из водного солевого раствора молекулы воды и катионов металлов. Наряду с ними поверхностью частиц могут притягиваться положительно заряженные мелкие частицы гидроксидов железа, алюминия и других веществ. Этот слой является первичным слоем противоионов на ядре (рис. 8.1). Вокруг такой частицы располагаются более мелкие кристаллы глинистых компонентов (размером менее 0,5 мкм), представляющие собой, в свою очередь, сложные образования. Благодаря сильно развитой поверхности частицы глины обладают большим запасом поверхностной энергии. Ненасыщенные связи поверхностных узлов решетки способны прочно удерживать комплексы силикагеля, гиббсита, гидроксида железа. [c.274]
Известно, что гомолигандные аквакатионы алюминия существуют в заметных количествах при рН10. Объясните эти факты и изобразите геометрическое строение указанных ионов, используя метод валентных связей. Какие другие частицы, содержащие алюминий, присутствуют в водном растворе при pH 4—10 [c.77]
Таким образом, при растворении некоторых веществ в воде они, благодаря гидратации, настолько преображаютс я (получаются новые соединения, имеющие иное строение), что получают новые свойства, какими не обладали до взаимодействия с водой. Например, хлорид алюминия AIGU— ковалентное соединение (т. мл. 193 0), тогда как раствор хлорида алюминия — сильный электролит. Причина такого превращении в том, что в растворе это соединение приобретает иной состав, а именно (. 1 (Н,0) I U. Это соединение, подобно хлориду ам, юния, имеет ионную связь. [c.73]
Для инертных комплексных ионов в растворе некоторое время может существовать неравновесная смесь изомеров и инертные комплексы могут быть переведены в твердую фазу без изменения строения. Так, соединение [Со(МНз) 5 I ]С1 а и в кристалле, и.в растворе состоит из ионов [ o(NHg)5 lp+ и С1 . При растворении же, например, алюмокалиевых квасцов, в кристаллах которых ионы 8042″координированы алюминием, оказывается, что лишь очень малая доля ионов в растворе связана в сульфатные комплексы. По мере разбавления раствора комплексного соединения степень диссоциации лабильных комплексов увеличивается, так как лиганды из них вытесняются растворителем, инертные же комплексные ионы не изменяются. [c.50]
Электронное строение атомов алюминия. Физические и химические свойства простого вещества алюминия Изучить особенности строения атома алюминия. Закрепление полученных знаний
Алюминий: строение атома, распространение в природе. Физические и химические свойства алюминия. Применение алюминия
Алюминий — металлический элемент главной подгруппы III группы 3 периода периодической системы химических элементов. Электронная конфигурация внешнего энергетического уровня его атома 3s 2 3p 1 . При химических взаимодействиях в возбужденном состоянии он способен образовывать три ковалентных связи или полностью отдавать свои три электроны, проявляя в своих соединениях степень окисления +3. Следовательно, Алюминий является активным восстановителем.
В этом поле слева есть вся информация, которую вам нужно знать об одном элементе. Он рассказывает вам массу одного атома, сколько штук находится внутри и где оно должно быть помещено на периодическую таблицу. В следующем разделе мы собираемся охватить электронные орбитали или электронные оболочки. Это может стать новой темой для некоторых из вас.
Это означает, что в атоме алюминия имеется 13 электронов. Глядя на картину, вы можете видеть, что в оболочке один, восемь в оболочке два, два электрона и три в третьей. Правило октета: правило, утверждающее, что атомы теряют, выигрывают или обмениваются электронами, чтобы иметь полную валентную оболочку из 8 электронов. Электронная оболочка: коллективные состояния всех электронов в атоме с одним и тем же главным квантовым числом. Нильс Бор предложил раннюю модель атома как центрального ядра, содержащего протоны и нейтроны, вращающиеся на орбите электронами в оболочках.
Алюминий по распространенности занимает третье место среди других элементов. Массовая доля Алюминия в земной коре составляет 8,5 %. В природе он встречается только в виде соединений. Он входит в состав алюмосиликатов, к которым относятся: глины, слюды, полевые шпаты, в частности каолин. Промышленно важным алюминиевой рудой являются боксит Al 2 O 3 · n Н 2 О. Алюминий входит в состав минерала корунда, который является кристаллическим алюминий оксидом Al 2 O 3 . Различные примеси способны оказывать корундовые разных цветов. зеленого, желтого, оранжевого, фиолетового и других цветов и оттенков. Его синий разновидность называют сапфиром, а красный — рубином. И рубины, и сапфиры являются драгоценными камнями.
Как обсуждалось ранее, существует связь между числом протонов в элементе, атомным числом, которое отличает один элемент от другого, и количеством электронов, которое оно имеет. Во всех электрически нейтральных атомах число электронов совпадает с числом протонов. Каждый элемент, когда электрически нейтральный, имеет число электронов, равное его атомному номеру.
Модель Бора показывает атом как центральное ядро, содержащее протоны и нейтроны с электронами на круговых орбиталях на определенных расстояниях от ядра. Эти орбиты образуют электронные оболочки или энергетические уровни, которые являются способом визуализации числа электронов в различных оболочках.
Простое вещество алюминий — блестящий серебристо-белый металл. Он имеет высокую способность отражать световые и тепловые лучи, а также высокие тепло — и электропроводность. Температура плавления алюминия 660 °С. Это достаточно легкий и пластичный металл. С него можно производить тонкую проволоку и фольгу.
Химически алюминий очень активный. На воздухе он быстро окисляется и покрывается тонкой пленкой алюминий оксида. Оксидная пленка является достаточно прочной и предопределяет коррозионную стойкость алюминия. При нагревании на воздухе или в кислороде алюминий сгорает, образуя также алюминий оксид:
Рисунок 1: Модель Бора постулировала, что электрон вращается вокруг ядра в фиксированных расстояниях. Обычно электрон находится в самой низкой энергетической оболочке, которая является ближайшей к ядру. Энергия от фотона света может поднять ее до более высокой энергетической оболочки, но эта ситуация неустойчива, и электрон быстро переходит в основное состояние.
На диаграммах Бора показаны электроны, вращающиеся вокруг ядра атома, подобно орбитам вокруг Солнца. В модели Бора электроны изображаются как движущиеся в кругах в разных оболочках, в зависимости от того, какой элемент у вас есть. На рис. 2 показаны диаграммы Бора для атомов лития, фтора и алюминия.
4Al + 3O 2 = 2Al 2 O 3 .
Алюминий активно реагирует с другими неметаллами. При обычных условиях он взаимодействует с хлором и бромом, образуя соли, например, алюминий хлорид:
2Al + 3Сl 2 = 2AlСl 3 .
Реакция алюминия с йодом происходит, если к смеси алюминиевого порошка с йодом добавить несколько капель воды, которая выполняет роль катализатора:
Рисунок 2: диаграммы Бора для нейтральных атомов лития, фтора и алюминия. Каждая оболочка может содержать только определенное количество электронов. Электроны заполняют орбитальные оболочки в последовательном порядке. В стандартных условиях атомы сначала заполняют внутренние оболочки, часто приводя к переменному числу электронов в самой внешней оболочке. Самая внутренняя оболочка имеет максимум два электрона, но каждая из двух электронных оболочек может иметь максимум восемь электронов. Это известно как правило октета, в котором говорится, что, за исключением самой внутренней оболочки, атомы более стабильны энергетически, когда у них есть восемь электронов в их валентной оболочке — самой внешней электронной оболочке.
2Al + 3I 2 = 2AlІ 3 .
При нагревании алюминий реагирует с серой, азотом, углеродом, например:
2Al + 3S = Al 2 S 3 .
В обычном состоянии алюминий покрыт защитной оксидной пленкой и является устойчивым к воздействию воды даже при нагревании. Если пленка алюминий оксида будет разрушена, то алюминий будет активно реагировать с водой с выделением газуватого водорода:
Закрепление полученных знаний
Примеры некоторых нейтральных атомов и их электронных конфигураций показаны на рисунке. Как показано, гелий имеет полную внешнюю электронную оболочку с двумя электронами, заполняющими ее первую и единственную оболочку. Напротив, хлор и натрий имеют семь и один электроны в их внешних оболочках, соответственно.
Теоретически, они были бы более энергетически устойчивыми, если бы они следовали правилу октета и имели восемь. Диаграммы Бора показывают, сколько электронов заполняет каждую основную оболочку. Элементы группы 18 имеют полную внешнюю оболочку или валентную оболочку. Полная валентная оболочка является наиболее стабильной электронной конфигурацией. Элементы в других группах имеют частично заполненные валентные оболочки и получают или теряют электроны для достижения стабильной конфигурации электронов.
2Al + 6Н 2 О = 2Al(ОН) 3 ↓ + 3Н 2 .
Алюминий реагирует с растворами кислот с образованием солей и водорода, например:
2Al + 6НСl= 2AlCl 3 + 3Н 2 .
Концентрированные сульфатная и азотная кислоты пассивируют алюминий, то есть увеличивают прочность оксидной пленки. Таким образом, алюминий с ними не реагирует.
Оксидная пленка легко растворяется в щелочах и алюминий реагирует с растворами щелочей с выделением водорода:
Атом может получить или потерять электроны для достижения полной валентной оболочки, самой стабильной электронной конфигурации. Периодическая таблица размещается в столбцах и строках на основе количества электронов и где эти электроны расположены, обеспечивая инструмент для понимания того, как электроны распределены во внешней оболочке атома. Как показано на рисунке, атомы группы 18 гелий, неон и аргон все заполняют внешние электронные оболочки, что делает их ненужными для получения или потери электронов для достижения стабильности; они очень устойчивы как одиночные атомы.
2Al + 2NaOH +6Н 2 O = 2Na + 3Н 2 .
Алюминий восстанавливает металлы из их оксидов при нагревании (алюмінотермія), например:
Fe 2 O 3 + 2Al = 2Fe + Al 2 O 3 .
Алюминий добывают путем электролиза глинозема, растворенного в расплавленном криолите Na 3 .
Широкое применение алюминия обусловлено его свойствами. Сочетание легкости с достаточно высокой электропроводностью позволяет применять алюминий как проводник электрического тока. Алюминий и его сплавы используют практически во всех областях современной техники: в авиационной и автомобильной промышленности, железнодорожном и водном транспорте, машиностроении и т.п. Благодаря высокой коррозионной стойкости алюминий широко применяют при изготовлении аппаратуры для производства пищевых продуктов и некоторых химических веществ. Из полированного алюминия изготавливают зеркала и поверхности нагревательных и осветительных рефлекторов. Алюминий используют как розкисник сталей и других сплавов. Им восстанавливают металлы из их оксидов.
Их нереактивность привела к тому, что их назвали инертными газами. Для сравнения, элементы группы 1, включая водород, литий и натрий, имеют один электроны в своих самых внешних оболочках. Это означает, что они могут достичь стабильной конфигурации и заполненной внешней оболочки путем пожертвования или потери электрона. В результате потери отрицательно заряженного электрона они становятся положительно заряженными ионами. Элементы группы 17, включая фтор и хлор, имеют семь электронов в своих внешних оболочках; они, как правило, заполняют эту оболочку, получая электрон от других атомов, делая их отрицательно заряженными ионами.
I.Положение элемента в периодической системе а) порядковый номер, б) номер периода (малый или большой), в) номер группы (главная или побочная) II.Атомная масса III.Строение атома а) заряд ядра, б) число протонов, в) число нейтронов, г) число электронов IV.Свойства атом (окислительные или восстановительные) V.Степень окисления VI.Характер оксидов и гидроксидов
Al — алюминий N порядковый — N периода — N группы (малый) III группа главная п/группа Состав атома Al (13 р n1 14) 13 е — Строение электронной оболочки Al +13))) 28 3 е — Свойства атома Al 0 -3 е — Al 3+ (восстановитель, процесс окисления)
3. Взаимодействует со сложными веществами (с водой, с кислотами, со щелочами, с оксидами металлов) 1. Алюминий — это активный металл 2. Взаимодействует с простыми веществами (кислородом, галогенами, серой) 4. Алюминий проявляет амфотерные свойства, т.е. может взаимодействовать и с кислотами, и со щелочами.
состав, структура, свойства, процесс плавления
Алюминий вошел в промышленное и бытовое применение относительно не так давно. На пересечении XIX – XX было освоено производство этого металла в промышленных масштабах. Все дело в том, что началось производство множества товаров, в которых алюминий широко применялся, например, при строительстве катеров, железнодорожных вагонов и пр. Кстати, именно тогда был показан широкой публике автомобиль с кузовом, выполненным из алюминия.
Анодированный алюминийСостав и структура алюминия
Алюминий – это самый распространенный в земной коре металл. Его относят к легким металлам. Он обладает небольшой плотностью и массой. Кроме того, у него довольно низкая температура плавления. В то же время он обладает высокой пластичностью и показывает хорошие тепло- и электропроводные характеристики.
- Кристаллическая решетка алюминия
- Структура алюминия
Предел прочности чистого алюминия составляет всего 90 МПа. Но, если в расплав добавить некоторые вещества, например, медь и ряд других, то предел прочности резко вырастает до 700 МПа. Такого же результат можно достичь, применяя термическую обработку.
Алюминий, обладающий предельно высокой чистотой – 99,99% производят для использования в лабораторных целях. Для применения в промышленности применяют технически чистый алюминий. При получении алюминиевых сплавов применяют такие добавки, как – железо и кремний. Они не растворяются в расплаве алюминия, а из добавка снижает пластичность основного материала, но в то же время повышает его прочность.
Внешний вид простого вещества
Структура этого металла состоит из простейших ячеек, состоящих из четырех атомов. Такую структуру называют гранецентрической.
Проведенные расчеты показывают, что плотность чистого металла составляет 2,7 кг на метр кубический.
Свойства и характеристики
Алюминий – это металл с серебристо-белой поверхности. Как уже отмечалось, его плотность составляет 2,7 кг/м3. Температура составляет 660°C.
Его электропроводность равняется 65% от меди и ее сплавов. Алюминий и бо́льшая часть сплавов из него стойко воспринимает воздействие коррозии. Это связано с тем, что на его поверхности образуется оксидная пленка, которая и защищает основной материал от воздействия атмосферного воздуха.
В необработанном состоянии его прочность равна 60 МПа, но после добавления определенных добавок она вырастает до 700 МПа. Твердость в этом состоянии достигает 250 по НВ.
Алюминий хорошо обрабатывается давлением. Для удаления наклепа и восстановления пластичности после обработки алюминиевые детали подвергают отжигу, при этом температура должна лежать в пределах 350°C.
Температура плавления алюминия
Получение алюминиевого расплава, как и многих других материалов, происходит после того, как к исходному металлу подвели тепловую энергию. Она может быть подведена как непосредственно в него, так и снаружи.
Температура плавления алюминия напрямую зависит от уровня его чистоты:
- Сверхчистый алюминий плавится при температуре 660, 3°C.
- При количестве алюминия 99,5% температура плавления составляет 657°C.
- При содержании этого металла в 99% расплав можно получить при 643°C.
- Алюминиевый расплав
- Процесс получения алюминия
Алюминиевый сплав может включать в свой состав различные вещества, в том числе и легирующие. Их наличие приводит к снижению температуры плавления. Например, при наличии большого количества кремния, температура может понизиться до 500°C. На самом деле понятие температуры плавления относят к чистым металлам. Сплавы не обладают какой-то постоянной температурой плавления. Этот процесс происходит в определенном диапазоне нагрева.
В материаловедении существует понятие – температура солидус и ликвидус.
Первая температура обозначает ту точку, в которой начинается плавление алюминия, а вторая, показывает, при какой температуре, сплав будет окончательно расплавлен. В промежутке между ними сплав будет находиться в кашеобразном состоянии.
Уменьшение температуры
Перед тем как приступать к плавке металла, можно выполнить определенные операции, которые позволят снизить температуру плавления. Например, иногда расплаву подвергают алюминиевый порошок. В порошкообразном состоянии металл начинает плавиться несколько быстрее. Но при такой обработке возникает реальная опасность того, что при взаимодействии с кислородом, который содержится в атмосфере алюминиевый порошок, начнет окисляться с большим выделением тепла и образования оксидов металла, этот процесс происходит при температуре 2300 градусов. Главное, в этот момент плавления не допустить контакта расплава и воды. Это приведет к взрыву.
Процесс плавления в домашних условиях
Относительно низкая температура плавления алюминия позволяет проводить эту операцию в домашних условия. Надо сразу отметить, что в качестве сырья в домашней мастерской использовать порошкообразную смесь слишком опасно. Поэтому в качестве сырья применяют или чушки, или нарезанную проволоку. Если к будущему изделию нет особых требований по качеству, то для плавления можно использовать все, что изготовленного из этого металла.
Плавка алюминия в самодельном горне
При этом не особо важно, будет сырье покрыто краской или нет. Когда происходит плавление алюминия, все посторонние вещества просто выгорят и будут удалены вместе со шлаком.
Для получения качественного результата плавки необходимо использовать материалы, которые называют флюсами. Они призваны решать задачу по связыванию и удалению из расплава посторонних примесей и загрязнений.
Средства защиты
Домашний мастер, решивший в домашних условиях выполнять плавление алюминия должен отдавать себе отчет в том, что это довольно опасный процесс. И поэтому без применения средств защиты не обойтись. В частности, должны быть использованы перчатки, фартук, очки. Дело в том, что температура расплава лежит в пределах 600 градусов. Поэтому имеет смысл использовать средства защиты, которые применяют сварщики.
Использование средств защиты при плавке алюминия
Кстати, при плавлении алюминия и использовании очищающих химикатов необходимо защищать органы дыхания от продуктов их сгорания.
Выбор формы для литья
При выборе формы для отливки алюминия домашний мастер должен понимать, а для какой цели он обрабатывает алюминий. Если будущая отливка будет предназначена для использования в качестве припоя, то использовать, какие-то специальные формы, нет необходимости. Для этого можно использовать металлический лист, на котором можно остудить расплавленный металл.
Но если возникает необходимость получения даже простой детали, то мастер должен определиться с типом формы для литья.
Форму можно изготовить из гипса. Для этого, гипс в жидком состоянии заливают в обработанную маслом форму. После того, как начнет застывать, в него устанавливают литейную модель. Для того, чтобы в форму можно было залить расплавленный металл необходимо сформировать литник. Для этого в форму устанавливают цилиндрическую деталь. Формы бывают разъемные и нет. Процесс изготовления разъемной формы усложняется тем, что модель будет находиться в двух полуформах. После застывания их разделяют, удаляют модель и соединяют снова. Форма готова к работе.
Кокиль для литья алюминия
Для получения качественных отливок целесообразно использовать металлические формы (кокили), но изготавливать их целесообразно только в заводских условиях.
ЭЛЕКТРОННОЕ СТРОЕНИЕ И МАГНИТНЫЕ СВОЙСТВА ГЕКСАГОНАЛЬНОЙ И КУБИЧЕСКОЙ МОДИФИКАЦИЙ НИТРИДА АЛЮМИНИЯ, АКТИВИРОВАННОГО ПРИМЕСЯМИ sp-ЭЛЕМЕНТОВ (B, C, O)
TY — JOUR
T1 — ЭЛЕКТРОННОЕ СТРОЕНИЕ И МАГНИТНЫЕ СВОЙСТВА ГЕКСАГОНАЛЬНОЙ И КУБИЧЕСКОЙ МОДИФИКАЦИЙ НИТРИДА АЛЮМИНИЯ, АКТИВИРОВАННОГО ПРИМЕСЯМИ sp-ЭЛЕМЕНТОВ (B, C, O)
AU — Банников, В.В.
AU — Елагин, Андрей Александрович
AU — Баранов, Михаил Владимирович
AU — Бекетов, Аскольд Рафаилович
AU — Кудякова, Валерия Сергеевна
PY — 2016
Y1 — 2016
N2 — Первопринципным методом FLAPW-GGA выполнено сравнительное исследование зонной структуры и магнитных свойств гексагональной и кубической модификаций нитрида алюминия, допированных бором, углеродом и кислородом по азотной подрешетке. На основании оценок энергий замещения атомов азота примесями были сделаны предварительные выводы о сравнительной химической активности этих фаз. Показано, что допирование бором и углеродом приводит к переходу гексагонального AlN в магнитное состояние с высокой спиновой поляризацией прифермиевских электронов, однако для кубической фазы подобный эффект отсутствует.
AB — Первопринципным методом FLAPW-GGA выполнено сравнительное исследование зонной структуры и магнитных свойств гексагональной и кубической модификаций нитрида алюминия, допированных бором, углеродом и кислородом по азотной подрешетке. На основании оценок энергий замещения атомов азота примесями были сделаны предварительные выводы о сравнительной химической активности этих фаз. Показано, что допирование бором и углеродом приводит к переходу гексагонального AlN в магнитное состояние с высокой спиновой поляризацией прифермиевских электронов, однако для кубической фазы подобный эффект отсутствует.
UR — http://elibrary.ru/item.asp?id=27517631
U2 — 10.15372/JSC20160807
DO — 10.15372/JSC20160807
M3 — Статья
VL — 57
SP — 1633
EP — 1639
JO — Журнал структурной химии
JF — Журнал структурной химии
SN — 0136-7463
IS — 8
ER —
алюминия | Использование, свойства и соединения
Алюминий (Al) , также пишется алюминий , химический элемент, легкий серебристо-белый металл основной группы 13 (IIIa, или группа бора) периодической таблицы. Алюминий — самый распространенный металлический элемент в земной коре и наиболее широко используемый цветной металл. Из-за своей химической активности алюминий никогда не встречается в природе в металлической форме, но его соединения в большей или меньшей степени присутствуют почти во всех породах, растительности и животных.Алюминий сосредоточен во внешних 16 км (10 милях) земной коры, из которых он составляет около 8 процентов по весу; по количеству его превосходят только кислород и кремний. Название «алюминий» происходит от латинского слова alumen , которое используется для описания калийных квасцов или сульфата алюминия-калия, KAl (SO 4 ) 2 ∙ 12H 2 O.
alumenAluminium.
Британская энциклопедия, Inc.Британская викторина
118 Названия и символы Периодической таблицы викторины
Периодическая таблица Менделеева состоит из 118 элементов.Насколько хорошо вы знаете их символы? В этой викторине вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
| атомный номер | 13 |
|---|---|
| атомный вес | 26.9815384 |
| точка плавления | 660 ° C (1220 ° F) |
| точка кипения | 2467 ° C ( 4473 ° F) |
| удельный вес | 2.70 (при 20 ° C [68 ° F]) |
| валентность | 3 |
| электронная конфигурация | 1 с 2 2 с 2 2 p 6 3 с 2 3 p 1 |
Возникновение и история
Алюминий встречается в магматических породах главным образом в виде алюмосиликатов в полевых шпатах, полевых шпатах и слюдах; в почве, полученной из них в виде глины; а при дальнейшем выветривании — боксит и богатый железом латерит.Боксит, смесь гидратированных оксидов алюминия, является основной алюминиевой рудой. Кристаллический оксид алюминия (наждак, корунд), который встречается в некоторых магматических породах, добывается как природный абразив или в его более мелких разновидностях, таких как рубины и сапфиры. Алюминий присутствует в других драгоценных камнях, таких как топаз, гранат и хризоберилл. Из многих других минералов алюминия алунит и криолит имеют некоторое коммерческое значение.
До 5000 г. до н. Э. Люди в Месопотамии изготавливали прекрасную керамику из глины, которая в основном состояла из соединения алюминия, а почти 4000 лет назад египтяне и вавилоняне использовали соединения алюминия в различных химических веществах и лекарствах.Плиний относится к алюминию, ныне известному как квасцы, соединению алюминия, широко используемому в древнем и средневековом мире для фиксации красителей в текстильных изделиях. Во второй половине 18 века химики, такие как Антуан Лавуазье, признали глинозем в качестве потенциального источника металла.
Сырой алюминий был выделен (1825 г.) датским физиком Гансом Кристианом Эрстедом путем восстановления хлорида алюминия амальгамой калия. Британский химик сэр Хамфри Дэви (1809 г.) приготовил железо-алюминиевый сплав путем электролиза плавленого оксида алюминия (оксида алюминия) и уже назвал этот элемент алюминием; позже это слово было изменено на алюминий в Англии и некоторых других европейских странах.Немецкий химик Фридрих Велер, используя металлический калий в качестве восстановителя, произвел алюминиевый порошок (1827 г.) и небольшие шарики металла (1845 г.), по которым он смог определить некоторые из его свойств.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишитесь сейчасНовый металл был представлен публике (1855 г.) на Парижской выставке примерно в то время, когда он стал доступен (в небольших количествах за большие деньги) за счет восстановления расплавленного хлорида алюминия натрием посредством процесса Девиля.Когда электроэнергия стала относительно обильной и дешевой, почти одновременно Чарльз Мартин Холл в Соединенных Штатах и Поль-Луи-Туссен Эру во Франции открыли (1886 г.) современный метод промышленного производства алюминия: электролиз очищенного глинозема (Al 2 O ). 3 ) в расплавленном криолите (Na 3 AlF 6 ). В 60-е годы алюминий вышел на первое место, опередив медь, в мировом производстве цветных металлов. Для получения более подробной информации о добыче, рафинировании и производстве алюминия, см. обработка алюминия.
Применение и свойства
Алюминий добавляется в небольших количествах к некоторым металлам для улучшения их свойств для конкретных целей, например, в алюминиевых бронзах и большинстве сплавов на основе магния; или, для сплавов на основе алюминия, к алюминию добавляются умеренные количества других металлов и кремния. Металл и его сплавы широко используются в авиастроении, строительных материалах, товарах длительного пользования (холодильники, кондиционеры, кухонная утварь), электрических проводниках, химическом и пищевом оборудовании.
Чистый алюминий (99,996%) довольно мягкий и непрочный; Технический алюминий (чистота от 99 до 99,6%) с небольшим содержанием кремния и железа тверд и прочен. Пластичный и очень ковкий алюминий можно растянуть в проволоку или свернуть в тонкую фольгу. Металл примерно на треть меньше по плотности, чем железо или медь. Хотя алюминий химически активен, он, тем не менее, очень устойчив к коррозии, потому что на воздухе на его поверхности образуется твердая, прочная оксидная пленка.
Алюминий отлично проводит тепло и электричество.Его теплопроводность примерно вдвое меньше, чем у меди; его электропроводность — около двух третей. Он кристаллизуется в гранецентрированной кубической структуре. Весь природный алюминий представляет собой стабильный изотоп алюминия-27. Металлический алюминий, его оксид и гидроксид нетоксичны.
Алюминий медленно разрушается большинством разбавленных кислот и быстро растворяется в концентрированной соляной кислоте. Однако концентрированную азотную кислоту можно перевозить в алюминиевых цистернах, поскольку она делает металл пассивным.Даже очень чистый алюминий активно разрушается щелочами, такими как гидроксид натрия и калия, с образованием водорода и алюминат-иона. Из-за своего большого сродства к кислороду тонкодисперсный алюминий при воспламенении будет гореть в оксиде углерода или диоксиде углерода с образованием оксида и карбида алюминия, но при температурах до красного каления алюминий инертен к сере.
Алюминий может быть обнаружен с помощью эмиссионной спектроскопии в концентрациях от одной части на миллион.Алюминий может быть количественно проанализирован как оксид (формула Al 2 O 3 ) или как производное органического соединения азота 8-гидроксихинолина. Производное имеет молекулярную формулу Al (C 9 H 6 ON) 3 .
Соединения
Обычно алюминий трехвалентен. Однако при повышенных температурах было получено несколько газообразных одновалентных и двухвалентных соединений (AlCl, Al 2 O, AlO). В алюминии конфигурация трех внешних электронов такова, что в некоторых соединениях (например.например, кристаллический фторид алюминия [AlF 3 ] и хлорид алюминия [AlCl 3 ]), как известно, возникает чистый ион, Al 3+ , образовавшийся в результате потери этих электронов. Однако энергия, необходимая для образования иона Al 3+ , очень высока, и в большинстве случаев для атома алюминия энергетически более выгодно образовывать ковалентные соединения посредством гибридизации sp 2 , как бор. Ион Al 3+ может быть стабилизирован путем гидратации, а октаэдрический ион [Al (H 2 O) 6 ] 3+ находится как в водном растворе, так и в нескольких солях.
Ряд соединений алюминия имеет важное промышленное применение. Оксид алюминия, который встречается в природе в виде корунда, также готовится в больших количествах в промышленных масштабах для использования в производстве металлического алюминия и изготовления изоляторов, свечей зажигания и различных других продуктов. При нагревании оксид алюминия приобретает пористую структуру, которая позволяет ему адсорбировать водяной пар. Эта форма оксида алюминия, известная как активированный оксид алюминия, используется для сушки газов и некоторых жидкостей.Он также служит носителем для катализаторов различных химических реакций.
Анодный оксид алюминия (AAO), обычно получаемый путем электрохимического окисления алюминия, представляет собой наноструктурированный материал на основе алюминия с очень уникальной структурой. AAO содержит цилиндрические поры, которые позволяют использовать его в самых разных целях. Это термически и механически стабильный состав, при этом он оптически прозрачен и является электрическим изолятором. Размер пор и толщину AAO можно легко адаптировать к определенным приложениям, включая использование в качестве шаблона для синтеза материалов в нанотрубки и наностержни.
Еще одно важное соединение — сульфат алюминия, бесцветная соль, полученная действием серной кислоты на гидратированный оксид алюминия. Товарная форма представляет собой гидратированное кристаллическое твердое вещество с химической формулой Al 2 (SO 4 ) 3 . Он широко используется в производстве бумаги как связующее для красителей и как поверхностный наполнитель. Сульфат алюминия соединяется с сульфатами одновалентных металлов с образованием гидратированных двойных сульфатов, называемых квасцами. Квасцы, двойные соли формулы MAl (SO 4 ) 2 · 12H 2 O (где M — однозарядный катион, такой как K + ), также содержат ион Al 3+ ; M может быть катионом натрия, калия, рубидия, цезия, аммония или таллия, а алюминий может быть заменен множеством других ионов M 3+ — e.например, галлий, индий, титан, ванадий, хром, марганец, железо или кобальт. Наиболее важной из таких солей является сульфат алюминия-калия, также известный как квасцы калия или квасцы поташа. Эти квасцы находят множество применений, особенно в производстве лекарств, текстиля и красок.
При реакции газообразного хлора с расплавленным металлическим алюминием образуется хлорид алюминия; последний является наиболее часто используемым катализатором в реакциях Фриделя-Крафтса, то есть в синтетических органических реакциях, участвующих в получении широкого спектра соединений, включая ароматические кетоны и антрохинон и его производные.Гидратированный хлорид алюминия, широко известный как хлоргидрат алюминия, AlCl 3 ∙ H 2 O, используется в качестве местного антиперспиранта или дезодоранта для тела, который сужает поры. Это одна из нескольких солей алюминия, используемых в косметической промышленности.
Гидроксид алюминия, Al (OH) 3 , используется для водонепроницаемости тканей и для производства ряда других соединений алюминия, включая соли, называемые алюминатами, которые содержат группу AlO — 2 .С водородом алюминий образует гидрид алюминия AlH 3 , твердое полимерное вещество, из которого получают тетрогидроалюминаты (важные восстановители). Литийалюминийгидрид (LiAlH 4 ), образованный реакцией хлорида алюминия с гидридом лития, широко используется в органической химии, например, для восстановления альдегидов и кетонов до первичных и вторичных спиртов соответственно.
Эта статья была последней отредактирована и обновлена старшим редактором Эриком Грегерсеном.Узнайте больше в этих связанных статьях Britannica:
элемент группы бора
— это бор (B), алюминий (Al), галлий (Ga), индий (In), таллий (Tl) и нихоний (Nh).Они характеризуются как группа наличием трех электронов во внешних частях их атомной структуры. Бор самый легкий…
Материаловедение: алюминий
Поскольку плотность алюминия составляет примерно одну треть плотности стали, его замена стали в автомобилях может показаться разумным подходом к снижению веса и, таким образом, к увеличению экономии топлива и сокращению вредных выбросов.Однако такие замены не могут быть произведены без учета…
химическая промышленность: рафинирование алюминия
Фтористая промышленность тесно связана с производством алюминия. Глинозем (оксид алюминия, Al 2 O 3 ) может быть восстановлен до металлического алюминия путем электролиза при сплавлении с флюсом, состоящим из фторалюмината натрия (Na 3 AlF 6 ), обычно называемого криолитом.После запуска процесса криолит составляет…
Расшифровка: Химия в ее элементе: алюминий(Promo) Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журналом Королевского химического общества. (Конец промо) Крис Смит На этой неделе химическая причина трансатлантического языкового трения. Это ум или ум в конце? Оказывается, у нас, британцев, на лицах может быть яйцо, а также немного того, что мы называем алюминием. Кира Дж. Вайсман «Я чувствую себя запертым в жестяной коробке на высоте 39000 футов». Это распространенный рефрен у людей, страдающих фобией к полетам, но, возможно, им будет легче узнать, что коробка на самом деле сделана из алюминия — более 66000 кг, если они сидят в гигантском реактивном самолете.Хотя сетовать на присутствие в «алюминиевой коробке» — это не совсем то же самое кольцо, есть несколько веских причин оценить этот выбор материала. Чистый алюминий мягкий. Тем не менее, легирование его такими элементами, как медь, магний и цинк, значительно повышает его прочность, при этом делая его легким, что очевидно является преимуществом в борьбе с гравитацией. Полученные сплавы, иногда более пластичные, чем сам алюминий, можно формовать в различные формы, включая аэродинамическую дугу крыльев самолета или его трубчатый фюзеляж.И в то время как железо ржавеет под воздействием элементов, алюминий образует микроскопически тонкий оксидный слой, защищающий его поверхность от дальнейшей коррозии. С этим здоровенным резюме неудивительно, что алюминий можно найти во многих других транспортных средствах, включая корабли, автомобили, грузовики, поезда и велосипеды. К счастью для транспортной отрасли, природа одарила нас огромным количеством алюминия. Самый распространенный металл в земной коре, он буквально повсюду. Тем не менее, алюминий оставался неоткрытым до 1808 года, так как он связан с кислородом и кремнием в сотни различных минералов, которые никогда не появляются в своей металлической форме.Сэр Хамфри Дэви, химик из Корнуолла, открывший этот металл, назвал его «алюминием» в честь одного из его исходных соединений — квасцов. Однако вскоре после этого вмешался Международный союз теоретической и прикладной химии (или ИЮПАК), стандартизовавший суффикс до более обычного «ium». Еще одним поворотом в номенклатурной истории стало то, что Американское химическое общество возродило первоначальное написание в 1925 году, и по иронии судьбы именно американцы, а не британцы произносят название элемента, как задумал Дэви. В 1825 году честь впервые выделить алюминий выпала на долю датского ученого Ганса Христиана Эрстеда. Сообщается, что он сказал о своей награде: «Он образует кусок металла, напоминающий олово по цвету и блеску» — не слишком лестное описание, но, возможно, объяснение нынешнего замешательства пассажиров авиалиний. Трудность отделения алюминия от его оксидов — ибо все ранние процессы давали в лучшем случае только килограммы — обеспечили ему временный статус драгоценного металла, более ценного даже, чем золото.Фактически, алюминиевый бар занимал почетное место рядом с драгоценностями короны на Парижской выставке 1855 года, в то время как Наполеон, как говорят, зарезервировал алюминиевую посуду только для своих самых почетных гостей. Только в 1886 году Чарльз Мартин Холл, необычайно упорный 22-летний ученый-любитель, разработал первые экономические средства для извлечения алюминия. Работая в сарае со своей старшей сестрой помощницей, он растворил оксид алюминия в ванне с расплавленным гексафторалюминатом натрия (более известный как «криолит»), а затем разделил алюминий и кислород с помощью сильного электрического тока.Примечательно, что другой 22-летний француз Поль Луи Туссен Эру открыл точно такую же электролитическую технику почти в то же время, что спровоцировало трансатлантическую гонку патентов. Их наследие, закрепленное как процесс Холла-Эру, остается основным методом производства алюминия в промышленных масштабах — в настоящее время ежегодно производится миллион тонн алюминия из самой богатой алюминиевой руды, боксита. Не только транспортная промышленность осознала преимущества алюминия.К началу 1900-х годов алюминий уже вытеснил медь в линиях электропередач, его гибкость, легкий вес и низкая стоимость с лихвой компенсировали его более низкую проводимость. Алюминиевые сплавы являются фаворитом конструкции, находя применение в облицовке, окнах, желобах, дверных рамах и кровле, но с такой же вероятностью они могут появиться и внутри дома: в бытовой технике, кастрюлях и сковородах, посуде, телевизионных антеннах и мебели. В качестве тонкой фольги алюминий представляет собой упаковочный материал par excellence , гибкий и прочный, непроницаемый для воды и стойкий к химическим воздействиям — короче говоря, он идеально подходит для защиты спасательного лекарства или вашего любимого шоколадного батончика.Но, пожалуй, наиболее узнаваемым воплощением алюминия является алюминиевая банка для напитков, сотни миллиардов штук которых производятся ежегодно. Естественно глянцевая поверхность каждой банки служит привлекательным фоном для названия продукта, и хотя ее тонкие стенки могут выдерживать давление до 90 фунтов на квадратный дюйм (в три раза больше, чем в типичной автомобильной шине), к содержимому можно легко получить доступ с помощью просто потяните за язычок. И хотя рафинирование алюминия поглощает значительную часть мирового электричества, алюминиевые банки можно перерабатывать экономично и многократно, каждый раз экономя почти 95% энергии, необходимой для плавки металла. Однако у этого блестящего металла есть и более темная сторона. Несмотря на его изобилие в природе, известно, что алюминий не служит какой-либо полезной цели для живых клеток. Однако в своей растворимой форме +3 алюминий токсичен для растений. Высвобождение Al 3+ из его минералов ускоряется в кислых почвах, которые составляют почти половину пахотных земель на планете, что делает алюминий основным виновником снижения урожайности сельскохозяйственных культур. Людям не нужен алюминий, но он попадает в наш организм каждый день — он содержится в воздухе, которым мы дышим, в воде, которую мы пьем, и в еде, которую мы едим.Хотя небольшое количество алюминия обычно присутствует в пищевых продуктах, мы отвечаем за основные источники пищевого алюминия: пищевые добавки, такие как разрыхлители, эмульгаторы и красители. Проглатывание антацидов, отпускаемых без рецепта, может повысить уровень их потребления в несколько тысяч раз. Многие из нас ежедневно наносят дезодоранты, содержащие алюминий, непосредственно на кожу. Что беспокоит, так это то, что несколько исследований показали, что алюминий является фактором риска как рака груди, так и болезни Альцгеймера.Хотя большинство экспертов по-прежнему не убеждены в доказательствах, алюминий в высоких концентрациях является доказанным нейротоксином, в первую очередь влияющим на кости и мозг. Итак, пока не будут проведены дополнительные исследования, жюри останется открытым. Теперь, возможно, это то, что вас беспокоит во время вашего следующего дальнемагистрального полета. Крис Смит Исследователь Кира Вайсман из Саарландского университета в Саарбрукене, Германия, рассказала историю алюминия и почему я не говорю это так, как задумал Хамфри Дэвид.На следующей неделе, поговорим о том, как звучат элементы, а как насчет этого? Брайан Клегг Не так много элементов со звукоподражательными названиями. Скажите кислород или йод, и в звучании слова нет ключа к природе элемента, но цинк — это другое дело — цинк, цинк, цинк, вы почти можете услышать, как набор монет падает в старомодную ванну. Это просто должен быть твердый металл. При использовании цинк часто скрыт, почти скрыт. Он останавливает ржавчину железа, успокаивает солнечные ожоги, защищает от перхоти, соединяется с медью, образуя очень знакомый сплав золотого цвета и сохраняет нам жизнь, но мы почти не замечаем этого. Крис Смит И вы можете догнать звон цинка с Брайаном Клеггом на следующей неделе на Chemistry in its element. Я Крис Смит, спасибо за внимание и до свидания. (Промо) (Окончание промо) |
Al Информация об элементе из алюминия: факты, свойства, тенденции, использование и сравнение — Периодическая таблица элементов
История алюминия
Элемент Алюминий был открыт None в год. 1825 г. в Дании .Алюминий получил свое название от глинозема, соединения (первоначально алюминия)
Присутствие алюминия: изобилие в природе и вокруг нас
В таблице ниже показано содержание алюминия во Вселенной, Солнце, метеоритах, Земная кора, океаны и человеческое тело.
Кристаллическая структура алюминия
Твердотельная структура алюминия — кубическая грань центрированная.
Кристаллическую структуру можно описать с помощью ее элементарной ячейки. Элементарные ячейки повторяются в три пространственное пространство для формирования конструкции.
Параметры элементарной ячейки
Элементарная ячейка представлена в терминах ее параметров решетки, которые являются длинами ячейки края Константы решетки ( a , b и c )
| a | б | с |
|---|---|---|
| 404.95 | 404,95 | 404.95 вечера |
и углы между ними Углы решетки (альфа, бета и гамма).
| альфа | бета | гамма |
|---|---|---|
| π / 2 | π / 2 | π / 2 |
Положения атомов внутри элементарной ячейки описываются набором атомных положений ( x i , y i , z i ), измеренные от опорной точки решетки.
Свойства симметрии кристалла описываются концепцией пространственных групп. Все возможно симметричное расположение частиц в трехмерном пространстве описывается 230 пространственными группами (219 различных типов или 230, если хиральные копии считаются отдельными.
Атомные и орбитальные свойства алюминия
Атомы алюминия имеют 13 электронов и структура электронной оболочки [2, 8, 3] с символом атомного члена (квантовые числа) 2 P 1/2 .
Оболочечная структура алюминия — количество электронов на энергию уровень
| n | с | п. | г | f | |
|---|---|---|---|---|---|
| 1 | К | 2 | |||
| 2 | L | 2 | 6 | ||
| 3 | M | 2 | 1 |
Основное состояние электронной конфигурации алюминия — нейтраль Атом алюминия
Электронная конфигурация нейтрального атома алюминия в основном состоянии [Ne] 3с2 3п1.Часть конфигурации алюминия, которая эквивалентна благородному газу предыдущий период сокращенно обозначается как [Ne]. Для атомов с большим количеством электронов это нотация может стать длинной, поэтому используется сокращенная нотация. валентные электроны 3s2 3p1, электроны в внешняя оболочка, определяющая химические свойства элемента.
Полная электронная конфигурация нейтрального алюминия
Полная электронная конфигурация основного состояния для атома алюминия, несокращенная электронная конфигурация
1с2 2с2 2п6 3с2 3п1
Атомная структура алюминия
Атомный радиус алюминия 118 пм, а его ковалентный радиус 118 пм.
Атомный спектр алюминия
Алюминий Химические свойства: Энергии ионизации алюминия и сродство к электрону
Сродство к электрону алюминия составляет 42,5 кДж / моль.
Энергия ионизации алюминия
Энергии ионизации алюминия
см. В таблице ниже.| Число энергии ионизации | Энтальпия — кДж / моль |
|---|---|
| 1 | 577.5 |
| 2 | 1816,7 |
| 3 | 2744,8 |
| 4 | 11577 |
| 5 | 14842 |
| 6 | 18379 |
| 7 | 23326 |
| 8 | 27465 |
| 9 | 31853 |
| 10 | 38473 |
Физические свойства алюминия
Физические свойства алюминия см. В таблице ниже
| Плотность | 2.7 г / см3 |
| Молярный объем | 9.99316222222 см3 |
Упругие свойства
Твердость алюминия — Испытания для измерения твердости элемента
Электрические свойства алюминия
Алюминий — проводник электричества. Ссылаться на Таблица ниже электрические свойства алюминия
Теплопроводность и теплопроводность алюминия
Магнитные свойства алюминия
Оптические свойства алюминия
Акустические свойства алюминия
Тепловые свойства алюминия — энтальпии и термодинамика
Термические свойства алюминия
см. В таблице ниже.Энтальпия алюминия
Изотопы алюминия — ядерные свойства алюминия
Изотопы родия.Алюминий природного происхождения 1 стабильный изотоп — 27Al.
| Изотоп | Масса изотопа | % Изобилие | Т половина | Режим распада |
|---|---|---|---|---|
| 21Al | ||||
| 22Al | ||||
| 23Al | ||||
| 24Al | ||||
| 25Al | ||||
| 26Al | ||||
| 27Al | 100% | Стабильный | N / A | |
| 28Al | ||||
| 29Al | ||||
| 30Al | ||||
| 31Al | ||||
| 32Al | ||||
| 33Al | ||||
| 34Al | ||||
| 35Al | ||||
| 36Al | ||||
| 37Al | ||||
| 38Al | ||||
| 39Al | ||||
| 40Al | ||||
| 41Al | ||||
| 42Al |
Нормативно-правовое регулирование и здравоохранение — Параметры и рекомендации по охране здоровья и безопасности
Поиск в базе данных
Список уникальных идентификаторов для поиска элемента в различных базах данных химического реестра
Изучите нашу интерактивную таблицу Менделеева
Сравнение элементов периодической таблицы
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в cookie-файлах может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Атом алюминия — обзор
6.1.8 Номенклатура
Как и другие металлоорганические соединения, соединения алюминия могут быть названы системами, полученными из органической химии (A) или координационной химии (B).В общем, первая система проще и больше подходит для обычных производных, не требующих особой структурной спецификации. Последняя система позволяет специфицировать молекулярную ассоциацию, сольватацию и связывание лигандов. В следующих параграфах будут сформулированы и проиллюстрированы правила номенклатуры, применимые к различным типам соединений алюминия для систем (A) и (B).
Соединения, состоящие из отдельных атомов алюминия, связанных с атомами углерода одной или нескольких органических групп и / или с одним или несколькими атомами водорода, упоминаются в системе (A) путем цитирования таких групп или атомов водорода в алфавитном порядке с последующим указанием слово «алюминий».Между названиями групп и словом «алюминий» пробелы не ставятся. Водород, присоединенный к алюминию, должен обозначаться префиксом «гидридо». Количество идентичных групп указывается префиксами ди, три, тетра или пента или префиксами бис, трис, тетракис или пентакис для сложных групп. Таким образом:
| триметилалюминий | [Me 3 Al] 2 |
| гидридо (диизобутил) алюминий | [Bu 2 i AlH] 3 |
| этил ( метил) фенилалюминий | [EtMePhAl] 2 |
| трис (триметилсилил) алюминий | (Me 3 Si) 3 Al |
В системе (B) все группы присоединены к центральному алюминию атомы, будь то органические, водородные, анионные или нейтральные группы, перечислены в виде префиксов в алфавитном порядке, при этом приведенные выше числовые префиксы используются для обозначения количества идентичных групп.Структура может быть дополнительно обозначена следующим образом: (1) когда непрерывный массив атомов в органической группе связан с алюминием, используется префикс η (читаемый как «эта» или «гапто»), которому может предшествовать арабские числа, обозначающие первый и последний такие связанные атомы; и (2) группы, соединяющие два атома алюминия, имеют префикс μ. Таким образом:
ди-μ-метил (тетраметил) диалюминий ( 3 )
бутил (дифенил) пиридиналюминий BuPh 2 Al · NC 5 H 5
1–3 -η-циклопентадиенил (диметил) алюминий ( 91a )
Чередующиеся скобки полезны для разделения ряда различных заместителей в обеих системах.
Анионные замещенные соединения обозначаются в системе (A) путем указания названий и номеров органических групп в качестве префиксов ( см. Выше ), затем слова «алюминий» и, наконец, анионов с окончанием «ид». В этом соглашении группы AlH рассматриваются как анионы. Приведены названия радикалов и анионов в алфавитном порядке. Таким образом:
| хлорид фенилалюминийбромида | PhAl (Br) Cl |
| di- s -бутилалюминийгидрид | {CH 3 CH 2 C (Me) H} 2 AlH |
| этил (фенилэтинил) этоксид алюминия | Et (PhCC) AlOEt |
Альтернативно вышеуказанные соединения могут быть названы координационными соединениями, i.е. бром- (хлор) фенилалюминий, ди- s -бутил (гидридо) алюминий и этокси (этил) фенилэтинилалюминий.
Алюминийорганические анионы названы так, что все заместители на алюминии указаны в качестве префиксов (система B) и помещены перед корнем «алюминат». Степень окисления может быть помещена в конце как римская цифра (Stock), или вместо нее может быть указан заряд аниона (Ewens – Bassett). Таким образом:
| гидридотрифенилалюминат (III) | [Ph 3 AlH] — |
| триизобутил (метил) алюминат (1-) | [Bu 3 i AlMe] — |
В качестве альтернативы первый ион может быть назван в системе (A) как анион гидрида трифенилалюминия.
Гетероциклы, несущие алюминий в кольце, могут быть названы замещающей номенклатурой (система C) или расширенной номенклатурой Hantzsch – Widman (система D). В первом методе название соответствующего карбоцикла является корневым названием, и один или несколько атомов углерода изображаются как замещенные алюминием или другими гетероатомами. Такие замещающие атомы даются как префиксы, оканчивающиеся на -a, и указываются в заданном порядке «старшинства». 131 Таким образом:
1-этил-1-алюмациклопентан ( 91b )
1-фенил-1-алюминаинден ( 92 )
В системе Гантча – Видмана alumin- ‘имеет суффикс с окончаниями -irene, -etc, -ole, -in, -epin, и т. д., для обозначения трех-, четырех-, пяти-, шести- и семичленных колец, соответственно, которые имеют максимальную ненасыщенность. Полностью насыщенные кольца этих соответствующих размеров могут быть названы алюминораном, -этаном, -оланом, -аном и -епаном. Таким образом, соединения ( 91b ) и ( 92 ) будут называться 1-этилалюминоланом и 1-фенилбензалюминолом.
Алюминиевоорганические соединения субвалентной природы могут быть названы в соответствии со степенью окисления, установленной в соответствии со стандартом Stock (дифенилалюминий (II) равен Ph 2 Al ·).Если кто-то желает рассматривать группу с алюминиевым центром в качестве заместителя, он указывает группы, присоединенные к алюминию, как префиксы к слову «aluminio». Таким образом, группы Et 2 Al и ClPhAl представляют собой группы диэтилалюминия и хлор (фенил) алюминия; и соединение ( 93 ) будет ( E ) -1,2-бис (диэтилалюмино) -1,2-дифенилэтеном.
Алюминиевые сплавы 101 | The Aluminium Association
Quick Read
Алюминиевый сплав — это химический состав, в котором к чистому алюминию добавляются другие элементы для улучшения его свойств, в первую очередь для повышения его прочности.Эти другие элементы включают железо, кремний, медь, магний, марганец и цинк в количествах, которые вместе могут составлять до 15 процентов сплава по весу. Легирование требует тщательного смешивания алюминия с этими другими элементами, пока алюминий находится в расплавленной — жидкой — форме.
Основные факты
- В химии
На свойства алюминия, такие как прочность, плотность, обрабатываемость, электропроводность и коррозионная стойкость, влияет добавление других элементов, таких как магний, кремний или цинк. - Боевая машина Bradley
Военная боевая машина Bradley изготовлена из двух различных алюминиевых сплавов: серии 7xxx и серии 5xxx. Алюминий, которому доверяют обеспечивать безопасность и мобильность солдат, также используется во многих других военных транспортных средствах. - Наша любимая тара для напитков
Самая любимая в Америке тара для напитков — алюминиевая банка — изготавливается из различных алюминиевых сплавов. Оболочка банки состоит из 3004, а крышка — из 5182.Иногда для изготовления одного повседневного предмета требуется более одного сплава. - Горячий и холодный
Алюминиевые сплавы можно сделать более прочными путем термообработки или холодной обработки. Свойства конкретного сплава различны из-за их добавок и обработки.
Алюминиевый сплав 101
Что такое алюминиевый сплав
Алюминиевый сплав — это химический состав, в котором к чистому алюминию добавляются другие элементы для улучшения его свойств, в первую очередь для повышения его прочности.Эти другие элементы включают железо, кремний, медь, магний, марганец и цинк в количествах, которые вместе могут составлять до 15 процентов сплава по весу. Сплавам присваивается четырехзначный номер, в котором первая цифра обозначает общий класс или серию, характеризующуюся его основными легирующими элементами.
Технически чистый алюминий
1xxx Серия
Сплавы серии 1xxx состоят из алюминия чистотой 99% или выше. Эта серия имеет отличную коррозионную стойкость, отличную обрабатываемость, а также высокую теплопроводность и электрическую проводимость.Вот почему серия 1xxx обычно используется для линий электропередачи или линий электропередач, которые соединяют национальные сети через Соединенные Штаты. Обычные обозначения сплавов в этой серии: 1350 для электрических применений и 1100 для лотков для упаковки пищевых продуктов.
Термообрабатываемые сплавы
Некоторые сплавы упрочняются термообработкой на твердый раствор с последующей закалкой или быстрым охлаждением. При термической обработке твердый легированный металл нагревается до определенной точки. Элементы сплава, называемые растворенными веществами, равномерно распределяются с алюминием, превращая их в твердый раствор.Затем металл закаливают или быстро охлаждают, в результате чего растворенные атомы замерзают на месте. Следовательно, растворенные атомы объединяются в мелкодисперсный осадок. Это происходит при комнатной температуре, которая называется естественным старением, или при низкотемпературной работе печи, которая называется искусственным старением.
2xxx Серия
В серии 2xxx в качестве основного легирующего элемента используется медь, которая может быть значительно усилена путем термообработки на твердый раствор. Эти сплавы обладают хорошим сочетанием высокой прочности и ударной вязкости, но не обладают такой стойкостью к атмосферной коррозии, как многие другие алюминиевые сплавы.Поэтому эти сплавы обычно окрашивают или плакируют для таких воздействий. Обычно они плакированы сплавом высокой чистоты или сплавом серии 6ххх, чтобы значительно противостоять коррозии. Сплав 2024, пожалуй, самый широко известный авиационный сплав.
6xxx Серия
Серия 6xxx универсальна, поддается термообработке, легко поддается формованию, сварке и имеет умеренно высокую прочность в сочетании с отличной коррозионной стойкостью. Сплавы этой серии содержат кремний и магний для образования силицида магния внутри сплава.Экструзионные продукты серии 6xxx — лучший выбор для архитектурных и строительных приложений. Сплав 6061 является наиболее широко используемым сплавом этой серии и часто используется в рамах грузовиков и морских судов. Кроме того, в некоторых версиях iPhone использовались алюминиевые профили серии 6xxx.
7xxx серии
Цинк является основным легирующим агентом для этой серии, и когда магний добавляется в меньшем количестве, в результате получается термически обрабатываемый высокопрочный сплав.Другие элементы, такие как медь и хром, также могут быть добавлены в небольших количествах. Наиболее широко известны сплавы 7050 и 7075, которые широко используются в авиастроении. Алюминиевые часы Apple®, выпущенные в 2015 году, были изготовлены из специального сплава серии 7xxx.
Сплавы без термической обработки
Сплавы без термической обработки упрочняются холодной обработкой. Холодная обработка происходит во время методов прокатки или ковки и представляет собой действие по «обработке» металла, чтобы сделать его более прочным.Например, при прокатке алюминия до более тонких размеров он становится прочнее. Это связано с тем, что холодная обработка приводит к образованию дислокаций и вакансий в структуре, что затем препятствует перемещению атомов друг относительно друга. Это увеличивает прочность металла. Легирующие элементы, такие как магний, усиливают этот эффект, что приводит к еще большей прочности.
3xxx Серия
Марганец является основным легирующим элементом в этой серии, часто с добавлением меньшего количества магния.Однако только ограниченный процент марганца может быть эффективно добавлен в алюминий. 3003 — популярный сплав общего назначения, поскольку он имеет умеренную прочность и хорошую обрабатываемость и может использоваться в таких устройствах, как теплообменники и кухонная утварь. Сплав 3004 и его модификации используются в корпусах алюминиевых банок для напитков.
4xxx Серия
Сплавы серии4ххх комбинируются с кремнием, который можно добавлять в достаточных количествах для понижения температуры плавления алюминия без образования хрупкости.Благодаря этому серия 4xxx производит превосходную сварочную проволоку и припои там, где требуется более низкая температура плавления. Сплав 4043 — один из наиболее широко используемых присадочных сплавов для сварки сплавов серии 6ххх в конструкционных и автомобильных приложениях.
5xxx Серия
Магний является основным легирующим агентом серии 5xxx и одним из наиболее эффективных и широко используемых легирующих элементов для алюминия. Сплавы этой серии обладают прочностными характеристиками от умеренных до высоких, а также хорошей свариваемостью и устойчивостью к коррозии в морской среде.Из-за этого алюминиево-магниевые сплавы широко используются в строительстве, резервуарах для хранения, сосудах высокого давления и морских применениях. Примеры распространенных применений сплавов включают: 5052 в электронике, 5083 в морских приложениях, анодированный лист 5005 для архитектурных применений и 5182 для изготовления алюминиевых крышек для банок для напитков. Боевая машина США Брэдли изготовлена из алюминия серий 5083 и 7xxx.
Создание новых сплавов
Более 60 лет назад Алюминиевая ассоциация создала систему обозначения деформируемых сплавов через свой Технический комитет по стандартам на продукцию (TCPS), которая была принята в США в 1954 году.Три года спустя система была утверждена как национальный стандарт Америки h45.1. Эта система обозначений была официально принята странами, подписавшими Декларацию согласия в 1970 году, и стала международной системой обозначений. В том же году Комитет по стандартам h45 по алюминиевым сплавам был уполномочен Американским национальным институтом стандартов (ANSI), при этом Ассоциация выполняла функции секретариата. С тех пор Ассоциация является основной организацией, устанавливающей стандарты для мировой алюминиевой промышленности.
Система регистрации сплавов в настоящее время находится в ведении TCPS Ассоциации. Весь процесс, от регистрации нового сплава до присвоения нового обозначения, занимает от 60 до 90 дней. Когда нынешняя система была первоначально разработана в 1954 году, список включал 75 уникальных химических составов. На сегодняшний день зарегистрировано более 530 активных композиций, и это число продолжает расти. Это подчеркивает, насколько универсальным и повсеместным стал алюминий в нашем современном мире.
