состав, структура, свойства, процесс плавления
Алюминий вошел в промышленное и бытовое применение относительно не так давно. На пересечении XIX – XX было освоено производство этого металла в промышленных масштабах. Все дело в том, что началось производство множества товаров, в которых алюминий широко применялся, например, при строительстве катеров, железнодорожных вагонов и пр. Кстати, именно тогда был показан широкой публике автомобиль с кузовом, выполненным из алюминия.
 Анодированный алюминий
Анодированный алюминийСостав и структура алюминия
Алюминий – это самый распространенный в земной коре металл. Его относят к легким металлам. Он обладает небольшой плотностью и массой. Кроме того, у него довольно низкая температура плавления. В то же время он обладает высокой пластичностью и показывает хорошие тепло- и электропроводные характеристики.

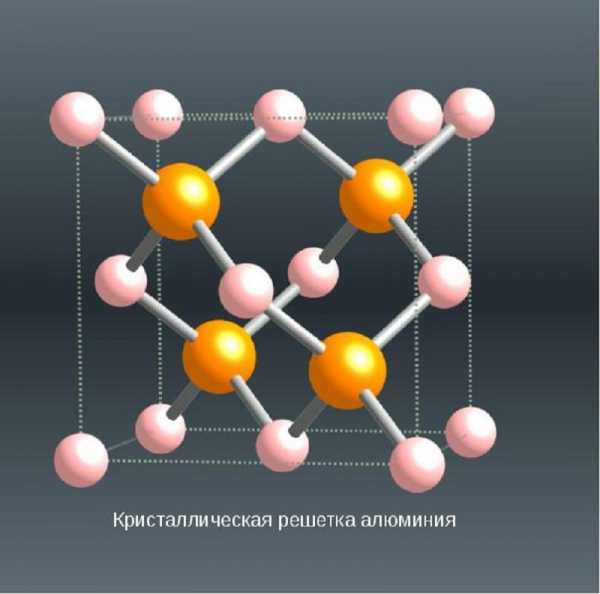
- Кристаллическая решетка алюминия

- Структура алюминия
Предел прочности чистого алюминия составляет всего 90 МПа. Но, если в расплав добавить некоторые вещества, например, медь и ряд других, то предел прочности резко вырастает до 700 МПа. Такого же результат можно достичь, применяя термическую обработку.
Алюминий, обладающий предельно высокой чистотой – 99,99% производят для использования в лабораторных целях. Для применения в промышленности применяют технически чистый алюминий. При получении алюминиевых сплавов применяют такие добавки, как – железо и кремний. Они не растворяются в расплаве алюминия, а из добавка снижает пластичность основного материала, но в то же время повышает его прочность.

Внешний вид простого вещества
Структура этого металла состоит из простейших ячеек, состоящих из четырех атомов. Такую структуру называют гранецентрической.
Проведенные расчеты показывают, что плотность чистого металла составляет 2,7 кг на метр кубический.
Свойства и характеристики
Алюминий – это металл с серебристо-белой поверхности. Как уже отмечалось, его плотность составляет 2,7 кг/м3. Температура составляет 660°C.
Его электропроводность равняется 65% от меди и ее сплавов. Алюминий и бо́льшая часть сплавов из него стойко воспринимает воздействие коррозии. Это связано с тем, что на его поверхности образуется оксидная пленка, которая и защищает основной материал от воздействия атмосферного воздуха.
В необработанном состоянии его прочность равна 60 МПа, но после добавления определенных добавок она вырастает до 700 МПа. Твердость в этом состоянии достигает 250 по НВ.
Алюминий хорошо обрабатывается давлением. Для удаления наклепа и восстановления пластичности после обработки алюминиевые детали подвергают отжигу, при этом температура должна лежать в пределах 350°C.
Температура плавления алюминия
Получение алюминиевого расплава, как и многих других материалов, происходит после того, как к исходному металлу подвели тепловую энергию. Она может быть подведена как непосредственно в него, так и снаружи.
Температура плавления алюминия напрямую зависит от уровня его чистоты:
- Сверхчистый алюминий плавится при температуре 660, 3°C.
- При количестве алюминия 99,5% температура плавления составляет 657°C.
- При содержании этого металла в 99% расплав можно получить при 643°C.

- Алюминиевый расплав

- Процесс получения алюминия
Алюминиевый сплав может включать в свой состав различные вещества, в том числе и легирующие. Их наличие приводит к снижению температуры плавления. Например, при наличии большого количества кремния, температура может понизиться до 500°C. На самом деле понятие температуры плавления относят к чистым металлам. Сплавы не обладают какой-то постоянной температурой плавления. Этот процесс происходит в определенном диапазоне нагрева.
В материаловедении существует понятие – температура солидус и ликвидус.
Первая температура обозначает ту точку, в которой начинается плавление алюминия, а вторая, показывает, при какой температуре, сплав будет окончательно расплавлен. В промежутке между ними сплав будет находиться в кашеобразном состоянии.
Уменьшение температуры
Перед тем как приступать к плавке металла, можно выполнить определенные операции, которые позволят снизить температуру плавления. Например, иногда расплаву подвергают алюминиевый порошок. В порошкообразном состоянии металл начинает плавиться несколько быстрее. Но при такой обработке возникает реальная опасность того, что при взаимодействии с кислородом, который содержится в атмосфере алюминиевый порошок, начнет окисляться с большим выделением тепла и образования оксидов металла, этот процесс происходит при температуре 2300 градусов. Главное, в этот момент плавления не допустить контакта расплава и воды. Это приведет к взрыву.
Процесс плавления в домашних условиях
Относительно низкая температура плавления алюминия позволяет проводить эту операцию в домашних условия. Надо сразу отметить, что в качестве сырья в домашней мастерской использовать порошкообразную смесь слишком опасно. Поэтому в качестве сырья применяют или чушки, или нарезанную проволоку. Если к будущему изделию нет особых требований по качеству, то для плавления можно использовать все, что изготовленного из этого металла.

Плавка алюминия в самодельном горне
При этом не особо важно, будет сырье покрыто краской или нет. Когда происходит плавление алюминия, все посторонние вещества просто выгорят и будут удалены вместе со шлаком.
Для получения качественного результата плавки необходимо использовать материалы, которые называют флюсами. Они призваны решать задачу по связыванию и удалению из расплава посторонних примесей и загрязнений.
Средства защиты
Домашний мастер, решивший в домашних условиях выполнять плавление алюминия должен отдавать себе отчет в том, что это довольно опасный процесс. И поэтому без применения средств защиты не обойтись. В частности, должны быть использованы перчатки, фартук, очки. Дело в том, что температура расплава лежит в пределах 600 градусов. Поэтому имеет смысл использовать средства защиты, которые применяют сварщики.

Использование средств защиты при плавке алюминия
Кстати, при плавлении алюминия и использовании очищающих химикатов необходимо защищать органы дыхания от продуктов их сгорания.
Выбор формы для литья
При выборе формы для отливки алюминия домашний мастер должен понимать, а для какой цели он обрабатывает алюминий. Если будущая отливка будет предназначена для использования в качестве припоя, то использовать, какие-то специальные формы, нет необходимости. Для этого можно использовать металлический лист, на котором можно остудить расплавленный металл.
Но если возникает необходимость получения даже простой детали, то мастер должен определиться с типом формы для литья.
Форму можно изготовить из гипса. Для этого, гипс в жидком состоянии заливают в обработанную маслом форму. После того, как начнет застывать, в него устанавливают литейную модель. Для того, чтобы в форму можно было залить расплавленный металл необходимо сформировать литник. Для этого в форму устанавливают цилиндрическую деталь. Формы бывают разъемные и нет. Процесс изготовления разъемной формы усложняется тем, что модель будет находиться в двух полуформах. После застывания их разделяют, удаляют модель и соединяют снова. Форма готова к работе.

Кокиль для литья алюминия
Для получения качественных отливок целесообразно использовать металлические формы (кокили), но изготавливать их целесообразно только в заводских условиях.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
stankiexpert.ru
План-конспект урока по химии (9 класс) по теме: Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства алюминия.
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ОБЩАЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 81
Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства алюминия.
Автор Ицкович Т.Я.
учитель химии
МБОУ ООШ №81
2013г
Тема урока: Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства алюминия.
Цели урока: рассмотреть распространение алюминия в природе, его физические и химические свойства, а также свойства образуемых им соединений.
Ход работы
1. Организационный момент урока.
2. Изучение нового материала. Алюминий
Главную подгруппу III группы периодической системы составляют бор (В),алюминий (Аl), галлий (Ga), индий (In) и таллий (Тl).
Как видно из приведенных данных, все эти элементы были открыты в XIXстолетии.
Открытие металлов главной подгруппы III группы
В | Al | Ga | In | Tl |
1806 г. | 1825 г. | 1875 г. | 1863 г. | 1861 г. |
Г.Люссак, | Г.Х.Эрстед | Л. де Буабодран | Ф.Рейх, | У.Крукс |
Л. Тенар | (Дания) | (Франция) | И.Рихтер | (Англия) |
(Франция) | (Германия) |
Бор представляет собой неметалл. Алюминий — переходный металл, а галлий, индий и таллий — полноценные металлы. Таким образом, с ростом радиусов атомов элементов каждой группы периодической системы металлические свойства простых веществ усиливаются.
В данной лекции мы подробнее рассмотрим свойства алюминия.
1. Положение алюминия в таблице Д. И. Менделеева. Строение атома, проявляемые степени окисления.
Элемент алюминий расположен в III группе, главной «А» подгруппе, 3 периоде периодической системы, порядковый номер №13, относительная атомная массаAr(Al) = 27. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными.
Al +13 )2)8)3 , p – элемент,
Основное состояние 1s22s22p63s23p1 |
|
Возбуждённое состояние 1s22s22p63s13p2 |
|
Алюминий проявляет в соединениях степень окисления +3:
Al0 – 3 e- → Al+3
2. Физические свойства
Алюминий в свободном виде — серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Температура плавления 650 оС. Алюминий имеет невысокую плотность (2,7 г/см3) — примерно втрое меньше, чем у железа или меди, и одновременно — это прочный металл.
3. Нахождение в природе
По распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7,45 до 8,14 % от массы земной коры.
В природе алюминий встречается только в соединениях (минералах).
Некоторые из них:
Бокситы — Al2O3 • h3O (с примесями SiO2, Fe2O3, CaCO3)
Нефелины — KNa3[AlSiO4]4
Алуниты — KAl(SO4)2 • 2Al(OH)3
Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3)
Корунд — Al2O3
Полевой шпат (ортоклаз) — K2O×Al2O3×6SiO2
Каолинит — Al2O3×2SiO2 × 2h3O
Алунит — (Na,K)2SO4×Al2(SO4)3×4Al(OH)3
Берилл — 3ВеО • Al2О3 • 6SiO2
Боксит |
|
Al2O3 | Корунд |
Рубин | |
Сапфир |
4. Химические свойства алюминия и его соединений
Алюминий легко взаимодействует с кислородом при обычных условиях и покрыт оксидной пленкой (она придает матовый вид).
Её толщина 0,00001 мм, но благодаря ней алюминий не коррозирует. Для изучения химических свойств алюминия оксидную пленку удаляют. (При помощи наждачной бумаги, или химически: сначала опуская в раствор щелочи для удаления оксидной пленки, а затем в раствор солей ртути для образования сплава алюминия с ртутью – амальгамы).
I. Взаимодействие с простыми веществами
Алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды. При нагревании он взаимодействует с серой (200 °С), азотом (800 °С), фосфором (500 °С) и углеродом (2000 °С), с йодом в присутствии катализатора — воды:
2Аl + 3S = Аl2S3 (сульфид алюминия),
2Аl + N2 = 2АlN (нитрид алюминия),
Аl + Р = АlР (фосфид алюминия),
4Аl + 3С = Аl4С3 (карбид алюминия).
2 Аl + 3 I2 = 2 AlI3 (йодид алюминия)
Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана:
Al2S3 + 6h3O = 2Al(OH)3 + 3h3S
Al4C3 + 12h3O = 4Al(OH)3+ 3Ch5
В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты:
4Аl + 3O2 = 2Аl2О3 + 1676 кДж.
II. Взаимодействие со сложными веществами
Взаимодействие с водой:
2 Al + 6 h3O = 2 Al (OH)3 + 3 h3
без оксидной пленки
Взаимодействие с оксидами металлов:
Алюминий – хороший восстановитель, так как является одним из активных металлов. Стоит в ряду активности сразу после щелочно-земельных металлов. Поэтому восстанавливает металлы из их оксидов. Такая реакция – алюмотермия – используется для получения чистых редких металлов, например таких, как вольфрам, ваннадий и др.
3 Fe3O4 + 8 Al = 4 Al2O3 + 9 Fe +Q
Термитная смесь Fe3O4 и Al (порошок) –используется ещё и в термитной сварке.
Сr2О3 + 2Аl = 2Сr + Аl2О3
Взаимодействие с кислотами:
С раствором серной кислоты: 2 Al + 3 h3SO4 = Al2(SO4)3 + 3 h3
С холодными концентрированными серной и азотной не реагирует (пассивирует). Поэтому азотную кислоту перевозят в алюминиевых цистернах. При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода:
2Аl + 6Н2SО4(конц) = Аl2(SО4)3 + 3SО2 + 6Н2О,
Аl + 6НNO3(конц) = Аl(NO3)3 + 3NO2 + 3Н2О.
Взаимодействие со щелочами.
2 Al + 2 NaOH + 6 h3O = 2 NaAl(OH)4 + 3 h3
Na[Аl(ОН)4] – тетрагидроксоалюминат натрия
По предложению химика Горбова, в русско-японскую войну эту реакцию использовали для получения водорода для аэростатов.
С растворами солей:
2Al + 3CuSO4 = Al2(SO4)3 + 3Cu
Если поверхность алюминия потереть солью ртути, то происходит реакция:
2Al + 3HgCl2 = 2AlCl3 + 3Hg
Выделившаяся ртуть растворяет алюминий, образуя амальгаму.
5. Применение алюминия и его соединений
Физические и химические свойства алюминия обусловили его широкое применение в технике. Крупным потребителем алюминия является авиационная промышленность: самолет на 2/3 состоит из алюминия и его сплавов. Самолет из стали оказался бы слишком тяжелым и смог бы нести гораздо меньше пассажиров. Поэтому алюминий называют крылатым металлом. Из алюминия изготовляют кабели и провода: при одинаковой электрической проводимости их масса в 2 раза меньше, чем соответствующих изделий из меди.
Учитывая коррозионную устойчивость алюминия, из него изготовляют детали аппаратов и тару для азотной кислоты. Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии, а также для отражения тепловых лучей такой краской покрывают нефтехранилища, костюмы пожарных.
Оксид алюминия используется для получения алюминия, а также как огнеупорный материал.
Гидроксид алюминия – основной компонент всем известных лекарств маалокса, альмагеля, которые понижают кислотность желудочного сок.
Соли алюминия сильно гидролизуются. Данное свойство применяют в процессе очистки воды. В очищаемую воду вводят сульфат алюминия и небольшое количество гашеной извести для нейтрализации образующейся кислоты. В результате выделяется объемный осадок гидроксида алюминия, который, оседая, уносит с собой взвешенные частицы мути и бактерии.
Таким образом, сульфат алюминия является коагулянтом.
6. Получение алюминия
1) Современный рентабельный способ получения алюминия был изобретен американцем Холлом и французом Эру в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит Na3AlF6 растворяет Al2O3, как вода растворяет сахар. Электролиз “раствора” оксида алюминия в расплавленном криолите происходит так, как если бы криолит был только растворителем, а оксид алюминия — электролитом.
2Al2O3 эл.ток→ 4Al + 3O2
В английской “Энциклопедии для мальчиков и девочек” статья об алюминии начинается следующими словами: “23 февраля 1886 года в истории цивилизации начался новый металлический век — век алюминия. В этот день Чарльз Холл, 22-летний химик, явился в лабораторию своего первого учителя с дюжиной маленьких шариков серебристо-белого алюминия в руке и с новостью, что он нашел способ изготовлять этот металл дешево и в больших количествах”. Так Холл сделался основоположником американской алюминиевой промышленности и англосаксонским национальным героем, как человек, сделавшим из науки великолепный бизнес.
2) 2Al2O3 + 3 C = 4 Al + 3 CO2
ЭТО ИНТЕРЕСНО:
- Металлический алюминий первым выделил в 1825 году датский физик Ханс Кристиан Эрстед. Пропустив газообразный хлор через слой раскаленного оксида алюминия, смешанного с углем, Эрстед выделил хлорид алюминия без малейших следов влаги. Чтобы восстановить металлический алюминий, Эрстеду понадобилось обработать хлорид алюминия амальгамой калия. Через 2 года немецкий химик Фридрих Вёллер. Усовершенствовал метод, заменив амальгаму калия чистым калием.
- В 18-19 веках алюминий был главным ювелирным металлом. В 1889 году Д.И.Менделеев в Лондоне за заслуги в развитии химии был награжден ценным подарком – весами, сделанными из золота и алюминия.
- К 1855 году французский ученый Сен- Клер Девиль разработал способ получения металлического алюминия в технических масштабах. Но способ был очень дорогостоящий. Девиль пользовался особым покровительством Наполеона III, императора Франции. В знак своей преданности и благодарности Девиль изготовил для сына Наполеона, новорожденного принца, изящно гравированную погремушку – первое «изделие ширпотреба» из алюминия. Наполеон намеревался даже снарядить своих гвардейцев алюминиевыми кирасами, но цена оказалась непомерно высокой. В то время 1 кг алюминия стоил 1000 марок, т.е. в 5 раз дороже серебра. Только после изобретения электролитического процесса алюминий по своей стоимости сравнялся с обычными металлами.
- А знаете ли вы, что алюминий, поступая в организм человека, вызывает расстройство нервной системы. При его избытке нарушается обмен веществ. А защитными средствами является витамин С, соединения кальция, цинка.
- При сгорании алюминия в кислороде и фторе выделяется много тепла. Поэтому его используют как присадку к ракетному топливу. Ракета «Сатурн» сжигает за время полёта 36 тонн алюминиевого порошка. Идея использования металлов в качестве компонента ракетного топлива впервые высказал Ф. А. Цандер.
3. Закрепление изученного материала
№1. Для получения алюминия из хлорида алюминия в качестве восстановителя можно использовать металлический кальций. Составьте уравнение данной химической реакции, охарактеризуйте этот процесс при помощи электронного баланса.
Подумайте! Почему эту реакцию нельзя проводить в водном растворе?
№2. Закончите уравнения химических реакций:
Al + h3SO4 (раствор) ->
Al + CuCl2 ->
Al + HNO3(конц) -t->
Al + NaOH + h3O ->
№3. Решите задачу:
На сплав алюминия и меди подействовали избытком концентрированного раствора гидроксида натрия при нагревании. Выделилось 2,24 л газа (н.у.). Вычислите процентный состав сплава, если его общая масса была 10 г?
4. Домашнее задание
Примечание: на уроке может использоваться презентация « Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства алюминия.»
nsportal.ru
Алюминий и его характеристики
Общая характеристика алюминия
Алюминий – самый распространенный в земной коре металл. Он входит в состав глин, полевых шпатов, слюд и многих других минералов. Общее содержание алюминия в земной коре составляет 8% (масс.).
Алюминий – серебристо-белый (рис. 1) легкий металл. Он легко вытягивается в проволоку и прокатывается в тонкие листы.
При комнатной температуре алюминий не изменяется на воздухе, но лишь потому, что его поверхность покрыта тонкой пленкой оксида, обладающего очень сильным защитным действием.

Рис. 1. Алюминий. Внешний вид.
Атомная и молекулярная масса алюминия
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии алюминий существует в виде одноатомных молекул Al, значения его атомной и молекулярной масс совпадают. Они равны 26,9815.
Изотопы алюминия
Известно, что в природе алюминий может находиться в виде одного стабильного изотопа 27Al. Массовое число равно 27. Ядро атома изотопа алюминия 27Al содержит тринадцать протонов и четырнадцать нейтронов.
Существуют радиоактивные изотопы алюминия с массовыми числами от 21-го до 42-х, среди которых наиболее долгоживущим является изотоп 26Al, период полураспада которого составляет 720 тысяч лет.
Ионы алюминия
На внешнем энергетическом уровне атома алюминия имеется три электрона, которые являются валентными:
В результате химического взаимодействия алюминий отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
Al0-3e → Al3+.
Молекула и атом алюминия
В свободном состоянии алюминий существует в виде одноатомных молекул Al. Приведем некоторые свойства, характеризующие атом и молекулу алюминия:
|
Энергия ионизации атома, эВ |
5,99 |
|
Относительная электроотрицательность |
1,61 |
|
Радиус атома, нм |
0,143 |
|
Стандартная энтальпия диссоциации молекул при 25oС, кДж/моль |
329,1 |
Сплавы алюминия
Основное применение алюминия – производство сплавов на его основе. Легирующие добавки (например, медь, кремний, магний, цинк, марганец) вводят в алюминий главным образом для повышения его прочности.
Широкое применение имеют дуралюмины, содержащие медь и магний, силумины, в которых основной добавкой служит кремний, магналий (сплав алюминия с 9,5-11,5% магния).
Алюминий – одна из наиболее распространенных добавок в сплавах на основе меди, магния, титана, никеля, цинка и железа.
Примеры решения задач
ru.solverbook.com
общая характеристика, строение; свойства и получение — урок. Химия, 8–9 класс.
Алюминий как атом и химический элемент
Алюминий находится в \(IIIA\) группе Периодической системы химических элементов Д. И. Менделеева.
Строение электронной оболочки атома алюминия — [Ne]3s23p1.
На внешнем электронном уровне атом содержит \(3\) электрона.
Поэтому в своих соединениях алюминий всегда проявляет только одну степень окисления, равную \(+3\).
Обрати внимание!
По распространённости в земной коре алюминий занимает третье место после кислорода и кремния, а среди металлов — первое.
В земной коре алюминий встречается только в составе соединений.
Основные природные минералы алюминия:
- боксит, состав которого можно примерно выразить формулой Al2O3 \(•\) xh3O,
- нефелин (Na,K)O2 \(•\) Al2O3 \(•\) 2h3O,
- каолинит Al2O3 \(•\) SiO2 \(•\) 2h3O.
Каолинит — образец многочисленных алюмосиликатов, включающих преимущественно атомы кремния и кислорода, которые очень широко распространены в природе.
Физические свойства
В свободном состоянии алюминий — светлый блестящий металл, лёгкий, относительно мягкий, легкоплавкий, имеет высокую тепло- и электропроводность.
Алюминий является химически активным металлом, однако при обычных условиях он устойчив на воздухе и сохраняет свой металлический блеск длительное время. Это объясняется тем, что поверхность алюминия покрыта тонкой, невидимой глазу, прозрачной, но плотной плёнкой оксида алюминия, которая препятствует взаимодействию алюминия с компонентами атмосферы (парами воды и кислородом).
Свойства алюминия обусловили его широкое применение и необходимость получения алюминия в свободном виде.
В лабораторных условиях небольшое количество алюминия можно получить путём восстановления хлорида алюминия калием при высокой температуре:
AlCl3+3K=t3KCl+Al.
Так был впервые получен алюминий.
В промышленных условиях алюминий получают из бокситов. При нагревании бокситов образуется оксид алюминия. Восстановить алюминий из оксида с помощью традиционных восстановителей практически невозможно, поэтому его получают методом электролиза.
При этом на катоде восстанавливается алюминий, а на аноде — окисляется кислород.
Суммарная реакция электролиза выражается уравнением:
2Al2O3=4Al+3O2↑.
www.yaklass.ru
Алюминий: свойства химические и физические
Одними из самых удобных в обработке материалов являются металлы. Среди них также есть свои лидеры. Так, например, основные свойства алюминия известны людям уже давно. Они настолько подходят для применения в быту, что данный металл стал очень популярным. Каковы же свойства алюминия как простого вещества и как атома, рассмотрим в данной статье.

История открытия алюминия
Издавна человеку было известно соединение рассматриваемого металла — алюмокалиевые квасцы. Оно использовалось как средство, способное набухать и связывать между собой компоненты смеси, это было необходимо и при выделке кожаных изделий. О существовании в чистом виде оксида алюминия стало известно в XVIII веке, во второй его половине. Однако при этом чистое вещество получено не было.
Сумел же выделить металл из его хлорида впервые ученый Х. К. Эрстед. Именно он обработал амальгамой калия соль и выделил из смеси серый порошок, который и был алюминием в чистом виде.
Тогда же стало понятно, что химические свойства алюминия проявляются в его высокой активности, сильной восстановительной способности. Поэтому долгое время с ним никто больше не работал.

Однако в 1854 году француз Девиль смог получить слитки металла методом электролиза расплава. Этот способ актуален и по сей день. Особенно массовое производство ценного материала началось в XX веке, когда были решены проблемы получения большого количества электроэнергии на предприятиях.
На сегодняшний день данный металл — один из самых популярных и применяемых в строительстве и бытовой промышленности.
Общая характеристика атома алюминия
Если характеризовать рассматриваемый элемент по положению в периодической системе, то можно выделить несколько пунктов.
- Порядковый номер — 13.
- Располагается в третьем малом периоде, третьей группе, главной подгруппе.
- Атомная масса — 26,98.
- Количество валентных электронов — 3.
- Конфигурация внешнего слоя выражается формулой 3s23p1.
- Название элемента — алюминий.
- Металлические свойства выражены сильно.
- Изотопов в природе не имеет, существует только в одном виде, с массовым числом 27.
- Химический символ — AL, в формулах читается как «алюминий».
- Степень окисления одна, равна +3.
Химические свойства алюминия полностью подтверждаются электронным строением его атома, ведь имея большой атомный радиус и малое сродство к электрону, он способен выступать в роли сильного восстановителя, как и все активные металлы.
Алюминий как простое вещество: физические свойства
Если говорить об алюминии, как о простом веществе, то он представляет собой серебристо-белый блестящий металл. На воздухе быстро окисляется и покрывается плотной оксидной пленкой. Тоже самое происходит и при действии концентрированных кислот.

Наличие подобной особенности делает изделия из этого металла устойчивыми к коррозии, что, естественно, очень удобно для людей. Поэтому и находит такое широкое применение в строительстве именно алюминий. Свойства вещества также еще интересны тем, что данный металл очень легкий, при этом прочный и мягкий. Сочетание таких характеристик доступно далеко не каждому веществу.
Можно выделить несколько основных физических свойств, которые характерны для алюминия.
- Высокая степень ковкости и пластичности. Из данного металла изготовляют легкую, прочную и очень тонкую фольгу, его же прокатывают в проволоку.
- Температура плавления — 660 0С.
- Температура кипения — 2450 0С.
- Плотность — 2,7 г/см3.
- Кристаллическая решетка объемная гранецентрированная, металлическая.
- Тип связи — металлическая.
Физические и химические свойства алюминия определяют области его применения и использования. Если говорить о бытовых сторонах, то большую роль играют именно уже рассмотренные нами выше характеристики. Как легкий, прочный и антикоррозионный металл, алюминий применяется в самолето- и кораблестроении. Поэтому эти свойства очень важно знать.
Химические свойства алюминия
С точки зрения химии, рассматриваемый металл — сильный восстановитель, который способен проявлять высокую химическую активность, будучи чистым веществом. Главное — это устранить оксидную пленку. В этом случае активность резко возрастает.
Химические свойства алюминия как простого вещества определяются его способностью вступать в реакции с:
- кислотами;
- щелочами;
- галогенами;
- серой.
С водой он не взаимодействует при обычных условиях. При этом из галогенов без нагревания реагирует только с йодом. Для остальных реакций нужна температура.

Можно привести примеры, иллюстрирующие химические свойства алюминия. Уравнения реакций взаимодействия с:
- кислотами — AL + HCL = AlCL3 + H2;
- щелочами — 2Al + 6H2O + 2NaOH = Na[Al(OH)4] + 3Н2;
- галогенами — AL + Hal = ALHal3;
- серой — 2AL + 3S = AL2S3.
В целом, самое главное свойство рассматриваемого вещества — это высокая способность к восстановлению других элементов из их соединений.
Восстановительная способность
Восстановительные свойства алюминия хорошо прослеживаются на реакциях взаимодействия с оксидами других металлов. Он легко извлекает их из состава вещества и позволяет существовать в простом виде. Например: Cr2O3 + AL = AL2O3 + Cr.
В металлургии существует целая методика получения веществ, основанная на подобных реакциях. Она получила название алюминотермии. Поэтому в химической отрасли данный элемент используется именно для получения других металлов.
Распространение в природе
По распространенности среди других элементов-металлов алюминий занимает первое место. Его в земной коре содержится 8,8 %. Если же сравнивать с неметаллами, то место его будет третьим, после кислорода и кремния.
Вследствие высокой химической активности он не встречается в чистом виде, а лишь в составе различных соединений. Так, например, известно множество руд, минералов, горных пород, в состав которых входит алюминий. Однако добывается он только из бокситов, содержание которых в природе не слишком велико.

Самые распространенные вещества, содержащие рассматриваемый металл:
- полевые шпаты;
- бокситы;
- граниты;
- кремнезем;
- алюмосиликаты;
- базальты и прочие.
В небольшом количестве алюминий обязательно входит в состав клеток живых организмов. Некоторые виды плаунов и морских обитателей способны накапливать этот элемент внутри своего организма в течение жизни.
Получение
Физические и химические свойства алюминия позволяют получать его только одним способом: электролизом расплава соответствующего оксида. Однако процесс этот технологически сложен. Температура плавления AL2O3 превышает 2000 0С. Из-за этого подвергать электролизу непосредственно его не получается. Поэтому поступают следующим образом.
- Добывают бокситы.
- Очищают их от примесей, оставляя лишь оксид алюминия.
- Затем плавят криолит.
- Добавляют туда оксид.
- Данную смесь элекролизуют и получают чистый алюминий и углекислый газ.

Выход продукта составляет 99,7 %. Однако возможно получение и еще более чистого металла, который используется в технических целях.
Применение
Механические свойства алюминия не столь хороши, чтобы применять его в чистом виде. Поэтому чаще всего используются сплавы на основе данного вещества. Таких много, можно назвать самые основные.
- Дюралюминий.
- Алюминиево-марганцевые.
- Алюминиево-магниевые.
- Алюминиево-медные.
- Силумины.
- Авиаль.
Основное их отличие — это, естественно, сторонние добавки. Во всех основу составляет именно алюминий. Другие же металлы делают материал более прочным, стойким к коррозии, износоустойчивым и податливым в обработке.
Можно назвать несколько основных областей применения алюминия как в чистом виде, так и в виде его соединений (сплавов).
- Для изготовления проволоки и фольги, используемой в быту.
- Изготовление посуды.
- Самолетостроение.
- Кораблестроение.
- Строительство и архитектура.
- Космическая промышленность.
- Создание реакторов.

Вместе с железом и его сплавами алюминий — самый важный металл. Именно эти два представителя периодической системы нашли самое обширное промышленное применение в руках человека.
Свойства гидроксида алюминия
Гидроксид — самое распространенное соединение, которое образует алюминий. Свойства химические его такие же, как и у самого металла, — он амфотерный. Это значит, что он способен проявлять двойственную природу, вступая в реакции как с кислотами, так и со щелочами.
Сам по себе гидроксид алюминия — это белый студенистый осадок. Получить его легко при взаимодействии соли алюминия с щелочью или гидроксидом аммония. При взаимодействии с кислотами данный гидроксид дает обычную соответствующую соль и воду. Если же реакция идет с щелочью, то формируются гидроксокомплексы алюминия, в которых его координационное число равно 4. Пример: Na[Al(OH)4] — тетрагидроксоалюминат натрия.
fb.ru
Алюминий: строение атома, распространение в природе. Физические и химические свойства алюминия. Применение алюминия — Химия — Мастер-класс
Алюминий: строение атома, распространение в природе. Физические и химические свойства алюминия. Применение алюминия
Алюминий — металлический элемент главной подгруппы III группы 3 периода периодической системы химических элементов. Электронная конфигурация внешнего энергетического уровня его атома 3
Алюминий по
распространенности занимает третье место среди других элементов. Массовая доля Алюминия в
земной коре составляет 8,5 %. В природе он встречается только в виде
соединений. Он входит в состав алюмосиликатов, к которым относятся: глины, слюды,
полевые шпаты, в частности каолин. Промышленно важным алюминиевой рудой являются боксит
Al
Простое вещество алюминий — блестящий серебристо-белый металл. Он имеет высокую способность отражать световые и тепловые лучи, а также высокие тепло — и электропроводность. Температура плавления алюминия 660 °С. Это достаточно легкий и пластичный металл. С него можно производить тонкую проволоку и фольгу.
Химически алюминий очень активный. На воздухе он быстро окисляется и покрывается тонкой пленкой алюминий оксида. Оксидная пленка является достаточно прочной и предопределяет коррозионную стойкость алюминия. При нагревании на воздухе или в кислороде алюминий сгорает, образуя также алюминий оксид:
4Al + 3O2 = 2Al2O3.
Алюминий активно реагирует с другими неметаллами. При обычных условиях он взаимодействует с хлором и бромом, образуя соли, например, алюминий хлорид:
2Al + 3Сl2 = 2AlСl
Реакция алюминия с йодом происходит, если к смеси алюминиевого порошка с йодом добавить несколько капель воды, которая выполняет роль катализатора:
2Al + 3I2 = 2AlІ3.
При нагревании алюминий реагирует с серой, азотом, углеродом, например:
2Al + 3S = Al2S3.
В обычном состоянии алюминий покрыт защитной оксидной пленкой и является устойчивым к воздействию воды даже при нагревании. Если пленка алюминий оксида будет разрушена, то алюминий будет активно реагировать с водой с выделением газуватого водорода:
2Al + 6Н2О = 2Al(ОН)3↓ + 3Н2↑.
Алюминий реагирует с растворами кислот с образованием солей и водорода, например:
2Al + 6НСl= 2AlCl3 + 3Н2↑.
Концентрированные сульфатная и азотная кислоты пассивируют алюминий, то есть увеличивают прочность оксидной пленки. Таким образом, алюминий с ними не реагирует.
Оксидная пленка легко растворяется в щелочах и алюминий реагирует с растворами щелочей с выделением водорода:
Алюминий восстанавливает металлы из их оксидов при нагревании (алюмінотермія), например:
Fe2O3 + 2Al = 2Fe + Al2O3.
Алюминий добывают путем электролиза глинозема, растворенного в расплавленном криолите Na3[AlF6].
Широкое применение алюминия обусловлено его свойствами. Сочетание легкости с достаточно высокой электропроводностью позволяет применять алюминий как проводник электрического тока. Алюминий и его сплавы используют практически во всех областях современной техники: в авиационной и автомобильной промышленности, железнодорожном и водном транспорте, машиностроении и т.п. Благодаря высокой коррозионной стойкости алюминий широко применяют при изготовлении аппаратуры для производства пищевых продуктов и некоторых химических веществ. Из полированного алюминия изготавливают зеркала и поверхности нагревательных и осветительных рефлекторов. Алюминий используют как розкисник сталей и других сплавов. Им восстанавливают металлы из их оксидов.
na-uroke.in.ua
Общие сведения об алюминии и его атомарном строении
Нахождение в природе
Практически единственным методом получения металлического алюминия является электролиз криолитоглиноземного расплава. Основное сырье для этого процесса — глинозем (Al
Строение атома и кристаллическая решетка
В Периодической системе Д.И. Менделеева порядковый номер алюминия 13, его атомная масса составляет 26,9815 (по углероду 12С) и 26,98974 (по кислороду 16O).
Основным изотопом является 27Al, который устойчив и состоит из 14 нейтронов и 13 протонов. Кроме одного изотопа 26Al, период полураспада которого равен 106 лет, установлено существование еще шести изотопов с массовыми числами 23, 24, 25, 26, 28 и 29 и с малыми периодами полураспада (от 0,13 до 396с), а также пренебрежимо малой распространенностью в природе (от 2×10-5 до 1,5×10-4 %).
Алюминий трехвалентен, и 13 его электронов распределены на электронных оболочках ls2, 2s2, 2р6, 3s2, 3р1. На внешнем электронном слое М находятся три валентных электрона: два на 3s-орбите с потенциалами ионизации 1800 и 2300 кДж/моль и один на 3p-орбите с потенциалом 574,5 кДж/моль, и поэтому в химических соединениях алюминий обычно трехвалентен (Al3+). Так как электрон на p-орбите с ядром атома связан слабее, чем два спаренных электрона на s-орбите, то при определенных условиях, теряя р-электрон, атом алюминия становится одновалентным ионом (Al+), образуя соединения низшей валентности (субсоединения), и еще реже — Al2+.
Кристаллическая решетка алюминия — гранецентрированный куб, которая устойчива при температуре от 4°К до точки плавления. В алюминии нет аллотропических превращений, т.е. его строение постоянно. Элементарная ячейка состоит из четырех атомов размером 4,049596×10-10 м; при 25 °С атомный диаметр (кратчайшее расстояние между атомами в решетке) составляет 2,86×10-10 м, а атомный объем 9,999×10-6 м3/г-атом . Примеси в алюминии незначительно влияют на величину параметра решетки.
Химическая активность
Алюминий обладает большой химической активностью, энергия образования его соединений с кислородом, серой и углеродом весьма велика. В ряду напряжений он находится среди наиболее электроотрицательных элементов, и его нормальный электродный потенциал равен -1,67 В. В обычных условиях, взаимодействуя с кислородом воздуха, алюминий покрыт тонкой (2-10-5 см), но прочной пленкой оксида алюминия Al203, которая защищает от дальнейшего окисления, что обусловливает его высокую коррозионную стойкость. Однако при наличии в алюминии или окружающей среде Hg, Na, Mg, Ca, Si, Си и некоторых других элементов прочность оксидной пленки и ее защитные свойства резко снижаются.
Расплавленный алюминий активно реагирует с оксидом и диоксидом углерода и парами воды. Наибольший интерес представляет растворимость водорода в алюминии, так как присутствие водорода в металле негативно влияет на механические свойства алюминия и его сплавов. Водород в алюминии в количествах, превосходящих растворимость в твердом состоянии, рассматривается как вредная примесь.
Алюминий обладает амфотерными свойствами, т.е. реагируя с кислотами, образует соответствующие соли, а при взаимодействии с щелочами — алюминаты. Эта особенность существенно расширяет возможности извлечения алюминия из руд различного состава. Алюминий растворяется в серной и соляной кислотах, а также в щелочах, но концентрированная азотная и органическая кислоты на алюминий не действуют.
www.metmk.com.ua