| Относительная электроотрицательность (по Полингу): | 1,55 |
| Температура плавления: | 327,502°C |
| Температура кипения: | 1740°C |
| Теплопроводность: | 35 |
| Плотность: | 11,34 г/см3 |
| Открыт: | Известен с глубокой древности |
| Цвет в твёрдом состоянии: | Голубовато-белый |
| Тип: | Металл |
| Орбитали: | 1s22s22p63s23p63d104s24p64d104f145s25p65d105f06s26p2 |
|
Pb — 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 4f14 5d10 6s2 6p2 Pb — [Xe] 4f14 5d10 6s2 6p2 |
|
| Валентность: | +2, +4 |
| Степени окисления: | 0, +II, IV |
| Сверхпроводящее состояние при температуре: | 7,23 К |
| Потенциалы ионизации: | 7,415 В 15,028 В 31,943 В |
| Электропроводность в тв. фазе: | 5,27*106 при 273K |
| Ковалентный радиус: | 1,47 Å |
| Атомный объем: | 18,17 см^3/моль |
| Атомный радиус: | 1,81 Å |
| Теплота распада: | 4,799 Кдж/моль |
| Теплота парообразования: | 177,7 Кдж/моль |
| Кристаллическая структура: | Гранецентрированный куб. Высота, ширина, длина равны. Все углы прямые. По атому имеется в каждой вершине, а также атом в центре каждой грани |
Свинец
Свинец — 82 элемент таблицы Менделеева
Свинец (лат. Plumbum) — химический элемент, ковкий, сравнительно легкоплавкий металл серого цвета.
Происхождение слова «свинец» неясно. В большинстве славянских языков (болгарском, сербско-хорватском, чешском, польском) свинец называется оловом. Слово с тем же значением, но похожее по произношению на «свинец», встречается только в языках балтийской группы: svinas (литовский), svins (латышский).
Латинское же plumbum (тоже неясного происхождения) дало английское слово plumber — водопроводчик (когда-то трубы зачеканивали мягким свинцом), и название венецианской тюрьмы со свинцовой крышей — Пьомбе, из которой по некоторым данным ухитрился бежать Казанова. Известен с глубокой древности. Изделия из этого металла (монеты, медальоны) использовались в Древнем Египте, свинцовые водопроводные трубы — в Древнем Риме. Указание на свинец как на определённый металл имеется в Ветхом Завете. Выплавка свинца была первым из известных человеку металлургических процессов. До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
Содержание в земной коре 1,6·10-3 % по массе. Самородный свинец встречается редко. Входит в состав 80 различных минералов. Важнейшие из них: галенит PbS, церуссит PbCO3, англезит PbSO4; из более сложных — тиллит PbSnS2 и бетехтинит Pb2(Cu,Fe)21S15, а также сульфосоли свинца — джемсонит FePb4Sn6S14, буланжерит Pb5Sb4S11. Всегда содержится в рудах урана и тория. В природных условия часто образует крупные залежи свинцово-цинковых или полиметаллических руд стратиформного типа (Холоднинское, Забайкалье), а также скарнового (Дальнегорское (бывшее Тетюхинское), Приморье; Брокен-Хилл в Австралии) типа; галенит часто встречается и в месторождениях других металлов: колчеданно-полиметаллических (Южный и Средний Урал), медно-никелевых (Норильск), урановых (Казахстан), золоторудных и др. Сульфосоли обычно встречаются в низкотемпературных гидротермальных месторождениях с сурьмой, мышьяком, а также в золоторудных месторождениях (Дарасун, Забайкалье). Минералы свинца сульфидного типа имеют гидротермальный генезис, минералы окисного типа часты в корах выветривания (зонах окисления) свинцово-цинковых месторождений. В кларковых концентрациях свинец входит практически во все породы.
В вашем браузере отключен Javascript.Свинец в таблице Менделеева, химический элемент
Свинец (Pb от лат. Plumbum) – химический элемент, который находится в IV группе Таблицы Менделеева. Свинец имеет множество изотопов, среди которых более 20 обладают радиоактивными свойствами. Изотопы свинца являются продуктами распада урана и тория, поэтому содержание свинца в литосфере постепенно увеличивалось в течение миллионов лет и сейчас составляет около 0,0016% по массе, но он более распространен, чем его ближайшие родственники, такие как золото и ртуть. Свинец легко выделяется из рудных месторождений. Основные источники свинца — галенит, англезит и церуссит. В руде со свинцом очень часто соседствуют другие металлы, например, цинк, кадмий и висмут. В самородном виде свинец встречается исключительно редко.
Свинец — интересные исторические факты
Этимология слова «свинец» до сих пор точно не выяснена и является предметом очень интересных исследований. Свинец очень похож на олово, очень часто их путали, поэтому в большинстве западнославянских языков свинец это олово. Зато слово «свинец» встречается в литовском (svinas) и латышском (svin) языках. Свинец в переводе на английский lead, на голландский lood. Видимо отсюда и пошло слово «лудить», т.е. покрывать изделие слоем олова (или свинца). Не до конца понятно также происхождение латинского слова Plumbum, от которого произошло английское слово plumber – водопроводчик. Дело в том, что когда-то водопроводные трубы «запечатывали» свинцом, «пломбировали» (франц. plomber «запечатывать свинцом»). Кстати, отсюда же всем известное слово «пломба». Но на этом путаница не заканчивается, греки всегда называли свинец «молибдос», отсюда и латинское «molibdaena», незнающему человеку легко спутать это название с наименованием химического элемента молибден. Так в древности называли блестящие минералы оставляющие тёмный след на светлой поверхности. Этот факт оставил свой след в немецком языке: «карандаш» по-немецки называется Bleistift, т.е. свинцовый стержень. Человечество знакомо со свинцом с незапамятных времен. Археологами найдены свинцовые изделия выплавленные 8000 лет тому назад. В Древнем Египте из свинца даже отливали статуи. В Древнем Риме из свинца были изготовлены водопроводные трубы, именно он предопределил первую в истории экологическую катастрофу. Римляне не имели никакого представления о вреде свинца, им нравился податливый, прочный и простой в работе металл. Считалось даже, что свинец, добавленный в вино, улучшает его вкус. Поэтому почти каждый римлянин был отравлен свинцом. О симптомах отравления свинцом мы расскажем ниже, а пока лишь укажем, что одним из них является расстройство рассудка. Видимо отсюда и берут свое начало все эти безумные выходки знатных римлян и бесчисленные сумасшедшие оргии. Некоторые исследователи даже считают, что свинец явился чуть ли основной причиной падения Древнего Рима. В древности гончары мололи свинцовую руду, разводили водой и обливали полученной смесью глиняные предметы. После обжига такие сосуды покрывались тонким слоем блестящего свинцового стекла. Англичанин Джордж Равенскрофт в 1673 году усовершенствовал состав стекла, добавив к исходным компонентам оксид свинца и таким образом получил легкоплавкое блестящее стекло, которое было очень похоже на натуральный горный хрусталь. А в конце 18 века Георг Страсс при производстве стекла сплавил вместе белый песок, поташ и оксид свинца, получив такое чистое и блестящее стекло, что его сложно было отличить от алмаза. Отсюда и пошло название «стразы», по сути подделка под драгоценные камни. К сожалению, среди современников Страсс прослыл мошенником и его изобретение находилось в забвении до тех пор, пока в начале XX века Даниэль Сваровски не смог сделать из производства страз целую индустрию моды и направление искусства. После появления и широкого распространения огнестрельного оружия, свинец начал использоваться для производства пуль и дроби. Из свинца изготавливали типографские литеры. Свинец ранее входил в состав белой и красной красок, ими писали почти все старинные художники.


Химические свойства свинца кратко
Влияние свинца на организм человека и симптомы отравления
Любые соединения свинца очень ядовиты. Металл проникает в организм вместе с едой или со вдыхаемым воздухом и разносится кровью. Причем вдыхание паров свинцовых соединений и пыли намного более опасно, чем присутствие его в пище. Свинец имеет свойство накапливаться в костях, частично замещая в этом случае кальций. При повышении концентрации свинца в организме развивается анемия, поражается головной мозг, что приводит к снижению интеллекта, а у детей может вызвать необратимые задержки в развитии. Достаточно растворить один миллиграмм свинца в литре воды и она станет не только непригодной, но и опасной для питья. Такое низкое количество свинца представляет также определенную опасность, ни цвет ни вкус воды не изменяется. Основные симптомы отравления свинцом:
- серая кайма на деснах,
- вялость,
- апатия,
- потеря памяти,
- слабоумие,
- проблемы со зрением,
- раннее старение.
Применение свинца
Всё же, несмотря на токсичность, отказаться от использования свинца пока нет никакой возможности ввиду его исключительных свойств и дешевизны. Свинец в основном используется для производства аккумуляторных пластин, на эти нужды в настоящее время тратится около 75% добываемого на планете свинца. Свинец используется как оболочка для электрических кабелей, благодаря своей пластичности и неподверженности коррозии. Этот металл широко используется в химической и нефтеперерабатывающей промышленности, например, для облицовки реакторов в которых получают серную кислоту. Свинец обладает свойством задерживать радиоактивное излучение, этим тоже широко пользуются в энергетике, медицине и химии. В свинцовых контейнерах, к примеру, транспортируют радиоактивные элементы. Свинец идет в производство сердечников пуль и шрапнели. Также этот металл находит свое применение в производстве подшипников.


Свинец (лат. Plumbum) — химический элемент, ковкий, сравнительно легкоплавкий металл серого цвета.
Происхождение слова «свинец» неясно. В большинстве славянских языков (болгарском, сербско-хорватском, чешском, польском) свинец называется оловом. Слово с тем же значением, но похожее по произношению на «свинец», встречается только в языках балтийской группы: svinas (литовский), svins (латышский).
Латинское же plumbum (тоже неясного происхождения) дало английское слово plumber — водопроводчик (когда-то трубы зачеканивали мягким свинцом), и название венецианской тюрьмы со свинцовой крышей — Пьомбе, из которой по некоторым данным ухитрился бежать Казанова. Известен с глубокой древности. Изделия из этого металла (монеты, медальоны) использовались в Древнем Египте, свинцовые водопроводные трубы — в Древнем Риме. Указание на свинец как на определённый металл имеется в Ветхом Завете. Выплавка свинца была первым из известных человеку металлургических процессов. До 1990 г. большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.

 Содержание в земной коре 1,6·10-3 % по массе. Самородный свинец встречается редко. Входит в состав 80 различных минералов. Важнейшие из них: галенит PbS, церуссит PbCO3, англезит PbSO4; из более сложных — тиллит PbSnS2 и бетехтинит Pb2(Cu,Fe)21S15, а также сульфосоли свинца — джемсонит FePb4Sn6S14, буланжерит Pb5Sb4S11. Всегда содержится в рудах урана и тория. В природных условия часто образует крупные залежи свинцово-цинковых или полиметаллических руд стратиформного типа (Холоднинское, Забайкалье), а также скарнового (Дальнегорское (бывшее Тетюхинское), Приморье; Брокен-Хилл в Австралии) типа; галенит часто встречается и в месторождениях других металлов: колчеданно-полиметаллических (Южный и Средний Урал), медно-никелевых (Норильск), урановых (Казахстан), золоторудных и др. Сульфосоли обычно встречаются в низкотемпературных гидротермальных месторождениях с сурьмой, мышьяком, а также в золоторудных месторождениях (Дарасун, Забайкалье). Минералы свинца сульфидного типа имеют гидротермальный генезис, минералы окисного типа часты в корах выветривания (зонах окисления) свинцово-цинковых месторождений. В кларковых концентрациях свинец входит практически во все породы.
Содержание в земной коре 1,6·10-3 % по массе. Самородный свинец встречается редко. Входит в состав 80 различных минералов. Важнейшие из них: галенит PbS, церуссит PbCO3, англезит PbSO4; из более сложных — тиллит PbSnS2 и бетехтинит Pb2(Cu,Fe)21S15, а также сульфосоли свинца — джемсонит FePb4Sn6S14, буланжерит Pb5Sb4S11. Всегда содержится в рудах урана и тория. В природных условия часто образует крупные залежи свинцово-цинковых или полиметаллических руд стратиформного типа (Холоднинское, Забайкалье), а также скарнового (Дальнегорское (бывшее Тетюхинское), Приморье; Брокен-Хилл в Австралии) типа; галенит часто встречается и в месторождениях других металлов: колчеданно-полиметаллических (Южный и Средний Урал), медно-никелевых (Норильск), урановых (Казахстан), золоторудных и др. Сульфосоли обычно встречаются в низкотемпературных гидротермальных месторождениях с сурьмой, мышьяком, а также в золоторудных месторождениях (Дарасун, Забайкалье). Минералы свинца сульфидного типа имеют гидротермальный генезис, минералы окисного типа часты в корах выветривания (зонах окисления) свинцово-цинковых месторождений. В кларковых концентрациях свинец входит практически во все породы.
Таблица Менделеева — общепринятое графическое выражение Периодического закона, открытого Д.И. Менделеевым в 1869 г. Первоначальный вариант таблицы был разработан Менделеевым в 1869—1871 годах. За время существования было предложено более сотни вариантов её изображения, однако наиболее общепринятый вариант представляет собой двумерную таблицу в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Мы постарались описать основные химические элементы Таблицы Менделеева, для подробной информации о них переходите по соответствующей ссылке в таблице. Обращаем ваше внимание, что целью нашего сайта Занимательная химия не является описание химических элементов с научной точки зрения, мы больше сконцентрировались на интересных фактах, которые будут интересны даже детям, не углубляясь в непонятные термины и цифры. Однако, для каждого элемента приводится краткое описание химических свойств в простой и доступной форме.
| ГРУППЫ ЭЛЕМЕНТОВ | |||||||||
| I | II | III | IV | V | VI | VII | VIII | ||
| 1 Hводород | 2 Heгелий | ||||||||
| 3 Li<center>литий</center> | 4 Be<center>бериллий</center> | 5 Bбор | 6 С<center>углерод</center> | 7 N<center>азот</center> | 8 O<center>кислород</center> | 9 F<center>фтор</center> | 10Neнеон | ||
| 11 Na<center>натрий</center> | 12 Mg<center>магний</center> | 13 Al<center>алюминий</center> | 14 Si<center>кремний</center> | 15 P<center>фосфор</center> | 16 S<center>сера</center> | 17 Cl хлор | 18Arаргон | ||
| 19 K<center>калий</center> | 20 Ca<center>кальций</center> | 21 Sc скандий | 22 Ti<center>титан</center> | 23 V ванадий | 24 Cr<center>хром</center> | 25 Mn<center>марганец</center> | 26 Fe железо | 27 Coкобальт | 28 Ni никель |
| 29 Cu медь | 30 Znцинк | 31 Ga галлий | 32 Ge германий | 33 Asмышьяк | 34 Se селен | 35 Br бром | 36 Kr криптон | ||
| 37 Rb<center>рубидий</center> | 38 Sr<center>стронций</center> | 39 Y<center>иттрий</center> | 40 Zr<center>цирконий</center> | 41 Nb<center>ниобий</center> | 42 Mo<center>молибден</center> | 43 Tc<center>технеций</center> | 44 Ru<center>рутений</center> | 45 Rh<center>родий</center> | 46 Pd<center>палладий</center> |
| 47 Agсеребро | 48 Cd кадмий | 49 In индий | 50 Sn олово | 51 Sb сурьма | 52 Te теллур | 53 Iиод | 54Xe ксенон | ||
| 55 Cs<center>цезий</center> | 56 Ba<center>барий</center> | 57 La<center>лантан ×</center> | 72 Hf<center>гафний</center> | 73 Ta<center>тантал</center> | 74 W<center>вольфрам</center> | 75 Re<center>рений</center> | 76 Os<center>осмий</center> | 77 Ir<center>иридий</center> | 78 Pt<center>платина</center> |
| 79 Auзолото | 80 Hgртуть | 81 Tl<center>таллий</center> | 82 Pb<center>свинец</center> | 83 Bi<center>висмут</center> | 84 Po<center>полоний</center> | 85 At<center>астат</center> | 86Rn<center>радон</center> | ||
| 87 Fr<center>франций</center> | 88 Ra<center>радий</center> | 89 Ac<center>актиний ××</center> | 104 Rf<center>резерфордий</center> | 105 Db<center>дубний</center> | 106 Sg<center>сиборгий</center> | 107 Bh<center>борий</center> | 108 Hs<center>хассий</center> | 109 Mt<center>мейтнерий</center> | 110 Ds<center>дармштадтий</center> |
| 111 Rg рентгений | 112 Сn<center>коперниций</center> | 113 Nh<center>нихоний</center> | 114Fl<center>флеровий</center> | 115Mc<center>московий</center> | 116Lv<center>ливерморий</center> | 117 Tn<center>теннесин</center> | 118Og<center>оганессон</center> |
| 57 La<center>лантан</center> | 58 Ce<center>церий</center> | 59 Pr<center>празеодим</center> | 60 Nd<center>неодим</center> | 61 Pm<center>прометий</center> | 62 Sm<center>самарий</center> | 63 Eu<center>европий</center> | 64 Gd<center>гадолиний</center> | 65 Tb<center>тербий</center> | 66 Dy<center>диспрозий</center> | 67 Ho<center>гольмий</center> | 68 Er<center>эрбий</center> | 69 Tm<center>тулий</center> | 70 Yb<center>иттербий</center> | 71 Lu<center>лютеций</center> |
| 89 Ac<center>актиний</center> | 90 Th<center>торий</center> | 91 Pa<center>протактиний</center> | 92 U<center>уран</center> | 93 Np<center>нептуний</center> | 94 Pu<center>плутоний</center> | 95 Am<center>америций</center> | 96 Cm<center>кюрий</center> | 97 Bk<center>берклий</center> | 98 Cf<center>калифорний</center> | 99 Es<center>эйнштейний</center> | 100 Fm<center>фермий</center> | 101 Md<center>менделевий</center> | 102 No<center>нобелий</center> | 103 Lr<center>лоуренсий</center> |
Таблица Менделеева и её значение
Открытие Периодического закона стало важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях. Появление периодической системы и открытие периодического закона открыло новую, подлинно научную эру в истории химии и ряде смежных наук — взамен разрозненных сведений об элементах и соединениях была создана стройная таблица Менделеева, на основе которой стало возможным обобщать, делать выводы и предвидеть открытие новых химических элементов.


Список химических элементов Таблицы Менделеева
Список химических элементов упорядочен в порядке возрастания атомных номеров, приводятся обозначения элемента в Таблице Менделеева, латинское и русское названия.
| Z | Символ | Name | Название |
| 1 | H | Hydrogen | Водород |
| 2 | He | Helium | Гелий |
| 3 | Li | Lithium | Литий |
| 4 | Be | Beryllium | Бериллий |
| 5 | B | Boron | Бор |
| 6 | C | Carbon | Углерод |
| 7 | N | Nitrogen | Азот |
| 8 | O | Oxygen | Кислород |
| 9 | F | Fluorine | Фтор |
| 10 | Ne | Neon | Неон |
| 11 | Na | Sodium | Натрий |
| 12 | Mg | Magnesium | Магний |
| 13 | Al | Aluminium | Алюминий |
| 14 | Si | Silicon | Кремний |
| 15 | P | Phosphorus | Фосфор |
| 16 | S | Sulfur | Сера |
| 17 | Cl | Chlorine | Хлор |
| 18 | Ar | Argon | Аргон |
| 19 | K | Potassium | Калий |
| 20 | Ca | Calcium | Кальций |
| 21 | Sc | Scandium | Скандий |
| 22 | Ti | Titanium | Титан |
| 23 | V | Vanadium | Ванадий |
| 24 | Cr | Chromium | Хром |
| 25 | Mn | Manganese | Марганец |
| 26 | Fe | Iron | Железо |
| 27 | Co | Cobalt | Кобальт |
| 28 | Ni | Nickel | Никель |
| 29 | Cu | Copper | Медь |
| 30 | Zn | Zinc | Цинк |
| 31 | Ga | Gallium | Галлий |
| 32 | Ge | Germanium | Германий |
| 33 | As | Arsenic | Мышьяк |
| 34 | Se | Selenium | Селен |
| 35 | Br | Bromine | Бром |
| 36 | Kr | Krypton | Криптон |
| 37 | Rb | Rubidium | Рубидий |
| 38 | Sr | Strontium | Стронций |
| 39 | Y | Yttrium | Иттрий |
| 40 | Zr | Zirconium | Цирконий |
| 41 | Nb | Niobium | Ниобий |
| 42 | Mo | Molybdenum | Молибден |
| 43 | Tc | Technetium | Технеций |
| 44 | Ru | Ruthenium | Рутений |
| 45 | Rh | Rhodium | Родий |
| 46 | Pd | Palladium | Палладий |
| 47 | Ag | Silver | Серебро |
| 48 | Cd | Cadmium | Кадмий |
| 49 | In | Indium | Индий |
| 50 | Sn | Tin | Олово |
| 51 | Sb | Antimony | Сурьма |
| 52 | Te | Tellurium | Теллур |
| 53 | I | Iodine | Иод |
| 54 | Xe | Xenon | Ксенон |
| 55 | Cs | Caesium | Цезий |
| 56 | Ba | Barium | Барий |
| 57 | La | Lanthanum | Лантан |
| 58 | Ce | Cerium | Церий |
| 59 | Pr | Praseodymium | Празеодим |
| 60 | Nd | Neodymium | Неодим |
| 61 | Pm | Promethium | Прометий |
| 62 | Sm | Samarium | Самарий |
| 63 | Eu | Europium | Европий |
| 64 | Gd | Gadolinium | Гадолиний |
| 65 | Tb | Terbium | Тербий |
| 66 | Dy | Dysprosium | Диспрозий |
| 67 | Ho | Holmium | Гольмий |
| 68 | Er | Erbium | Эрбий |
| 69 | Tm | Thulium | Тулий |
| 70 | Yb | Ytterbium | Иттербий |
| 71 | Lu | Lutetium | Лютеций |
| 72 | Hf | Hafnium | Гафний |
| 73 | Ta | Tantalum | Тантал |
| 74 | W | Tungsten | Вольфрам |
| 75 | Re | Rhenium | Рений |
| 76 | Os | Osmium | Осмий |
| 77 | Ir | Iridium | Иридий |
| 78 | Pt | Platinum | Платина |
| 79 | Au | Gold | Золото |
| 80 | Hg | Mercury | Ртуть |
| 81 | Tl | Thallium | Таллий |
| 82 | Pb | Lead | Свинец |
| 83 | Bi | Bismuth | Висмут |
| 84 | Po | Polonium | Полоний |
| 85 | At | Astatine | Астат |
| 86 | Rn | Radon | Радон |
| 87 | Fr | Francium | Франций |
| 88 | Ra | Radium | Радий |
| 89 | Ac | Actinium | Актиний |
| 90 | Th | Thorium | Торий |
| 91 | Pa | Protactinium | Протактиний |
| 92 | U | Uranium | Уран |
| 93 | Np | Neptunium | Нептуний |
| 94 | Pu | Plutonium | Плутоний |
| 95 | Am | Americium | Америций |
| 96 | Cm | Curium | Кюрий |
| 97 | Bk | Berkelium | Берклий |
| 98 | Cf | Californium | Калифорний |
| 99 | Es | Einsteinium | Эйнштейний |
| 100 | Fm | Fermium | Фермий |
| 101 | Md | Mendelevium | Менделевий |
| 102 | No | Nobelium | Нобелий |
| 103 | Lr | Lawrencium | Лоуренсий |
| 104 | Rf | Rutherfordium | Резерфордий |
| 105 | Db | Dubnium | Дубний |
| 106 | Sg | Seaborgium | Сиборгий |
| 107 | Bh | Bohrium | Борий |
| 108 | Hs | Hassium | Хассий |
| 109 | Mt | Meitnerium | Мейтнерий |
| 110 | Ds | Darmstadtium | Дармштадтий |
| 111 | Rg | Roentgenium | Рентгений |
| 112 | Cn | Copernicium | Коперниций |
| 113 | Nh | Nihonium | Нихоний |
| 114 | Fl | Flerovium | Флеровий |
| 115 | Mc | Moscovium | Московий |
| 116 | Lv | Livermorium | Ливерморий |
| 117 | Ts | Tennessine | Теннесин |
| 118 | Og | Oganesson | Оганессон |
Таблица Менделеева в хорошем качестве
Предлагаем вам скачать несколько вариантов таблицы Менделеева в хорошем качестве, которые можно распечатать на принтере большого формата, как в черно-белом так и в цветном вариантах.
Используемые источники:
- http://www.alto-lab.ru/elements/svinec/
- https://tablica-mendeleeva.ru/82-element-tablici-mendeleeva
- http://www.alto-lab.ru/tablica-mendeleeva/
Свинец — Знаешь как
Содержание статьи
(Plumbum), Pb — хим. элемент IV группы периодической системы элементов; ат. н. 82, ат. м. 207,2. Синевато-серый металл. В соединеиях проявляет степени окисления +2 и +4. Природный свинец состоит из стабильных изотопов 204Рb (1,4%), 206Рb (25,2%), 2о7Рb (21,7%) и 208Рb (51,7%). Есть также несколько радиоактивных изотопов. С. известен с давних времен. Египтяне выплавляли его за 5—7 тыс. лет до н. э. Римляне изготовляли из свинца водопроводные трубы. Содержание С. в земной коре 1,0-10 4%. Самородный свинец в природе не встречается. Важнейший минерал — галенит, Содержащийся преим, в сульфидных полиметаллических рудах. Кристаллическая решетка С. гранецентрированная кубическая с периодом а = 4,9495 А.
Плотность чистого металла 11,34 г/см3; tпл 327,4° С; tкип1740° С; скрытая теплота плавления 6,26 кал/г; скрытая теплота испарения 201 кал/г; температурный коэфф. линейного расширения (т-ра 20° С) 27,56 х 10-6 град ; удельная теплопроводность (т-ра 18° С) 0,083 кал/см х сек х град; теплоемкость (т-ра 0—100° С) 0,0306 кал/г х град; удельное электрическое сопротивление 20,68-10-6 ом-см. Вязкость при т-ре 340° С равна 0,0189 nз, при т-ре 470° С составляет 0,0144 пз. Т-ра перехода в сверхпроводящее состояние 7,17 К. С. мягок и пластичен. Модуль норм, упругости 1700 кгс/мм2; предел прочности на растяжение 1,2—1,3 кгс/мм2;
относительное удлинение 55%; НВ = 3—4.
На воздухе свинец покрывается окисной пленкой, предохраняющей металл от дальнейшего окисления. При нагревании расплавленного С. на воздухе образуется окись РbО. При медленном нагревании на воздухе РbО превращается в Рb304 красного цвета. Разбавленные соляная и серная к-ты почти не действуют на металл. Свинец легко растворяется в азотной к-те, образуя нитрат. При доступе воздуха свинец растворяется в уксусной к-те с образованием ацетата. Растворяется свинец в щелочах. Свинец сплавляется со многими металлами, образуя свинца сплавы и интерметаллические соединения. С железом не реагирует в жидком и твердом состоянии.
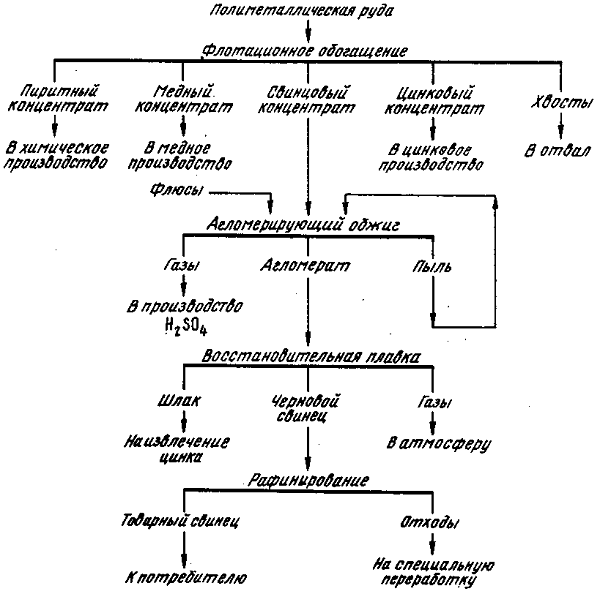
При нагревании непосредственно уединяется со многими неметаллами, в частности со всеми галогенами, с серой, селеном и теллуром. с. и его соединения ядовиты. Предельно допустимая концентрация в воздухе 0,01 мг/м3. Свинец получают из сульфидных концентратов, к-рые подвергают агломерирующему обжигу с последующей плавкой шихты в шахтной печи. Осн. продуктом плавки является черновой свинец (веркблей), содержащий 97—99% осн. металла и 3—1% примесей (меди, сурьмы, олова, серебра, висмута и др.). Распространены методы пирометаллургического и гидроэлектролитического рафинирования веркблея. Разработаны также способы рафинирования чернового свинца и разделения его сплавов электролизом ионных расплавов.
Для получения особо чистого металла применяют методы амальгамной металлургии, зонной перекристаллизации и др. Свинец весьма легко поддается ковке и прокатывается в листы любой толщины. Свинцовую стружку можно спрессовать в монолитную массу при давлении 2 тс/см2. Свинцовую проволоку получают, продавливая через фильеру твердый металл. Кислород, азот, сернистый газ, водород, окись углерода, углекислый газ и углеводороды не растворяются ни в жидком, ни в твердом металлическом свинце. Свинец применяют для облицовки (футеровки) хим. аппаратуры, в электролизных ваннах металлургических заводов. Он предохраняет от коррозии телеграфные и электр. провода, прокладываемые под землей или под водой (см. Коррозия металлов). Большое количество свинец расходуется на произ-во аккумуляторов. На его основе изготовляют легкоплавкие, типографские и антифрикционные сплавы.
Некоторое количество С. из-за способности поглощать радиоактивное излучение применяют в рентгенотехнике и ядерной технике. Свинец используют в огнестрельном оружии, в полупроводниковой технике. Особо чистый металл идет на изготовление термоэлектрогенераторов, в к-рых осуществляется прямое превращение тепловой энергии в электрическую. Эффективными материалами для изготовления термоэлектрогенераторов служат теллурид и селенид свинца. Сплав меди со свинцом используют в сверхпроводниковой технике Соединения свинец применяют в произ-ве красок, стекла, для очистки нефти. Оси. углекислую соль свинца 2PbCOs · Рb (0Н)2 используют для приготовления свинцовых белил; соединение Рb304 — для получения краски ярко-красного цвета; тетра-этилсвинец (С2Н5)4Рb — самый распространенный антидетонатор; азид свинца PbN6 — инициирующее вещество. Окись РbО применяют в произ-ве легкоплавких, сильно преломляющих свет стекол, эмалей.
Плюмбум или свинец
Свинец — голубовато серый , мягкий , пластичный металл , легко режется ножом , имеет плотность 11,34 г/см³ и температурой плавления 327,5.
Тепло — и электропроводность свинца низкая . На воздухе он покрывается защитной оксидной плёнкой и тускнеет образуя PbO :
Pb + O2 = PbO
Также оксид свинца образуется при накаливании его на воздухе , а при большом доступе воздуха и не очень высокой температуре переходит в Pb3O4 ( свинцовый сурик ) .
В присутствии влаги взаимодействует с кислородом воздуха по реакции:
2Pb+ O2 + 2h3O + 2Pb( OH)2
При повышенной температуре свинец преимущественно находится в соединении со степенью окисления 2+ .
Отрицательную степень окисления проявляет только в соединении с некоторыми более электро положительными металлами , например с магнием ( плюмбид Mg2Pb )
С водородом свинец непосредственно не взаимодействует , но его соединения получают косвенно :
Mg2Pb + 4HCl = 2MgCl2 + Pbh5
При этом образуется неустойчивый , ядовитый газ плюмбан Pbh5
Свинец практически не растворяется в соляной и разбавленной серной кислоте , так как покрывается нерастворимой плёнкой солей PbCl2 и PbSO4 :
Pb + 2HCl = PbCl2 + h3
Pb + h3SO4 = PbSO4 + h3
Только при действии концентрированной серной кислоты образуется растворимая кислая соль и свинец начинает растворятся Pb(HSO4)2 .
При взаимодействии с концентрированной и разбавленной азотной кислотой метал образует нитрат свинца Pb( NO3 )2 :
Pb + HNO3 = Pb( NO3 )2 + NO + h3O
Для свинца более характерны соединения со степенью окисления 2+ .Окисление соединения свинца ( II ) до соединения свинца ( IV ) происходит лишь при действии сильных кислот :
Pb(Ch4COO)2 + CaOCl2 + h3O = Pb2 + 2Ch4COOH + CaCl2
Соединения свинца ( IV )—сильные окислители , например , при кипячении с 30% серной кислотой диоксид свинца окисляет марганец с ( II ) до ( VII ) :
5PbO2 + 2MnSO4 + 3h3SO4 = 5PbSO4 + 2HMnO4 + 2h3O
Применение свинца
Свинец применяется для изготовления источников постоянного тока — аккумуляторов . В производстве взрывчатых веществ ( азид свинца Pb(N3)2 ) , входит в состав многих сплавов ( сплавы для производства подшипников ) . Из свинца изготовляют химическую аппаратуру , оболочки для кабелей , трубы . Он служит также для изготовления винтовочных и шрапнельных пуль и выделки дроби . Свинец сильно поглощает гамма — лучи и поэтому применяется для защиты от гамма — излучений при работе с радиоактивными веществами . Оксид свинца PbO используют при производстве стёкол ( в частности , хрусталя ) , оксид свинца PbO2 — в кислотных аккумуляторах . Ацетат свинца Pb(Ch4COO)2 применяют в качестве протравы при крашении тканей , ахромат свинца PbCrO4 — для изготовления красок ( жёлтый пигмент )
Физические свойства
Свинец — Pb,голубовато — серый металл ,горючее вещество . Ат. масса 207,2 ; температура плавления 327,4°C ;температура кипения 1745°C . При дисперсности образца 74 мкм тем. самовоспл.:аэрогеля 270°C , аэровзвеси 580 °C ; макс . давл . взрыва 20 кПа ; макс . скорость нарастания давл . 700 кПа /с ; МВСК 10% (об) .
Свинца сульфат , трудно горючее вещество , не склонен к самовозгоранию . Мол . масса 239,25; плотность 7100 кг /м3 ; температура плавления 1100°C . Дисперсность образца 250 мкм . Температура самовоспламенения аэрогеля 780 °C ;
Лит.; Основы металлургии, т. 2. М., Лоскутов Ф. М. Металлургия свинца. М., 1965; Некрасов Б. В. Курс общей химии.
Вы читаете, статья на тему свинец
Cвинец химический элемент, плотность, температура плавления, удельный вес, формула плюмбума, молярная масса, степень окисления, свойства, применение

Свинец — это один из редких самородных металлов, имеющий бело-серебристый цвет. Он мягкий, легкоплавкий, пластичный.
Этот металл был известен уже в древние времена. В данной статье мы поговорим об использовании, производстве, физических и химических свойствах плюмбума Pb химического элемента таблицы Менделеева.
Что такое свинец
Это элемент в химической таблице под атомным номером 82, он же Pb (Plumbum).

В классическом виде он обычно имеет серебряный цвет. Удельный вес 11,35 г/см3.
История открытия химического элемента Pb
На ближнем Востоке свинец стал известен ещё с 3 тысячелетия до нашей эры, где он участвовал в создании кирпичей, статуй и разных бытовых предметов. Его сопоставляли Сатурну.

Археологические раскопки, которые проводились на территории Древнего царства Египта, помогли найти свинцовые изделия. Подобные открытия сделаны и на территории бывшей Месопотамии и Армении.
Его использовали не только в качестве самостоятельного металла для изделия, но также для очищения серебра и золота. Затем металлу нашли новую задачу – им обшивали корпуса кораблей и применяли в медицинских целях.
В конце 17 века появилось хрустальное стекло за счет добавления в стекло свинца. После, из него стали изготавливать пули.
Характеристика свинца
Если вас интересует, какого цвета свинец, то ответ следующий — плюмбум имеет голубовато-серый оттенок. Он плотный и тяжелый. Достаточно несложно добывается.

Как и любой из существующих металлов, свинец отличается своими физическими и химическими особенностями, которые и отличают его от других металлов.
Физические свойства
Металл не отличает высокая твердость. Это довольно мягкий металл, легко режущийся лезвием. Плавится при невысокой температуре плавления (327 градусов).

Температура кристаллизации 327 градусов, а температура кипения 2022 К. Плюмбум подлежит достаточно быстрому окислению на открытом воздухе.
Полезно знать: неприятным критерием свинца является его токсичность: в хроническом течении он собирается во внутренних органах и костной ткани, чем вызывает нарушения в организме живых существ.
Теплопроводность в два раза меньше железа.
Молярная масса 207,2 а. е. м. ± 0,1 а. е. м.
Формула простых оксидов — оксид свинца (II) PbO и оксид свинца (IV) PbO2 и смешанный Pb3O4 (свинцовый сурик).
Химические свойства
Является металлом малоактивным, стоящим в электрохимическом ряду перед водородом, что делает его легко вытесняемым иными металлами из растворов его солей. Степень окисления +2.

Заметно растворим в лимонной, уксусной и винной кислотах. Бесцветные ядовитые жидкости производные свинца. Его пары ядовиты.
Некоторые школьники и студенты спрашивают свинец магнитится или нет? Нет, такие качества отсутствуют.
Помимо токсичности, хочется знать, свинец радиоактивен или нет? Искусственные изотопы металла радиоактивны.
Основные соединения свинца
Галогениды образуются, взаимодействуя с фтором, хлором, бромом, йодом, и астатом. Халькогениды с кислородом, серой, селеном, теллуром, и полонием. Пниктиды с азотом и фосфором.
Области применения
Элемент получил широкое применение:
- В электротехнической системе, благодаря своей сопротивляемости коррозии, применяется в целях защиты кабелей, сверхпроводников, применяются свинцовые аккумуляторы.
- В военной промышленности делают пули и снаряды, взрывчатки и детонаторы.
- В медицине является защитником от радиации (пример: обследование рентгеном).
- В производстве — свинец входит в состав цемента, используется для защитных барьеров керамики и стекла.

Люди, боящиеся отравления свинцом, спрашивают где можно найти свинец? В домашних условиях его можно обнаружить в аккумуляторах, в кабелях.
Производство свинца
Около половины металла производится из руд. Годовая добыча составляет 5 млн. тонн. Переработка крайне выгодна в плане экономии.
Приемы получения свинца это:
- пирометаллургический,
- гидрометаллургический.
В пирометаллургическом способе имеющиеся компоненты переплавляются, а во втором наблюдается разложение существующих концентратов.

Наибольшими объёмами добычи свинцовой руды могут быть отмечены такие страны, как:
- Китай,
- Мексика,
- Австралия,
- США,
- Перу.
Добыча свинца в России
Седьмое место по производству этого металла занимает Россия. Доля РФ в запасах этого метала чуть более 2% из-за его низкой концентрации в местных месторождениях. Причем свинец отправляется на экспорт.

Было высчитано, что на территории России находится около 70 месторождений свинца, производящих 93% процента этого металла в таких регионах, как: Красноярский край, Республика Бурятия, Читинская область, Алтайский край и Приморский край.
Можно это выявить в процентном соотношении:
- Сибирь – приблизительно 75%,
- Урал – около 15%,
- Дальний Восток – немногим меньше 10%.
Нахождение в природе
Обычно металл перемешан с каким-либо другим металлом, например, с оловом, а не встречается в чистом виде.

Галенит
Свинец – является стадией распада урана, поэтому может находиться в урановых рудах. Свинец получается из такого сырья, как галенит.
Заключение
Свинец — это металл, который уже известен людям многие тысячи лет. Такая наука, как химия, сейчас помогает разобраться в его свойствах, чтобы правильно и экономно употребить. Его месторождения располагаются во многих частях Земли.
На мировом рынке его цена достаточно стабильна. Благодаря уникальности своих физико-химических свойств, Pb применяется во многих сферах и отраслях, подлежит импорту и экспорту.
Следом за свинцом в таблице, 6 букв, первая буква В — кроссворды и сканворды
висмут
Слово «висмут» состоит из 6 букв:
— первая буква В
— вторая буква И
— третья буква С
— четвертая буква М
— пятая буква У
— шестая буква Т
Посмотреть значние слова «висмут» в словаре.
Альтернативные варианты определений к слову «висмут», всего найдено — 20 вариантов:
- «Bi» в таблице Менделеева
- 83-й в менделеевской шеренге
- В периодической системе последний стабильный (не радиоактивный) элемент
- Восемьдесят третий в таблице химических элементов
- Восемьдесят третий элемент
- До полония в таблице
- М. один из металлов, невстречаемых в чистом виде и в деле, а только в окисях и солях; легкоплавкий, белый, с красноватым отливом. Висмутовый, к нему относящ., содержащий его. Висмутовые или шпанские белила
- Между свинцом и полонием в таблице
- Менделеев поставил его на 83-е место
- Металл для получения полония-210
- Металл из таблицы
- Металл №83
- Металл, Bi
- Металл, химический элемент
- Перед полонием в таблице
- После свинца в таблице
- Тяжелый металл с розоватым оттенком
- Химический элемент с позывным Bi
- Химический элемент, серебристо-белый металл с розоватым оттенком, делают спирали приборов для измерений напряж. магнитного поля
- Элемент таблицы Менделеева
Периодическая таблица в KnowledgeDoor
Ссылки (Щелкните рядом со значением выше, чтобы просмотреть полную информацию о цитировании для этой записи)
Allred, A. L. «Значения электроотрицательности из термохимических данных». Журнал неорганической и ядерной химии, том 17, номер 3-4, 1961 г., стр. 215–221. DOI: 10.1016 /
Андерс, Эдвард и Николас Гревесс. «Изобилие элементов: метеоритное и солнечное». Geochimica et Cosmochimica Acta, том 53, номер 1, 1989 г., стр.197–214. DOI: 10.1016 /
Андерсен Т., Х. К. Хауген и Х. Хотоп. «Энергии связи в атомных отрицательных ионах: III». Справочный журнал физических и химических данных, том 28, номер 6, 1999 г., стр. 1511–1533.
Болл, Дэвид В. «Элементная этимология: что в имени?» Журнал химического образования, том 62, номер 9, 1985 г., стр. 787–788. DOI: 10.1021 /
Барсан, Майкл Э., редактор. Карманный справочник NIOSH по химической опасности.Цинциннати, Огайо: NIOSH Publications, 2007.
Batsanov, S. S. «Ван-дер-Ваальсовые радиусы элементов». Неорганические материалы, том 37, номер 9, 2001 г., стр. 871–885. См. Реферат
Бедфорд Р. Э., Г. Боннье, Х. Маас и Ф. Павезе. «Рекомендуемые значения температуры по международной температурной шкале 1990 г. для выбранного набора вторичных контрольных точек». Метрология, том 33,
№ 2, 1996, с. 133–154. DOI: 10.1088 /
Бонди, А.«Объемы и радиусы Ван дер Ваальса». Журнал физической химии, том 68, номер 3, 1964 г., стр. 441–451. DOI: 10.1021 /
Боуэн, Х. Дж. М. Экологическая химия элементов. Лондон: Academic Press, Inc., 1979.
Bratsch, Steven G. «Пересмотренные значения электроотрицательности Малликена: I. Расчет
и преобразование в единицы Полинга «. Журнал химического образования, том 65, номер 1, 1988 г., стр. 34–41. doi: 10.1021 /
Campbell, J.L. «Выходы флуоресценции и вероятности Костера – Кронига для
субоболочки Atomic L. Часть II: Возвращение к подоболочке L1. «Атомные данные и таблицы ядерных данных, том 95, номер 1, 2009 г., стр. 115–124. Doi: 10.1016 /
Campbell, JL» Флуоресценция Урожайности и вероятности Костера – Кронига для
the Atomic L Subshells. «Атомные данные и таблицы ядерных данных, том 85, номер 2, 2003 г., стр. 291–315. doi: 10.1016 /
Cardarelli, François.Справочник по материалам: краткий Настольный справочник, 2-е издание. Лондон: Springer – Verlag, 2008.
Шовен, Реми. «Явный периодический тренд радиусов Ван-дер-Ваальса». Журнал физической химии, том 96, номер 23, 1992 г., стр. 9194–9197. DOI: 10.1021 /
Clementi, E., D. L. Raimondi и W. P. Reinhardt. «Константы экранирования атомов от функций SCF. II. Атомы с 37 до 86 электронов». Журнал химической физики, том 47, номер 4, 1967, стр.1300–1307. DOI: 10.1063 /
Коэн, Э. Ричард, Дэвид Р. Лид и Джордж Л. Тригг, редакторы. Настольный справочник по физике AlP, 3-е издание. Нью-Йорк: Springer-Verlag New York, Inc., 2003.
Коннелли, Нил Г., Туре Дамхус, Ричард М. Хартсхорн и Алан Т. Хаттон. Номенклатура неорганической химии: Рекомендации IUPAC 2005. Кембридж: RSC Publishing, 2005.
Кордеро, Беатрис, Вероника Гомес, Ана Э. Платеро-Пратс, Марк Ревес, Хорхе Эчеверрия, Эдуард Кремадес, Флавиа Барраган и Сантьяго.«Ковалентные радиусы еще раз». Dalton Transactions, номер 21, 2008 г., стр. 2832–2838. DOI: 10.1039 /
Кронан Д. С. «Базальные металлоносные отложения восточной части Тихого океана». Бюллетень Геологического общества Америки, том 87, номер 6, 1976 г., стр. 928–934. DOI: 10.1130 /
де Подеста, Майкл. Понимание свойств материи, 2-е издание. Лондон: Тейлор и Фрэнсис, 2002.
Дронсковски, Ричард. Вычислительная химия твердотельных материалов.Вайнхайм, Германия: WILEY-VCH Verlag GmbH & Co. KGaA, 2005.
Эббинг, Даррелл Д. и Стивен Д. Гаммон. Общая химия, 8-е издание. Бостон, Массачусетс: Компания Houghton Mifflin, 2005.
Эмсли, Джон. Строительные блоки природы: руководство по элементам от А до Я. Оксфорд: издательство Оксфордского университета, 2003.
Эмсли, Джон. Элементы, 3-е издание. Oxford: Oxford University Press, 1998.
Файерстоун, Ричард Б. Таблица изотопов, 8-е издание, том 2. Под редакцией Вирджинии С.Ширли с помощниками редактора Корал М. Бэглин, С. Ю. Фрэнк Чу и Джин Зипкин. Нью-Йорк: John Wiley & Sons, Inc., 1996.
Галассо, Фрэнсис С. Структура и свойства неорганических твердых тел. Oxford: Pergamon Press, 1970.
Грин, Дон В., редактор. Справочник инженеров-химиков Перри, 8-е издание. Нью-Йорк: McGraw-Hill Companies, Inc., 2008.
Гринвуд, Н. Н. и А. Эрншоу. Химия Элементы, 2-е издание. Оксфорд: Баттерворт-Хайнеманн, 1997.
Гвин Уильямс. Энергии связи электронов. http: //
Хо, К. Ю., Р. У. Пауэлл и П. Э. Лили. «Теплопроводность элементов: всесторонний обзор». Справочный журнал физических и химических данных, том 3, приложение 1, 1974 г., стр. С I – 1 по I – 796.
Höhne, G. W. H., W. F. Hemminger, и H.-J. Фламмерсхайм. Дифференциальная сканирующая калориметрия, 2-е издание.Берлин: Springer – Verlag, 2003.
Хорват, А. Л. «Критическая температура элементов и периодическая система». Журнал химического образования, том 50, номер 5, 1973 г., стр. 335–336. DOI: 10.1021 /
Хухи, Джеймс Э., Эллен А. Кейтер и Ричард Л. Кейтер. Неорганическая химия: основы структуры и реакционной способности, 4-е издание. Нью-Йорк: издательство HarperCollins College, 1993.
Международная организация труда (МОТ). Международная карта химической безопасности свинца.http: //
Дженсен, Дж. Э., Р. Б. Стюарт, В. А. Таттл, Х. Брехна и А. Г. Проделл, редакторы. Записная книжка избранных криогенных данных Брукхейвенской национальной лаборатории. БНЛ 10200-Р, т. 1, Брукхейвенская национальная лаборатория, август 1980 г.
младший, Элберт Дж. Литтл и Марк М. Джонс. «Полная таблица
Электроотрицательность. «Журнал химического образования, том 37, номер 5, 1960, стр. 231–233. Doi: 10.1021 /
Кинг, Х. У.» Аллотропные структуры элементов, зависящие от давления «.
Бюллетень фазовых диаграмм сплавов, том 4, номер 4, 1983 г., стр. 449–450. DOI: 10.1007 /
Киттель, Чарльз. Введение в физику твердого тела, 8-е издание. Хобокен, Нью-Джерси: John Wiley & Sons, Inc., 2005.
Киттель, Чарльз. Введение в физику твердого тела, 5-е издание. Нью-Йорк: John Wiley & Sons, Inc., 1976.
Li, Y.-H., and J. E. Schoonmaker. «Химический состав и минералогия морских отложений». С. 1–36 в Отложения, диагенез и осадочные породы. Отредактированный Фредом Т. Маккензи. Oxford: Elsevier Ltd., 2005.
Liboff, Ричард Л. Введение в Quantum Механика, 3-е издание. Ридинг, Массачусетс: Addison Wesley Longman, Inc., 1998.
Lide, David R., редактор. CRC Справочник по химии и физике, 88-е издание. Бока-Ратон, Флорида: Taylor & Francis Group, 2008.
Манн, Джозеф Б., Терри Л. Мик и Леланд К. Аллен. «Энергии конфигурации основных элементов группы». Журнал Американского химического общества, том 122, номер 12, 2000 г., стр. 2780–2783. DOI: 10.1021 /
Мануэль, О., редактор. Происхождение элементов в Солнечной системе: последствия наблюдений после 1957 года. Нью-Йорк: Kluwer Academic Publishers, 2000.
Мартин, В. К. «Электронная структура элементов». Европейский физический журнал C — Частицы и поля, том 15, номер 1–4, 2000 г., стр. 78–79. DOI: 10.1007 /
МакДонаф, В. Ф. «Композиционная модель ядра Земли». стр. 547–568 в The Mantle and Core. Под редакцией Ричарда В. Карлсона. Oxford: Elsevier Ltd., 2005.
Mechtly, Eugene A. «Свойства материалов». С. 4–1–4–33 в Справочных данных для инженеров: радио, электроника, компьютер и связь.Мак Э. Ван Валкенбург, отредактированный Венди М. Миддлтон. Woburn, MA: Butterworth-Heinemann, 2002. doi: 10.1016 /
Miessler, Gary L., and Donald A. Tarr. Неорганическая химия, 3-е издание. Аппер-Сэдл-Ривер, Нью-Джерси: Pearson Prentice Hall, 2004.
Мур, Шарлотта Э. Ионизационные потенциалы и пределы ионизации, полученные из анализа оптических спектров. Вашингтон, округ Колумбия: национальный Бюро стандартов, 1970.
Нэгл, Джеффри К.«Атомная поляризуемость и электроотрицательность». Журнал Американского химического общества, том 112, номер 12, 1990 г., стр. 4741–4747. DOI: 10.1021 /
Национальный институт охраны труда и здоровья (NIOSH). Международная карта химической безопасности свинца. http: //
Национальный институт охраны труда и здоровья (NIOSH). Реестр токсического действия химических веществ на свинец.http: //
Николас, Дж. В. и Д. Р. Уайт. «Температура». С. 8–41 в Измерение термодинамических свойств одиночных фаз. Под редакцией А. Р. Х. Гудвина, В. А. Уэйкхема и К. Н. Марша. Амстердам: Elsevier Science, 2003.
Орем, У. Х. и Р. Б. Финкельман. «Угледобыча и геохимия». стр. 191–222 в отложениях, диагенез, и осадочные породы. Под редакцией Фреда Т.Маккензи. Oxford: Elsevier Ltd., 2005.
Oxtoby, Дэвид У., Х. П. Гиллис и Алан Кэмпион. Принципы современной химии, 6-е издание. Бельмонт, Калифорния: Томсон Брукс / Коул, 2008.
Пальм, Х. и Хью Сент-К. О’Нил. «Космохимические оценки состава мантии». стр. 1–38 в The Mantle and Core. Под редакцией Ричарда В. Карлсона. Оксфорд: Elsevier Ltd., 2005.
Полинг, Линус. Природа химической связи, 3-е издание. Итака, Нью-Йорк: Издательство Корнельского университета, 1960.
Пирсон, Ральф Г. «Абсолютная электроотрицательность и твердость: применение в неорганической химии». Неорганическая химия, том 27, номер 4, 1988 г., стр. 734–740. DOI: 10.1021 /
Pekka Pyykkö. Самосогласованные, ковалентные радиусы 2009 г. http: //
Pyykkö, Pekka, and Michiko Atsumi. «Ковалентные радиусы молекул с двойной связью для элементов Li-E112.»Chemistry — A European Journal, volume 15, number 46, 2009, pp. 12770–12779. Doi: 10.1002 /
Pyykkö, Pekka, and Michiko Atsumi.» Ковалентные радиусы одной молекулярной связи для элементов 1 -118. «Chemistry — A European Journal, volume 15, number 1, 2009, pp. 186–197. Doi: 10.1002 /
Pyykkö, Pekka, Sebastian Riedel, and Michael Patzschke.» Triple-Bond Ковалентные радиусы ». Химия — Европейский журнал, том 11, номер 12, 2005 г., стр.3511–3520. DOI: 10.1002 /
Рорер, Грегори С. Структура и связь в кристаллических материалах. Кембридж: Cambridge University Press, 2001.
Самсонов Г.В., редактор. Справочник по физико-химическим свойствам элементов. Нью-Йорк: Plenum Publishing Corporation, 1968.
Сандерсон, Р. Т. Простые неорганические вещества. Малабар, Флорида: Robert E. Krieger Publishing Co., Inc., 1989.
Сандерсон, Р. Т. «Принципы электроотрицательности: Часть I.General Nature ». Журнал химического образования, том 65, номер 2, 1988 г., стр. 112–118. Doi: 10.1021 /
Sanderson, RT Polar Covalence. Нью-Йорк: Academic Press, Inc., 1983.
Сансонетти, Дж. Э. и В. К. Мартин. «Справочник основных атомных спектроскопических данных». Journal Of Physical And
Справочные химические данные, том 34, номер 4, 2005 г., стр. 1559–2259. DOI: 10.1063 /
Научная группа Thermodata Europe (SGTE). Чистые вещества: Часть 1 — Элементы и соединения от AgBr до Ba3N2.Под редакцией И.
Уртадо и Д. Нойшютц. Берлин: Springer-Verlag, 1999. doi: 10.1007 /
Шеннон Р. Д. «Пересмотренные эффективные ионные радиусы и систематические исследования межатомных расстояний в галогенидах и халькогенидах». Acta Crystallographica Раздел A, том 32, номер 5, 1976 г., стр. 751–767. DOI: 10.1107 /
Силби, Роберт Дж., Роберт А. Олберти и Мунги Г. Бавенди. Физическая химия, 4-е издание. Хобокен, Нью-Джерси: John Wiley & Sons, Inc., 2005.
Сингман, Чарльз Н. «Атомный объем и аллотропия элементов». Журнал химического образования, том 61, номер 2, 1984 г., стр. 137–142. DOI: 10.1021 /
Слейтер, Дж. К. «Атомные радиусы в кристаллах». Журнал
Химическая физика, том 41, номер 10, 1964, стр. 3199–3204. doi: 10.1063 /
Смит, Дерек В. «Электроотрицательность в двух измерениях: переоценка и разрешение парадокса Пирсона-Полинга». Журнал химической
Образование, том 67, номер 11, 1990 г., стр.911–914. DOI: 10.1021 /
Смит, Дерек В. Неорганические вещества: прелюдия к изучению описательной неорганической химии. Кембридж: Кембриджский университет Press, 1990.
Стюарт Г. Р. «Измерение низкотемпературной удельной теплоемкости». Review of Scientific Instruments, том 54, номер 1, 1983 г., стр. 1–11. DOI: 10.1063 /
Стюарт, Г. Р. «Измерение низкотемпературной удельной теплоемкости». Review of Scientific Instruments, том 54, номер 1, 1983 г., стр.1–11. DOI: 10.1063 /
Тари, А. Низкая удельная теплоемкость вещества Температуры. Лондон: Imperial College Press, 2003.
Вайнштейн, Борис К., Владимир М. Фридкин и Владимир Л. Инденбом. Структура кристаллов, 2-е издание. Современная кристаллография 2. Под ред. Б. К. Вайнштейна, А. А. Чернова, Л. А. Шувалова. Берлин: Springer-Verlag, 1995.
Фойгт, Х. Х., редактор. Ландольт – Бернштейн — Астрономия и астрофизика VI группы. Берлин: Springer – Verlag, 1993.
Waber, J. T., and Don T. Cromer. «Радиусы орбит атомов и ионов». Журнал химической физики, том 42, номер 12, 1965, стр. 4116–4123. DOI: 10.1063 /
Уолдрон, Кимберли А., Эрин М. Ферингер, Эми Э. Стриб, Дженнифер Э. Троски и Джошуа Дж. Пирсон. «Процент скрининга, основанный на эффективном
Ядерный заряд как универсальный инструмент для обучения периодическим тенденциям ». Журнал химического образования, том 78, номер 5, 2001 г., стр. 635–639. Doi: 10.1021/
Визер, Майкл Э. и Тайлер Б. Коплен. «Атомный вес элементов 2009 (Технический отчет ИЮПАК)». Чистая и прикладная химия, том 83, номер 2, 2011 г., стр. 359–396. DOI: 10.1351 /
Yaws, Карл Л. «Плотность жидкости в элементах». Химическая инженерия, том 114, номер 12, 2007 г., стр. 44–46.
Yaws, Карл Л. Справочник по физическим свойствам углеводородов и химикатов Yaws. Хьюстон, Техас: издательство Gulf Publishing Company, 2005.
.EniG. Периодическая таблица элементов
УГЛЕРОДНАЯ ГРУППА
| Атомный номер: | 82 |
| Групповые номера: | 14 |
| Период: | 6 |
| Электронная конфигурация: | [Xe] 4f 14 5d 10 6s 2 6p 2 |
| Формальный номер степени окисления: | +2 +4 |
| Электроотрицательность: | 1.8 |
| Атомный радиус / пм: | 175 |
| Относительная атомная масса: | 207,2 (1) |
Свинец известен с древних времен. Название происходит от латинского слова plumbum , что означает жидкое серебро . Это очень мягкий, очень ковкий и пластичный бело-голубой блестящий металл, тускнеющий на влажном воздухе, но устойчивый к кислороду и воде. Свинец растворяется в азотной кислоте, и его соединения токсичны при вдыхании или проглатывании.Токсины обладают кумулятивным действием. Свинец чаще всего встречается в рудах, называемых галенитом или сульфидом свинца (PbS). Он используется в припое, защите от излучения и в аккумуляторах. Цена гранул чистого свинца 99,5% составляет 28,70 евро за 500 г.
| Плотность / г дм -3 : | 11350 | (293 K) |
| 10678 | (т.пл.) | |
| Молярный объем / см 3 моль -1 : | 18.26 | (293 КБ) |
| 19,40 | (т.пл.) | |
| Удельное электрическое сопротивление / мкОм · см: | 20,648 | (20 ° C) |
| Теплопроводность / Вт · м -1 K -1 : | 35,3 |
| Точка плавления / ° C: | 327,46 |
| Точка кипения / ° C: | 1749 |
| Теплота плавления / кДж моль -1 : | 5.121 |
| Теплота испарения / кДж моль -1 : | 177,8 |
| Теплота распыления / кДж моль -1 : | 195,74 |
| Энергия первой ионизации / кДж моль -1 : | 715,60 |
| Энергия второй ионизации / кДж моль -1 : | 1450,40 |
| Третья энергия ионизации / кДж моль -1 : | 3081.50 |
| в атмосфере / частей на миллион: | — |
| в земной коре / г / т: | 8 |
| в океанах / частей на миллион: | 0,003 |
| Кристаллическая структура: | гранецентрированная кубическая |
| Размеры элементарной ячейки / пм: | a = 495.00 |
| Космическая группа: | Fm3m |

| Изотоп | Относительная атомная масса | Массовый процент (%) |
|---|---|---|
| 204 Пб | 203.973029 (3) | 1,4 (1) |
| 206 Pb | 205.974449 (3) | 24,1 (1) |
| 207 Pb | 206.975881 (3) | 22,1 (1) |
| 208 Pb | 207.976636 (3) | 52,4 (1) |
| Сбалансированная полуреакция | E o / V | |
|---|---|---|
| Pb 4+ + 2e — → Pb 2+ | +1.694 | |
| Pb 2+ + 2e — → Pb | — 0,126 | |
| Pb 2+ + 2e — → Pb (s) | — 0,14 | (1 моль дм -3 HClO 4 ) |
| Pb 2+ + 2e — → Pb (s) | — 0,29 | (1 моль дм -3 H 2 SO 4 ) |
| 3PbO 2 (s) + 2H 2 O + 4e — → Pb 3 O 4 (s) + 4OH — | +0.295 | |
| PbO 2 (s) + 4H + + 2e — → Pb 2+ + 2H 2 O | +1,455 | |
| PbO 2 (с) + 4H + + SO 4 2- + 2e — → PbSO 4 (с) + 2H 2 O | +1.685 | |
| PbO 2 (s) + H + + 2e — → HPbO 2 — | +0.621 | |
| 3PbO 3 2- + 10H + + 4e — → Pb 3 O 4 (s) + 5H 2 O | +2.515 | |
| PbO 3 2- + 4H + + 2e — → PbO (s) + 2H 2 O | +2.001 | |
| PbO 3 2- + 3H + + e — → HPbO 2 — + H 2 O | +1.547 | |
| PbO 3 2- + 6H + + 2e — → Pb 2+ + 3H 2 O | +2,375 | |
| Pb 3 O 4 (s) + H 2 O + 2e — → 3PbO (s) + 2OH — | +0,249 | |
| Pb 3 O 4 (s) + 8H + + 2e — → 3Pb 2+ + 3H 2 O | +2.094 | |
| Pb 3 O 4 (s) + 2H 2 O + 2e — → 3HPbO 2 — + H + | — 0,390 | |
| PbO (s) + 2H + + 2e — → Pb (s) + H 2 O | +0,249 | |
| PbSO 4 + 2e — → Pb (s) + SO 4 2- | — 0,350 | |
| HPbO 2 — + 3H + + 2e — → Pb (s) + 2H 2 O | +0.702 | |
| Pb (s) + 2H + + 2e — → PbH 2 | — 1,507 |
Simple English Wikipedia, бесплатная энциклопедия
 | |||||||||||||||
| Общие свойства | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | | ||||||||||||||
| 18 Внешний вид | |||||||||||||||
| 18 серый | |||||||||||||||
| Стандартный атомный вес ( A r, стандартный ) | 207,2 (1) [1] | ||||||||||||||
| Свинец в таблице Менделеева | |||||||||||||||
| Атомный номер ( Z ) | 82 | ||||||||||||||
| Группа | группа 14 (углеродная группа) | ||||||||||||||
| Период | период 6 | ||||||||||||||
| Блок | p-block | ||||||||||||||
| Категория элемента | металл после перехода | ||||||||||||||
| Электронная конфигурация | [Xe] 4f 14 5d 10 6s 2 6p 2 | ||||||||||||||
Электронов на оболочку | 2, 8, 18, 32, 18, 4 | ||||||||||||||
| Физические свойства | |||||||||||||||
| Фаза при STP | твердое тело | ||||||||||||||
| Точка плавления | 600.61 K (327,46 ° C, 621,43 ° F) | ||||||||||||||
| Температура кипения | 2022 K (1749 ° C, 3180 ° F) | ||||||||||||||
| Плотность (около rt ) | 11,34 г / см 3 | ||||||||||||||
| в жидком состоянии (при т.пл. ) | 10,66 г / см 3 | ||||||||||||||
| Теплота плавления | 4,77 кДж / моль | ||||||||||||||
| Теплота испарения | 179,5 кДж / моль | ||||||||||||||
| Молярная теплоемкость | 26.650 Дж / (моль · К) | ||||||||||||||
Давление пара
| |||||||||||||||
| Атомные свойства | |||||||||||||||
| Состояния окисления | −4, −2, −1, +1, +2 , +3, +4 (амфотерный оксид) | ||||||||||||||
| Электроотрицательность | Шкала Полинга: 1.87 (+2) | ||||||||||||||
| Энергии ионизации |
| ||||||||||||||
| Эмпирический радиус | : 175 pm | ||||||||||||||
| Ковалентный радиус | 146 ± 5 pm | ||||||||||||||
| Радиус Ван-дер-Ваальса | 202 pm | ||||||||||||||
 Спектральные линии свинца Спектральные линии свинца | |||||||||||||||
| Другие свойства | |||||||||||||||
| Естественное происхождение | изначальный | ||||||||||||||
| Кристаллическая структура | гранецентрированная кубическая (ГЦК)  | ||||||||||||||
| Скорость звука тонкого стержня | 1190 м / с (при р.т. ) (отожженный) | ||||||||||||||
| Тепловое расширение | 28,9 мкм / (м · К) (при 25 ° C) | ||||||||||||||
| Теплопроводность | 35,3 Вт / (м · К) | ||||||||||||||
| Удельное электрическое сопротивление | 208 нОм · м (при 20 ° C) | ||||||||||||||
| Магнитное упорядочение | диамагнитное | ||||||||||||||
| Магнитная восприимчивость | −23,0 × 10 −6 см 3 / моль (при 298 K) | ||||||||||||||
| Модуль Юнга | 16 ГПа | ||||||||||||||
| Модуль упругости | 5.6 ГПа | ||||||||||||||
| Объемный модуль | 46 ГПа | ||||||||||||||
| Коэффициент Пуассона | 0,44 | ||||||||||||||
| Твердость по Моосу | 1,5 | ||||||||||||||
| Твердость по Бринеллю | 38–50 МПа | ||||||||||||||
| Число CAS 7439-92-1 | |||||||||||||||
| История | |||||||||||||||
| Открытие | на Ближнем Востоке (7000 г. до н.э.) | ||||||||||||||
| Основные изотопы свинца | |||||||||||||||
| Содержание изотопов сильно различается в зависимости от образца | |||||||||||||||
| | ссылки | |||||||||||||||

Свинец (произносится: «/ ‘lɛd /») — химический элемент.Его химический символ — Pb , который происходит от plumbum , латинского слова, обозначающего свинец. [3] Его атомный номер 82, атомная масса 207,2 и температура плавления 327,8 ° C. Это очень ядовитый и тяжелый металл.
Физические свойства [изменить | изменить источник]
Свинец — блестящий, серо-голубой бедный металл. Легко тускнеет до тускло-серого цвета. Он мягкий и податливый. Когда он растоплен, он очень блестит. Это очень тяжело. Он очень устойчив к коррозии.Его усиливают за счет добавления сурьмы или кальция. Может образовывать сплав с натрием. При проглатывании он токсичен для людей и животных.
Химические свойства [изменить | изменить источник]
Свинец горит на воздухе серовато-белым пламенем, выделяя токсичные пары оксида свинца (II). Воздух разъедает только поверхность. Он растворяется в азотной кислоте с образованием нитрата свинца (II). Не растворяется в серной или соляной кислоте. Он реагирует с нитратом натрия с образованием оксида свинца (II) и нитрита натрия.Он реагирует с хлором с образованием хлорида свинца (II). Оксид свинца (II) реагирует с сульфидом свинца с образованием металлического свинца и диоксида серы.
Химические соединения [изменить | изменить источник]
Свинец образует химические соединения в двух основных степенях окисления: +2 и +4. +2 соединения, также известные как соединения свинца (II) или свинцовые соединения, являются слабыми окислителями. Соединения +4, также известные как соединения свинца (IV) или соединения свинца, являются сильными окислителями. Соединения свинца токсичны, как и элемент.Галогениды свинца не растворяются в воде. Оксид свинца (IV) является наиболее распространенным соединением свинца (IV). Это черное твердое вещество. Все оксиды свинца окрашены, а другие соли — белые или бесцветные. Нитрат свинца и ацетат свинца (II) являются растворимыми соединениями свинца.
- +2 соединения
Это состояние встречается чаще, чем состояние +4. Это слабые окислители. Все, кроме оксидов, бесцветные или белые.
- Ацетат свинца (II), бесцветный растворимый
- Арсенат свинца (II), нерастворимый бывший пестицид
- Бромид свинца (II) нерастворимый
- Карбонат свинца (II), белый, используемый в качестве пигмента
- Хлорид свинца (II) нерастворимый
- Нитрат свинца (II) растворимый, бесцветный
- Оксид свинца (II), красный или желтый
- Сульфат свинца (II), белый, содержится в свинцово-кислотных аккумуляторах
- Сульфид свинца (II), черный, обыкновенный как минерал
- Соединения со смешанной степенью окисления
Соединения со смешанной степенью окисления содержат свинец в степени окисления +2 и +4.
- +4 соединения
Это реже. Они сильные окислители.
Свинец очень редко встречается в земной коре в виде металла. Обычно свинец содержится в минерале галените. Галенит — сульфид свинца.Галенит — основная свинцовая руда.
Свинециспользовался на протяжении тысяч лет, потому что его легко достать из земли, его легко придать форму и работать с ним. Римляне использовали свинец очень часто. Они использовали его для труб, сосудов для питья и крепежа.
Свинец производится из галенита. Галенит очищается путем пенной флотации, чтобы удалить все примеси. Затем сульфид свинца обжигается в печи с получением оксида свинца (II). Оксид свинца (II) нагревают с коксом для получения жидкого металлического свинца.
Как элемент [изменить | изменить источник]
 Темные кирпичи свинцовые.Они предназначены для защиты людей от радиоактивных материалов внутри.
Темные кирпичи свинцовые.Они предназначены для защиты людей от радиоактивных материалов внутри.Свинец используется в балласте парусных лодок. Он также используется в грузовых поясах для подводного плавания. Он также используется для изготовления дробинок и пуль для стрелкового оружия. Некоторые печатные машины используют свинцовый тип, потому что ему легко придать форму. Его можно использовать на улице, потому что он не подвержен коррозии в воде.
Однако большая часть свинца используется в свинцово-кислотных аккумуляторах. Свинец окисляется, образуя электричество. Листы свинца используются для блокировки звука в некоторых местах.Свинец используется в радиационной защите. Расплавленный свинец может использоваться в качестве теплоносителя в ядерных реакторах. Раньше его смешивали с оловом для изготовления трубок в органах. Разное количество свинца издает разные звуки. Кроме того, свинец нашел применение в припое.
Используется в некоторых припоях. Он используется для покрытия проводов, находящихся под высоким напряжением. В некоторых теннисных ракетках есть свинец, что делает их тяжелее. Он используется для балансировки колес автомобилей, изготовления статуй и украшения зданий.
Как химические соединения [изменить | изменить источник]
Многие соединения свинца используются для изготовления цветной глазури на керамике. Свинец можно использовать в трубах из ПВХ. В свечи добавляют соединения свинца, чтобы они лучше горели. Свинцовое стекло содержит оксид свинца (II). Свинцовые соединения все еще используются в некоторых местах в качестве пигментов. Соединения свинца были добавлены в бензин, но теперь запрещены. Некоторые соединения свинца являются полупроводниками и используются в фотодетекторах.
Старое использование [изменение | изменить источник]
Свинец использовался во многих красных, желтых и белых пигментах в красках.Свинец также использовался в пестицидах. Раньше свинец использовался в трубах, по которым идет вода, но теперь это не так, потому что свинец может попадать в воду.
Хотя к нему можно безопасно прикасаться, следует избегать контакта со свинцом — он очень токсичен для людей и других животных при проглатывании, и его использование ограничено во многих странах.
Если кто-то подвергается воздействию свинца в течение длительного времени, он разрушает почки и вызывает боли в животе. Свинец также разрушает нервную систему. Свинцовую краску ели дети, и они отравились свинцом.
Лучший способ понять свинец и его свойства — прочитать его паспорт безопасности материала.
.Как элементы сгруппированы в Периодической таблице?
В конце 19 века русский химик Дмитрий Менделеев опубликовал свою первую попытку сгруппировать химические элементы по их атомному весу. В то время было известно только около 60 элементов, но Менделеев понял, что, когда элементы были организованы по весу, определенные типы элементов возникали через равные промежутки времени или периоды.
Сегодня, 150 лет спустя, химики официально признают 118 элементов (после добавления четырех новичков в 2016 году) и до сих пор используют периодическую таблицу элементов Менделеева для их организации.Таблица начинается с простейшего атома, водорода, а затем упорядочиваются остальные элементы по атомному номеру, который представляет собой количество протонов, содержащихся в каждом. За некоторыми исключениями порядок элементов соответствует возрастающей массе каждого атома.
В таблице семь строк и 18 столбцов. Каждая строка представляет один период; номер периода элемента показывает, сколько из его энергетических уровней содержат электроны. Натрий, например, находится в третьем периоде, что означает, что атом натрия обычно имеет электроны на первых трех энергетических уровнях.Двигаясь вниз по таблице, периоды становятся длиннее, потому что для заполнения более крупных и сложных внешних уровней требуется больше электронов.
Столбцы таблицы представляют группы или семейства элементов. Элементы в группе часто выглядят и ведут себя одинаково, потому что у них одинаковое количество электронов во внешней оболочке — лице, которое они показывают миру. Элементы группы 18, например, в крайней правой части таблицы, имеют полностью заполненные внешние оболочки и редко участвуют в химических реакциях.
Элементы обычно классифицируются как металлические или неметаллические, но разделительная линия между ними нечеткая. Металлические элементы обычно хорошо проводят электричество и тепло. Подгруппы металлов основаны на схожих характеристиках и химических свойствах этих коллекций. Согласно данным Лос-Аламосской национальной лаборатории, в нашем описании периодической таблицы элементов используются общепринятые группы элементов.
Щелочные металлы: Щелочные металлы составляют большую часть Группы 1, первого столбца таблицы.Эти блестящие и достаточно мягкие, чтобы разрезать ножом, эти металлы начинаются с лития (Li) и заканчиваются францием (Fr). Они также чрезвычайно реактивны и воспламеняются или даже взрываются при контакте с водой, поэтому химики хранят их в маслах или инертных газах. Водород с одним электроном также находится в группе 1, но газ считается неметаллом.
Щелочно-земельные металлы: Щелочно-земельные металлы составляют 2-ю группу периодической таблицы, от бериллия (Be) до радия (Ra).Каждый из этих элементов имеет два электрона на внешнем энергетическом уровне, что делает щелочноземельные земли достаточно реактивными, поэтому их редко можно встретить в природе в одиночку. Но они не так реактивны, как щелочные металлы. Их химические реакции обычно протекают медленнее и выделяют меньше тепла по сравнению с щелочными металлами.
Lanthanides: Третья группа слишком длинна, чтобы поместиться в третьем столбце, поэтому она вырывается и переворачивается боком, чтобы стать верхней строкой острова, плавающего в нижней части таблицы.Это лантаноиды, элементы с 57 по 71 — от лантана (La) до лютеция (Lu). Элементы этой группы имеют серебристо-белый цвет и тускнеют при контакте с воздухом.
Актиниды: Актиниды выстилают нижний ряд острова и включают элементы от 89, актиний (Ac) до 103, лоуренсий (Lr). Из этих элементов только торий (Th) и уран (U) встречаются на Земле в значительных количествах. Все радиоактивны. Актиниды и лантаноиды вместе образуют группу, называемую внутренними переходными металлами.
Переходные металлы: Возвращаясь к основной части таблицы, остатки групп с 3 по 12 представляют остальные переходные металлы. Твердые, но пластичные, блестящие и обладающие хорошей проводимостью, эти элементы — это то, о чем вы обычно думаете, когда слышите слово «металл». Здесь живут многие из лучших хитов металлического мира, в том числе золото, серебро, железо и платина.
Постпереходные металлы: Перед прыжком в мир неметаллов общие характеристики не разделены аккуратно по вертикальным групповым линиям.Постпереходными металлами являются алюминий (Al), галлий (Ga), индий (In), таллий (Tl), олово (Sn), свинец (Pb) и висмут (Bi), и они охватывают группы с 13 по 17. Эти элементы обладают некоторыми из классических характеристик переходных металлов, но они, как правило, более мягкие и проводят хуже, чем другие переходные металлы. Во многих периодических таблицах жирным шрифтом будет выделена линия «лестницы» под диагональю, соединяющей бор с астатом. Металлы постпереходного типа расположены в нижнем левом углу этой линии.
Металлоиды: Металлоиды: бор (B), кремний (Si), германий (Ge), мышьяк (As), сурьма (Sb), теллур (Te) и полоний (Po). Они образуют лестницу, символизирующую постепенный переход от металлов к неметаллам. Эти элементы иногда ведут себя как полупроводники (B, Si, Ge), а не как проводники. Металлоиды также называют «полуметаллами» или «бедными металлами».
Неметаллы: Все остальное в правом верхнем углу лестницы — плюс водород (H), скрученный назад в Группе 1 — является неметаллом.К ним относятся углерод (C), азот (N), фосфор (P), кислород (O), сера (S) и селен (Se).
Галогены: Четыре верхних элемента Группы 17, от фтора (F) до астата (At), представляют собой одно из двух подмножеств неметаллов. Галогены довольно химически активны и имеют тенденцию образовывать пары со щелочными металлами с образованием различных типов солей. Например, поваренная соль на вашей кухне — это смесь щелочного металла натрия и галогенового хлора.
Благородные газы: Бесцветные, без запаха и почти полностью инертные, инертные или благородные газы завершают таблицу в группе 18.Многие химики ожидают, что оганессон, один из четырех недавно названных элементов, будет обладать этими характеристиками; однако, поскольку этот элемент имеет период полураспада в миллисекундах, никто не смог проверить его напрямую. Оганессон завершает седьмой период периодической таблицы, поэтому, если кому-то удастся синтезировать элемент 119 (а гонка за это уже начата), он перейдет в цикл, чтобы начать восьмую строку в столбце щелочного металла.
Из-за цикличности, создаваемой периодичностью, которая дала название таблице, некоторые химики предпочитают визуализировать таблицу Менделеева в виде круга.
Дополнительные ресурсы :
.




