Железо — общая характеристика элемента, химические свойства железа и его соединений
 Желе́зо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия). Металл средней активности, восстановитель.
Желе́зо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия). Металл средней активности, восстановитель.
Основные степени окисления — +2, +3
Простое вещество железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
Химические свойства простого вещества — железа:
Ржавление и горение в кислороде
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe + 3O2 + 6H2 O → 4Fe(OH)3
Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа (II, III):
3Fe + 2O2 → Fe3O4
3Fe+2O2→(Fe IIFe2III)O4 (160 °С)
2) При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O –t°→ Fe3O4 + 4H2
3) Железо реагирует с неметаллами при нагревании:
2Fe+3Cl2→2FeCl3 (200 °С)
2Fe + 3Br2 –t°→ 2FeBr3
Fe + S –t°→ FeS (600 °С)
Fe+2S → Fe+2(S2-1) (700°С)
4) В ряду напряжений стоит левее водорода, реагирует с разбавленными кислотами НСl и Н
Fe + 2HCl → FeCl2 + H2 (реакции проводятся без доступа воздуха, иначе Fe+2 постепенно переводится кислородом в Fe+3 )
Fe + H2SO4(разб.) → FeSO4 + H2
В концентрированных кислотах–окислителях железо растворяется только при нагревании, оно сразу переходит в катион Fе3+:
2Fe + 6H2SO4(конц.) –t°→ Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3(конц.) –t°→ Fe(NO3
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
Железный гвоздь, погруженный в голубоватый раствор медного купороса, постепенно покрывается налетом красной металлической меди
5) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe + CuSO4 → FeSO4 + Cu
6)
Амфотерность железа проявляется только в концентрированных щелочах при кипячении:
Fе + 2NaОН (50 %) + 2Н2O= Nа2[Fе(ОН)4]↓+ Н2↑
и образуется осадок тетрагидроксоферрата(II) натрия.
Техническое железо — сплавы железа с углеродом: чугун содержит 2,06-6,67 % С, сталь 0,02-2,06 % С, часто присутствуют другие естественные примеси (S, Р, Si) и вводимые искусственно специальные добавки (Мn, Ni, Сr), что придает сплавам железа технически полезные свойства — твердость, термическую и коррозионную стойкость, ковкость и др.
Доменный процесс производства чугуна
Доменный процесс производства чугуна составляют следующие стадии:
а) подготовка (обжиг) сульфидных и карбонатных руд — перевод в оксидную руду:
FeS2→Fe2O3 (O2,800°С, -SO2) FeCO3→Fe2O3 (O
б) сжигание кокса при горячем дутье:
С(кокс) + O2 (воздух) →СO2 (600—700°С) СO2 + С(кокс) ⇌ 2СО (700—1000 °С)
в) восстановление оксидной руды угарным газом СО последовательно:
Fe2O3→(CO) (FeIIFe2III)O4→(CO) FeO→(CO) Fe
г) науглероживание железа (до 6,67 % С) и расплавление чугуна:
Fе(т)→(C(кокс) 900—1200°С)Fе(ж) (чугун, t пл 1145°С)
В чугуне всегда в виде зерен присутствуют цементит Fe2С и графит.
Производство стали
Получение чистого железа в промышленности — электролиз раствора солей железа, например:
FеСl2→ Fе↓ + Сl
(существуют и другие специальные методы, в том числе восстановление оксидов железа водородом).
Чистое железо применяется в производстве специальных сплавов, при изготовлении сердечников электромагнитов и трансформаторов, чугун — в производстве литья и стали, сталь — как конструкционный и инструментальный материалы, в том числе износо-, жаро- и коррозионно-стойкие.
Оксид железа(II) FеО. Амфотерный оксид с большим преобладанием основных свойств. Черный, имеет ионное строение Fе2+ O2-. При нагревании вначале разлагается, затем образуется вновь. Не образуется при сгорании железа на воздухе. Не реагирует с водой. Разлагается кислотами, сплавляется со щелочами. Медленно окисляется во влажном воздухе. Восстанавливается водородом, коксом. Участвует в доменном процессе выплавки чугуна. Применяется как компонент керамики и минеральных красок. Уравнения важнейших реакций:
4FеО ⇌(FeIIFe2 III) + Fе (560—700 °С , 900—1000°С)
FеО + 2НС1 (разб.) = FеС12 + Н2O
FеО + 4НNO3 (конц.) = Fе(NO3)3 +NO2↑ + 2Н2O
FеО + 4NаОН =2Н2O + Nа4FеO3(красн
FеО + Н2 =Н2O + Fе (особо чистое) (350°С)
FеО + С(кокс) = Fе + СО (выше 1000 °С)
FеО + СО = Fе + СO2 (900°С)
4FеО + 2Н2O(влага) + O2(воздух) →4FеО(ОН) (t)
6FеО + O2 = 2(FeIIFe2III )O4 (300—500°С)
Получение в лаборатории: термическое разложение соединений железа (II) без доступа воздуха:
Fе(ОН)2 = FеО + Н2O (150-200 °С)
FеСОз = FеО + СO2 (490-550 °С)
Оксид дижелеза (III) – железа(
2(FeIIFe2 III )O4 = 6FеО + O2 (выше 1538 °С)
(FeIIFe2III )O4 + 8НС1 (разб.) = FеС12 + 2FеС13 + 4Н2O
(FeIIFe2III )O4 +10НNO3 (конц.) =3Fе(NO3)3 + NO2↑+ 5Н2O
(FeIIFe2III )O4 + O2 (воздух) = 6Fе2O3 (450-600°С)
(FeIIFe2III )O4 + 4Н2 = 4Н2O + 3Fе (особо чистое, 1000 °С)
(FeIIFe2III )O4 + СО =ЗFеО + СO2 (500—800°C)
(FeIIFe2 III )O4 + Fе ⇌4FеО (900—1000 °С , 560—700 °С)
Получение: сгорание железа (см.) на воздухе.
В природе — оксидная руда железа магнетит.
Оксид железа(III) Fе2О3. Амфотерный оксид с преобладанием основных свойств. Красно-коричневый, имеет ионное строение (Fе 3+)2(O2-)3. Термически устойчив до высоких температур. Не образуется при сгорании железа на воздухе. Не реагирует с водой, из раствора выпадает бурый аморфный гидрат Fе
Уравнения важнейших реакций:
6Fе2O3 = 4(FeIIFe2III )O4 +O2 (1200—1300 °С)
Fе2O3 + 6НС1 (разб.) →2FеС13 + ЗН2O (t) (600°С,р)
Fе2O3 + 2NaОН (конц.) →Н2O+ 2NаFеO2 (красн.) диоксоферрат(III)
Fе2О3 + МО=(МIIFе2III)O4 (М=Сu, Мn, Fе, Ni, Zn)
Fе2O3 + ЗН2 =ЗН2O+ 2Fе (особо чистое, 1050—1100 °С)
Fе2O3 + Fе = ЗFеО (900 °С)
3Fе2O3 + СО = 2(FeIIFе2III)O4 + СO2 (400—600 °С)
Получение в лаборатории — термическое разложение солей железа (III) на воздухе:
Fе2(SO4)3 = Fе2O3 + 3SO3 (500-700 °С)
4{Fе(NO3)3 9 Н2O} = 2FеaO3 + 12NO2+ 3O2 + 36Н2O (600-700 °С)
В природе — оксидные руды железа гематит Fе2O3 и лимонит Fе2O3 nН2O
Гидроксид железа (II) Fе(ОН)2. Амфотерный гидроксид с преобладанием основных свойств. Белый (иногда с зеленоватым оттенком), связи Fе — ОН преимущественно ковалентные. Термически неустойчив. Легко окисляется на воздухе, особенно во влажном состоянии (темнеет). Нерастворим в воде. Реагирует с разбавленными кислотами, концентрированными щелочами. Типичный восстановитель. Промежуточный продукт при ржавлении железа. Применяется в изготовлении активной массы железоникелевых аккумуляторов.
Уравнения важнейших реакций:
Fе(OН)2 = FеО + Н2O (150-200 °С, в атм.N2)
Fе(ОН)2 + 2НС1 (разб.) =FеС12 + 2Н2O
Fе(ОН)2 + 2NаОН (> 50%) = Nа2[Fе(ОН)4] ↓(сине-зеленый) (кипячение)
4Fе(ОН)2 (суспензия) + O2 (воздух) →4FеО(ОН)↓ + 2Н2O (t)
2Fе(ОН)2 (суспензия) +Н2O2 (разб.) = 2FеО(ОН)↓ + 2Н2O
Fе(ОН)2 + КNO3(конц.) = FеО(ОН)↓ + NO↑+ КОН (60 °С)
Получение: осаждение из раствора щелочами или гидратом аммиака в инертной атмосфере:
Fе2+ + 2OH (разб.) = Fе(ОН)2↓
Fе2+ + 2(NH3Н2O) = Fе(ОН)2↓+ 2NH4
Метагидроксид железа FеО(ОН). Амфотерный гидроксид с преобладанием основных свойств. Светло-коричневый, связи Fе — О и Fе — ОН преимущественно ковалентные. При нагревании разлагается без плавления. Нерастворим в воде. Осаждается из раствора в виде бурого аморфного полигидрата Fе2O3 nН2O, который при выдерживании под разбавленным щелочным раствором или при высушивании переходит в FеО(ОН). Реагирует с кислотами, твердыми щелочами. Слабый окислитель и восстановитель. Спекается с Fе(ОН)2. Промежуточный продукт при ржавлении железа. Применяется как основа желтых минеральных красок и эмалей, поглотитель отходящих газов, катализатор в органическом синтезе.
Соединение состава Fе(ОН)3 не известно (не получено).
Уравнения важнейших реакций:
Fе2O3. nН2O→(200-250 °С, —H2O) FеО(ОН)→( 560-700° С на воздухе , -h3O) →Fе2О3
FеО(ОН) + ЗНС1 (разб.) =FеС13 + 2Н2O
FeO(OH)→Fe2O3.nH2O -коллоид (NаОН (конц.))
FеО(ОН)→Nа3[Fе(ОН)6] белый , Nа5[Fе(OН)8желтоватый (75 °С, NаОН( т))
2FеО(ОН) + Fе(ОН)2=( FeIIFe2III )O4 + 2Н2O (600—1000 °С)
2FеО(ОН) + ЗН2 = 4Н2O+ 2Fе (особо чистое, 500—600 °С)
2FеО(ОН) + ЗВr2 + 10КОН = 2К2FеO4 + 6Н2O + 6КВr
Получение: осаждение из раствора солей железа(Ш) гидрата Fе2О3 nН2O и его частичное обезвоживание (см. выше).
В природе — оксидная руда железа лимонит Fе2O3 nН2О и минерал гётит FеО(ОН).
Феррат калия К2FеО4. Оксосоль. Красно-фиолетовый, разлагается при сильном нагревании. Хорошо растворим в концентрированном растворе КОН, реагирует с кипящей водой, неустойчив в кислотной среде. Сильный окислитель.
Качественная реакция — образование красного осадка феррата бария. Применяется в синтезе ферритов — промышленно важных двойных оксидов железа (III) и других металлов.
Уравнения важнейших реакций:
4К2FеO4= 4КFеO2 + 3O2 + 2К2O (700 °С)
4К2FеO4 + 6Н2O (гор.) =4FeО(ОН)↓ + 8КОН + 3O2↑
FеО42- + 2OН+(разб.) =4Fе3+ + 3O2↑+10Н2O
FеО42- + 2(NH3. Н2O) →2FеО(ОН)↓ + N2↑+ 2Н2O+ 4OН—
FеО42- + Ва2+ = ВаFеO4 (красн.)↓ (в конц. КОН)
Получение: образуется при окислении соединений железа, например метагидроксида FеО(ОН), бромной водой, а также при действии сильных окислителей (при спекании) на железо
Fе + 2КОН + 2КNO3 = К2FеO4 + 3КNO2+ H2O (420 °С)
и электролизе в растворе:
электролиз
Fе + 2КОН (конц.) + 2Н2O→ЗН2↑ + К2FеO4 ( электролиз)
(феррат калия образуется на аноде).
Качественные реакции на ионы Fе2+ и Fе3+
Обнаружение ионов Fе2+ и Fе3+в водном растворе проводят с помощью реактивов К3[Fе(СN)6] и К4[Fе(СN)6] соответственно; в обоих случаях выпадает синий продукт одинакового состава и строения, КFеIII[FеII (СN)6]. В лаборатории этот осадок называют берлинская лазурь, или турнбуллева синь:
Fе2+ + К+ + [Fе(СN)6]3- = КFеIII[FеII (СN) 6]↓
Fе3+ + К+ + [Fе(СN)6]4- = КFеIII[FеII (СN) 6]↓
Химические названия исходных реактивов и продукта реакций:
К3FеIII[Fе(СN) 6]- гексацианоферрат (III) калия
К4FеIII[Fе (СN) 6]- гексацианоферрат (II) калия
КFеIII[FеII (СN) 6]- гексацианоферрат (II) железа (Ш) калия
Кроме того, хорошим реактивом на ионы Fе3+ является тиоцианат-ион NСS—, железо (III) соединяется с ним, и появляется ярко-красная («кровавая») окраска:
Fе3+ + 6NСS— = [Fе(NСS)6]3-
Этим реактивом (например, в виде соли КNСS) можно обнаружить даже следы железа (III) в водопроводной воде, если она проходит через железные трубы, покрытые изнутри ржавчиной.


himege.ru
Железо. Описание, свойства, происхождение и применение металла

Чистое железо (99,97%), очищенное методом электролиза
Железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
СТРУКТУРА
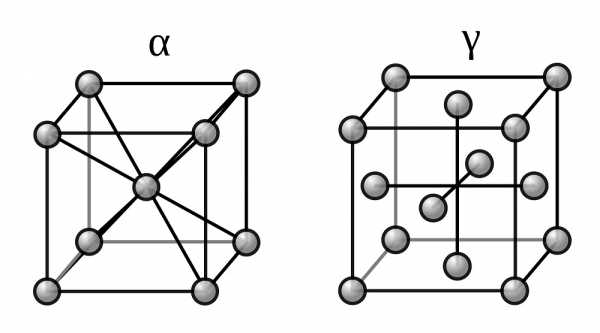
Две модификации кристаллической решетки железа
Для железа установлено несколько полиморфных модификаций, из которых высокотемпературная модификация — γ-Fe(выше 906°) образует решетку гранецентрированного куба типа Сu (а0 = 3,63), а низкотемпературная — α-Fe-решетку центрированного куба типа α-Fe (a0 = 2,86).
В зависимости от температуры нагрева железо может находиться в трех модификациях, характеризующихся различным строением кристаллической решетки:
- В интервале температур от самых низких до 910°С —а-феррит (альфа-феррит), имеющий строение кристаллической решетки в виде центрированного куба;
- В интервале температур от 910 до 1390°С — аустенит, кристаллическая решетка которого имеет строение гранецентрированного куба;
- В интервале температур от 1390 до 1535°С (температура плавления) — д-феррит (дельта-феррит). Кристаллическая решетка д-феррита такая же, как и а-феррита. Различие между ними только в иных (для д-феррита больших) расстояниях между атомами.
При охлаждении жидкого железа первичные кристаллы (центры кристаллизации) возникают одновременно во многих точках охлаждаемого объема. При последующем охлаждении вокруг каждого центра надстраиваются новые кристаллические ячейки, пока не будет исчерпан весь запас жидкого металла.
В результате получается зернистое строение металла. Каждое зерно имеет кристаллическую решетку с определенным направлением его осей.
При последующем охлаждении твердого железа при переходах д-феррита в аустенит и аустенита в а-феррит могут возникать новые центры кристаллизации с соответствующим изменением величины зерна
СВОЙСТВА

Железная руда
В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все. Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, — единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
ЗАПАСЫ И ДОБЫЧА
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.

Железо
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах.
Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты.
Содержание железа в морской воде — 1·10−5-1·10−8 %
В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3).
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха.
Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
ПРОИСХОЖДЕНИЕ

Самородное железо
Происхождение теллурическое (земное) железо редко встречается в базальтовыхлавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe1-xS) и когенит (Fe3C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO)n. В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов — железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.
ПРИМЕНЕНИЕ

Кольцо из железа
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Железо (англ. Iron) — Fe
| Молекулярный вес | 55.85 г/моль |
| Происхождение названия | возможно англо-саксонского происхождения |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.57
| Strunz (8-ое издание) | 1/A.07-10 |
| Nickel-Strunz (10-ое издание) | 1.AE.05 |
| Dana (7-ое издание) | 1.1.17.1 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | железно-черный |
| Цвет черты | серый |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | несовершенная по {001} |
| Твердость (шкала Мооса) | 4,5 |
| Излом | в зазубринах |
| Прочность | ковкий |
| Плотность (измеренная) | 7.3 — 7.87 г/см3 |
| Радиоактивность (GRapi) | 0 |
| Магнетизм | ферромагнетик |
ОПТИЧЕСКИЕ СВОЙСТВА
| Тип | изотропный |
| Цвет в отраженном свете | белый |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | m3m (4/m 3 2/m) — изометрический — гексаоктаэдральный |
| Пространственная группа | Im3m (I4/m 3 2/m) |
| Сингония | кубическая |
| Параметры ячейки | a = 2.8664Å |
| Двойникование | (111) также в пластинчатых массах {112} |
| Морфология | в маленьких пузырьках |
Интересные статьи:
mineralpro.ru 13.07.2016mineralpro.ru
Химическое и физические свойства железа
Железо — всем известный химический элемент. Он относится к средним по химической активности металлам. Свойства и применение железа мы рассмотрим в этой статье.
Распространенность в природе
Существует довольно большое количество минералов, в состав которых входит феррум. Прежде всего, это магнетит. Он на семьдесят два процента состоит из железа. Его химическая формула — Fe3O4. Данный минерал еще называют магнитный железняк. Он обладает светло-серым цветом, иногда с темно-серым, вплоть до черного, с металлическим блеском. Наибольшее его месторождение среди стран СНГ находится на Урале.

Следующий минерал с высоким содержанием железа — гематит — он на семьдесят процентов состоит из данного элемента. Его химическая формула — Fe2O3. Его еще называют красным железняком. Он обладает окраской от красно-коричневой до красно-серой. Наибольшее месторождение на территории стран СНГ находится в Кривом Роге.
Третий по содержанию феррума минерал — лимонит. Здесь железа шестдесят процентов от общей массы. Это кристаллогидрат, то есть в его кристаллическую решетку вплетены молекулы воды, его химическая формула — Fe2O3•H2O. Как понятно из названия, данный минерал имеет желто-коричневатый цвет, изредка бурый. Он является одной из главных составляющих природных охр и используется в качестве пигмента. Его также называют бурый железняк. Самые крупные места залегания — Крым, Урал.
В сидерите, так называемом шпатовом железняке, сорок восемь процентов феррума. Его химическая формула — FeCO3. Его структура неоднородна и состоит из соединенных вместе кристаллов разного цвета: серых, бледно-зеленых, серо-желтых, коричнево-желтых и др.
Последний часто встречающийся в природе минерал с высоким содержанием феррума — пирит. Он обладает такой химической формулой FeS2. Железа в нем находится сорок шесть процентов от общей массы. Благодаря атомам серы данный минерал имеет золотисто-желтую окраску.
Многие из рассмотренных минералов применяются для получения чистого железа. Кроме того, гематит используют в изготовлении украшений из натуральных камней. Вкрапления пирита могут иметься в украшениях из лазурита. Кроме этого, в природе железо встречается в составе живых организмов — оно является одним из важнейших компонентов клетки. Данный микроэлемент обязательно должен поступать в организм человека в достаточном количестве. Лечебные свойства железа во многом связаны с тем, что данный химический элемент является основой гемоглобина. Поэтому употребление феррума хорошо сказывается на состоянии крови, а следовательно, и всего организма в целом.
Железо: физические и химические свойства
Рассмотрим по порядку два этих больших раздела. Физические свойства железа — это его внешний вид, плотность, температура плавления и т. д. То есть все отличительные черты вещества, которые связаны с физикой. Химические свойства железа — это его способность вступать в реакцию с другими соединениями. Начнем с первых.
Физические свойства железа
В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод.
 Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все.
Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость. Но и это еще далеко не все.Также в физические свойства железа входит и его ферромагнитность. Что это такое? Железо, магнитные свойства которого мы можем наблюдать на практических примерах каждый день, — единственный металл, обладающий такой уникальной отличительной чертой. Это объясняется тем, что данный материал способен намагничиваться под действием магнитного поля. А по прекращении действия последнего железо, магнитные свойства которого только что сформировались, еще надолго само остается магнитом. Такой феномен можно объяснить тем, что в структуре данного металла присутствует множество свободных электронов, которые способны передвигаться.
С точки зрения химии
Данный элемент относится к металлам средней активности. Но химические свойста железа являются типичными и для всех остальных металлов (кроме тех, которые находятся правее водорода в электрохимическом ряду). Оно способно реагировать со многими классами веществ.
Начнем с простых
Феррум вступает во взаимодействие с килородом, азотом, галогенами (йодом, бромом, хлором, фтором), фосфором, карбоном. Первое, что нужно рассмотреть, — реакции с оксигеном. При сжигании феррума образуются его оксиды. В зависимости от условий проведения реакции и пропорций между двумя участниками они могут быть разнообразными. Как пример такого рода взаимодействиям можно привести следующие уравнения реакций: 2Fe + O2 = 2FeO; 4Fe + 3O2 = 2Fe2O3; 3Fe + 2O2 = Fe3O4. И свойства оксида железа (как физические, так и химические) могут быть разнообразными, в зависимости от его разновидности. Такого рода реакции происходят при высоких температурах.

Следующее — взаимодействие с азотом. Оно также может произойти только при условии нагревания. Если взять шесть молей железа и один моль азота, получим два моля нитрида железа. Уравнение реакции будет выглядеть следующим образом: 6Fe + N2 = 2Fe3N.
При взаимодействии с фосфором образуется фосфид. Для проведения реакции необходимы такие компоненты: на три моля феррума — один моль фосфора, в результате образуется один моль фосфида. Уравнение можно записать следующим образом: 3Fe + P = Fe3P.
Кроме того, среди реакций с простыми веществами можно также выделить взаимодействие с серой. При этом можно получить сульфид. Принцип, по которому происходит процесс образования данного вещества, подобен описанным выше. А именно происходит реакция присоединения. Для всех химических взаимодействий подобного рода нужны специальные условия, в основном это высокие температуры, реже — катализаторы.
Также распространены в химической промышленности реакции между железом и галогенами. Это хлорирование, бромирование, йодирование, фторирование. Как понятно из названий самих реакций, это процесс присоединения к атомам феррума атомов хлора/брома/йода/фтора с образованием хлорида/бромида/йодида/фторида соответственно. Данные вещества широко используются в разнообразных отраслях промышленности. Кроме того, феррум способен соединяться с кремнием при высоких температурах. Благодаря тому что химические свойства железа разнообразны, его часто используют в химической отрасли промышленности.
Феррум и сложные вещества
От простых веществ перейдем к тем, молекулы которых состоят из двух и более различных химических элементов. Первое, что нужно упомянуть, — реакцию феррума с водой. Здесь проявляются основные свойства железа. При нагревании воды вместе с железом образуется основный оксид (называется он так потому, что при взаимодействии с той же водой образует гидроксид, по-другому говоря — основание). Итак, если взять по одному молю обоих компонентов, образуются такие вещества, как диоксид феррума и водород в виде газа с резким запахом — также в молярных пропорциях один к одному. Уравнение такого рода реакции можно записать следующим образом: Fe + H2O = FeO + H2. В зависимости от пропорций, в которых смешать эти два компонента, можно получить ди- либо триоксид железа. Оба этих вещества очень распространены в химической промышленности, а также используются во многих других отраслях.
С кислотами и солями
Так как феррум находится левее водорода в электрохимическом ряду активности металлов, он спосособен вытеснять данный элемент из соединений. Примером этому является реакция замещения, которую можно наблюдать при добавлении железа к кислоте. Например, если смешать в одинаковых молярных пропорциях железо и сульфатную кислоту (она же серная) средней концентрации, в результате получим сульфат железа (ІІ) и водород в одинаковых молярных пропорциях. Уравнение такой реакции будет выглядеть таким образом: Fe + H2SO4 = FeSO4 + H2.
При взаимодействии с солями проявляются восстановительные свойства железа. То есть с помощью него можно выделить менее активный металл из соли. Например, если взять один моль сульфата меди и столько же феррума, то можно получить сульфат железа (ІІ) и чистую медь в одинаковых молярных пропорциях.
Значение для организма
Один из самых распространенных в земной коре химических элементов — железо. Свойства вещества мы уже рассмотрели, теперь подойдем к нему с биологической точки зрения. Феррум выполняет очень важные функции как на клеточном уровне, так и на уровне всего организма. В первую очередь железо является основой такого белка, как гемоглобин. Он необходим для транспорта кислорода по крови от легких ко всем тканям, органам, к каждой клетке организма, в первую очередь к нейронам головного мозга. Поэтому полезные свойства железа невозможно переоценить.
Кроме того что он влияет на кровеобразование, феррум также важен для полноценного функционирования щитовидной железы (для этого нужен не только йод, как некоторые считают). Также железо принимает участие во внутриклеточном обмене веществ, регулирует иммунитет. Еще феррум в особенно большом количестве содержится в клетках печени, так как помогает нейтрализовать вредные вещества. Также он является одним из главных компонентов многих видов ферментов нашего организма. В суточном рационе человека должно содержаться от десяти до двадцати миллиграмм данного микроэлемента.
Продукты, богатые железом
Таких немало. Они есть как растительного, так и животного происхождения. Первые — это злаки, бобовые, крупы (в особенности гречка), яблоки, грибы (белые), сухофрукты, шиповник, груши, персики, авокадо, тыква, миндаль, финики, помидоры, брокколи, капуста, черника, ежевика, сельдерей и др. Вторые — печень, мясо. Употребление продуктов с высоким содержанием железа особенно важно в период беременности, так как организм формирующегося плода требует большого количества данного микроэлемента для полноценного роста и развития.
Признаки недостатка в организме железа
Симптомами слишком маленького количества феррума, поступающего в организм, являются усталость, постоянное замерзание рук и ног, депрессии, ломкость волос и ногтей, снижение интеллектуальной активности, пищеварительные расстройства, низкая работоспособность, нарушения в работе щитовидной железы. Если вы заметили несколько из этих симптомов, то стоит увеличить количество продуктов с содержанием железа в своем рационе либо купить витамины или пищевые добавки с содержанием феррума. Также обязательно нужно обратиться к врачу, если какие-либо из этих симптомов вы ощущаете слишком остро.

Использование феррума в промышленности
Применение и свойства железа тесно связаны. В связи с его ферромагнитностью, его применяют для изготовления магнитов — как более слабых для бытовых целей (сувенирные магниты на холодильник и т. д.), так и более сильных — для промышленных целей. В связи с тем что рассматриваемый металл обладает высокой прочностью и твердостью, его с древности использовали для изготовления оружия, доспехов и других военных и бытовых инструментов. К слову, еще в Древнем Египте было известно метеоритное железо, свойства которого превосходят таковые у обычного металла. Также такое особенное железо использовалось и в Древнем Риме. Из него изготавливали элитное оружие. Щит или меч, выполненный из метеоритного металла, мог иметь только очень богатый и знатный человек.

Вообще, металл, который мы рассматриваем в данной статье, является самым разносторонне используемым среди всех веществ данной группы. Прежде всего, из него изготавливаются сталь и чугун, которые применяются для производства всевозможных изделий, необходимых как в промышленности, так и в повседневной жизни.
Чугуном называется сплав железа и углерода, в котором второго присутствует от 1,7 до 4,5 процента. Если второго меньше, чем 1,7 процента, то такого рода сплав называется сталью. Если углерода в составе присутствует около 0,02 процента, то это уже обыкновенное техническое железо. Присутствие в сплаве углерода необходимо для придания ему большей прочности, термоустойчивости, стойкости к ржавлению.
Кроме того, в стали может содержаться много других химических элементов в качестве примесей. Это и марганец, и фосфор, и кремний. Также в такого рода сплав для придания ему определенных качеств могут быть добавлены хром, никель, молибден, вольфрам и многие другие химические элементы. Виды стали, в которых присутствует большое количество кремния (около четырех процентов), используются в качестве трансформаторных. Те, в составе которых много марганца (вплоть до двенадцати-четырнадцати процентов), находят свое применение при изготовлении деталей железных дорог, мельниц, дробилок и других инструментов, части которых подвержены быстрому стиранию.
Молибден вводят в состав сплава, чтобы сделать его более термоустойчивым — такие стали используются в качестве инструментальных. Кроме того, для получения всем известных и часто используемых в быту в виде ножей и других бытовых инструментов нержавеющих сталей необходимо добавление в сплав хрома, никеля и титана. А для того чтобы получить ударостойкую, высокопрочную, пластичную сталь, достаточно добавить к ней ванадий. При вводе в состав ниобия можно добиться высокой устойчивости к коррозии и воздействию химически агрессивных веществ.
Минерал магнетит, который был упомянут в начале статьи, нужен для изготовления жестких дисков, карт памяти и других устройств подобного типа. Благодаря магнитным свойствам, железо можно найти в устройстве трансформаторов, двигателей, электронных изделий и др. Кроме того, феррум могут добавлять в сплавы прочих металлов для придания им большей прочности и механической устойчивости. Сульфат данного элемента применяют в садоводстве для борьбы с вредителями (наряду с сульфатом меди).
 Хлориды железа являются незаменимыми при очистке воды. Кроме того, порошок магнетита используется в черно-белых принтерах. Главный способ применения пирита — получение из него серной кислоты. Данный процесс происходит в лабораторных условиях в три этапа. На первой стадии пирит феррума сжигают, получая при этом оксид железа и диоксид серы. На втором этапе происходит превращение диоксида сульфура в его триоксид при участии кислорода. И на завершающей стадии полученное вещество пропускают через водяной пар в присутствии катализаторов, тем самым и получая серную кислоту.
Хлориды железа являются незаменимыми при очистке воды. Кроме того, порошок магнетита используется в черно-белых принтерах. Главный способ применения пирита — получение из него серной кислоты. Данный процесс происходит в лабораторных условиях в три этапа. На первой стадии пирит феррума сжигают, получая при этом оксид железа и диоксид серы. На втором этапе происходит превращение диоксида сульфура в его триоксид при участии кислорода. И на завершающей стадии полученное вещество пропускают через водяной пар в присутствии катализаторов, тем самым и получая серную кислоту.Получение железа
В основном добывают данный металл из двух основных его минералов: магнетита и гематита. Делают это с помощью восстановления железа из его соединений углеродом в виде кокса. Делается это в доменных печах, температура в которых достигает двух тысяч градусов по шкале Цельсия. Кроме того, есть способ восстановления феррума водородом. Для этого необязательно наличие доменной печи. Для осуществления данного метода берут специальную глину, смешивают ее с измельченной рудой и обрабатывают водородом в шахтной печи.
Заключение
Свойства и применение железа разнообразны. Это, пожалуй, самый важный в нашей жизни металл. Став известным человечеству, он занял место бронзы, которая на тот момент была основным материалом для изготовления всех орудий труда, а также оружия. Сталь и чугун во многом превосходят сплав меди с оловом с точки зрения своих физических свойств, устойчивости к механическим воздействиям.
Кроме того, железо на нашей планете более распространено, чем многие другие металлы. Массовая доля его в земной коре составляет почти пять процентов. Это четвертый по распространенности в природе химический элемент. Также данный химический элемент очень важен для нормального функционирования организма животных и растений, прежде всего потому, что на его основе построен гемоглобин. Железо является важнейшим микроэлементом, употребление которого важно для поддержания здоровья и нормальной работы органов. Кроме вышеперечисленного, это единственный металл, который обладает уникальными магнитными свойствами. Без феррума невозможно представить нашу жизнь.
fb.ru
Железо и его соединения
В организме человека содержится около 5 г железа, большая часть его (70%) входит в состав гемоглобина крови.
В свободном состоянии железо — серебристо-белый металл с сероватым оттенком. Чистое железо пластично, обладает ферромагнитными свойствами. На практике обычно используются сплавы железа — чугуны и стали.
Fe — самый главный и самый распространенный элемент из девяти d-металлов побочной подгруппы VIII группы. Вместе с кобальтом и никелем образует «семейство железа».
При образовании соединений с другими элементами чаще использует 2 или 3 электрона (В = II, III ).
Железо, как и почти все d-элементы VIII группы, не проявляет высшую валентность, равную номеру группы. Его максимальная валентность достигает VI и проявляется крайне редко.
Наиболее характерны соединения, в которых атомы Fe находятся в степенях окисления +2 и +3.
Fe+2 | Fe+3 | Fe+6 | ||
Оксиды | FeOосновный | Fe2O3основный со слабыми признаками амфотерости | FeO3 — не выделен | |
Гидроксиды | Fe(OH)2 слабое основание | Fe(OH)3 ↔ HFeO2 + H2O | H2FeO4кислота, в свободном состоянии не выделена | |
Соли | FeCl2, FeSO4, Fe(NO3)2 и др. | Тип IFeCl3 | Тип IIKFeO2 | K2FeO4BaFeO4SrFeO4ферраты (IV) |
1. Техническое железо (в сплаве с углеродом и другими примесями) получают карботермическим восстановлением его природных соединений по схеме:
Восстановление происходит постепенно, в 3 стадии:
1) 3Fe2O3 + СО = 2Fe3O4 + СO2
2) Fe3O4 + СО = 3FeO +СO2
3) FeO + СО = Fe + СO2
Образующийся в результате этого процесса чугун содержит более 2% углерода. В дальнейшем из чугуна получают стали — сплавы железа, содержащие менее 1,5 % углерода.
2. Очень чистое железо получают одним из способов:
а) разложение пентакарбонила Fe
Fe(CO)5 = Fe + 5СО
б) восстановление водородом чистого FeO
FeO + Н2 = Fe + Н2O
в) электролиз водных растворов солей Fe+2
FeC2O4 = Fe + 2СO2
оксалат железа (II)
Fe — металл средней активности, проявляет общие свойства, характерные для металлов.
Уникальной особенностью является способность к «ржавлению» во влажном воздухе:
4Fe + 6Н2O + 3O2 = 4Fe(OH)3
В отсутствие влаги с сухим воздухом железо начинает заметно реагировать лишь при Т > 150°С; при прокаливании образуется «железная окалина» Fe3O4:
3Fe + 2O2 = Fe3O4
В воде в отсутствие кислорода железо не растворяется. При очень высокой температуре Fe реагирует с водяным паром, вытесняя из молекул воды водород:
3 Fe + 4Н2O(г) = 4H2
Процесс ржавления по своему механизму является электрохимической коррозией. Продукт ржавления представлен в упрощенном виде. На самом деле образуется рыхлый слой смеси оксидов и гидроксидов переменного состава. В отличие от пленки Аl2О3, этот слой не предохраняет железо от дальнейшего разрушения.
2Fe + 3Cl2 = 2FeCl3
2Fe + 3F2 = 2FeF3
2Fe + 3Br2 = 2FeBr3
Fe + I2 = FeI2
Fe + S = FeS
Образуются соединения, в которых преобладает ионный тип связи.
Fe + Р = FexPy
Fe + C = FexCy
Fe + Si = FexSiy
Образуются вещества переменного состава, т к. бертоллиды (в соединениях преобладает ковалентный характер связи)
Fe0 + 2Н+ → Fe2+ + Н2↑
Поскольку Fe располагается в ряду активности левее водорода (Е°Fe/Fe2+ = -0,44В), оно способно вытеснять Н2 из обычных кислот.
Fe + 2HCl = FeCl2 + Н2↑
Fe + H2SO4 = FeSO4 + Н2↑
Fe0 — 3e— → Fe3+
Концентрированные HNO3 и H2SO4 «пассивируют» железо, поэтому при обычной температуре металл в них не растворяется. При сильном нагревании происходит медленное растворение (без выделения Н2).
В разб. HNO3 железо растворяется, переходит в раствор в виде катионов Fe3+ а анион кислоты восстанавливется до NO*:
Fe + 4HNO3 = Fe(NO3)3 + NO↑ + 2Н2O
Очень хорошо растворяется в смеси НСl и HNO3
В водных растворах щелочей Fe не растворяется. С расплавленными щелочами реагирует только при очень высоких температурах.
Fe + CuSO4 = FeSO4 + Cu
Fe0 + Cu2+ = Fe2+ + Cu0
Fe(порошок) + 5CO (г) = Fe0(CO)5пентакарбонил железа
Соединения Fe(III)
Красно-бурый порошок, н. р. в Н2O. В природе — «красный железняк».
1) разложение гидроксида железа (III)
2Fe(OH)3 = Fe2O3 + 3H2O
2) обжиг пирита
4FeS2 + 11O2 = 8SO2 + 2Fe2O3
3) разложение нитрата
4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2
Fe2O3 — основный оксид с признаками амфотерности.
I. Основные свойства проявляются в способности реагировать с кислотами:
Fe2О3 + 6Н+ = 2Fe3+ + ЗН2О
Fe2О3 + 6HCI = 2FeCI3 + 3H2O
Fe2О3 + 6HNO3 = 2Fe(NO3)3 + 3H2O
II. Слабокислотные свойства. В водных растворах щелочей Fe2O3 не растворяется, но при сплавлении с твердыми оксидами, щелочами и карбонатами происходит образование ферритов:
Fe2О3 + СаО = Ca(FeО2)2
Fe2О3 + 2NaOH = 2NaFeО2 + H2O
Fe2О3 + MgCO3 = Mg(FeO2)2 + CO2
III. Fe2О3 — исходное сырье для получения железа в металлургии:
Fe2О3 + ЗС = 2Fe + ЗСО или Fe2О3 + ЗСО = 2Fe + ЗСO2
Получают при действии щелочей на растворимые соли Fe3+:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
В момент получения Fe(OH)3 — красно-бурый слизистоаморфный осадок.
Гидроксид Fe(III) образуется также при окислении на влажном воздухе Fe и Fe(OH)2:
4Fe + 6Н2O + 3O2 = 4Fe(OH)3
4Fe(OH)2 + 2Н2O + O2 = 4Fe(OH)3
Гидроксид Fe(III) является конечным продуктом гидролиза солей Fe3+.
Fe(OH)3 — очень слабое основание (намного слабее, чем Fe(OH)2). Проявляет заметные кислотные свойства. Таким образом, Fe(OH)3 имеет амфотерный характер:
1) реакции с кислотами протекают легко:
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
2) свежий осадок Fe(OH)3 растворяется в горячих конц. растворах КОН или NaOH с образованием гидроксокомплексов:
Fe(OH)3 + 3КОН = K3[Fe(OH)6]
В щелочном растворе Fe(OH)3 может быть окислен до ферратов (солей не выделенной в свободном состоянии железной кислоты H2FeO4):
2Fe(OH)3 + 10КОН + 3Br2 = 2K2FeO4 + 6КВr + 8Н2O
Наиболее практически важными являются: Fe2(SO4)3, FeCl3, Fe(NO3)3, Fe(SCN)3, K3[Fe(CN)6).
Характерно образование двойных солей — железных квасцов: (NH4)Fe(SO4)2•12Н2O, KFe(SO4)2• 12Н2O
Соли Fe3+ часто имеют окраску как в твердом состоянии, так и в водном растворе. Это объясняется наличием гидратированных форм или продуктов гидролиза.
1. Fe + неметалл
2Fe + 3Cl2 = 2FeCl3
2.Fe + кислота
Fe + 4HNO3 разб = Fe(NO3)3 + NO + 2H2O
3. Fe2O3 + кислота
Fe2O3 + 3H2SO4 = Fe2(SО4)3 + 3H2O
4. Fe(OH)3 + кислота
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
5. Окисление Fe2+ до Fe3+
2FeCl2 + Cl2 = 2FeCl3
2Fe2O3 + H2O2 + H2SO4 = Fe2(SO4)3 + 2H2O
I. Все растворимые соли Fe3+ в водных растворах сильно гидролизованы:
Fe3+ + Н2O = FeOH2+ + Н+
FeOH2+ + Н2O = Fe(OH)2+ + Н+
Fe(OH)2+ Н2O = Fe(OH)3 + Н+
Водные растворы солей Fe3+ имеют сильнокислую реакцию. Соли Fe3+ с анионами слабых кислот подвергаются необратимому гидролизу.
II. В реакциях с сильными восстановителями соли Fe3+ проявляют окислительную активность:
2FeCl3 + 2KI = 2FeCl2 + I2 + 2KCl
Fe2(SO4)3 + H2S = 2FeSO4 + S + H2SO4
III. При действии щелочей и водных растворов аммиака на растворы солей Fe3+ образуется осадок:
Fe3+ + ЗОН— = Fe(OH)3
IV. При нагревании многие соли разлагаются:
2FeCl3 = 2FeCl2 + Cl2
Fe2(SO4)3 = Fe2O3 + 3SO3
4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2
V. Качественные реакции для обнаружения катионов Fe3+:
а) 4Fe3+ + 3[Fe(CN)6]4-желтая кровяная соль = Fe4[Fe(CN)6]3 берлинская лазурь (темно-синий осадок)
б) Fe3+ + 3SCN— = Fe(SCN)3 роданид Fe(III) (р-р кроваво-красного цвета)
examchemistry.com
Железо, свойства атома, химические и физические свойства
Железо, свойства атома, химические и физические свойства.
Fe 26 Железо
55,845(2) 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Железо — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Расположен в 8-й группе (по старой классификации — побочной подгруппе восьмой группы), четвертом периоде периодической системы.
Общие сведения
Свойства атома
Химические свойства
Физические свойства
Химические реакции
Таблица химических элементов Д.И. Менделеева
Общие сведения | |
| Название | Железо/ Ferrum |
| Символ | Fe |
| Номер в таблице | 26 |
| Тип | Металл |
| Открыт | Известен с глубокой древности |
| Внешний вид и пр. | Ковкий, вязкий металл серебристо-белого цвета |
| Содержание в земной коре | 6,3 % |
| Содержание в океане | 3,0×10-7 % |
Свойства атома | |
| Атомная масса (молярная масса) | 55,845(2) а. е. м. (г/моль) |
| Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d6 4s2 |
| Радиус атома | 126 пм |
Химические свойства | |
| Степени окисления | +6, +3, +2, 0 |
| Валентность | +2, +3, (+4), (+6) |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+3e) 64 (+2e) 74 пм |
| Электроотрицательность | 1,83 (шкала Полинга) |
| Энергия ионизации (первый электрон) | 759,1 кДж/моль (7,87 эВ) |
| Электродный потенциал | Fe←Fe3+ −0,04 В, Fe←Fe2+ −0,44 В |
Физические свойства | |
| Плотность (при нормальных условиях) | 7,874 г/см3 |
| Температура плавления | 1538 °C (1811 K) |
| Температура кипения | 2861 °C (3134 K) |
| Уд. теплота плавления | 13,8 кДж/моль |
| Уд. теплота испарения | ~340 кДж/моль |
| Молярная теплоёмкость | 25,14 Дж/(K·моль) |
| Молярный объём | 7,1 см³/моль |
| Теплопроводность (при 300 K) | 80,4 Вт/(м·К) |
| Электропроводность в твердой фазе | 10х106 См/м |
| Сверхпроводимость при температуре | |
| Твёрдость | 4 по шкале Мооса, 608 МПа по Виккерсу |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 2,866 Å |
| Температура Дебая | 460 К |
Химические реакции:
1. Реакция взаимодействия железа и углерода:
3Fe + C → Fe3C.
В результате реакции образуется карбид железа.
2. Реакция взаимодействия железа и кислорода:
3Fe + 2O2 → Fe3O4 (t = 150-500 °C),
2Fe + O2 → 2FeO,
4Fe + 3O2 → 2Fe2O3.
Первая реакция – это реакция сгорания железа на воздухе. Вторая реакция происходит при продувании воздуха через расплавленный чугун.В результате первой реакции образуется оксида железа (II, III), в результате второй – оксид железа (II), в результате третьей – оксид железа (III).
3. Реакция взаимодействия железа и красного фосфора:
Fe + 3P → Fe3P (t = 600-700 °C).
В результате реакции образуются фосфид железа. Так же образуются Fe2P, FeP, FeP2.
4. Реакция взаимодействия хлора и железа:
2Fe + 3Cl2 → 2FeCl3 (t = 250 °C).
В результате реакции образуется хлорида железа.
5. Реакция взаимодействия железа и серы:
Fe + S → FeS (t = 600-700 °C),
Fe + 2S → FeS2 (t = 689 °C).
В результате первой реакции образуется сульфид железа, в результате второй – дисульфид железа.
6. Реакция взаимодействия железа и фтора:
2Fe + 3F2 → 2FeF3 (t = 300 °C).
В результате реакции образуется фторида железа.
7. Реакция взаимодействия железа и брома:
2Fe + 3Br2 → 2FeBr3 (t°).
В результате реакции образуется бромид железа. В ходе реакции используется бром в виде насыщенного раствора. Реакция протекает при кипении.
8. Реакция взаимодействия железа и селена:
Fe + Se → FeSe (t = 600-950 °C).
В результате реакции образуется селенид железа.
9. Реакция взаимодействия железа и брома:
Fe + Br2 → FeBr2 (t = 600-700 °C).
В результате реакции образуется бромид железа.
10.Реакция взаимодействия железа и иода:
Fe + I2 → FeI2 (t = 500 °C),
3Fe + 4I2 → Fe3I8.
В результате первой реакции образуется иодид железа, в результате второй – иодида железа (II, III). Вторая реакция медленно протекает при растирании реакционной смеси.
11. Реакция взаимодействия железа и теллура:
Fe + Te → FeTe (t = 500 °C).
В результате реакции образуется теллурид железа. Реакция протекает при температуре 600-950°C.
12. Реакция взаимодействия кремния и железа:
2Si + Fe → FeSi2.
В результате реакции образуется силицид железа. Реакция протекает при сплавлении реакционной смеси.
13. Реакция взаимодействия железа, кремния и кислорода:
2Fe + Si + 2O2 → Fe2SiO4 (t = 1100-1300 °C),
2Fe + 2Si + 3O2 → 2FeSiO3 (t = 1100-1300 °C).
В результате первой реакции образуется ортосиликат железа, в результате второй – метасиликат железа.
14. Реакция взаимодействия железа, азота и лития:
Fe + N2 + 3Li → Li3FeN2 (t ≈ 600 °C).
В результате реакции образуется динитридоферрат лития.
15. Реакция взаимодействия железа и оксида углерода:
Fe + 5CO → [Fe(CO)5] (t = 150-200 °C).
В результате реакции образуется пентакарбонил железа. Порошок железа нагревается в струе CO при давлении 1·107-2·107 Па).
16. Реакция взаимодействия железа и оксида серы:
2Fe + 3SO2 → FeSO3 + FeS2O3
В результате реакции образуются сульфит железа и тиосульфат железа. В ходе реакции используется влажный оксид серы. Реакция медленно протекает при комнатной температуре.
17. Реакция взаимодействия железа и воды:
3Fe + 4H2O → Fe3O4 + 4H2 (t = 570 °C).
В результате реакции образуются оксид железа (II,III) и водород. Реакция протекает при температуре не более 570°C. Данная реакция является исторически первым способом получения водорода.
18. Реакция взаимодействия железа, воды и кислорода:
2Fe + 2H2O + O2 → 2Fe(OH)2.
В результате реакции образуется гидроксид железа. Реакция протекает медленно. Коррозия железа.
19. Реакция взаимодействия железа, воды, кислорода и оксида углерода:
2Fe + 2H2O + O2 + 4CO2 → 2Fe(HCO3)2.
В результате реакции образуется гидрокарбонат железа. Реакция протекает медленно.
20. Реакция взаимодействия оксида железа (III) и железа:
Fe2O3 + Fe → 3FeO (t ≈ 900 °C).
В результате реакции образуется оксида железа (II).
21. Реакция взаимодействия оксида железа (II, III) и железа:
Fe3O4 + Fe → 5FeO (t = 900-1000 °C).
В результате реакции образуется оксид железа (II).
22. Реакция взаимодействия оксида циркония(IV), углерода и железа:
ZrO2 + 2C + Fe → (Zr,Fe) + 2CO (t = 1400-1600 °C).
В результате реакции образуются ферроцирконий и оксид углерода.
23. Реакция взаимодействия железа, метагидроксида никеля и воды:
Fe + 2NiO(OH) + 2H2O ⇄ Fe(OH)2 + 2Ni(OH)2.
В результате реакции образуются гидроксид железа и гидроксид никеля – никель-железный гальванический элемент.
24. Реакция взаимодействия железа и азотной кислоты:
Fe + 6HNO3 → Fe(NO3)3 + 3NO2 + 3H2O,
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O,
4Fe + 10HNO3 → 4Fe(NO3)2 + NH4NO3 + 3H2O,
5Fe + 12HNO3 → 5Fe(NO3)2 + N2 + 6H2O (t = 0-10 °C).
В результате первой реакции образуются нитрат железа, оксид азота (IV) и вода, в результате второй – нитрат железа, оксид азота (II) и вода, в результате третьей – нитрат железа (II), нитрат аммония и вода, в результате четвертой – нитрат железа, азот и вода. В ходе первой реакции используется концентрированная азотная кислота, в ходе второй – 50%-й раствор азотной кислоты, в ходе третьей – разбавленный раствор азотной кислоты (6,5%), в ходе четвертой – очень разбавленный раствор азотной кислоты. В ходе четвертой реакции образуется также примесь – N2O, NH4NO3.
25. Реакция взаимодействия железа, азотной кислоты и кислорода:
4Fe + 12HNO3 + 3O2 → 4Fe(NO3)3 + 6H2O.
В результате реакции образуются нитрат железа и вода. Это промышленный метод получения нитрата железа.
26. Реакция взаимодействия железа и азотной кислоты:
В результате реакции образуются. В ходе реакции используется. Реакция взаимодействия железа и ортофосфорной кислоты:
4Fe + 3H3PO4 → FeHPO4 + Fe2(PO4)2 + 4H2.
В результате реакции образуются гидроортофосфат железа, ортофосфат железа и водород. В ходе реакции используется разбавленный раствор ортофосфорной кислоты.
27. Реакция взаимодействия железа и фтороводорода:
Fe + 2HF → FeF2 + H2.
В результате реакции образуются фторид железа и водород. В ходе реакции используется разбавленный раствор фтороводорода.
28. Реакция взаимодействия железа и бромоводорода:
Fe + 2HBr м FeBr2 + H2 (t = 800-900 °C).
В результате реакции образуются бромид железа и водород.
29. Реакция взаимодействия железа, гидроксида натрия и воды:
Fe + 2NaOH + 2H2O → Na2[Fe(OH)4] + H2 (t°).
В результате реакции образуются тетрагидроксоферрат натрия и водород. Реакция протекает при кипении раствора в атмосфере азота.
30. Реакция взаимодействия железа, гидроксида калия и нитрата калия:
Fe + 2KOH + 3KNO3 → K2FeO4 + 3KNO2 + H2O (t = 400-420 °C).
В результате реакции образуются феррат калия, нитрит калия и вода.
31. Реакция электролиза концентрированного водного раствора гидроксида калия и железа:
Fe + 2KOH + 2H2O → 3H2 + K2FeO4.
В результате реакции образуются феррат калия и водород.
32. Реакция взаимодействия железа, пероксида калия и воды:
Fe + 3K2O2 + 2H2O → K2FeO4 + 4KOH.
В результате реакции образуются феррат железа и гидроксид калия. Реакция медленно протекает в концентрированном растворе гидроксида калия.
33. Реакция взаимодействия железа и аммиака:
4Fe + 2NH3 → 2Fe2N + 3H2 (t = 350-550 °C).
В результате реакции образуются нитрид железа и водород. Так же образуются FeN, Fe4N.
34. Реакция взаимодействия хлорида меди и железа:
CuCl2 + Fe → FeCl2 + Cu
В результате реакции образуются хлорид железа и медь.
35. Реакция взаимодействия железа, гидроксида натрия, кислорода и воды:
4Fe + 20NaOH + 3O2 + 6H2O → 4Na5[Fe(OH)8] (t = 20-25 °C).
В результате реакции образуются октагидроксоферрат и натрий. В ходе реакции используется 50%-й раствор гидроксида натрия.
36. Реакция взаимодействия железа, гидроксида натрия, брома и воды:
2Fe + 14NaOH + 3Br2 + 2H2O → 2Na4[Fe(H2O)(OH)7] + 6NaBr (t = 50-60 °C).
В результате реакции образуются гептагидроксоакваферрат натрия и бромид натрия. В ходе реакции используется 50%-й раствор гидроксида натрия.
37. Реакция взаимодействия сульфида свинца и железа:
PbS + Fe → Pb + FeS (t = 1000 °C).
В результате реакции образуются свинец и сульфид железа.
38. Реакция взаимодействия железа и бензола:
18Fe + C6H6 → 6Fe3C + 3H2 (t = 700 °C).
В результате реакции образуются карбид железа и водород. Реакция протекает в вакууме.
39. Реакция взаимодействия железа, карбоната калия и серы:
6Fe + 4K2CO3 + 13S → 6K[FeS2] + K2SO4 + 4CO2 (t = 900-1000 °C).
В результате реакции образуются дисульфидоферрат калий, сульфат калия и оксид углерода.
40. Реакция взаимодействия железа, хлорида нитроила и воды:
2Fe + 6NO2Cl + 6H2O → 2FeCl3 + 6HNO3 + 3H2.
В результате реакции образуются хлорид железа, азотная кислота и водород.
41. Реакция взаимодействия железа, иодата натрия и пероксида водорода:
2Fe + NaIO3 + H2O2 → NaI + 2FeO(OH) (t°).
В результате реакции образуются иодид натрия и метагидроксид железа. Реакция протекает при кипении на воздухе.
42. Реакция взаимодействия сульфида сурьмы и железа:
Sb2S3 + 3Fe → 2Sb + 3FeS (t = 600-1300 °C).
В результате реакции образуются сурьма и сульфид железа. Сплавление реакционной смеси.
43. Реакция взаимодействия сульфида висмута и железа:
Bi2S3 + 3Fe → 2Bi + 3FeS (t = 1000 °C).
В результате реакции образуются висмут и сульфид железа.
44. Реакция взаимодействия хлорида сурьмы и железа:
2SbCl3 + 3Fe → 2Sb + 3FeCl3
В результате реакции образуются сурьма и хлорид железа. Реакция протекает в концентрированном растворе хлороводорода.
45. Реакция взаимодействия хлорида ванадия и железа:
3VCl4 + 4Fe → 3V + 4FeCl3 (t = 900 °C).
В результате реакции образуются ванадий и хлорид железа.
46. Реакция взаимодействия нитрата меди и железа:
Cu(NO3)2 + Fe → Fe(NO3)2 + Cu.
В результате реакции образуются нитрат железа и меди.
47. Реакция взаимодействия нитрата серебра и железа:
2AgNO3 + Fe → Fe(NO3)2 + 2Ag.
В результате реакции образуются нитрат железа и серебро.
48. Реакция взаимодействия железа и сульфата меди:
Fe + CuSO4 → FeSO4 + Cu.
В результате реакции образуются сульфат железа и медь.
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 47. Серебро
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
железо атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле железа
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 72
comments powered by HyperCommentsxn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai
| Таблица =>> v
| История открытия:Железо известно с древнейших времён. Самые древние изделия из железа, найденные при археологических раскопках, датируются 4-м тысячелетием до н. э. и относятся к древнешумерской и древнеегипетской цивилизациям. Латинское ferrum, скорее всего, заимствовано из какого-то восточного языка, скорее всего из финикийского. Нахождение в природе и получение:Железо — один из самых распространённых элементов на Земле и вообще в Солнечной системе. Металлическое железо в образует ядро Земли, где его содержание, по оценкам, около 90%. Содержание железа в земной коре составляет 5 %, тем не менее и здесь из металлов железо уступает по распространённости только алюминию. Из минералов наибольшее практическое значение имеют красный железняк (гематит, Fe2O3), магнитный железняк (магнетит, Fe3O4), бурый железняк или лимонит (FeOOH и FeOOH·nH2O). Пирит FeS2 (серный или железный колчедан) используется в производстве серной кислоты. Физические свойства:Железо — типичный металл, в свободном состоянии — серебристо-белого цвета с сероватым оттенком. Чистый металл пластичен, ковок, различные примеси (в частности — углерод) повышают его твёрдость и хрупкость. Обладает ярко выраженными магнитными свойствами. Tпл=1812K, Tкип=3134K. Химические свойства: Железо относится к металлам средней активности, в ряду напряжений стоит до водорода и растворяется во многих кислотах, но концентрированной серной и азотной кислотами пассивируется и на холоду с ними не реагирует. Раскаленное железо реагирует с водяным паром: 3Fe + 4H2O = Fe3O4 + 4H2↑ (раньше так получали водород для наполнения аэростатов). Важнейшие соединения:Степень окисления +2 — основный оксид FeO (чёрный), гидроксид Fe(OH)2 (зеленый). Соли железа(II) (бледно-зеленого цвета), образуют кристаллогидраты (напр. железный купорос, FeSO4*7H2O), легко окисляются кислородом до соединений железа(III). Степень окисления +3 — наиболее устойчивая степень окисления железа, ей соответствуют: оксид Fe2O3 и гидроксид Fe(OH)3 (оба — коричневого цвета), соли железа(III) — (образуют кристаллогидраты, в растворах сильно гидролизованы). Т.к. оксид железа(III) проявляет слабые основные свойства, он частично растворим в конц. щелочах, а при сплавлении со щелочами образует соотв. соли — ферриты: Fe2O3 + 2NaOH = 2NaFeO2 + H2O↑ Для железа в степени окисления +2 и +3 характерно образование многочисленных комплексных соединений, например таких как гексацианоферрат(II) калия K4[Fe(CN)6] («желтая кровяная соль») и гексацианоферрат(III) калия K3[Fe(CN)6] («красная кровяная соль»). При взаимодействии ионов Fe3+ и [Fe(CN)6]4- выпадает ярко-синий осадок гексацианоферрата(II) калия-железа(III) (берлинская лазурь): FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6]↓ + 3KCl. Это качественная реакция для обнаружения ионов Fe3+. Аналогичная реакция используется для открытия ионов железа(II): FeCl2 + K3[Fe(CN)6] = KFe[Fe(CN)6]↓ + 2KCl; («турнбулева синь»). Степень окисления +6 — Ферраты — соли не существующей в свободном виде железной кислоты H2FeO4. Это соединения фиолетового цвета, по окислительным свойствам напоминающие перманганаты, а по растворимости — сульфаты. Ферраты — сильные окислители. Получают ферраты при действии газообразного хлора или озона на взвесь Fe(OH)3 в щелочи: 2Fe(OH)3 + 3Cl2 + 10KOH = 2K2FeO4 + 6KCl + 8H2O Применение — Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов. Биологическая роль и физиологическое действиеЖелезо входит в состав гемоглобина крови, обеспечивая, за счет своих окислительно-восстановительных свойств, ее важнейшую функцию, транспорт кислорода в ткани организма. В крови взрослого человека содержится около 4 г железа, его недостаток приводит к заболеванию железодефицитной анемией. Восполнить недостаток железа можно за счет пищевых продуктов, содержащих железо в хорошо усвояемой форме (печень, мясо, бобовые) или медикаментов. Избыточное накопление железа в организме оказывает токсическое действие. ПДК железа в воде 0,3 мг/л. Аксенова Ирина, Пуртова Ксения, ТюмГУ, 502(1) группа, 2013 г. Источники: Железо// Википедия. URL: http://ru.wikipedia.org/wiki/Железо (дата обращения: 6.01.2014). |
www.kontren.narod.ru
Железо
Автор: редакционная статья
Категории: теория металлургических процессов
Определение. История. Геохимия. Свойства железа. Месторождения. Физические и химические свойства. Соединения. Применение железа.
Железо
Железо — элемент восьмой группы (по старой классификации — побочной подгруппы восьмой группы) четвёртого периода периодической системы химических элементовД. И. Менделеева с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия).
Простое вещество железо (CAS-номер: 7439-89-6) — ковкий металл серебристо-белого цветас высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
Собственно, железом обычно называют его сплавы с малым содержанием примесей (до 0,8 %), которые сохраняют мягкость и пластичность чистого металла. Но на практике чаще применяются сплавы железа с углеродом: сталь (до 2,14 вес. % углерода) и чугун (более 2,14 вес. % углерода), а также нержавеющая(легированная) сталь с добавками легирующих металлов (хром, марганец, никель и др.). Совокупность специфических свойств железа и его сплавов делают его «металлом № 1» по важности для человека.
В природе железо редко встречается в чистом виде, чаще всего оно встречается в составе железо-никелевых метеоритов. Распространённость железа в земной коре — 4,65 % (4-е место после O, Si, Al). Считается также, что железо составляет большую часть земного ядра.
www.metaljournal.com.ua
