Титан, Вступление | |
| Символ | Ti |
| Латинское название | Titanium |
| Тип вещества | простой химический элемент |
| Год открытия | 1791 |
Основные параметры титана по таблице Менделеева | |
| Атомный номер Z | 22 |
| Атомная масса | 47.867 |
| Группа | 4 |
| Период | 4 |
| Принадлежность к группе | переходные металлы |
Механические свойства титана | |
| Плотность твердых веществ | 4.500 · 103 (Килограмм / Метр3) |
| Скорость звука | 4140 (Метр / Секунда) |
Термодинамические свойства титана | |
| Агрегатное состояние при нормальных условиях | твердое тело |
| Точка плавления по Кельвину | 1941.15 (Кельвин) |
| Точка плавления по Цельсию | 1668 (°C) |
| Точка кипения по Кельвину | 3560.15 (Кельвин) |
| Точка кипения по Цельсию | 3287 (°C) |
Электрические свойства титана | |
| Тип электрической проводимости | проводник |
Магнитные свойства титана | |
| Тип магнитной проницаемости | парамагнетик |
Свойства атома титана | |
| Конфигурация электронного облака | 1s2 | 2s22p6 | 3s23p63d24s2 |
| Радиус атома | 176 · 10 − 12 (Метр) |
| Массовое число A | 48 |
Химические свойства титана | |
| Валентность | 4 |
Распространенность титана | |
| Вселенная состоит из титана на | 0.0003% |
| Солнце состоит из титана на | 0.0004% |
| Мировой океан состоит из титана на | 1×10-7% |
Вселенная | |
| Вселенная состоит из титана на | 0.0003% |
Титановая кислота — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 23 февраля 2018; проверки требуют 5 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 23 февраля 2018; проверки требуют 5 правок.Тита́новая кислота́ (ортотитановая кислота, α-титановая кислота) — неорганическое соединение, гидратированный оксид металла титана с формулой TiO2•2H2O или H4TiO4, белое аморфное вещество, не растворимое в воде.
- TiOSO4+2NaOH+h3O → h5TiO4↓+Na2SO4{\displaystyle {\mathsf {TiOSO_{4}+2NaOH+H_{2}O\ {\xrightarrow {}}\ H_{4}TiO_{4}\downarrow +Na_{2}SO_{4}}}}
- TiCl4+4NaOH → h5TiO4↓+4NaCl{\displaystyle {\mathsf {TiCl_{4}+4NaOH\ {\xrightarrow {}}\ H_{4}TiO_{4}\downarrow +4NaCl}}}
Титановая кислота образует белое аморфное вещество.
- h5TiO4 → h3TiO3+h3O{\displaystyle {\mathsf {H_{4}TiO_{4}\ {\xrightarrow {}}\ H_{2}TiO_{3}+H_{2}O}}}
Данный процесс происходит за счёт превращения гидроксильных мостиков в оксоловые в α-титановой кислоте. Такое превращение называется оксоляцией. Его скорость увеличивается при повышении температуры, увеличении значения pH. В присутствии нитрат-ионов «старение» α-титановой кислоты протекает практически мгновенно.
- Растворяется в концентрированной серной кислоте:
- h5TiO4+h3SO4 → TiOSO4+3h3O{\displaystyle {\mathsf {H_{4}TiO_{4}+H_{2}SO_{4}\ {\xrightarrow {}}\ TiOSO_{4}+3H_{2}O}}}
Титан, свойства атома, химические и физические свойства
Титан, свойства атома, химические и физические свойства.
Ti 22 Титан
47,867(1) 1s2 2s2 2p6 3s2 3p6 3d2 4s2
Титан — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 22. Расположен в 4-й группе (по старой классификации — побочной подгруппе четвертой группы), четвертом периоде периодической системы.
Атом и молекула титана. Формула титана. Строение титана
Изотопы и модификации титана
Свойства титана (таблица): температура, плотность, давление и пр.
Физические свойства титана
Химические свойства титана. Взаимодействие титана. Реакции с титаном
Получение титана
Применение титана
Таблица химических элементов Д.И. Менделеева
Атом и молекула титана. Формула титана. Строение титана:
Титан (лат. Titanium, назван в честь титанов) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением Ti и атомным номером 22. Расположен в 4-й группе (по старой классификации – побочной подгруппе четвертой группы), четвертом периоде периодической системы.
Титан
Как простое вещество титан при нормальных условиях представляет собой лёгкий прочный металл серебристо-белого цвета.
Молекула титана одноатомна.
Химическая формула титана Ti.
Электронная конфигурация атома титана 1s2 2s2 2p6 3s2 3p6 3d2 4s2. Потенциал ионизации атома титана равен 6,8281 эВ (657,8 кДж/моль).
Строение атома титана. Атом титана состоит из положительно заряженного ядра (+22), вокруг которого по четырем оболочкам движутся 22 электрона. При этом 20 электронов находятся на внутреннем уровне, а 2 электрона – на внешнем. Поскольку титан расположен в четвертом периоде, оболочек всего четыре. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внутренняя оболочка представлена s-, р- и d-орбиталями. Четвертая – внешняя оболочка представлена s-орбиталью. На внутреннем энергетическом уровне атома титана на 3d-орбитали находятся два неспаренных электрона. На внешнем энергетическом уровне атома титана – на s-орбитали находится два спаренных электрона. В свою очередь ядро атома титана состоит из 22 протонов и 26 нейтронов.
Радиус атома титана составляет 147 пм.
Титан обладает высокой коррозионной стойкостью.
Изотопы и модификации титана:
Свойства титана (таблица): температура, плотность, давление и пр.:
| Общие сведения | |
| Название | Титан/ Titanium |
| Символ | Ti |
| Номер в таблице | 22 |
| Тип | Металл |
| Открыт | У. Грегор, Англия, 1791 г., М. Г. Клапрот, Германия, 1795 г. |
| Внешний вид и пр. | Лёгкий прочный металл серебристо-белого цвета |
| Содержание в земной коре | 0,66 % |
| Содержание в океане | 1,0×10-7 % |
| Свойства атома | |
| Атомная масса (молярная масса) | 47,867(1) а. е. м. (г/моль) |
| Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d2 4s2 |
| Радиус атома | 147 пм |
| Химические свойства | |
| Степени окисления | +2, +3, +4 |
| Валентность | +2, +3, +4 |
| Ковалентный радиус | 132 пм |
| Радиус иона | (+4e)68 (+2e)94 пм |
| Электроотрицательность | 1,54 (шкала Полинга) |
| Энергия ионизации (первый электрон) | 657,8 кДж/моль (6,8281 эВ) |
| Электродный потенциал | -1,64 В |
| Физические свойства | |
| Плотность (при нормальных условиях) | 4,54 г/см3 |
| Температура плавления | 1668° C (1941 K) |
| Температура кипения | 3287 °C (3560 K) |
| Уд. теплота плавления | 18,8 кДж/моль |
| Уд. теплота испарения | 422,6 кДж/моль |
| Молярная теплоёмкость | 25,51 Дж/(K·моль) |
| 10,6 см³/моль | |
| Теплопроводность (при 300 K) | 21,9 Вт/(м·К) |
| Электропроводность в твердой фазе | 2,5х106 См/м |
| Сверхпроводимость при температуре | |
| Твёрдость | 6 по шкале Мооса, 970 МПа по Виккерсу |
| Структура решётки | гексагональная плотноупакованная (α-Ti) |
| Параметры решётки | a = 2,951 Å, с = 4,697 Å (α-Ti) |
| Отношение c/a | 1,587 |
| Температура Дебая | 380 К |
Физические свойства алюминия:
Химические свойства титана. Взаимодействие титана. Реакции с титаном:
Получение титана:
Применение титана:
Таблица химических элементов Д.И. Менделеева
- 1. Водород
- 2. Гелий
- 3. Литий
- 4. Бериллий
- 5. Бор
- 6. Углерод
- 7. Азот
- 8. Кислород
- 9. Фтор
- 10. Неон
- 11. Натрий
- 12. Магний
- 13. Алюминий
- 14. Кремний
- 15. Фосфор
- 16. Сера
- 17. Хлор
- 18. Аргон
- 19. Калий
- 20. Кальций
- 21. Скандий
- 22. Титан
- 23. Ванадий
- 24. Хром
- 25. Марганец
- 26. Железо
- 27. Кобальт
- 28. Никель
- 29. Медь
- 30. Цинк
- 31. Галлий
- 32. Германий
- 33. Мышьяк
- 34. Селен
- 35. Бром
- 36. Криптон
- 37. Рубидий
- 38. Стронций
- 39. Иттрий
- 40. Цирконий
- 41. Ниобий
- 42. Молибден
- 43. Технеций
- 44. Рутений
- 45. Родий
- 46. Палладий
- 48. Кадмий
- 49. Индий
- 50. Олово
- 51. Сурьма
- 52. Теллур
- 53. Йод
- 54. Ксенон
- 55. Цезий
- 56. Барий
- 57. Лантан
- 58. Церий
- 59. Празеодим
- 60. Неодим
- 61. Прометий
- 62. Самарий
- 63. Европий
- 64. Гадолиний
- 65. Тербий
- 66. Диспрозий
- 67. Гольмий
- 68. Эрбий
- 69. Тулий
- 70. Иттербий
- 71. Лютеций
- 72. Гафний
- 73. Тантал
- 74. Вольфрам
- 75. Рений
- 76. Осмий
- 77. Иридий
- 78. Платина
- 79. Золото
- 80. Ртуть
- 81. Таллий
- 82. Свинец
- 83. Висмут
- 84. Полоний
- 85. Астат
- 86. Радон
- 87. Франций
- 88. Радий
- 89. Актиний
- 90. Торий
- 91. Протактиний
- 92. Уран
- 93. Нептуний
- 94. Плутоний
- 95. Америций
- 96. Кюрий
- 97. Берклий
- 98. Калифорний
- 99. Эйнштейний
- 100. Фермий
- 101. Менделеевий
- 102. Нобелий
- 103. Лоуренсий
- 104. Резерфордий
- 105. Дубний
- 106. Сиборгий
- 107. Борий
- 108. Хассий
- 109. Мейтнерий
- 110. Дармштадтий
- 111. Рентгений
- 112. Коперниций
- 113. Нихоний
- 114. Флеровий
- 115. Московий
- 116. Ливерморий
- 117. Теннессин
- 118. Оганесон
Таблица химических элементов Д.И. Менделеева
Примечание: © Фото https://www.pexels.com, https://pixabay.com




карта сайта
титан атомная масса степень окисления валентность плотность температура кипения плавления физические химические свойства структура теплопроводность электропроводность кристаллическая решетка
атом нарисовать строение число протонов в ядре строение электронных оболочек электронная формула конфигурация схема строения электронной оболочки заряд ядра состав масса орбита уровни модель радиус энергия электрона переход скорость спектр длина волны молекулярная масса объем атома
электронные формулы сколько атомов в молекуле титана
сколько электронов в атоме свойства металлические неметаллические термодинамические
Коэффициент востребованности 191
Титан (химический элемент) — Мегаэнциклопедия Кирилла и Мефодия — статья
Тита́н (лат. Titanium, по имени исполинов греческой мифологии — титанов), Ti (читается «титан»), химический элемент с атомным номером 22, атомная масса 47, 88. Расположен в группе IVB, в 4 периоде периодической системы элементов. Природный титан состоит из пяти стабильных изотопов с массовыми числами 46 (7, 95%), 47 (7, 75%), 48 (73, 45%), 49 (5, 51%) и 50 (5, 34%). Конфигурация внешнего и предвнешнего электронных слоев 3s2p6d24s2. Степени окисления +4, +3, +2 (валентность IV, III, II). Радиус атома 0, 149 нм, радиус иона Ti4+ 0, 065 нм (координационное число 6) и 0, 088 нм (8) и 0, 098 нм (8), радиус иона Ti3+ 0, 081 нм (6) и радиус иона Ti2+0, 100 нм (6). Энергии последовательной ионизации 6, 820, 13, 58, 27, 48, 43, 25 и 99, 3 эВ. Электроотрицательность по Полингу 1, 5. Сродство к электрону 0, 39 эВ. Открытие TiO 2 сделали одновременно и независимо друг от друга англичанин У. Грегор (1789), который обнаружил TiO2в минерале ильмените, и берлинский химик Клапрот (1795-1797) — в минерале рутил. Название для элемента предложил Клапрот. Первый образец металлического титана получил в 1825 Й. Я. Берцелиус. Из-за высокой химической активности титана и сложности его очистки чистый образец Ti получили голландцы А. ван Аркель и И. де Бур в 1925 термическим разложением паров иодида титана TiI4.Содержание в земной коре 0, 57% по массе. В свободном виде не встречается. Известно более 100 минералов. Важнейшие из них: рутил TiO2, ильменит FeTiO3, титаномагнетит FeTiO3 + Fe3O4, перовскит CaTiO3и титанит (сфен) CaTiOSiO4. Различают коренные руды титана — ильментит-титано-магнетитовые и россыпные — рутил-ильменит-циркониевые.Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4:
TiO2+ 2C + 2Cl2 =TiCl4 + 2CO
Образующиеся пары TiCl4при 850°C восстанавливают Mg:TiCl4+ 2Mg = 2MgCl2+ Ti
Полученную титановую «губку» переплавляют и очищают. Ильменитовые концентраты восстанавливают в электродуговых печах с последующим хлорированием возникающих титановых шлаков. Рaфинируют титан иодидным способом или электролизом, выделяя Ti из TiCl4. Для получения титановых слитков применяют дуговую, электроннолучевую или плазменную переработку.
Титан — серебристо-белый металл. Существует в двух модификациях. Ниже 883°C устойчива гексагональная α-модификация, a = 0, 2951 нм, c = 0, 4697 нм. Плотность 4, 505 кг/дм3. Выше 883°C устойчива β-модификация с кубической объемно-центрированной решеткой, а = 0, 3269 нм. Плотность (при 900°C) 4, 32кг/дм3. Температура плавления 1671°C, кипения 3260°C. Тi пластичен, сваривается в инертной атмосфере.
При обычной температуре покрывается защитной пленкой оксида TiO2, благодаря этому коррозионностоек. Стандартный электродный потенциал пары Tio/Ti3+ -1, 63 B, Ti3+/Ti4+ — 0, 20 В. Ti устойчив к разбавленным растворам многих кислот и щелочей. Легко реагирует с плавиковой кислотой, HF, образуя комплексный анион [TiCl6]2-.При нагревании на воздухе до 1200°C Ti загорается с образованием оксидных фаз переменного состава TiOx. Из растворов солей титана осаждается гидроксид TiO(OH)2·xH2O, осторожным прокаливанием которого получают оксид TiO2. Гидроксид TiO(OH)2·xH2O и диоксид TiO2амфотерны. TiO2 взаимодействует с серной кислотой при длительном кипячении. При сплавлении с содой Na2CO3 или поташом K2CO3 оксид TiO2 образует титанат:TiO2+K2CO3=K2TiO3+CO2При нагревании Ti взаимодействует с галогенами. Тетрахлорид титана TiCl4 при обычных условиях — желтоватая сильно дымящая на воздухе жидкость, что объясняется сильным гидролизом TiCl4 содержащимися в воздухе парами воды и образованием мельчайших капелек HCl и взвеси гидроксида титана. Восстановлением TiCl4водородом, Al, Si (другими сильными восстановителями) получен трихлорид и дихлорид титана (TiCl3, TiCl2) — твердые вещества с сильно-восстановительными свойствами. Ti взаимодействует с бромом и иодом.С N2 выше 400°C титан образует нитрид TiNx(x=0, 58-1, 00). При взаимодействии титана с C образуется карбид титана TiCx (x=0, 49-1, 00). При нагревании Ti поглощает H2 с образованием соединения переменного состава TiHх (х=1, 0). При нагревании эти гидриды разлагаются с выделением H2. Тi образует сплавы со многими металлами.Большая часть производимого Ti используется для изготовления сплавов с алюминием, ванадием, молибденом, марганцем, хромом и другими металлами, коррозионно-стойких покрытий. Диоксид TiO2 применяется при изготовлении титановых белил. Гидрид и дисульфид TiS2, титана находят применение при создании источников тока.
- Горощенко Я. Г. Химия титана. 1970-1972.
- Лучинский Г. П. Химия титана. 1971.
- Титан: Свойства, сырьевая база, физико-химические основы и способы получения. М., 1983.
- Юшков В. В. Химия и экология 3d-элементов. — Екатеринбург: УрО РАН, 2004.
- Титан в химической промышленности. — М.: НИИТЭхим, 1981.
- Химия поверхности раздела титан-газ: эксперимент и теория. — Екатеринбург: Ин-т химии твердого тела УрО РАН, 1999.
- Блинов В. А. Титан: Справочник. — М.: Геоинформмарк, 1998.
Характеристика титана
Характеристика титанаТитан (Ti) располагается в 4 периоде, в IV группе, побочной подгруппе, имеет порядковый номер 22.
Массовое число: A = 48
Число протонов: P = 22
Число электронов: ē = 22
Число нейтронов: N = A — Z = 48 — 22 = 26
 | 22Ti 1s2 2s2 2p6 3s2 3p6 3d2 4s2 |
Валентные электроны
| 22Ti | ↑ | ↑ | ↑↓ | |||||||||
| 3d | 4s | 4p | ||||||||||
| 22Ti* | ↑ | ↑ | ↑ | ↑ | ||||||||
| 3d | 4s | 4p | ||||||||||
Титан – d-элемент, металл.
Степени окисления
минимальная: 0
максимальная: +4
Высший оксид: TiO2 – оксид титана (IV).
Проявляет амфотерные свойства:
TiO2 + 2NaOH t ⟶ Na2TiO3 + H2O
TiO2 + 2H2SO4 ⟶ Ti(SO4)2 + 2H2O
Высший гидроксид: H2TiO3 – метатитановая кислота.
Проявляет амфотерные свойства:
H2TiO3 + 2NaOH ⟶ Na2SiO3 + 2H2O
H2TiO3 + H2SO4 t ⟶ TiOSO4 + 2H2O
Нитрид титана — Википедия
Нитри́д тита́на — бинарное химическое соединение титана с азотом.
Представляет собой фазу внедрения с широкой областью гомогенности, которая составляет от 14,8 до 22,6 % азота (по массе), что можно обозначить брутто-формулами от Ti10N6 до TiN соответственно[1].
Нитрид титана представляет собой порошок жёлто-коричневого цвета, а в компактном состоянии приобретает золотистую окраску.
Имеет кубическую гранецентрированную решётку типа NaCl, пространственная группа Fm3m, с периодом а = 0,4235 нм.
Нитрид титана можно получить одним из следующих способов[1][3].
- Непосредственным насыщением титана азотом:
- Процесс азотирования проводят обычно при температуре выше 1100 °C в среде азота или диссоциированного аммиака. Для этой цели используют титан в виде порошка или стружки. Чистый порошок титана может быть заменён гидридом титана;
- В основе этого способа лежит реакция:
- 2TiCl4+2Nh4⟶2TiN+6HCl+Cl2{\displaystyle {\ce {2TiCl4 + 2Nh4 -> 2TiN + 6HCl + Cl2}}}
- которую проводят при температуре выше 1000 °C. Также образующийся нитрид титана можно осадить на вольфрамовую нить нагретую до температуры 1400—2000 °C;
- Разложением аминохлоридов титана:
- TiCl4⋅4Nh4⟶TiN+HCl+Nh4{\displaystyle {\ce {TiCl4.4Nh4 -> TiN + HCl + Nh4}}}
- Аминохлорид титана разлагается с образованием промежуточного продукта TiNCl, нагрев которого до температуры 1000 °C приводит к образованию свободного от хлора нитрида титана;
- В основе процесса лежит реакция:
- 2TiO2+4C+N2⟶2TiN+4CO{\displaystyle {\ce {2TiO2 + 4C + N2 -> 2TiN + 4CO}}}
- С увеличение температуры процесса восстановления с 1000 °C до 1700 °C выход нитрида титана увеличивается, но при этом в продуктах реакции наблюдается появление карбида титана. Этот способ весьма пригоден для получения технически чистого нитрида титана в больших количествах, используемого для изготовления огнеупоров;
- Как исходный продукт для получения нитрида титана может быть использован TiCl4 или порошок титана, который подают в струю плазмы генерируемую СВЧ-плазмотроном. Плазмообразующим газом является азот. Порошки полученные этим способом могут иметь размеры от 10 нм до 100 нм[4];
- Суть способа заключается в химической реакции титана с азотом, которая происходит с выделением тепла. Процесс ведут в герметическом реакторе, в котором процесс самопроизвольного горения инициируют нагревом контейнера заполненного азотом и порошком титана[5].
Нитрид титана устойчив к окислению на воздухе до 700—800 °C, при этих же температурах сгорает в токе кислорода:
- 2TiN+2O2⟶2TiO2+N2⋅{\displaystyle {\ce {2TiN + 2O2 -> 2TiO2 + N2.}}}
При нагреве до 1200 °C в среде водорода или в смеси азота и водорода нитрид титана инертен.
Нитрид титана стехиометрического состава проявляет стойкость к CO, но медленно реагирует с CO2 по реакции:
- 2TiN+4CO2⟶2TiO2+4CO+N2⋅{\displaystyle {\ce {2TiN + 4CO2 -> 2TiO2 + 4CO + N2.}}}
Реагирует на холоде с фтором:
- 2TiN+4F2⟶2TiF4+N2⋅{\displaystyle {\ce {2TiN + 4F2 -> 2TiF4 + N2.}}}
Хлор не взаимодействует с нитридом титана до 270 °C, но реагирует с ним при температурах свыше 300—400 °C:
- 2TiN+4Cl2⟶2TiCl4+N2⋅{\displaystyle {\ce {2TiN + 4Cl2 -> 2TiCl4 + N2.}}}
При температуре 1300 °C хлороводород взаимодействует с TiN с образованием газообразных хлоридов титана и азота с водородом.
Взаимодействует с дицианом образуя карбонитрид титана[3]:
- 10TiN+(CN)2⟶2Ti5N4C+2N2⋅{\displaystyle {\ce {10TiN + (CN)2 -> 2Ti5N4C + 2N2.}}}
При комнатной температуре, по отношению к серной, соляной, фосфорной, хлорной кислотам, а также к смесям хлорной и соляной, щавелевой и серной кислот, нитрид титана является стойким соединением. Кипящие кислоты (соляная, серная и хлорная) слабо взаимодействуют с TiN. На холоде малоустойчив против растворов гидроксида натрия. Взаимодействует с азотной кислотой, а в присутствии сильных окислителей растворяется плавиковой кислотой.
Нитрид титана является стойким к действию расплавов олова, висмута, свинца, кадмия и цинка. При высокой температуре разрушается оксидами железа (Fe2O3), марганца (MnO), кремния (SiO2) и стеклом[1].
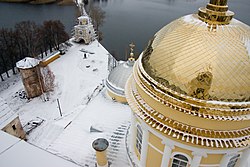 Купол Соборного храма во имя Богоявления Господня Ниловой пустыни, покрытый нитридом титана.
Купол Соборного храма во имя Богоявления Господня Ниловой пустыни, покрытый нитридом титана.Применяется как жаропрочный материал, в частности из него делают тигли для плавки металлов в бескислородной атмосфере.
В металлургии это соединение встречается в виде относительно крупных (единицы и десятки микрон) неметаллических включений в сталях, легированных титаном. Такие включения имеют на шлифах, как правило, форму квадратов и прямоугольников, их легко идентифицировать методом металлографического анализа. Такие крупные частицы нитрида титана, образующиеся из расплава, приводят к ухудшению качества литого металла.
Нитрид титана используется для создания износостойких покрытий металлорежущего инструмента, также для зубных протезов жёлтого «под золото» цвета.
Используется в микроэлектронике в качестве диффузионного барьера совместно с медной металлизацией и др.
Также нитрид титана применяется в качестве износостойкого и декоративного покрытия. Изделия, покрытые им, по внешнему виду похожи на золото и могут иметь различные оттенки, в зависимости от соотношения металла и азота в соединении. Нанесение покрытия из нитрида титана производится в специальных камерах термодиффузионным методом. При высокой температуре титан и азот реагируют вблизи поверхности покрываемого изделия и диффундируют в саму структуру металла.
Соединение не используется для покрытия электрических контактов.
- ↑ 1 2 3 Самсонов Г. В. Нитриды. — Наукова думка, 1969. — С. 133—158. — 380 с.
- ↑ Самсонов Г. В., Виницкий И. М. Тугоплавкие соединения (справочник). — Металлургия, 1976. — С. 560.
- ↑ 1 2 Лучинский Г. П. Химия титана. — Химия, 1971. — С. 168—170. — 472 с.
- ↑ Краснокутский Ю. И., Верещак В. Г. Получение тугоплавких соединений в плазме. — Вища шк., 1987. — С. 134—139. — 200 с.
- ↑ Степанчук А. Н., Билык И. И., Бойко П. А. Технология порошковой металлургии. — Выща шк., 1985. — С. 169—170. — 415 с.
Валентность титана (Ti), формулы и примеры
Общие сведения о валентности титана
В Виде простого вещества титан представляет собой серебристо-белый металл. Относится к легким металлам. Тугоплавок. Плотность – 4,50 г/см3. Температуры плавления и кипения равны 1668oС и 3330oС, соответственно.
Титан коррозионно-устойчив при на воздухе при обычной температуре, что объясняется наличием на его поверхности защитной пленки состава TiO2. Химически устойчив во многих агрессивных средах (растворы сульфатов, хлоридов, морской воды и т.д.).
Валентность титана в соединениях
Титан находится в четвертом периоде в IVB группе Периодической таблицы Д.И. Менделеева. Порядковый номер равен 22. В ядре атома титана содержится 22 протона и 26 нейтронов (массовое число равно 48). В атоме титана есть четыре энергетических уровня, на которых находятся 22 электрона (рис. 1).
Рис. 1. Строения атома титана.
Электронная формула атома титана в основном состоянии имеет следующий вид:
1s22s22p63s23p63d24s2.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие двух неспаренных электронов свидетельствует о том, что титан в своих соединениях может проявлять валентность II (TiIIO).
Атом титана способен переходить в возбужденное состояние: электроны 4s-подуровня распариваются и один из них занимает вакантную орбиталь 3d-подуровня:
Наличие четырех неспаренных электронов свидетельствует о том, что титан также проявляет валентность IV в своих соединениях (TiIVO2, TiIVF4).
Известно, что у титана есть валентность III (TiIII2O3, TiIIICl3).
